碎米莎草种子休眠与萌发特性研究
2021-08-26李欣勇黄迎金雪刘国道
李欣勇 黄迎 金雪 刘国道

摘 要:本研究以碎米莎草种子为材料,探讨了温度、光照、植物生长调节剂、水分、低温层积及人工老化处理对其休眠与萌发特性的影响,以揭示其休眠机制、破除方法及萌发关键环境因子,以期在农业生产中为碎米莎草的综合防治提供参考。结果表明:(1)碎米莎草为萌发喜光性植物,最佳萌发温度为20 ℃/35 ℃或25 ℃/35 ℃;(2)碎米莎草存在浅度生理休眠,氟啶酮(FL)和褪黑素(MLT)均可破除其休眠,显著提高种子萌发率(P<0.05);(3)碎米莎草种子只在20% PEG重度水分胁迫后萌发率显著下降(P<0.05)并低于50%,所以水分不是限制其萌发的主要因素;(4)碎米莎草在老化168 h后发芽率才低于50%,表明碎米莎草种子有较强的抗老化能力;(5)碎米莎草具有休眠循环特性,低温可诱导其进入次生休眠。研究认为,播种前深耕、播种早播或越年生作物品种是田间防控碎米莎草的有效方法。
关键词:碎米莎草;种子萌发;休眠;温度;植物生长调节剂;种子老化
中图分类号:S451 文献标识码:A
Seed Dormancy and Germination Characteristics of Cyperus iria
LI Xinyong1, HUANG Ying1, JIN Xue2, LIU Guodao1*
1. Tropical Crops Genetic Resources Institute, Chinese Academy of Tropical Agricultural Sciences, Danzhou, Hainan 571737, China; 2. College of Tropical Crops, Hainan University, Haikou, Hainan 570228, China
Abstract: In the study, the effects of temperature, light, pant growth regulators, drought, cold stratification and aging time treatment on the seed germination of Cyperus iria were investigated. Light significantly affected C. iria seed germination, and the optimum germination temperature was 20 ℃/35 ℃ or 25 ℃/35 ℃. C. iria exhibited non-deep physiological dormancy. Exogenous fluridone (FL) and melatonin (MLT) significantly improved seed germination (P<0.05). The seed germination percentage of C. iria significantly declined under 20% PEG concentration (P<0.05). The moisture was not a main factor which limited seed germination of C. iria. C. iria seeds had a good aging resistance as its germination percentage less than 50% after artificial aging for 168 h. C. iria seeds exhibited dormancy cycle, low temperature could induce secondary dormancy. The research showed that ploughing deeply before sowing, sowing early or over-year living crop varieties were effective ways to prevent C. iria.
Keywords: Cyperus iria; seed germination; dormancy; temperature; plant growth regulator; seed aging
DOI: 10.3969/j.issn.1000-2561.2021.07.025
杂草是适应性极强的一类草本植物,农田杂草常与作物竞争光热、土壤养分与水分等资源,不仅会降低作物产量,而且会降低农產品品质和经济效益,是影响作物生长导致减产的重要因素之一。因此,为保证作物生长良好,就必须对杂草进行合理控制。种子休眠是杂草的重要特性之一,是杂草适应逆境和保护其延续的一种策略,不同植物种子的休眠机制、类型及休眠破除方法存在较大差异。譬如,柠条锦鸡儿(Caragana korshinskii)在黑暗条件下的萌发率和萌发速率均显著高于有光条件下的萌发率和萌发速率[1];甘草(Glycyrrhiza uralensis)在光照条件下的萌发率显著高于无光照条件,光照有利于解除休眠[2];颜红波[3]对22种多年生禾本科植物种子萌发特性的研究发现,变温条件下的萌发率显著高于恒温条件下种子的萌发率。
碎米莎草(Cyperus iria)属莎草科(Cyperac?eae)莎草属(Cyperus Linnaeus)一年生草本植物,其环境适应能力极强,在中国广泛分布,为水、旱田常见杂草之一,在长江流域及以南地区多与异型莎草(Cyperus difformis)混生[4]。碎米莎草通过种子传播,繁殖力极强,种子萌发通常是植物生活史最为脆弱的阶段,容易受外界环境因子(如光照、温度、水分等)的影响。光照作为一种信号分子,影响种子萌发,促进或抑制种子休眠,进而调控种子在适宜条件下的萌发[5-6];温度是影响植物时空分布的控制因子,对种子萌发以及出苗起到关键性作用,能够促进或抑制种子吸水,影响酶促过程[7];种子萌发过程始于吸水后膨胀,所以水分是种子萌发的决定因素,主要通过渗透胁迫影响种子的萌发[8]。目前对碎米莎草的研究主要集中在芦笋(Asparagus officinalis)园[9]、玉米(Zea mays)田[10]、水稻(Oryza sativa)田[11]等田间杂草种群调查方面,对其萌发条件只有简单的研究[12],并未对其休眠类型及萌发进行系统研究。因此,本研究以碎米莎草种子为材料,探讨温度、光照、水分、层积、植物生长调节剂、人工老化处理对种子休眠及萌发的影响,深入了解碎米莎草种子的休眠类型及其萌发特性,从而为碎米莎草的田间综合防治提供参考。
1 材料与方法
1.1 材料
碎米莎草由中国热带农业科学院热带作物品种资源研究所的种质资源库提供。
1.2 方法
1.2.1 种子吸水率 取500粒种子称重,而后置于三角瓶中,加蒸馏水100 mL,置于20 ℃恒溫箱中,第2、4、8、24、36、48 h分别取出种子,用滤纸吸干种子表面水分称重,记录各次称量数据,最后计算种子吸水率。重复3次,计算平均值。
1.2.2 种子萌发试验 萌发试验采用纸上萌发法,种子用0.1% HgCl2溶液浸泡消毒10 min,再用蒸馏水冲洗3次,用滤纸吸干种子表面水分,在12 cm×12 cm方形培养皿中放置2层用蒸馏水润湿的滤纸作为萌发床,将种子放在萌发床上,培养皿加盖放置在培养箱里,在试验期间保持滤纸湿润。每天变换一下培养皿在培养箱中的位置,确保所有种子所处环境相同,每天记录萌发数(以胚根突出种皮1 mm视为萌发),计算各种子的萌发率、萌发时滞天数及萌发指数。
1.2.3 温度与光照处理 温度设置11个处理(6个恒温,5个变温):恒温10、15、20、25、30、35 ℃,变温15 ℃/25 ℃、15 ℃/30 ℃、20 ℃/30 ℃、20 ℃/35 ℃、25 ℃/35 ℃;其中变温为H/L 16 h/8 h。光照设置2个处理:全光照和全黑暗。黑暗处理是将培养皿用2层锡纸包裹起来以达到避光的目的,放在与光照相同的条件下。黑暗条件下的萌发数不需每天记录,以防止光照对种子萌发产生影响。每种处理3个重复,每个重复50粒种子,每天统计萌发个数,持续28 d。
1.2.4 水分处理 模拟干旱条件设置0、5%、10%、15%、20%的聚乙二醇(PEG-6000)水溶液,分别用10 mL 5%、10%、15%、20%的溶液代替标准萌发实验中的蒸馏水,放置在设有种子最适萌发温度的培养箱中,对照为同温度下的蒸馏水处理。为保持培养皿内水势不变,每2 d换一次滤纸和溶液,每种处理3个重复,每个重复50粒种子,每天统计萌发个数,持续28 d。
1.2.5 植物生长调节剂处理 生长调节剂处理采用100 μmol/L的赤霉素(GA3)、50 μmol/L的氟啶酮(FL)和1、10、100 μmol/L的褪黑素(MLT)5个处理,每个处理加10 mL的生长调节剂。温度设置为萌发不好的温度,为保持激素浓度不变,每2 d更换滤纸和溶液,对照为同温度下蒸馏水处理,每个处理3个重复,每个重复50粒种子,每天统计萌发个数,持续28 d。
1.2.6 低温层积处理 随机取足够量的种子置于培养皿中,加入适量的水,用封口膜密封,于4 ℃冰箱分别层积2、4、6个月。每隔5 d翻动检查1次,保持种子湿润。室温下干燥贮藏未经层积处理的种子为对照,置于25 ℃光照条件下进行萌发实验,以上处理均设置4个重复,每个重复50粒种子,每天统计萌发个数,持续28 d。
1.2.7 人工老化处理 人工老化是取带盖的盒子,在盒子里加入适量的水,盒子口部用纱布罩住,将足够量的种子装入纱网袋中,置于纱布上,盖上盖子,以保证盒子内的相对湿度为100%,放入45 ℃的老化箱中,还可在老化箱外放置一盆水,保证老化箱内的相对湿度为100%。将种子在老化箱中分别放置24、36、48、60、72、84、96 h,每12 h取一次种子进行标准萌发试验,直至萌发率显著降低,步骤同1.2.2,若96 h后的萌发率还是很高可放在老化箱中继续老化,每24 h取一次种子进行标准萌发试验,直至萌发率显著降低。
1.2.8 测定指标 吸水率=(浸种后种子重量?浸种前种子重量)/浸种前种子重量×100%
萌发率(GR)=试验结束时已萌发种子数/供试种子总数×100%
萌发时滞(germination time lag, GTL):指从萌发试验开始到第1粒种子开始萌发所用时间。
萌发指数(germination index, GI)=∑(Gt/Dt)
式中:Dt为萌发天数,Gt为Dt相对应的每天萌发种子数。
1.3 数据处理
采用SPSS 19.0软件进行数据统计分析,多重比较采用Duncan法,采用Excel 2013软件作图,所有数值结果均以平均值±标准误差(mean± SE)来表示。
2 结果与分析
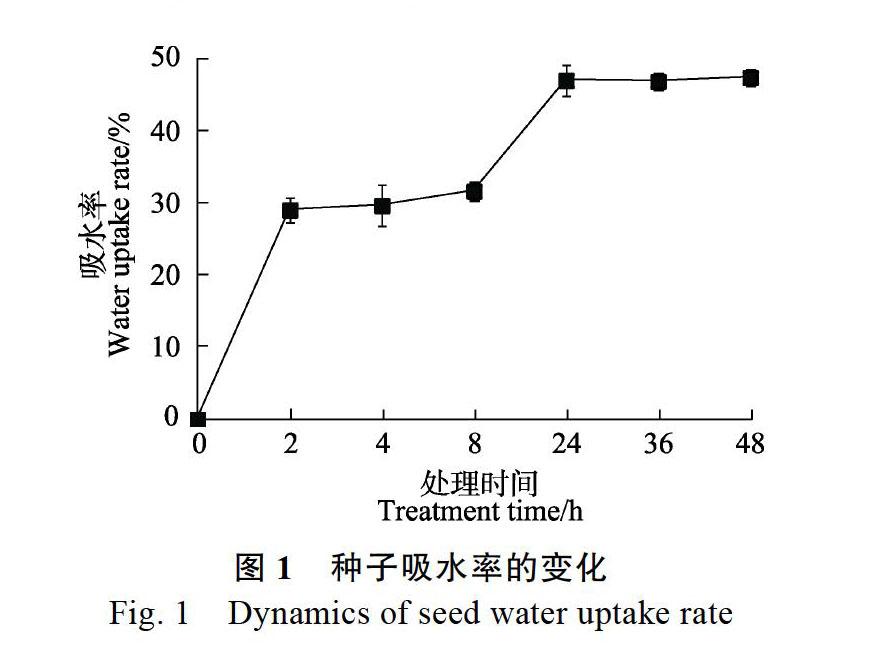
2.1 种子吸水率
碎米莎草种子吸水率随吸水时间的增加,呈先增加后稳定的趋势(图1)。浸种2 h内,吸水率直线上升,达到29.0%,浸种时间从2 h增加到8 h时,吸水率呈稳定趋势,浸种时间从8 h增加到24 h时,吸水率再次直线上升,达到47.0%,之后趋于稳定,最终吸水率为47.5%。
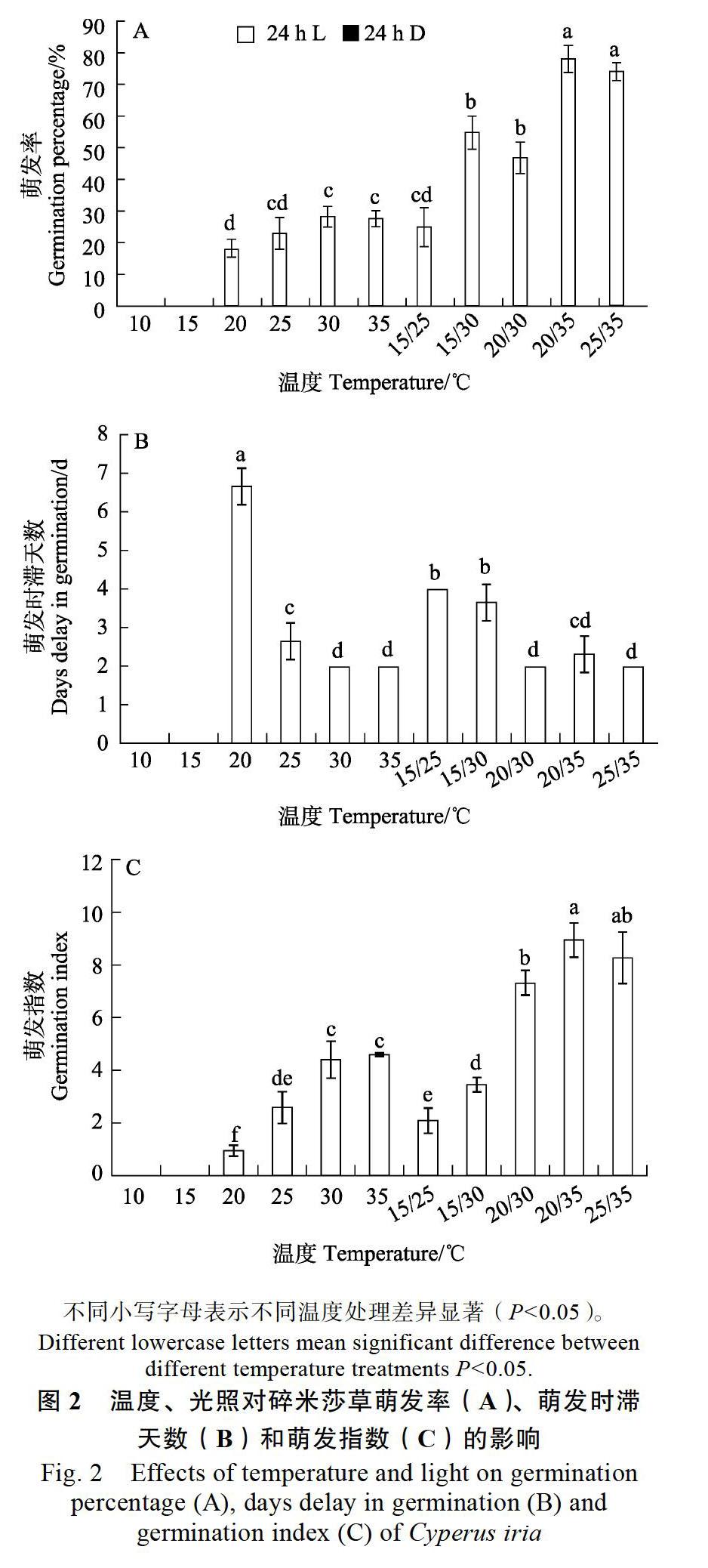
2.2 光照、温度对碎米莎草种子萌发的影响
由图2可知,碎米莎草在光照条件下除10 ℃和15 ℃时没有萌发,其余温度下均有萌发;恒温条件下的萌发率普遍较低,均在30%以下,最低为18%;而在变温条件下萌发率显著上升,并在20 ℃/35 ℃时萌发率达到最大(达78%),显著高于除25 ℃/35 ℃外的其他温度条件下的萌发率(P<0.05),比20 ℃时最低的萌发率高了60%。碎米莎草在黑暗条件下均没有萌发,说明光照是碎米莎草萌发的必需条件;随着温度的上升,碎
米莎草的萌发时滞天数呈显著下降趋势,20 ℃时的时滞天数最大,显著高于其他条件(P<0.05);随着温度的上升,碎米莎草的萌发指数呈显著增加趋势,20 ℃/30 ℃、20 ℃/35 ℃和25 ℃/35 ℃的萌发指数最大,显著大于其他温度下的萌发指数(P<0.05)。因此碎米莎草的最佳萌发温度为光照条件下的20 ℃/35 ℃或25 ℃/35 ℃。
2.3 不同植物生长调节剂对碎米莎草种子萌发的影响
植物生长调节剂试验在20 ℃(由2.2结果得出萌发不好温度)下进行,结果表明植物生长调节剂均可显著提高碎米莎草种子的萌发率(P<0.05)(图3)。其中,GA3处理的效果最差,仅使碎米莎草种子萌发率提高至26%,显著低于其他处理(P<0.05);FL和100 μmol/L MLT处理的效果最好,可使碎米莎草种子萌发率从18%提高至54%,显著高于其他处理(P<0.05)。
2.4 水分胁迫对碎米莎草种子萌发的影响
水分胁迫试验是在种子适宜的萌发温度条件下进行的,由2.2的结果得出碎米莎草在20 ℃/35 ℃下进行水分处理试验。结果表明,随PEG浓度增加,碎米莎草萌发率呈下降趋势,只有在20% PEG重度水分胁迫后萌发率显著下降并低于50%(P< 0.05),其他3个水分胁迫下的萌发率均在65%以上(图4)。
2.5 低温层积对碎米莎草植物种子萌发的影响
由图5可知,随层积时间增长,碎米莎草萌发率呈降低趋势,层积之前种子萌发率为22%, 层积2、4、6个月后的萌发率分别下降到13%、8%、0%,显著低于层积之前种子萌发率(P<0.05)。
2.6 人工老化对碎米莎草植物种子萌发的影响
由图6可知,老化时间小于84 h时,碎米莎草的萌发率呈缓慢下降趋势,与对照差异不显著(P>0.05);84 h之后,随老化时间的延长,萌发率下降明显。老化96 h后其萌发率为54%,显著低于对照(P<0.05);直至老化168 h后萌发率才低于50%,老化264 h后萌发率为29%。
3 讨论
3.1 碎米莎草种子的休眠类型
种子休眠可分为物理休眠(PY)、生理休眠(PD)、形态休眠(MD)、形态生理休眠(MPD)与复合休眠(PY+PD)5种类型[13]。本研究结果表明,碎米莎草种子可以吸收水分,浸种24 h后的吸水率达47%,表明水分不是限制碎米莎草种子萌发的主要因素,即碎米莎草种子不存在物理休眠。另外,在碎米莎草种子萌发过程中,观察到胚在种子内部无明显生长,且在25 ℃/35 ℃下的萌发时滞仅为2 d,表明胚未在萌发期间进一步发育或分化,即碎米莎草种子不存在形态休眠。综上所述,可认为碎米莎草种子是因胚生长势不够而导致的生理休眠。通过温度和生长调节剂结果表明,变温、FL和100 μmol/L MLT能显著提高碎米莎草种子至其潛在萌发率,说明碎米莎草属于浅度生理休眠。
3.2 休眠破除
温度对种子萌发起到最主要的作用。种子萌发是经多种酶催化后发生一系列物质转化和能量传递[14],而与酶的活性息息相关的就是温度,酶活性需要适宜的温度,温度过高和过低都会影响酶的活性,这对种子萌发都是不利的[15]。且大多数种子的休眠在变温条件下会更容易解除,有的甚至只在变温下萌发[16]。变温可加快酶的催化作用,促进贮藏物质的转化,其次变温有利于种壳软化,使种胚利于突破种皮,促进萌发。如变温可加快条叶百合(Lilium callosum)种子的萌发[17];颜红波[3]对22种禾本科种子研究发现,恒温和变温条件下的萌发率有显著性差异,恒温下的萌发率显著低于变温。本研究也表明变温更有利于打破碎米莎草种子的休眠,萌发率显著高于恒温条件下的萌发率,并且变温中需要有30 ℃以上的温度,碎米莎草的最适萌发温度为20 ℃/35 ℃或25 ℃/35 ℃。
氟啶酮(FL)是一种脱落酸抑制剂,可破除因存在ABA而抑制种子萌发产生的休眠,一方面可以阻碍脱落酸合成,使其含量降低,另一方面脱落酸的减少间接促进赤霉素的合成,促进种胚突破种皮[18]。氟啶酮可显著促进肉苁蓉(Cistanche deserticola)种子萌发[19]。褪黑素对水分和脂类有较强的亲和力,易于穿透种皮和细胞膜,进入种子细胞内部,不仅能减轻外部不良环境引起的氧化伤害,还能增强保护性酶活,从而提高种子的活力和萌发率,如褪黑素能提高黄瓜(Cucumis sativus)对低温与干旱的抗性[20-21],促进NaCl胁迫下狼尾草(Pennisetum alopecuroides)的萌发势和萌发率[22]。与此一致,本研究表明氟啶酮和褪黑素均可破除碎米莎草在低温下的休眠,显著提高其萌发率,这可能是因为脱落酸含量是导致碎米莎草种子休眠的主要原因,外源添加氟啶酮阻碍了其种子内脱落酸的合成,降低其含量,促进了种子萌发;褪黑素可提高碎米莎草种胚的生长能力,增强种子保护性酶活,从而解除了其在低温下的休眠。
通常认为低温层积可软化种壳,在层积过程中使种子内部的生理指标发生变化,使生理不成熟种子变成生理成熟状态,进入待萌发状态[18],然而本研究发现低温层积会降低碎米莎草种子萌发率,层积6个月后萌发率为0,这说明低温会引导碎米莎草种子进入次生休眠,表现出休眠循环现象。很多研究表明,具有非深度生理休眠的种子通常具有产生休眠循环的能力[23-24],王彦荣等[25]研究表明骆驼蒿(Peganum nigellastrum)种子具有典型的休眠循环现象,这与本研究结果一致。
3.3 杂草防控
光照对种子萌发的影响由多个因素共同决定[1],对于有些种子光照是萌发的必要环境因子,光照可促进种子萌发,如光照可显著促进有斑百合(L. concolor Salisb. var. pulchellum)、川百合(L. davidii Duchartre)和毛百合(Lilium dauricum)的萌发[17];对某些植物种子的萌发没有显著影响,如梭梭(Haloxylon ammodendron)种子无论有没有光照都会萌发,萌发率不存在显著性差异[26];有的甚至具有一定的抑制作用,如柠条锦鸡儿(Caragana korshinskii)在光照条件下的萌发率和萌发速率与黑暗条件下的存在差异,显著低于黑暗条件下的萌发率和萌发速率[1]。本研究结果表明,碎米莎草在黑暗条件下不萌发,说明碎米莎草属于萌发喜光性植物,光照是其种子萌发的必需条件之一。因此在田间防控碎米莎草时,可以采用播种前深耕的方法来抑制其种子的萌发。
由3.2结果可知,碎米莎草种子萌发时需要有30 ℃以上的温度,低温会引导碎米莎草种子进入次生休眠,因此也可在碎米莎草较多的土地上播种早播或越年生作物品种,从而避开碎米莎草的生育期,提高作物的杂草竞争力。
水分是一切生命活动所必需的,也是种子萌发的基础,种子必须在充足水分条件下才能吸胀萌发[13]。本研究结果表明碎米莎草只有在20% PEG浓度下萌发率显著下降并低于50%,说明碎米莎草萌发期有较强的抗旱性,水分不是限制其萌发的关键因素,因此碎米莎草才能在30 ℃以上高温下保证较高田间出苗率。田间控制杂草时,常用限制水分的方法来抑制杂草生长,由本研究结果可知,此方法在防控碎米莎草时效果应该不佳。
一般来说,种子活力最大的时候也就是种子生理成熟的时候,之后活力不断下降,直至种子死亡,这种随贮藏时间的增加而发生的不可逆的过程称为种子老化[27];种子活力的高低又代表着种子经长时间储藏后的耐储藏性[28]。本研究通过人工老化发现,碎米莎草在老化168 h后萌发率才低于50%,老化264 h后萌发率仍有29%,表明碎米莎草种子有较强的抗老化能力,也预示其可以在土壤种子库中保持种子活力,成为常见杂草,因此提高了田间防控工作的难度。
4 结论
综上所述,碎米莎草种子具有浅度生理休眠,变温、氟啶酮和褪黑素处理均可有效破除其休眠。播种前深耕或播种早播或越年生作物品种是田间防控碎米莎草的有效方法。
参考文献
[1] 孙 黎, 崔现亮. 光照对15种豆科植物种子萌发的影响[J]. 湖北林业科技, 2012(5): 13-17.
[2] 黄文静, 高 静, 王 楠, 等. 甘草种子萌发特性的研究[J]. 种子, 2018, 37(8): 12-15.
[3] 颜红波. 不同温度对多年生禾草种子发芽的影响[J]. 草业科学, 1998, 15(4): 22-26.
[4] 刘国道, 白昌军. 海南莎草志[M]. 北京: 科学出版社, 2012.
[5] 张 敏, 朱教君, 闫巧玲. 光对种子萌发的影响机理研究进展[J]. 植物生态学报, 2012, 36(8): 899-908.
[6] 张莹莹, 张春辉, 张 蕾, 等. 青藏高原东缘30种禾本科植物种子萌发对光的响应及其与生活史的关联[J]. 兰州大學学报(自然科学版), 2011, 47(4): 49-54.
[7] Abreu H M C D, Nobile P M, Shimizu M M, et al. Influence of air temperature on proteinase activity and beverage quality in Coffea arabica[J]. Brazilian Journal of Botany, 2012, 35(4): 357-376.
[8] Tobe K, Zhang L, Qiu G Y, et al. Characteristics of seed germination in five non-halophytic Chinese desert shrub species[J]. Journal of Arid Environments, 2011, 47(2): 191- 201.
[9] 章金明, 刘 敏, 林 雅, 等. 浙北芦笋园滋生甜菜夜蛾杂草种类调查[J]. 浙江农业科学, 2019, 60(9): 1500-1503.
[10] 李晓霞, 沈奕德, 黄乔乔, 等. 南繁区玉米田杂草调查与防治概述[J]. 杂草学报, 2017, 35(4): 8-12.
[11] 夏海生, 巫鹏云, 陈永田. 无为县水稻田主要危害性杂草调查分析[J]. 安徽农学通报, 2019, 25(1): 68-70.
[12] 黄勤勤, 柏连阳, 邬腊梅, 等. 碎米莎草种子萌发条件研究[J]. 现代农业科技, 2016(11): 156, 162.
[13] Baskin C C, Baskin J M. Seeds: Ecology, biogeography, and evolution of dormancy and germination[M]. 2nd ed. San Diego: Elsevier, 2014: 66-97.
[14] Kucera B, Cohn M A, Leubner-metzger G. Plant hormone interaction during seed dormancy release and germination[J]. Seed Science Research, 2005, 15(4): 281-307.
[15] 王丽娟. 牧草种子萌发对温度和水分胁迫的反应[D]. 呼和浩特: 内蒙古农业大学, 2008.
[16] Pegtel D M. Germination in declining and common herbaceous plant populations co-occurring in an acid peaty heathland[J]. Acta Botanica Neerlandica, 1988, 37(2): 215-223.
[17] 杨利平, 宋满珍, 张 晶. 光照和温度对百合属6种植物种子萌发的影响[J]. 植物资源与环境学报, 2000, 9(4): 14-18.
[18] 周芝琴, 李廷山, 胡小文. 莎草科4种植物种子休眠与萌发特性的研究[J]. 西北植物学报, 2013, 33(9):1885-1890.
[19] 赵 程, 郭晔红, 赵阳武, 等. 氟啶酮赤霉素协同诱导对肉苁蓉种子发芽率的影响[J]. 甘肃农业大学学报, 2018, 53(4): 54-58.
[20] Posmyk M, Balabusta M, Wieczorek M, et al. Melatonin applied to cucumber (Cucumis sativus L) seeds improves germination during chilling stress[J]. Journal of Pineal Research, 2009, 46: 214-223.
[21] Zhang N, Zhao B, Zhang H J, et al. Melatonin promotes water-stress tolerance, lateral root formation, and seed germination in cucumber (Cucumis sativus L) [J]. Journal of Pineal Research, 2013, 54: 15-23.
[22] 張 娜, 蒋 庆, 李殿波, 等. 外源施加褪黑素对NaCl胁迫下狼尾草种子萌发及相关生理指标的影响[J]. 中国农业大学学报, 2014, 19(4): 54-60.
[23] Baskin C C, Baskin J M. Seeds: Ecology, biogeography and evolution of dormancy, and germination[M]. San Diego: Academic Press, 1998.
[24] Baker K S, Steadman K J, Plummer J A, et al. The changing window of conditions that promotes germination of two fire ephemerals, Actinotus leucocephalus (Apiaceae) and Tersonia cyathiflora (Gyrostemonaceae)[J]. Annals of Botany, 2005, 96: 1225-1236.
[25] 王彦荣, 杨 磊, 胡小文. 埋藏条件下3种干旱荒漠植物的种子休眠释放和土壤种子库[J]. 植物生态学报, 2012, 36(8): 774-780.
[26] 黄振英, 张新时, Gutterman Y, 等. 光照、温度和盐分对梭梭种子萌发的影响[J]. 植物生理学报, 2001, 27(3): 275-280.
[27] 马平安. 人工老化对玉米种子活力影响[D]. 郑州: 河南农业大学, 2010.
[28] Sayama T, Nakazaki T, Ishikawa G, et al. QTL analysis of seed-flooding tolerance in soybean (Glycine max [L.] Merr.)[J]. Plant Science, 2009, 176(4): 514-521.
责任编辑:崔丽虹
