复方苦参注射液联合奥希替尼介导PI3K/AKT/mTOR信号通路在肺腺癌细胞H1975中的作用机制①
2021-08-23曾建昌刘君丽王楚明苏彦奇华中科技大学协和江北医院武汉430100
曾建昌 刘 艳 杨 俊 李 奔 周 翔 陈 丹 李 荣 姚 驰 杨 柳 刘君丽 王楚明 苏彦奇 罗 蓉(华中科技大学协和江北医院,武汉430100)
肺腺癌是一种非小细胞肺癌,该病主要起源于支气管黏膜上皮,早期无明显症状,手术、放射以及药物治疗仍是当前针对肺腺癌治疗的主要手段[1]。奥希替尼为第三代表皮生长因子受体酪氨酸激酶抑制剂,该药已被证实在延长非小细胞肺癌患者生存期,减轻患者痛苦和疾病风险中效果显著,被广泛应用于非小细胞肺癌的治疗[2]。复方苦参注射液由中国中医科学院中药所研制,主要由苦参和白土苓两味药组成,在清热利湿、凉血解毒、解结止痛、缓解癌性疼痛、出血、提升化疗效果以及免疫功能方面具有良好效果[3]。近年来复方苦参注射液被越来越多的应用于乳腺癌、结肠癌、肺癌等多种癌症的治疗中并且效果显著[4-6]。何敏等[7]在研究中发现,复方苦参注射液联合顺铂、拓扑替康等能够显著减轻肺癌患者疼痛,提高机体免疫能力并减少不良反应的发生。研究发现绝大多数非小细胞肺癌患者体内存在PI3K/AKT/mTOR通路激活的情况,PI3K/AKT/mTOR通路抑制剂联合免疫治疗等手段也被越来越多的应用于肺癌的治疗中[8-9]。现阶段奥希替尼联合中药处方治疗肺腺癌逐渐成为医疗领域的研究热点,但其具体作用机制仍有待探讨。本研究旨在分析复方苦参注射液联合奥希替尼对肺腺癌H1975细胞的影响及作用机制,为后续治疗奠定研究基础。现报告如下。
1 材料与方法
1.1 材料 H1975细胞由美国物种保留中心(Amer-ican Type Culture Collection,ATCC)提供;RPMI 1640培养基购自Invitrogen;Trizol试剂盒购自Gibco;RT-PCR试剂盒购自大连宝生物有限公司;PCR引物序列由华大基因合成;BCA蛋白定量试剂盒购自Sigma;Western blot中抗体购自Abcam;MTT溶液、Matrigel基质胶购自北京索莱宝公司;Annexin V-FITC/PI双染试剂盒购自贝博生物公司;PI3K/AKT/mTOR通路抑制剂特异性抑制剂BEZ235购自Selleck。
1.2 方法
1.2.1 细胞分组 使用含有10%胎牛血清的培养液作为培养基,在5%CO2、37℃培养箱中进行培养,使用0.25%胰蛋白酶进行消化传代。之后将人肺腺癌H1975细胞分为如下组:阴性对照组(Negative control,NC组,生理盐水干预)、苦参注射液组(苦参注射液干预)、奥希替尼组(奥希替尼干预)、苦参注射液+奥希替尼组(苦参注射液+奥希替尼干预)、BEZ235组(PI3K/AKT/mTOR通路抑制剂干预)、苦参注射液+奥希替尼+BEZ235组(苦参注射液+奥希替尼+PI3K/AKT/mTOR通路抑制剂干预)。苦参注射液使用浓度为1 mg/ml,奥希替尼为10μmol/L,BEZ235溶于无菌DMSO配制浓度为5 mmol/L的原液,使用前将原液用无血清培养基稀释至0.1μmol/L。
1.2.2 MTT细胞活力检测 将转染后的细胞接种至96孔板,4×105个/孔细胞,每组设置3个复孔。加入培养液进行培养,分别于培养24 h、48 h和72 h时换液并每孔加入20μl MTT溶液。孵育4 h后弃上清,加入100μl Formanzan溶液后继续孵育4 h。酶标仪检测492 nm波长下的各孔吸光度值。
1.2.3 Transwell实验 按照1∶10的比例将Matrigel胶用无血清DMEM培养基进行稀释,之后于上室加入100μl Matrigel胶,重悬细胞后稀释细胞浓度至3×105个/ml,将100μl细胞加入上室,于Transwell下室加入600μl DMEM培养基(含10%血清),依据Transwell说明书进行结晶紫染色。染色结束后于光学显微镜下观察染色结果,计算侵袭细胞数。
1.2.4 Annexin V-FITC/PI双染法 采用Annexin V-FITC/PI双染试剂盒检测H19175细胞凋亡情况,实验步骤如下:PBS洗涤细胞,以2 000 r/min转速离心5 min,加入500μl结合缓冲液,调整细胞密度为4×105个/ml,加入5μl Annexin V-FITC并混匀,避光室温温育10 min。加入5μl PI,混匀,于5 min内上流式细胞仪进行检测。激发波长为480 nm,530 nm处检测FITC,>575 nm处检测PI。
1.2.5 qRT-PCR检测 Trizol试剂盒一步法提取总RNA,取3μg总RNA,用M-MLV逆转录酶进行反转录。SYBR®Premix Ex TaqTMⅡ试剂盒进行荧光定量PCR,操作步骤依据试剂盒说明书进行,使用qRT-PCR仪进行扩增,相对表达水平以GAPDH为内参。记录各孔Ct值(扩增动力曲线拐点)。2-ΔΔCt法计算目的基因的相对表达水平,引物序列见表1。

表1 引物序列Tab.1 Primer sequences
1.2.6 Western blot检测 取对数生长期细胞进行实验,将200μl含有蛋白酶抑制剂的细胞裂解液加入培养孔。细胞离心后借助BCA蛋白定量试剂盒对蛋白浓度进行测定。之后每孔50μg蛋白行SDSPAGE凝胶电泳。转膜,脱脂牛奶封闭后加入兔抗人一抗p-PI3K、p-AKT、p-mTOR、Bax、Bcl-2、E-cadherin、N-cadherin、Vimentin,4℃孵育过夜,TBST冲洗后加入山羊抗兔二抗IgG,37℃孵育1 h,TBST冲洗,使膜与ECL反应液反应1 min,观察结果。蛋白相对表达量为目标条带与内参条带的灰度值之比。
1.3 统计学方法 采用SPSS21.0软件对本研究中数据进行统计分析,计量资料以±s的形式表示,两组间比较采用t检验,多组间比较采用单因素方差分析。细胞增殖实验数据使用重复测量方差分析。P<0.05表示差异具有统计学意义。
2 结果
2.1 复方苦参注射液、奥希替尼及联合使用抑制H1975细胞增殖、诱导细胞凋亡 使用MTT以及流式细胞术对各组细胞增殖、凋亡情况进行检测,结果发现,相对于NC组,苦参注射液组和奥希替尼组细胞凋亡率提高,且细胞增殖活力被抑制,苦参注射液+奥希替尼组效果更为显著(P<0.05)。见图1。

图1 各组细胞增殖、凋亡情况检测结果Fig.1 Results of cell proliferation and apoptosis in each group
2.2 复方苦参注射液、奥希替尼及联合使用抑制H1975细胞侵袭 Transwell检测结果显示,相对于NC组,苦参注射液组和奥希替尼组中细胞侵袭数目减少(均P<0.05),同时,与苦参注射液+奥希替尼组比较,苦参注射液组和奥希替尼组细胞侵袭数目增多(均P<0.05),表明苦参注射液和奥希替尼二者联合使用在抑制H1975细胞侵袭中效果更为显著。见图2。
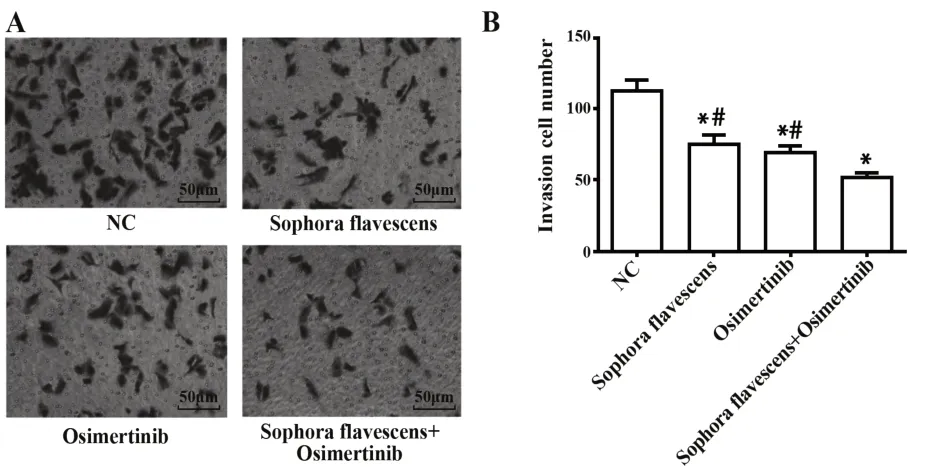
图2 各组细胞侵袭检测结果Fig.2 Cell invasion results in each group
2.3 复方苦参注射液和奥希替尼抑制H1975细胞中PI3K/AKT/mTOR信号通路的激活 为进一步探讨复方苦参注射液和奥希替尼调控H1975细胞生物学特性的具体机制,对细胞给予了BEZ235处理,qRT-PCR和Western blot检测各组细胞中PI3K/AKT/mTOR通路相关因子的表达,结果发现,相对于NC组,苦参注射液+奥希替尼组、BEZ235组中PI3K/AKT/mTOR通路相关因子的表达被显著抑制,且苦参注射液+奥希替尼+BEZ235组中抑制效果更为显著(P<0.05)。见图3。
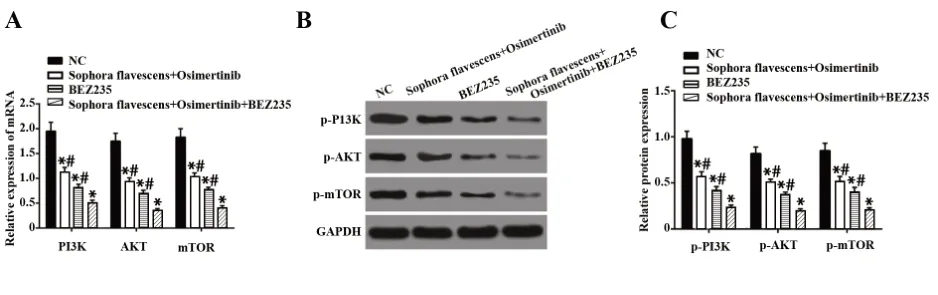
图3 各组细胞中PI3K/AKT/mTOR信号通路相关因子的表达Fig.3 PI3K/AKT/mTOR related factors expressions in each group
2.4 复方苦参注射液和奥希替尼通过PI3K/AKT/mTOR信号通路抑制H1975细胞增殖,促进凋亡相对于NC组,苦参注射液+奥希替尼组、BEZ235组细胞凋亡增多,细胞增殖活力被抑制,Bax表达增多,Bcl-2表达降低,且苦参注射液+奥希替尼+BEZ235组效果更为显著(P<0.05)。表明苦参注射液+奥希替尼能够通过调节PI3K/AKT/mTOR信号通路进而影响H1975细胞的增殖凋亡。见图4。
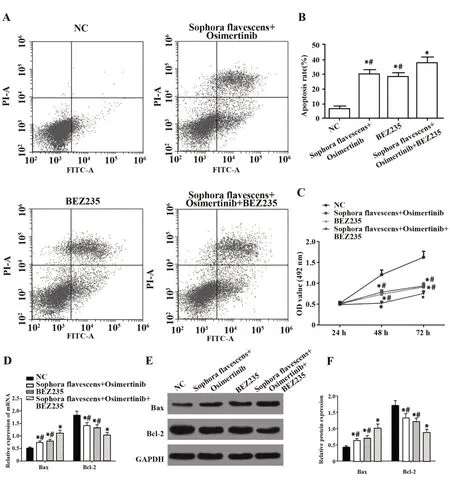
图4 各组细胞增殖和凋亡结果Fig.4 Cell proliferation and apoptosis results of each group
2.5 复方苦参注射液和奥希替尼通过PI3K/AKT/mTOR信号通路抑制H1975细胞侵袭 对各组细胞侵袭情况进行检测,结果发现,相对于NC组,苦参注射液+奥希替尼组、BEZ235组细胞侵袭被抑制,且苦参注射液+奥希替尼+BEZ235组侵袭数目减少更为显著(P<0.05)。见图5。

图5 各组细胞侵袭结果Fig.5 Cell invasion results in each group
2.6 复方苦参注射液和奥希替尼通过PI3K/AKT/mTOR信号通路抑制H1975细胞上皮间质转化 对各组细胞上皮间质转化相关因子表达进行检测,结果发现,相对于NC组,苦参注射液+奥希替尼组、BEZ235组细胞中N-cadherin、Vimentin表达被抑制,E-cadherin表达增强,苦参注射液+奥希替尼+BEZ235组各因子变化更为明显(P<0.05)。见图6。

图6 各组细胞上皮间质转化相关因子表达检测结果Fig.6 Epithelial mesenchymal transformation related factors expression in each group
3 讨论
本研究探讨了奥希替尼联合中药复方苦参注射液对肺腺癌H1975细胞增殖、凋亡和侵袭的影响,结果发现,联合使用奥希替尼和复方苦参注射液能够更显著的促进H1975细胞凋亡,抑制细胞增殖和侵袭,而该作用的实现可能与抑制PI3K/AKT/mTOR通路的激活有关。
奥希替尼为临床上用于治疗局部晚期或者转移性肺癌的常用药物之一,相对于传统药物,其具有靶向性强、具有良好治疗效果且不良反应较少等优点[10]。而复方苦参注射液作为中药制剂,被证实能够显著改善放疗患者肺损伤程度、减少放射性肺炎的发生,同时还能够显著改善肺炎患者症状,促进机体的耐受程度增强[11]。本研究首先通过对H1975细胞给予复方苦参注射液、奥希替尼等处理,结果发现,同时给予复方苦参注射液和奥希替尼对于H1975细胞的增殖和侵袭的抑制,以及诱导细胞凋亡的效果更显著。为了探讨复方苦参注射液联合奥希替尼作用于H1975的具体机制,对细胞给予BEZ235处理。
研究证实PI3K/AKT通路在多种实体瘤中均处于激活状态,AKT是丝氨酸苏氨酸蛋白激酶家族的重要成员,其在PI3K/AKT通路中处于最核心的位置,具有调控细胞增殖凋亡的作用[12-14]。mTOR在细胞的增殖、代谢以及骨架形成过程中起关键作用,还能够参与激活AKT的过程,因其在肿瘤学中的作用,也成为多种药物研发的重要针对目标[15]。为探究复方苦参注射液与奥希替尼在肺腺癌细胞H1975中发挥作用的具体机制,使用qRT-PCR和Western blot检测各组PI3K/AKT/mTOR通路相关因子的表达,结果发现,相对于NC组,苦参注射液+奥希替尼组中通路相关因子的表达被显著抑制。同时BEZ235组中细胞增殖、侵袭被抑制,显著诱导细胞凋亡,同时给予苦参注射液、奥希替尼以及BEZ235则效果更明显。上皮间质转化指的是上皮细胞向间质细胞转化的过程,其能够赋予细胞入侵以及转移的能力,在癌症的发生和发展中起重要作用[16-17]。另外有研究表明PI3K/AKT/mTOR信号通路在上皮源性恶性肿瘤的发生和发展中发挥重要作用,该通路的激活能够促进上皮间质转化过程[18]。本研究进一步探讨了各组H1975细胞中上皮间质转化相关因子的表达,结果发现,BEZ235或苦参注射液+奥希替尼能够显著抑制N-cadherin和Vimentin、促进E-cadherin的表达而联合使用效果更明显,这也进一步说明了奥希替尼、苦参注射液等对肺腺癌的影响可能与调节上皮间质转化有关。
综上所述,本研究发现,复方苦参注射液联合奥希替尼能够抑制H1975细胞增殖、侵袭和上皮间质转化,促进细胞凋亡,该作用可能是通过抑制PI3K/AKT/mTOR信号通路实现的,本研究在探讨药物效果的基础上进一步明确了其具体作用机制,并在肺腺癌的治疗中有一定指导意义。
