基于生物阻抗谱的舌体肿瘤组织识别方法*
2021-08-14姚佳烽胡松佩杨璐吴阳韩伟刘凯
姚佳烽 胡松佩 杨璐 吴阳 韩伟 刘凯†
1) (南京航空航天大学机电学院, 南京 210016)
2) (南京大学医学院, 南京大学医学院附属口腔医院, 南京 210008)
基于生物阻抗谱技术, 提出一种非侵入式、快速、便捷的舌体肿瘤组织识别方法.根据舌体组织不同病理及生理状态下电学特性的差异性来判断其是否病变, 以帮助主刀医师在临床舌体肿瘤手术切除中既能完整的切除肿瘤又能尽可能多的保留患者舌功能.本文在小鼠上建立了人舌鳞癌细胞(HSC3)原位舌癌移植瘤模型, 用生物阻抗谱的方法对其正常组织区域、混有肿瘤组织区域及肿瘤组织区域进行了电学特性研究.幅值频谱显示在8.09 × 105 —5 × 106 Hz的高频段可以根据其电学特性区分3种组织.在实验过程中, 从高频段的幅值频谱中提取出弛豫频率frelax、电阻抗实部 和电阻抗虚部 3个电学参数, 并根据这3个电学参数定义癌变组织系数α与β (待测组织阻抗值相对于正常组织阻抗值的实部变化百分比记为α, 虚部相对变化百分比记为β)进行肿瘤组织识别.结果表明, 当α ≤ 36.5%, β ≤ 31.2%时, 组织是正常组织; 当α ≥36.5%, β ≥ 31.2%时, 组织可能混有肿瘤组织; 当α ≥ 82.7%, β ≥ 73.6%时, 组织是肿瘤组织.
1 引 言
生物阻抗谱(bioelectrical impedance spectroscopy, BIS)是一种根据生物组织不同病理及生理状态下电学特性的差异性提取有效电信息来分辨生物体是否病变的技术.舌癌是头颈部最常见的恶性肿瘤之一, 也是发病率最高的一种, 在口腔癌中牙龈及口底癌占31.0%—49.5%, 而舌癌占比高达60.8%—67.5%[1].目前, 舌癌临床的治疗方法主要有: 外科手术[2]、放射治疗[3]、化疗[4]等.在这些方法中手术切除可以根除舌体肿瘤, 但是必须完全切除肿瘤才能达到控制的目的, 如手术切除的范围不够会导致疾病复发[2,5].如何能完整的切除舌体肿瘤又能保留健康的舌组织是提高患者术后存活率及术后生存质量的关键.目前临床上舌体肿瘤检测技术包括核磁共振成像[5-8]、口腔超声成像[5,6,9]及电子计算机断层扫描成像[10-13]等.这些技术都可以检测出舌体肿瘤病灶的具体位值和大致范围, 但检测出的肿瘤厚度与实际厚度会有偏差, 并且在手术中也无法做到实时引导, 这就常常会导致手术切除不彻底, 从而引起肿瘤复发, 并且上述方法的检测流程均较为复杂, 设备也比较昂贵.
BIS技术是向生物体注入安全的多频激励电流, 以一种低频到高频的扫频方式采集生物组织不同频率下的阻抗信息, 通过提取频谱中有效的电学参数来定量分析生物组织的电学特性[14].BIS是能定量分析, 使用便捷及具有医学应用前景广泛的检测技术, 如Yao等[15]采用BIS技术对单细胞的电学特性与其结构之间的关系进行了研究, 根据细胞的单、双壳模型理论提出了不同种类细胞的电学模型; Mahdavi等[16]采用BIS技术对从乳腺癌手术中切割下来的新鲜组织进行阻抗的扫描和分析, 提出了一种新的乳腺病变病理评分的电学模型; Chen等[17]从医学角度评价了BIS技术在乳腺癌保乳手术中对切缘肿瘤细胞是否残留进行快速定性的有效性, 其结果显示BIS检测的结果与冷冻切片活检的一致性较高, 对乳腺癌保乳手术中的切缘样本是否含有癌变组织的定性检测具有较高准确性, 可以适用于术中的快速判断.此外BIS是功能性成像, 癌细胞相较于正常细胞有诸多的特性[18], 会产生与正常组织不同的电学信号, 因此可以用BIS技术检测舌体中正常和癌变舌组织, 提取出两种组织的相异电学信息进而区分舌组织癌变区间.
本研究用人舌鳞癌细胞系(HSC3)培养了不同肿瘤体积的癌变舌体, 用现有的BIS检测设备对舌体舌尖、舌中、舌根3个部位的舌组织扫频检测, 之后用苏木精-伊红染色法(HE染色)确定舌部肿瘤的具体位置, 根据HE染色结果对照研究舌体中肿瘤组织区域、混有肿瘤组织区域及正常组织区域的电学特性, 最终从BIS中提取出frelax,3个电学参数对这3种舌组织进行定量分析.
2 实验设备及方法
2.1 实验设备
本实验以HSC3癌变舌体为被测对象.图1(a)给出了实验设备原理图: 1台PC机、1台阻抗分析仪(IM3570)、1个培养皿、1个四电极传感器.图1(b)是四电极传感器的结构图, 是由4根镀金电极和1个树脂外壳组成.镀金电极的直径为0.5 mm, 间隔1.6 mm; 树脂外壳直径为12 mm,长为31 mm, 由3D打印机打印而成.将传感器置于比色皿中的舌体进行测量, 传感器的4根镀金电极通过4条屏蔽线连接到阻抗分析仪上.阻抗分析仪捕获探头发出的信号后, 将测量数据传输给PC机进行后续的处理.
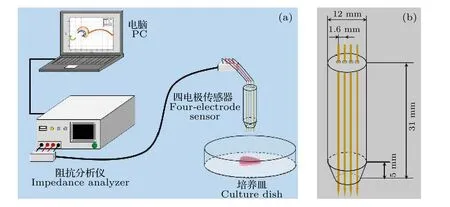
图1 BIS检测仪器 (a) 阻抗分析仪及传感器; (b) 四电极传感器结构图Fig.1.Measuring equipment of BIS: (a) Impedance analyzer and sensor; (b) structure diagram of four-electrode sensor.
2.2 HSC3舌体肿瘤制备
为了比较舌体肿瘤与正常舌组织的电学特性,参照文献[19]制备了原位HSC3舌体肿瘤.HSC3细胞培养使用了10%胎牛血清、100 U/mL青霉素和100 mg/mL链霉素的DMEM培养基, 置于37 ℃、5% CO2的恒温培养箱中培养.准备4只Balb/c-nude雌性小鼠, 当细胞培养完成后, 在其中3只小鼠麻醉状态下注射1 × 106细胞数量的HSC3细胞于每只小鼠的舌尖部位.每日观察小鼠舌尖并用游标卡尺测量肿瘤的长和宽, 然后用公式(V=(L×W2)/2, 其中L是肿瘤的长度, W是肿瘤的宽度)计算其大致体积.待肿物形成后, 用颈椎脱臼法处死麻痹状态下的小鼠, 最后切取小鼠的舌体置于磷酸缓冲盐(PBS)溶液中以便备用.
2.3 实验过程
准备两个培养皿, 用镊子将4只小鼠的舌体夹入其中1个培养皿以待检测, 并往培养皿中倒入PBS溶液以保持舌组织的活性.采用四电极法测量组织的阻抗谱, 用幅值I = 10 mA的交流电对其激励, 采集其两端的电压信号, 扫频范围为100 Hz—5 MHz.将标记好的舌体依次放入另1个培养皿中快速检测, 将四电极传感器对准舌尖的中线, 依次插入舌尖、舌中和舌根3个部位的表层组织, 深度约1 mm, 每个部位采集3次.扫频完成后保存实验数据, 将舌体夹回原培养皿中进行下1个舌体的检测.对每个部位3次采集的数据取平均值进行数据处理分析, 最终将所有舌体放入组织固定液中以便之后的染色处理.
2.4 HE染色
沿着舌体中线进行切片处理, 切片组织用95%乙醇固定20 min, 之后用PBS溶液洗涤, 每次1 min.洗涤后用苏木素染液对切片组织中细胞的细胞核染色, 染色2—3 min后用流水冲洗.然后通过显微镜观察, 如果细胞核染色过深, 用1%盐酸酒精溶液分色数秒, 之后用流水冲洗.分色之后用伊红染液对贴片组织中细胞的细胞质染色, 染色1 min后用流水冲洗.最后自然晾干切片组织并用中性树胶封片.
3 实验结果与讨论
3.1 HE染色结果
本文把含有HSC3肿瘤的舌体分为正常组织区域(N)、混有肿瘤组织区域(B)、肿瘤组织区域(T).图2给出了4只小鼠(正常舌体, Mou1, Mou2,Mou3)舌体的HE染色结果, 图中由黄色虚线圈出的细胞密集、颜色为深紫色的区域为HSC3肿瘤所在的大致位置, 从染色图可以清楚地看到正常舌体中并无HSC3肿瘤, Mou1, Mou2和Mou3的舌尖部位有HSC3肿瘤.为了对照研究3块区域的电学特性, 后文将以正常舌体和Mou1的HE染色结果作为对照.
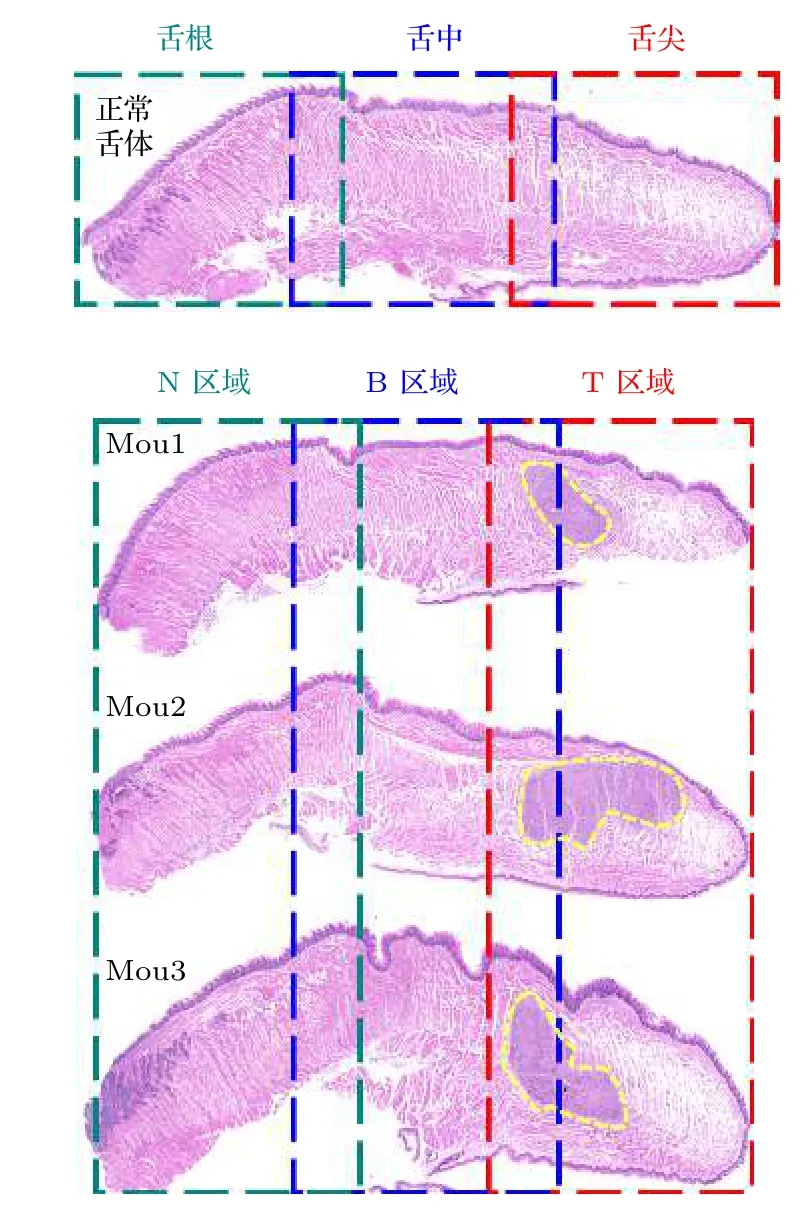
图2 舌体的HE染色图Fig.2.HE staining of tongue.
3.2 BIS检测结果
图3 给出了4只小鼠舌体的幅值频谱, 首先从HSC3癌变舌体(Mou1, Mou2, Mou3)的幅值频谱可看到, N, B, T 3块区域组织的阻抗幅值变化趋势都是一样的, 但是在各个频点上阻抗幅值大小不同, 唯有N区域的阻抗幅值一直保持最小.由实验结果可知: 当log(f ) < 5.907 (f < 8.09 ×105Hz)时, 3块区域的阻抗幅值在一直减小.因为低频时组织的阻抗成分中容抗成分是主导成分, 随着频率的提高阻抗值会不断减小, 而且3个区域组织的阻抗谱有交叉, 并不能很好地区分这3类组织;当log(f ) > 5.907 (f > 8.09 × 105Hz)时, 随着频率的升高, 感抗成分是主导成分, 随着频率的提高阻抗值又转而增大, 而且3块区域的阻抗谱无交叉, 可很好区分.在频率f为100—8.09 × 105Hz的范围内, 3个区域组织的阻抗谱有交叉, 是因为电流注入电极时, 电极与组织溶液界面会产生接触阻抗从而影响测量结果.根据复系数ξ=ξRe+ξIm(ξ为接触阻抗效应比; ξRe, ξIm分别为电阻抗实部和虚部的接触阻抗效应比)可以定量地评价接触阻抗的影响, ξRe和ξIm随频率而变化, 在低频段f <100 kHz时的ξRe远远大于f > 100 kHz时的ξRe,同样在低频段f < 100 Hz时的ξIm远远大于f >100 Hz时的ξIm[20].那么在低频段的ξ必然也远远大于高频段的ξ, 即低频段的接触阻抗效应远远大于高频段, 随着频率不断提高, 接触阻抗的影响会越来越小, 测量的阻抗幅值也就越来越准确.因此可以用0.8 MHz以上的频段对N, B, T 3块区域组织定量分析来区别这3类组织, 同时计算了该频段其阻抗幅值的最大相对误差(相对误差公式为:如表1所列.另外, 舌体本身不是前后对称的, 舌体各个位置的厚度、味觉感知等均有区域化差异, 可能对舌体的阻抗值大小有影响, 从正常舌体3个位置的幅值频谱可以看到,当log(f ) > 5.907时, 正常舌体3个部位的阻抗值大小接近, 因此可以排除舌体不同位置的细胞差异导致其阻抗值变化的影响.
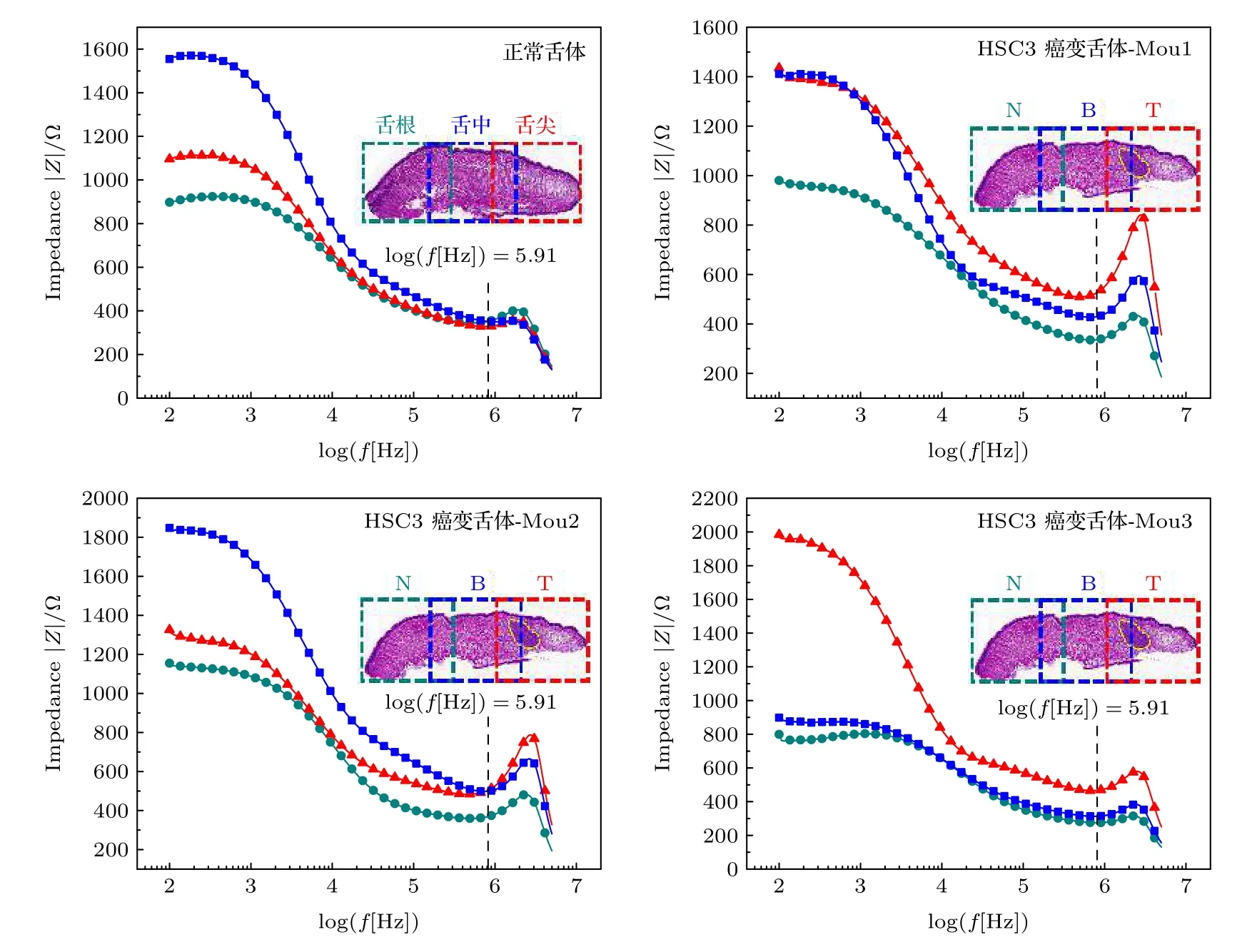
图3 舌体的幅值频谱Fig.3.Amplitude spectrum of tongue.

表1 阻抗测量值的最大相对误差Table 1.Maximum relative error of impedance value.
3.3 HSC3癌变舌体中不同区域组织的定量分析
图4是HSC3癌变舌体高频段(频率范围为2—5 MHz)的阻抗频谱.当舌部表层组织被激励时会产生电场, 表层组织受到电场力的作用下首先会发生表面极化, 随着频率不断提高, 舌内部的细胞会发生电荷极化、分子极化.当舌部正常区域发生癌变时, 其组成细胞不管是分子结构还是生理功能都发生了巨大改变.那么随着频率提高, 正常细胞和癌细胞从1个平衡状态转到另1个平衡状态所需的弛豫时间必定不同, 那么弛豫频率frelax也就不同.因此可以用弛豫频率frelax和frelax对应的电阻抗值的实部和虚部对3种区域的组织进行定量分析.
以图4 (Mou1)为例, T区域在弛豫频率fT=3.46 × 106Hz处的阻抗值实部= 409 Ω, 阻抗值虚部= 618 Ω; B区域在弛豫频率fB=3.31 × 106Hz处的阻抗值实部= 294 Ω, 阻抗值虚部= 443 Ω; N区域在弛豫频率fN=3.17 × 106Hz处的阻抗值实部= 208 Ω, 阻抗值虚部= 334 Ω.图4 (Mou2和Mou3)也有同样的规律, 无论是从电阻抗值的实部Z' 频谱还是Z''虚部频谱, 都可以看出N, B, T3块区域的frelax,和的值明显不同, T区域的这3个参数值最大, N区域的值最小.肿瘤组织的阻抗值大于正常组织, 是因为癌组织内的癌细胞无限繁殖, 细胞排列紧密, 又由于癌组织中的癌细胞需要快速分裂繁殖, 这样癌细胞就需要大量的自由水来促进新陈代谢, 使得癌组织的阻抗值提高.自由水的弛豫可能出现在109—1010Hz的微波领域的不同位置, 相较于细胞、生物大分子等物质体系而言, 自由水的弛豫频率更高.因而含有大量自由水的癌组织的弛豫频率也相对较高.
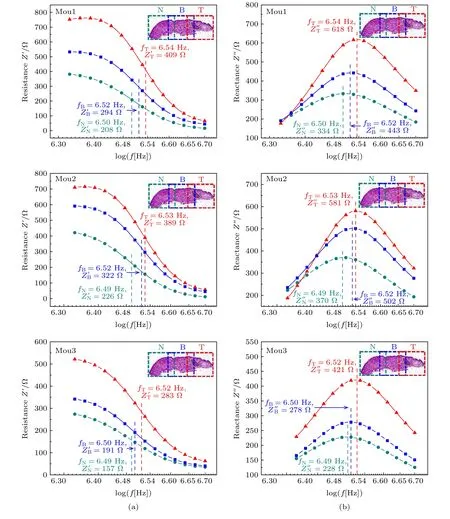
图4 HSC3癌变舌体的阻抗频谱 (a) 电阻抗实部Z′频谱; (b) 电阻抗虚部Z′′频谱Fig.4.Impedance spectrum of tongue with HSC3 canceration: (a) Real part spectrum of electrical impedance; (b) imaginary part spectrum of electrical impedance.
图5 把3种舌组织阻抗频谱中的frelax,和提取出来进而对这3种舌组织区分.正常组织的平均frelax= 3.12 × 106Hz, 平均=197 Ω, 平均= 311 Ω; 混有肿瘤组织的平均frelax= 3.26 × 106Hz, 平均= 269 Ω, 平均= 408 Ω; 肿 瘤 组 织 的 平 均frelax= 3.38 ×106Hz, 平均= 360 Ω, 平均= 540 Ω.为了识别检测的组织是否是肿瘤组织, 根据这3种组织的平均和值定义了组织癌变系数α=和其 中分别为弛豫频率下待测组织与正常组织之间阻抗实部与虚部的变化量.用α和β两个系数综合评价被检测组织, 当= 36.5%,=31.2%时, 组织是正常组织; 当α ≥ 36.5%, β ≥ 31.2%时, 组织可能混有肿瘤组织; 当= 82.7%,=73.6%时, 组织是肿瘤组织.
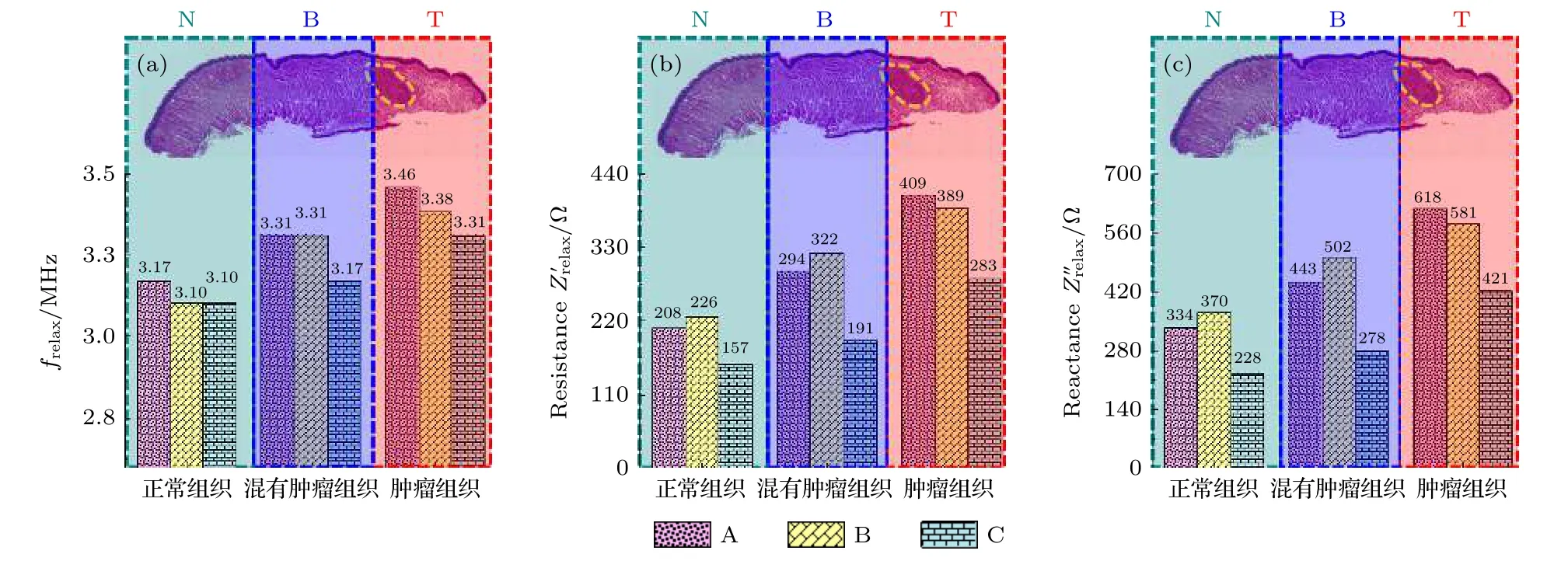
图5 HSC3癌变舌体组织电学特性对比 (a)弛豫频率 frelax对比; (b)电阻抗实部 对比; (c)电阻抗虚部 对比Fig.5.Comparison of the electrical characteristics of tongue tissue in HSC3 canceration: (a) Comparison of frelax; (b) comparison of (c) comparison of
4 结 论
根据HE染色结果用BIS方法对小鼠HSC3癌变舌体的正常组织区域、混有肿瘤边组织区域和肿瘤组织区域进行了电学特性研究, 发现肿瘤组织区 域高 频 段 的frelax,和值 明显 高于 正 常组织区域, 本文根据这3个电学参数定义癌变组织系数α与β进行肿瘤组织识别, 结果表明, 当α ≤36.5%, β ≤ 31.2%时, 组织是正常组织; 当α ≥36.5%, β ≥ 31.2%时, 组织可能混有肿瘤组织;当α ≥ 82.7%, β ≥ 73.6%时, 组织是肿瘤组织.本方法无需样品预处理, 可以直接检测舌表层组织, 操作简单, 为后续舌体肿瘤组织边界的确定做基础.因此, 本方法可以应用于舌体肿瘤切除的临床研究中, 为非侵入式、快速、便捷地检测出舌体肿瘤边界以利于主刀医师彻底切除舌体肿瘤提供一种新的检测方法.
感谢南京市口腔医院口腔颌面外科宋传慧博士提供的技术支持.
