猪β-防御素的表达及其生物学功能研究进展
2021-08-09苏国旗黄金秀刘作华
苏国旗 宋 陶 黄金秀 刘作华*
(1.重庆市畜牧科学院,重庆 402460;2.农业部养猪科学重点实验室,重庆 402460;3.西南大学动物科学技术学院,重庆 402460)
近几年,非洲猪瘟的爆发给我国养猪业带来重创,同时也给畜牧生产者和研究者带来启示,对于健康养殖而言,需要外部减少感染的风险和内部提高动物机体的免疫力。2020年7月起我国开始禁止在饲料中使用抗生素,这就要求养殖生产中必须增强猪自身的免疫力,以减少由饲用抗生素禁用引起的发病率和死亡率;另外,还可通过开发新型绿色饲用抗生素替代品来缓解饲料禁用抗生素对养猪业带来的负面影响。β-防御素是宿主先天免疫的重要组成部分,具有抗微生物活性,其主要作用机制是破坏细胞膜结构,且不易产生耐药性,具有替代饲用抗生素的潜力。β-防御素还具有连接先天免疫和适应性免疫,减少感染、降低炎症和提高免疫的功能,是提高动物机体抗病力的潜在位点。本文将就猪β-防御素(porcine β-defensins,PBD)的表达与分布、生物学功能、表达调控以及异源表达进行综述,旨在为PBD的研究和应用提供参考。
1 PBD的表达与分布
防御素是一类含有3个二硫键的多肽,根据二硫键的连接方式不同可以分为α-防御素、β-防御素和θ-防御素[1]。α-防御素二硫键的连接方式是C1-C6、C2-C4和C3-C5,β-防御素二硫键的连接方式是C1-C5、C2-C4和C3-C6,θ-防御素二硫键的连接方式是C1-C4、C2-C5、C3-C6,连接形成环状结构。θ-防御素在旧大陆猴和猩猩中有表达,但人和新大陆猴中不表达,人能够表达α-防御素和β-防御素[2]。PBD1是被发现的猪的第1个β-防御素。它是用简并引物从猪舌的cDNA库中扩增获得的,定位在猪的染色体15q14-q15.1[3]。通过生物信息学分析,目前已经发现了29种PBD[4]。这些PBD的氨基酸组成类似抗菌肽,富含带正电荷的氨基酸,如赖氨酸和精氨酸。29种PBD基因主要定位在4个染色体上,分别是猪染色体SSC7、SSC14、SSC15和SSC17[4]。因为猪基因组不完整,所以PBD的数量并不确定,从目前研究结果来推测,可能与其他哺乳动物的类似,具有一系列的PBD[5]。系统发育分析发现PBD与人和牛的β-防御素有一定相似性,其中人和猪有27对直系同源β-防御素核酸序列的平均同源性达84.38%[4]。
PBD基因在机体的各个组织中广泛表达,尤其是机体第1道防线组织(小肠和肺)及重要免疫器官(脾脏和胸腺)表达丰度比较高。其中PBD4、PBD122和PBD129基因在各个组织上的表达丰度都比较高(图1)。猪的肾脏和睾丸广泛表达多种PBD基因,另有研究表明PBD115基因在2周龄仔猪的睾丸上高表达,而在5月龄猪的睾丸上检测不到,并且PBD115基因在肝脏上的表达与睾丸相反。PBD114和PBD133位点在同一染色体上并且相邻,但它们的表达模式不同,而PBD4和PBD129位点在不同的染色体上,但它们的表达模式相似,说明PBD基因的表达是独立的[4]。
2 PBD的生物学功能
2.1 抗微生物活性
研究表明,β-防御素具有抗细菌和抗病毒的活性,本文主要就PBD1和PBD2的抗微生物活性进行综述(表1)。不同来源的PBD1都表现出了抗细菌和抗病毒活性,例如:化学合成的PBD1具有抗大肠杆菌和枯草芽孢杆菌活性[6],内源表达的PBD1具有抗百日咳博德氏菌[7]和丙型肝炎病毒活性[8],大肠杆菌异源表达的PBD1具有抗大肠杆菌、金黄色葡萄球菌、伤寒沙门氏菌、单核增生李斯特菌和白色念珠菌活性[9-10]。PBD2的来源要多于PBD1,除了化学合成、内源表达和大肠杆菌异源表达外,PBD2的来源还有枯草芽孢杆菌异源表达[11]、毕赤酵母异源表达[12]和转基因猪过表达[13-14]。化学合成的PBD2具有抗假单胞菌[6]、鼠伤寒沙门氏菌[15]、伪狂犬病病毒[16-17]和猪繁殖和呼吸综合征病毒活性[18],由大肠杆菌异源表达的PBD2具有抗金黄色葡萄球菌和大肠杆菌活性,由枯草芽孢杆菌和毕赤酵母异源表达的PBD2的抗菌谱更广,具有抗鼠伤寒沙门氏菌、大肠杆菌、副嗜血杆菌、金黄色葡萄球菌、表皮葡萄球菌、枯草杆菌和小脓疱杆菌活性[11-12]。另外PBD2转基因猪也表现出抗A.pleuropneumoniae[13]和副猪格雷氏菌感染的能力[14]。除了PBD1和PBD2外,另有少数PBD的抗微生物活性有过研究,例如:内源表达的PBD3具有抑制猪繁殖和呼吸综合征病毒感染的活性[19],大肠杆菌异源表达的PBD114有微弱的抗大肠杆菌DH5α活性[20],大肠杆菌异源表达的PBD129也有微弱的抗大肠杆菌DH5α和异乳链球活性[21]。
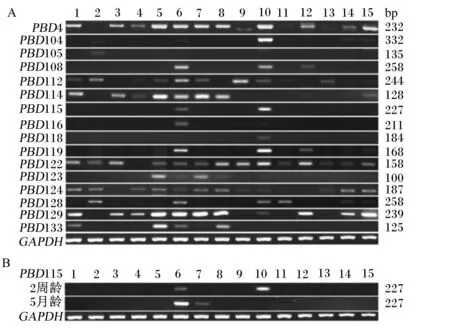
A:2周龄仔猪不同组织中PBD基因的表达丰度;B:2周龄和5月龄猪睾丸中PBD115基因表达丰度的变化。1:小肠;2:舌;3:眼睛;4:脑;5:脾脏;6:肾脏;7:肝脏;8:肺;9:胃;10:睾丸;11:肌肉;12:皮肤;13:直肠;14:气管;15:胸腺。PBD:猪β-防御素基因;GAPDH:甘油醛-3-磷酸脱氢酶基因。
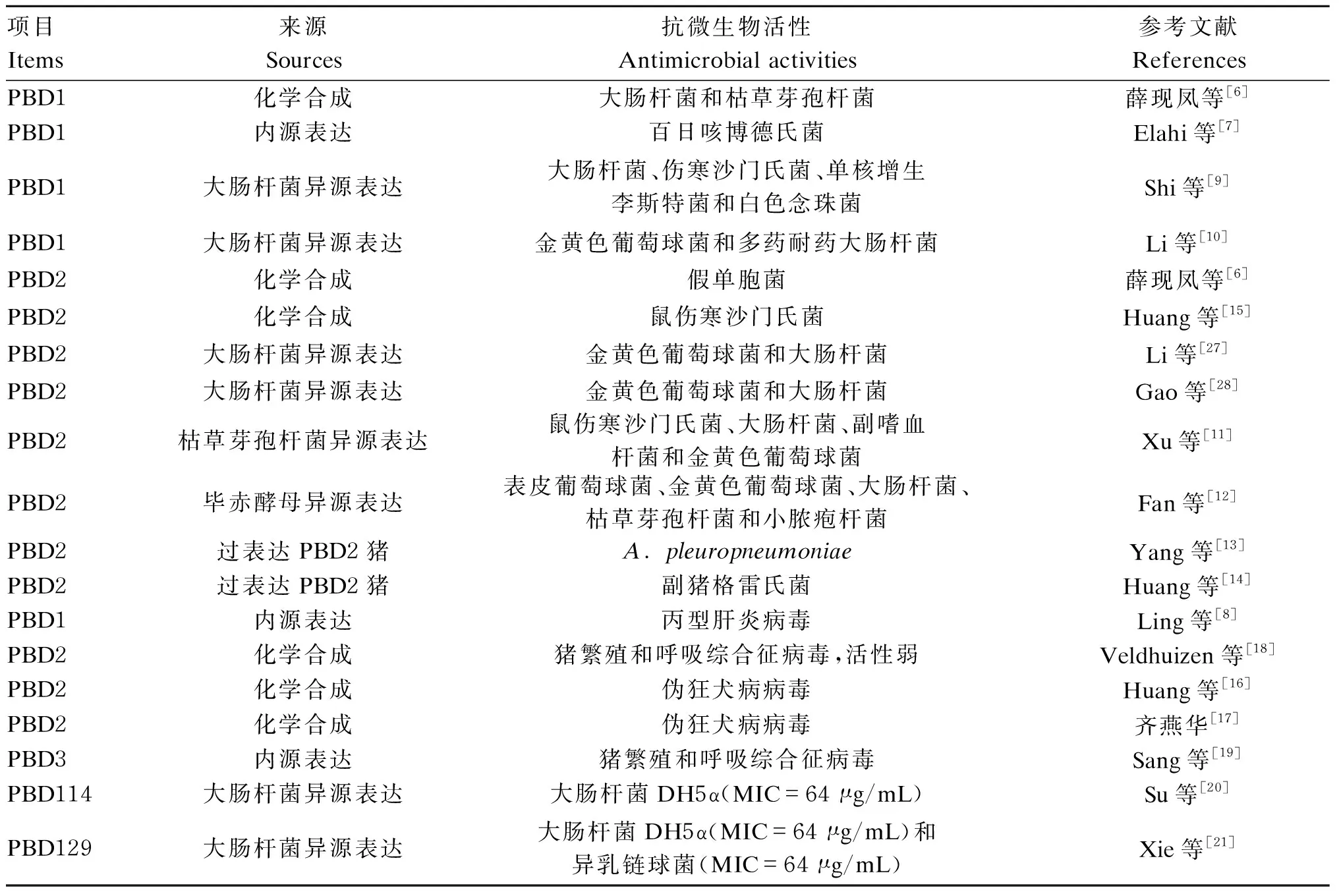
表1 PBD的抗微生物活性
抗菌肽的杀菌机制包括胞内和破膜两大方式,抗菌肽对胞内的靶点包括DNA、RNA和蛋白质等,破膜方式也有聚集体模型、环孔模型、桶板模型和地毯模型[22-23]。防御素是有3个二硫键的抗菌肽,具有抗菌肽的理化特性。透射电镜结果显示,PBD1和PBD2可通过跨膜孔的形成杀灭细菌[6]。经PBD2处理的鼠伤寒链球菌的透射电镜显示,相对低剂量的PBD2会导致细胞质膜收缩,而接近最小抑菌浓度(MIC)的PBD2会导致细胞质泄漏,细菌细胞完全裂解[18],这就表明PBD具有破坏病原菌细胞膜杀菌的机制。进一步的研究表明,PBD2主要定位到金黄色葡萄球菌的细胞膜,使细胞膜破裂、膨胀和穿孔,同时有少量直接进入细胞质。PBD2也能与涉及到跨膜运输、可遗传信息运输和其他代谢过程的DNA反应,最终杀死金黄色葡萄球菌[24]。PBD2可通过多种作用模式杀死大肠杆菌,主要机制是通过靶向细胞膜损伤后的细胞内分子来影响DNA转录和翻译,同时也会影响转运和代谢蛋白质[25]。有研究用精氨酸和赖氨酸取代了PBD2的8个氨基酸残基,这些突变蛋白对大肠杆菌和金黄色葡萄球菌表现出不同的抗菌活性,表明这些带正电荷的残基并不是影响其抗微生物活性的唯一因素,其他因素如这些残基在防御素表面的分布也可能影响其抗微生物活性[26]。
2.2 免疫调节功能
随着对防御素抗微生物活性研究的不断深入,人们发现防御素的抗微生物活性在生理盐水浓度下或者是在宿主其他生理条件下严重受损,过去20年的研究表明,防御素除了具有抗微生物活性外,还具有免疫调节功能,这有助于其抗微生物活性的发挥[29-31]。防御素具有多种多样的免疫调节功能,通过不同的机制直接作用于特定的细胞,可以诱导或抑制炎症反应,还可以与包括蛋白质、核酸和碳水化合物在内的细胞分子形成复合物来调节免疫反应[31]。然而对PBD免疫调节功能的研究比较匮乏且不够深入,主要研究了PBD的抗氧化能力、肠道屏障功能和抗炎活性。薛现凤[32]研究表明,PBD1和PBD2能够清除1,1-二苯基-2-三硝基苯肼自由基和羟基自由基,表现出一定的抗氧化能力。肠道黏膜屏障可以直接阻挡肠道病原微生物对宿主的感染,是保护机体的重要屏障,紧密连接蛋白和黏蛋白有助于维持肠道黏膜屏障的完整性,保持肠道正常生理功能。研究表明,PBD1和PBD2能够增加肠道紧密连接蛋白——闭合小带蛋白-1(ZO-1)、闭合小带蛋白-2(ZO-2)和封闭蛋白-1(Claudin-1)以及黏蛋白——黏蛋白1(Mucin1)、黏蛋白2(Mucin2)和黏蛋白20(Mucin20)基因或蛋白的表达[32-33],PBD129同样也能增强肠道紧密连接蛋白的表达[21]。在Caco-2细胞中,PBD2增加了跨上皮电阻和黏蛋白基因的表达,降低了细胞的通透性和凋亡,减少了结肠上皮的炎症浸润,同时保持了紧密连接的结构完整性[33]。过量的炎症因子会降低肠上皮细胞紧密连接蛋白的表达,破坏肠黏膜屏障的完整性。将人工合成的PBD2添加到猪饲粮中,能够降低空肠黏膜Toll样受体4(TLR4)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-8(IL-8)基因的表达[34]。而PBD129可通过降低小鼠血清中炎性细胞因子IL-1β、白细胞介素-6(IL-6)和TNF-α的浓度来缓解脂多糖诱导的炎症反应,高剂量PBD129显著降低脂多糖诱导小鼠的血清二胺氧化酶(DAO)活性,通过可调节凋亡相关基因[B淋巴细胞瘤-2基因(Bcl-2)和Bcl-2相关X蛋白基因(Bax)]和蛋白[半胱天冬酶-3(Caspase-3)和半胱天冬酶-9(Caspase-9)],降低肠上皮细胞凋亡[21]。体内试验研究表明PBD2能够降低硫酸葡聚糖钠(DSS)诱导的小鼠结肠炎性细胞因子(IL-8、IL-6和TNF-α)的基因表达和蛋白质翻译,可能是PBD2通过抑制蛋白激酶B(AKT)和核因子-κB(NF-κB)抑制蛋白(IκBα)的磷酸化,抑制NF-κB的磷酸化,从而抑制炎症调节分子诱导型一氧化氮合酶(iNOS)和环氧合酶-2(COX-2)的基因表达,以及降低一氧化氮(NO)和前列腺素E2(PGE2)的浓度来降低炎症[33]。
3 PBD的表达调控
3.1 病原微生物
动物感染病原微生物会引起免疫反应,首先是与病原微生物直接接触的先天免疫,可通过物理、化学和分子屏障阻止病原微生物入侵动物机体。研究发现病原菌(鼠伤寒沙门氏菌、大肠杆菌、链球菌和牛型结核杆菌)能够诱导PBD1、PBD2、PBD114和PBD129基因的表达[20,35-39],不同病原菌特异性地诱导相应的PBD基因的表达,例如:鼠伤寒沙门氏菌能够诱导PBD1基因表达,但是不能诱导PBD2基因表达[35],并且只有活的鼠伤寒沙门氏菌才能诱导PBD1基因表达。但是当把鼠伤寒沙门氏菌DT104灌注到生理状况更复杂的小肠中时,就不能诱导PBD1和PBD2基因表达[40]。病原体同样也能抑制PBD基因的表达,猪肺炎支原体通过阻断展开蛋白反应来抑制PBD2的产生,从而促进其在上皮细胞的黏附和感染[41]。
3.2 益生菌
益生菌是有益于宿主的微生物,能够抑制肠道有害菌群的定植,改善肠道菌群结构,从而减少疾病,提高畜禽生产性能[42-43]。近些年的研究表明,益生菌能够以非炎症方式上调PBD基因的表达,从而起到平衡肠道微生物的作用。例如:罗伊氏乳杆菌能够诱导IPEC-J2细胞的PBD2、PBD3、PBD114和PBD129基因表达[43];植物乳杆菌能够诱导哺乳仔猪空肠PBD2和PBD3以及回肠PBD1、PBD2和PBD3基因表达[44];植物乳杆菌ZLP001和罗伊氏乳杆菌LR1能够诱导PBD2基因表达[45-46]。罗伊氏乳杆菌诱导IPEC-J2细胞表达PBD基因具有时间效应,处理6 h时表达量最高,12 h后开始下降,并且PBD1基因表达基本不受罗伊氏乳杆菌的影响[43]。体内试验不同于体外试验,罗伊氏乳杆菌不诱导回肠PBD基因表达,但罗伊氏乳杆菌显著提高新生仔猪空肠PBD2以及结肠PBD2、PBD3、PBD114和PBD129基因表达,这种变化并不是由于罗伊氏乳杆菌的直接刺激造成的,而是通过增加结肠中丁酸的浓度,上调过氧化物酶体增殖物活化受体γ(PPARγ)和G蛋白偶联受体41(GPR41)基因的表达来调节肠道β-防御素的表达并改善肠道健康[47]。益生菌对PBD基因表达的诱导不仅具有时间效应,还具有剂量效应。Zhang等[48]研究发现,唾液酸杆菌B1在十二指肠黏膜早期定植,唾液中的PBD2基因表达水平随着肠上皮细胞暴露于唾液中而增加,并且与它的剂量呈正相关。正常生理状态下益生菌能够以非炎症方式上调PBD基因的表达;而当机体受到病原微生物感染时,益生菌又能降低由炎症方式诱导的PBD基因的表达,从而避免免疫过度激活对机体造成的损伤[49]。
3.3 脂肪酸
丁酸是一种挥发性短链脂肪酸,能够给肠上皮细胞提供能量,同时还具有调节免疫功能的作用。研究发现,丁酸能够显著诱导IPEC-J2细胞、3D4/31细胞和原代单核细胞的PBD2和PBD3基因表达,并且在断奶仔猪小肠上皮细胞上得到同样的结果,但是不影响PBD1基因表达[50-51]。丁酸钠能够诱导猪肾上皮细胞PK-15表达更多的PBD基因,能够强烈诱导PBD3、PBD128、PBD123和PBD115基因表达[52]。丁酸钠有一系列的类似物,包括甘油三丁酸、丁酸苄和4-苯基丁酸等,研究发现,它们对PBD基因表达的诱导作用与丁酸钠的相当[50,53]。中链脂肪酸辛酸和壬酸能够诱导IPEC-J2细胞的PBD1和PBD2基因表达,但是诱导强度要低于丁酸[50,54],胶囊包被棕榈油与未包被棕榈油相比可显著提高仔猪肠道PBD2和PBD129的分泌[55]。
3.4 氨基酸
近些年,氨基酸的功能性备受关注,尤其是氨基酸的免疫调节功能。研究表明,L-异亮氨酸能够诱导IPEC-J2细胞的PBD1、PBD2和PBD3基因表达,并且具有时间和剂量效应[56-58]。任曼等[57]研究了3种支链氨基酸和丙氨酸对IPEC-J2细胞的PBD基因表达的影响,发现对PBD基因表达诱导最强的是异亮氨酸,且3种支链氨基酸在诱导PBD基因表达时具有协同效应。精氨酸在机体内不仅能够参与鸟氨酸循环,还有重要的免疫调节功能。饲粮中添加L-精氨酸能够增加仔猪PBD1、PBD2和PBD3基因表达,也能增加间歇热处理的育肥猪PBD2基因表达[59];体外研究也得到类似的结果,L-精氨酸能提高猪胎儿皮肤纤维细胞(PFSF)的PBD1、PBD2和PBD3基因表达[60]。
3.5 其他
除了微生物、脂肪酸和氨基酸能够诱导PBD基因表达外,微量元素[56]、维生素[61]、功能性添加剂[62]和毒素[63]也能诱导PBD基因的表达,不同品种[64-65]和不同日龄[4]猪的PBD基因表达也不同。例如:Mao等[56]的研究表明,IPEC-J2细胞经过25或100 μmol/mL的硫酸锌处理12 h后,提高了PBD1、PBD2和PBD3的基因和蛋白表达;陈金永[61]研究发现,维生素A、维生素D和维生素E都能够调控PBD1、PBD2和PBD3基因的表达;染料木素和大豆苷元是大豆异黄酮的主要活性物质,能够诱导猪子宫内膜上皮细胞中PBD2基因表达,以及PBD2和PBD3分泌[62];呕吐毒素显著降低IPEC-J2细胞的PBD1和PBD3基因表达[63];抗病力高的地方品种猪,PBD基因的表达水平高于杜-长-大三元杂交猪[20,61,64-65]。
3.6 PBD基因表达的调控机制
综上所述,能够诱导PBD基因表达的因素很多,而不同因素对不同PBD基因的表达调控机制也有所不同,这就使PBD基因的表达调控机制变得非常复杂(图2)。研究发现丁酸能够上调PPARγ和GPR41基因的表达来调节肠道β-防御素的表达[47]。体外试验发现丁酸钠能够激活NF-κB诱导肾脏上皮细胞表达PBD基因,抑制丝裂原活化蛋白激酶(MAPK)信号通路能阻止丁酸钠对PBD基因表达的诱导[23]。苯甲酸钠通过激活NF-κB信号通路诱导肠上皮细胞表达PBD1和PBD3基因,并且这一过程依赖于Toll样受体2(TLR2)和TLR4[24]。辛酸和壬酸能够促进了组蛋白H3赖氨酸9(H3K9)在PBD1和PBD2启动子上的乙酰化,从而增加了PBD1和PBD2基因的表达[54]。任曼等[57]研究发现,抑制细胞外信号调节激酶(ERK)会降低β-防御素的表达,并且降低了由异亮氨酸诱发的ERK1/2和90 ku核糖体S6蛋白激酶(90RSK)的磷酸化,同时抑制沉默信息调节因子2相关酶1(Sirt1)信号通路降低异亮氨酸对β-防御素表达的促进作用,说明异亮氨酸能够通过Sirt1/ERK/90RSK信号通路调控IPEC-J2细胞的PBD基因表达。另外,Lan等[66]研究发现,L-精氨酸能够通过哺乳动物雷帕霉素靶蛋白(mTOR)信号通路增加IPEC-J2细胞的PBD基因表达。维生素A对不同的防御素的调控机制有所不同,维生素A通过NF-κB信号通路调控PBD2基因表达,通过丝裂原活化细胞外信号调节激酶(MEK)-ERK信号通路调控PBD1和PBD3基因表达[61]。

VA:维生素A vitamin A;TLR2:Toll样受体2 Toll-like receptor 2;TLR4:Toll样受体4 Toll-like receptor 4;PPARγ:过氧化物酶体增殖物活化受体γ peroxisome proliferator-activated receptor γ;GPR41:G蛋白偶联受体41 G protein-coupled receptor 41;ERK:细胞外信号调节激酶 extracellular signal-regulated kinase;MEK:丝裂原活化细胞外信号调节激酶 mitogen-activated extracellular signal-regulated kinase;mTOR:哺乳动物雷帕霉素靶蛋白 mammalian target of rapamycin;90RSK:90 ku核糖体S6蛋白激酶 90 ku ribosomal S6 kinase;H3K9:组蛋白H3赖氨酸9 histone H3 lysine 79;NF-κB:核因子-κB nuclear factor-κB;IκBα:核因子-κB抑制蛋白 inhibitor α of nuclear factor-κB;PBD:猪β防御素 porcine β-defensins;Degraded:被降解的。
4 PBD制备与应用
蛋白的生产方式主要有人工合成、直接提取和异源表达,目前用于研究的PBD主要是人工合成和异源表达。但是由于PBD氨基酸序列比较长,并且还有3个二硫键,合成难度比较大,因此异源表达是制备PBD经济有效的方式。用于制备PBD的异源表达方式主要是大肠杆菌,其次是毕赤酵母和枯草芽孢杆菌。表2总结了PBD的异源重组表达系统及其重组蛋白抗菌活性,发现毕赤酵母表达的PBD的抗菌谱要更广。通过重组枯草芽孢杆菌工程表达PBD2,在猪饲粮中添加该工程枯草芽孢杆菌可显著促进仔猪生长,降低腹泻发生率[11]。Tang等[34]使用合成的PBD2作为抗菌生长促进剂添加到饲粮中,发现每天摄入1 mg的PBD2可以提高仔猪的采食量、日增重以及空肠绒毛高度/隐窝深度,促进胰岛素样生长因子的表达,减少直肠中大肠杆菌、脆弱拟杆菌和链球菌的数量,并抑制促炎因子IL-1β、IL-8、TNF-α基因的表达。Peng等[67]使用毕赤酵母重组的PBD2替代抗生素应用于断奶仔猪,发现饲粮中添加5 g/kg的PBD2可以增加仔猪的采食量、日增重、十二指肠和空肠绒毛高度,并减少盲肠中致病菌的数量,降低腹泻发生率。因此,PBD2应用于仔猪生产中具有抗菌作用,可改善仔猪的生长性能,降低炎症细胞因子的表达,改善肠道形态指标,具有开发成饲用抗生素替代品的潜力。

表2 PBD的异源表达
5 小 结
PBD是猪重要的先天免疫分子,在猪的各个组织中广泛表达和分布。PBD表现出抗菌和抗病毒的活性,主要是通过破坏病原菌细胞膜,以及进入细胞影响DNA转录和蛋白质翻译来实现。PBD具有免疫调节功能,通过NF-κB信号通路降低宿主炎症,提高肠道紧密连接蛋白表达,改善肠道健康。微生物能够通过TLR2/TLR4-NF-κB/MAPK信号通路诱导PBD基因的表达抑制病原菌的感染,而营养素(脂肪酸、氨基酸和微量元素)能够通过Sirt1/ERK/90RSK+mTOR信号通路调节PBD基因的表达提高宿主的抗病力。在仔猪的应用中,PBD能提高生长性能,降低腹泻,具有替代饲用抗生素的潜力。然而,目前研究主要集中于PBD1和PBD2,对其他27种PBD的研究十分匮乏。对PBD仍需大量的基础性研究,其中营养素靶向调控PBD的内源表达和PBD免疫调节功能是未来研究的重点。
