热休克转录因子1和血管内皮生长因子在肝癌组织中的表达及其对血管生成的影响
2021-08-06肖亿侯晴晴张智施显茂龙中荣孙兴阮婕
肖亿 侯晴晴 张智 施显茂 龙中荣 孙兴 阮婕

【摘要】 目的 探討热休克转录因子1(heat shock transcription factor 1,HSF1)、血管内皮生长因子(vascular endothelial growth factor,VEGF)在肝癌组织中的表达以及对肝癌血管生成的影响。
方法 通过免疫组化法检测HSF1、VEGF在68例肝癌组织中的表达水平,分析其临床病理特征。通过siRNA沉默PLC/PRF5肝癌细胞HSF1基因表达。利用小管形成实验观察小管形成,ELISA实验检测细胞VEGF分泌情况,最后通过WB实验检测HSF1、pP13K、pAKT、mTOR蛋白的表达。
结果 免疫组化实验提示:HCC组织HSF1、VEGF在肝癌组织中的阳性表达率分别为67.65% (46/68)和66.18% (45/68),均高于癌旁组织的14.71% (10/68)和 19.12% (13/68) ,差异有统计学意义(P<0.001)。HSF1表达与HBsAg、肝内PVTT/HVTT形成、微血管侵犯、病理分期相关(P<0.05或0.01),与肿瘤大小等无关(P>0.05)。VEGF的表达与微血管侵犯、肝内PVTT/HVTT形成、病理分期相关(P<0.05或0.01),与 HBsAg、肿瘤分化程度等无关(P>0.05)。HSF1表达和VEGF表达呈正相关(r=0.287,P=0.018)。和Mock/PLC/PRF5组相比,sh/PLC/PRF5组明显抑制小管形成、VEGF分泌,下调HSF1、VEGF、pP13K、pAKT、mTOR蛋白的表达。
结论 肝癌组织中HSF1和VEGF的表达可促进肝癌肿瘤血管生成,其作用机制可能和P13K/AKT/mTOR通路有关。
【关键词】 肝癌;VEGF;HSF1;临床病理特征;信号通路
中图分类号:R737.7 文献标志码:A DOI:10.3969/j.issn.1003-1383.2021.05.004
【Abstract】 Objective To investigate the expressions of heat shock transcription factor 1 (HSF1) and vascular endothelial growth factor (VEGF) in hepatic carcinoma tissues and their effects on angiogenesis.
Methods The expression levels of HSF1 and VEGF in hepatocellular carcinoma tissues in 68 cases were detected by immunohistochemical experiment to analyze their clinicopathological characteristics. HSF1 gene expression of PLC/PRF5 cell was silenced by siRNA. Tubule formation was observed by tubule formation assay, the secretion of VEGF was detected by ELISA, and the expressions of HSF1, pP13k, pAkT and mTOR were detected by WB assay.
Results Immunohistochemical experiment showed that the positive expression rates of HCC tissue HSF1 and VEGF in liver cancer tissues were 67.65% (46/68) and 66.18% (45/68) respectively, which were higher than those in adjacent tissues (14.71% [10/68]and 19.12% [13/68]), and difference was statistically significant (P < 0.001). HSF1 expression was correlated with HBsAg, intrahepatic PVTT/HVTT formation, microvascular invasion and pathological staging (P < 0.05 or 0.01), but it was not correlated with tumor size (P > 0.05). The expression of VEGF was correlated with microvascular invasion, intrahepatic PVTT/HVTT formation and pathological staging (P < 0.05 or 0.01), but it was not correlated with HBsAg and tumor differentiation (P > 0.05). The expression of HSF1 was positively correlated with the expression of VEGF (r = 0.287, P = 0.018). Compared with Mock/PLC/PRF5 group, sh/PLC/PRF5 group could significantly inhibit tubule formation and VEGF secretion and down regulate the expressions of HSF1, VEGF, pP13K, pAKT and mTOR.
Conclusion The expressions of HSF1 and VEGF in liver cancer tissues can promote the angiogenesis of liver cancer tumor, and the mechanism of which may be related to PI3K/AKT/mTOR pathway.
【Key words】 liver cancer; VEGF; HSF1; clinicopathological characteristic; signal pathway
肝细胞癌(hepatocellular cancer,HCC)是全球常见恶性肿瘤之一,相关研究显示我国HCC发病率、病死率约占世界范围50%,且近年來呈逐渐上升趋势。HCC发生发展涉及多个病理阶段、多种分子改变,发展较快,预后较差[1]。热休克转录因子1(heat shock transcription factor 1,HSF1)通过编码蛋白质调控细胞内基因的稳态促进蛋白质合成、细胞增殖和糖代谢,参与HCC发生发展[2]。HCC新生血管的形成在促进肿瘤增殖、侵袭转移的过程中发挥重要的介导作用。血管内皮生长因子(vascular endothelial growth factor,VEGF)在HCC中高表达和不良预后呈正相关,这提示抑制HCC血管生成对患者预后有着重要意义[3]。但HSF1和VEGF表达在HCC中的相关性研究未见文献报道。因此,我们首先采用免疫组化法检测HCC组织中HSF1、VEGF的表达变化,并探讨其与临床病理特征的相关性及临床意义。接着通过siRNA沉默PLC/PRF5肝癌细胞HSF1基因表达,观察小管形成、VEGF分泌以及HSF1、VEGF、pP13K、pAKT、mTOR蛋白的表达,以便更进一步明确HSF1和VEGF相互作用对HCC血管形成的影响。
1 材料与方法
1.1 组织标本
收集2015年1 月~2018 年12月广西医科大学第五附属医院病理科存档的具有完整资料的68例HCC及癌旁组织标本。根据原发性肝癌规范化病理诊断指南[4],由两位资深病理医师采用双盲法重新阅片诊断。其中,男性42例,女性26例;年龄28~68岁,平均62岁;瘤直径≤5 cm者22例,>5 cm者46例;分化程度: 低分化24例,中分化29例,高分化15例;微血管侵犯47例。所有组织置入10%中性福尔马林中固定。该研究通过医院伦理委员会审查及批准,组织标本采集依据相关机构指导方针。所有受试者均签署书面知情同意,遵循医院伦理委员会审核的相关程序。
1.2 纳入与排除标准
纳入标准:(1)所选病例均为首次发现,术前均未行任何抗癌治疗。(2)患者的病理资料均完整。(3)均为原发性HCC。排除标准:(1)转移性HCC患者。(2)无手术治疗指征HCC患者。(3)合并其他部位恶性肿瘤的HCC患者。
1.3 细胞和试剂
PLC/PRF5细胞、HUVEC细胞购于中国科学院上海细胞库。鼠抗VEGF(ab1316) 购自Abcam公司,兔抗pAKT(#9614)、mTOR(#2983);鼠抗HSF1(#12972),pP13K(#17366),鼠二抗(#59997)、兔二抗(#7074)购自美国CST公司,免疫组化试剂盒购自北京中杉金桥公司。
1.4 方法
1.4.1 免疫组化实验
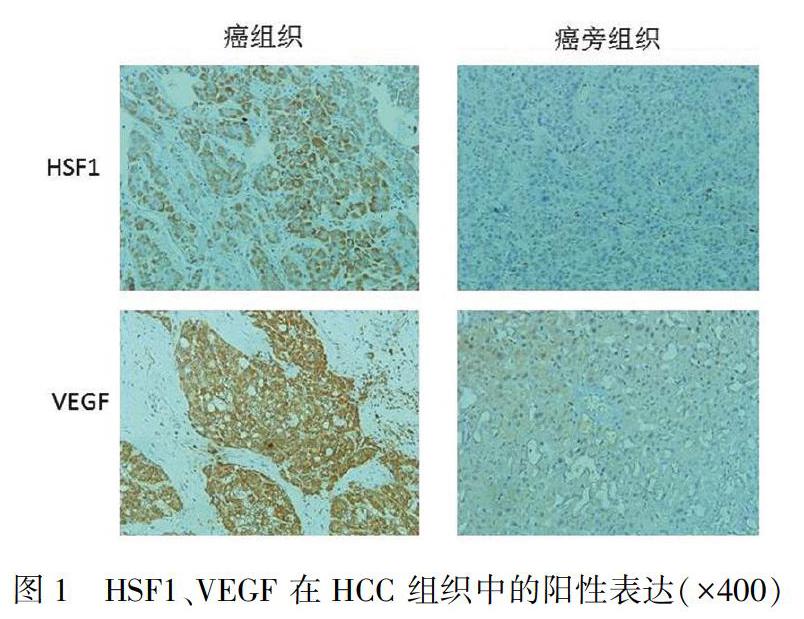
常规病理切片,行免疫组化SP 法检测HCC及癌旁组织中HSF1、VEGF表达水平。实验操作步骤严格按试剂盒说明。光学显微镜(OLIPICS电子显微镜购自上海精密仪器有限公司)下观察病理切片检测组织形态变化并记录实验结果。免疫组化结果判定:HSF1、VEGF的阳性表达呈棕黄色或棕褐色颗粒,主要位于肿瘤细胞膜和细胞质中,见图1。阳性判断采用半定量积分法[5],每张切片随机选取8个高倍视野,按照免疫组化染色反应的深度和阳性细胞分别记分,染色深度以多数细胞的呈色反应作为标准。浅黄色1 分,棕黄色2 分,棕褐色3 分,不着色0 分。阳性细胞数<5%为0 分,<10%为1 分,11%~50%为2分,51%~75%为3分,>75%为4分,将这两项积分相乘,<3为阴性,≥3为阳性。
1.4.2 细胞培养
PLC/PRF5细胞置10% FBS DMEM、37℃、5% CO2培养箱常规培养。HUVEC细胞置10% FBS DMEM,按 1∶3比例传代培养,取3~7代的细胞用于实验。
1.4.3 HSF1-siRNA瞬时转染PLC/PRF5细胞
由苏州吉玛基因股份有限公司设计合成和纯化针对HSF1基因的特异性siRNA 序列:上游5'-GCACATTCCATGCCCAAGTAT-3',下游5'- GGCCTCTCGTCTATGCTCC-3'。取对数生长期的PLC/PRF5 细胞,胰酶消化,按 1×105个/孔,接种于5 cm培养皿常规培养,待细胞密度达 75%左右进行转染。根据脂质体2000说明书转染PLC/PRF5细胞,分别获得Mock/PLC/PRF5细胞(对照组)和sh/PLC/PRF5细胞(实验组)。
1.4.4 Western blot 实验
Mock/PLC/PRF5和sh/PLC/PRF5细胞长至90%密度,胰酶消化离心收集细胞,每管细胞加400 μL裂解液(RIPA:PMSF/100∶1),冰上裂解30分钟,10 000 rpm,离心15分钟,留上清液。按照BCA试剂测细胞总蛋白浓度、制备蛋白样品。配置10% SDS聚丙烯酰胺凝胶,进行稳压电泳、转膜;PVDF膜用5%牛奶室温封闭液1小时,TBST洗涤3次,每次5分钟,加入目的抗体(1∶1000),4℃孵育过夜,TBST洗涤PVDF膜3次,每次5分钟,加入对应二抗(1∶2000)室温孵育2小时,TBST洗涤PVDF膜3次,每次5分钟。最后,加入ECL发光液,曝光、显影、定影、晾干保存、拍照记录实验结果。
1.4.5 ELISA实验
收集Mock/PLC/PRF5和sh/PLC/PRF5细胞培养基,按照ELISA试剂盒检测VEGF蛋白表达情况。实验重复3次。
1.4.6 小管形成实验
Matrigel基质胶置于4℃冰箱融化,按照50 μL/孔加入到96孔板,4℃冰箱孵育1小时。7代内的HUVEC细胞常规培养,离心收集细胞,细胞计数调整为2×105/mL,每孔加入50 μL细胞混悬液。收集Mock/PLC/PRF5和sh/PLC/PRF5细胞条件培养基,分别加入到96孔板中,每组设3个副孔。8小时后电子显微镜下观察HUVEC细胞小管形成,并拍照记录实验结果。实验重复3次。
1.5 统计学方法
采用SPSS 20.0软件进行数据处理,计量资料符合正态分布,以均数±标准差(±s)表示,组内比较采用配对样本均数t检验,组间比较采用两独立样本均数t检验,计数资料用例数和百分率(%)表示,组间比较采用χ2检验,Pearson相关性分析HSF1与VEGF相关性,检验水准:α=0.05,双侧检验。
2 结 果
2.1 HSF1与VEGF在HCC组织及癌旁正常组织中的表达情况
HCC组织HSF1、VEGF在肝癌组织中的阳性表达率分别为67.65% (46/68)和66.18% (45/68),均高于癌旁组织的14.71% (10/68)和 19.12% (13/68),差异有统计学意义(P<0.001)。HSF1、VEGF蛋白的阳性着色表达于细胞膜和细胞质中,癌旁组织细胞质HSF1未见阳性表达、VEGF弱阳性表达;仅在癌旁血管内皮细胞及血管基底膜细胞中见VEGF表达(见图1,表1)。在HCC组织中,HSF1与VEGF的阳性表达呈正相关(r=0.287,P=0.018)。
2.2 HSF1、VEGF表达与临床及病理特征的关系
HSF1表达与HBsAg、肝内PVTT/HVTT形成、微血管侵犯、病理分期相关(P<0.05或0.01),与肿瘤大小等无关(P>0.05)。VEGF的表达与微血管侵犯、肝内PVTT/HVTT形成、病理分期相关(P<0.05或0.01),与 HBsAg、肿瘤分化程度等无关(P>0.05)。见表2。
2.3 siRNA沉默PLC/PRF5细胞VEGF、HSF1、pP13K、pAKT、mTOR蛋白表达
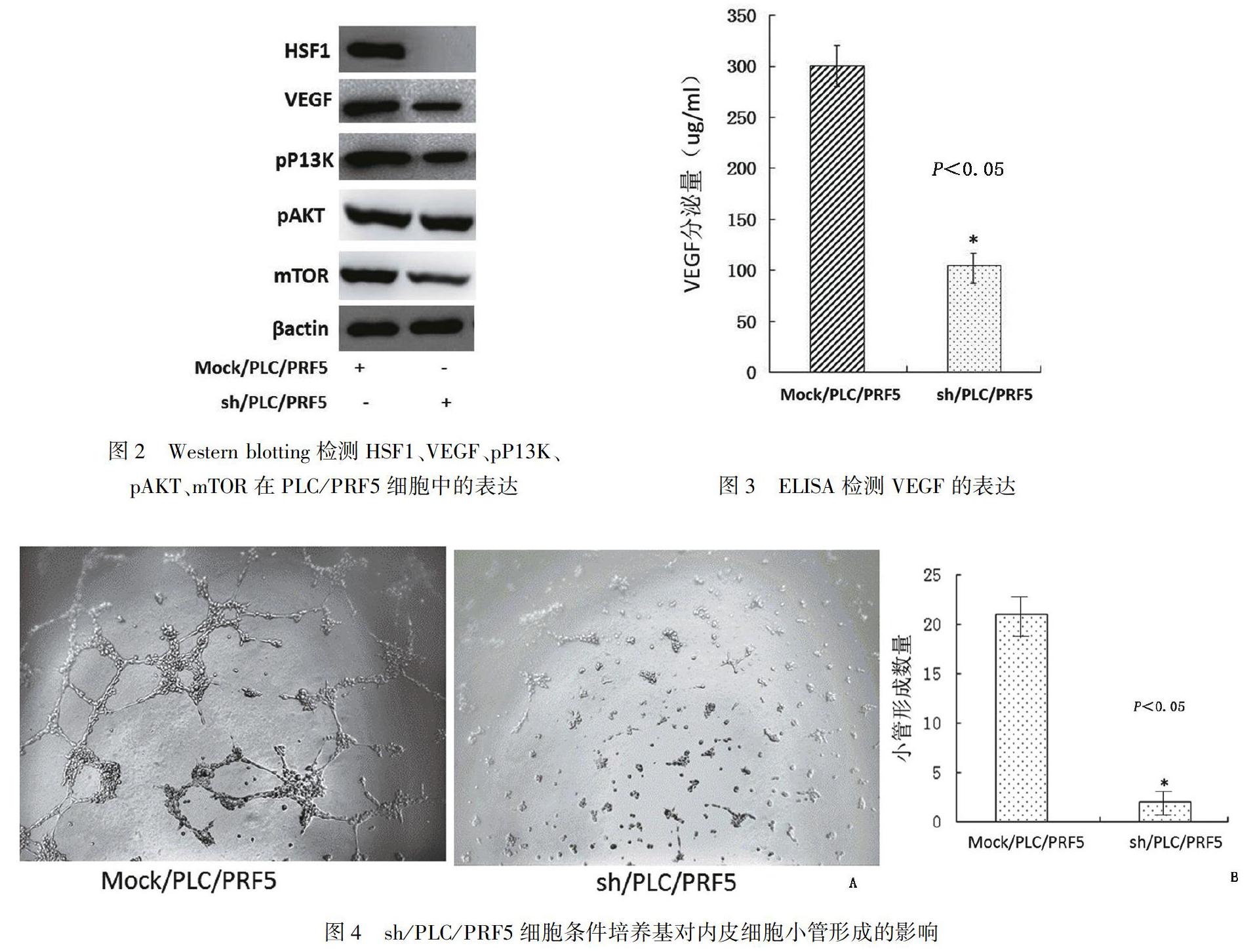
Western blot实验结果如图2所示:和Mock/PLC/PRF5组相比,PLC/PRF5细胞转染siRNA-HSF1质粒后,明显沉默HSF1、VEGF、pP13K、pAKT、mTOR蛋白表达。
2.4 ELISA实验检测PLC/PRF5细胞VEGF表达
ELISA实验结果如图3所示:和Mock/PLC/PRF5组相比,PLC/PRF5细胞转染siRNA-HSF1质粒后,明显抑制VEGF的分泌(P<0.05)。
2.5 小管形成实验检测sh/PLC/PRF5细胞条件培养基对内皮细胞小管形成的影响
小管形成实验结果如图4所示: Mock/PLC/PRF5细胞组接种后6小时,相邻细胞逐渐的突起组相比相互连接形成空腔,形成完整的网状结构。对照组sh/PLC/PRF5细胞条件培养基明显抑制内皮细胞生长,细胞退化未能诱导小管形成(P<0.05)。
3 讨 论
HCC属富血供肿瘤,血管生成被认为是其发生发展、侵袭转移的关键步骤。研究表明,HCC血管密度和肿瘤的不良预后呈正相关,这提示抑制HCC血管生成对患者预后有着重要意义[6]。抗血管生成药物索拉非尼目前在临床上广泛应用于晚期HCC患者的治疗并达到较为理想的治疗效果,但它仍面临着副反应和耐药性两大挑战[7]。虽然目前已有许多关于HCC血管生成各个步骤的研究,但对HCC血管生成的重要事件仍不清楚,无法实施精准靶向治疗。因此,深入研究HCC血管生成的分子机制,寻找新的更为有效的抗HCC血管生成抑制剂,具有非常重要的临床诊疗价值和社会价值。
活跃的血管生成能力和转移能力是恶性肿瘤主要特征,对肿瘤发生发展至关重要。肿瘤长到1~2 mm3,需要新生血管提供营养才能维持生长。新生血管壁的通透性高,肿瘤细胞可以穿透血管壁发生远处转移[8]。可见,血管生成是肿瘤发生、转移的基础,抑制肿瘤血管生成有望控制肿瘤的发生发展。研究表明许多恶性肿瘤细胞都具有自分泌VEGF 的能力,且VEGF 可与酪氨酸跨膜受体结合诱导血管内皮细胞的分化和成熟,并抑制内皮细胞凋亡,诱导新生血管生成,增加血管的通透性,促进癌细胞侵袭转移[9~10],提示VEGF有望作为其生物学标志物。
HSF1是调控热休克蛋白表达最关键的转录因子,由529个氨基酸组成,包括DNA结合域、三聚化结构域、调节结构域和转录活化域[11]。HSF1在非应激情况下以无活性单体的形式存在于细胞质中[12];在高温、缺血、炎症、氧化等应激状态下,HSF1转化为三聚体,诱导丝氨酸残基磷酸化,穿过核膜转移到细胞核,通过和热休克蛋白基因启动子结合形成热休克元件,诱导分子伴侣基因表达产生热休克蛋白(heat shock protein,Hsps),参与细胞分化、血管生成、增殖、凋亡、周期、转移和耐药[13]。
DU等[14]利用脂质体将过表达和沉默miR-199b-5p的质粒分别转染小鼠内皮细胞,结果发现,过表达miR-199b-5p组明显抑制内皮细胞侵袭和小管形成,同时下调HSF1和VEGF蛋白的表达。KUBO等[15]研究发现,HSF1敲除后的小鼠缺血组织VEGF、SDF-1、MVD均明显少于野生型小鼠,同时伴有骨髓干/祖细胞的减少,具体分子機制未明确。以上研究结果提示HSF1和VEGF相互作用具有促进血管新生的作用,可能是抑制血管生成靶点之一。
本研究发现,肝癌组织中的HSF1、VEGF蛋白表达阳性率均明显高于癌旁组织,差异有统计学意义,且HSF1与VEGF的阳性表达呈正相关。卢鹏[16]回顾性分析40例原发性肝癌组织的免疫组化结果,发现癌组织中的HSF1阳性表达水平为 62.5%(25/40),癌旁组织阳性率为 35%(14/40)。马薇等人[17]通过免疫组化实验检测94 例肝癌组织中VEGF 蛋白,癌组织阳性表达率为65.96%,癌旁组织阳性表达率为19.15%。这与本研究的结论较为一致。
近年来对分子生物学的研究正在逐步深入,肿瘤相关基因信号通路成为研究热点。与肝癌有关的细胞信号转导通路有:Ras/Raf/MEK信号通路、酪氨酸激酶信号转导通路、Notch信号转导通路、PDK/AKT信号通路、核转录因子kappaB(NF-κB)通路、Wnt通路和Hedgehog(Hh)信号通路等。其中P13K/Akt(phosphatidylinositol3 kinase-protein kinase B,P13K/Akt)信号通路在细胞中广泛存在,与肝癌细胞增殖、生长、分化、凋亡等密切相关[18]。研究发现,VEGF受体包括VEGF-1(Flt-1),VEGF-2(KDR)和VEGF-3(Flt-4),屬于跨膜酪氨酸激酶受体,分布在血管内皮细胞表面,通过特异性与VEGF结合,激发下游P13K/Akt/mTOR信号通路引起细胞内酶联反应,促进肝癌血管生成[19]。本研究发现,沉默PLC/PRF5肝癌细胞HSF1基因表达明显抑制小管形成、VEGF分泌,下调HSF1、VEGF、pP13K、pAKT、mTOR蛋白的表达。此外,研究表明RET基因过表达可激活P13K/Akt/mTOR信号通路,进一步诱导HSF1的表达,诱导血管生成,促进细胞恶性转化[20],这与本研究的结论较为一致。
综上所述,在临床及病理特点的关系方面,HSF1、VEGF 表达阳性者在Ⅲ期、肝内PVTT/HVTT形成、微血管形成方面比例较高,且在HCC组织中HSF1与VEGF的阳性表达呈正相关。沉默PLC/PRF5肝癌细胞HSF1基因表达明显抑制小管形成、VEGF分泌,下调HSF1、VEGF、pP13K、pAKT、mTOR蛋白的表达,提示HSF1可能通过VEGF调控P13K/Akt/mTOR信号通路参与了肝癌的血管生成,但本研究仅局限于初步研究,具体的分子机制还需要进一步实验验证,为以血管生成为靶点的靶向治疗提供新的实验依据。
参 考 文 献
[1]TIAN Z Q,HOU X J,LIU W T,et al.Macrophages and hepatocellular carcinoma[J].Cell Biosci,2019,9:79.
[2]LIU H T,HUANG D N,LI M M,et al.HSF1:a mediator in metabolic alteration of hepatocellular carcinoma cells in cross-talking with tumor-associated macrophages[J].Am J Transl Res,2019,11(8):5054-5064.
[3]YAO Y,WANG T Q,LIU Y J,et al.Co-delivery of sorafenib and VEGF-siRNA via pH-sensitive liposomes for the synergistic treatment of hepatocellular carcinoma[J].Artif Cells Nanomed Biotechnol,2019,47(1):1374-1383.
[4]中国抗癌协会肝癌专业委员会,中华医学会肝病学分会肝癌学组,中国抗癌协会病理专业委员会,等. 原发性肝癌规范化病理诊断指南(2015年版)[J].中华肝胆外科杂志,2015,21(3):145-151.
[5]俞武生,卢春丽,王在国,等.VEGF和MVD在术前接受过肝动脉栓塞化疗的肝癌组织中的表达及临床意义[J].中华普通外科学文献(电子版),2010,4(4):323-327.
[6]GONG X L,QIN S K.Study progression of anti-angiogenetic therapy and its combination with other agents for the treatment of advanced hepatocellular carcinoma[J].Hepatobiliary Surg Nutr,2018,7(6):466-474.
[7]ABDEL-RAHMAN O,LAMARCA A.Development of sorafenib-related side effects in patients diagnosed with advanced hepatocellular carcinoma treated with sorafenib:a systematic-review and meta-analysis of the impact on survival[J].Expert Rev Gastroenterol Hepatol,2017,11(1):75-83.
[8]RAMJIAWAN R R,GRIFFIOEN A W,DANG D D.Anti-angiogenesis for cancer revisited:Is there a role for combinations with immunotherapy?[J].Angiogenesis,2017,20(2):185-204.
[9]MAWALLA B,YUAN X,LUO X,et al.Treatment outcome of anti-angiogenesis through VEGF-pathway in the management of gastric cancer:a systematic review of phase II and III clinical trials[J].BMC Res Notes,2018,11(1):21.
[10]WANG B,LEE C W,WITT A,et al.Heat shock factor 1 induces cancer stem cell phenotype in breast cancer cell lines[J].Breast Cancer Res Treat,2015,153(1):57-66.
[11]CARPENTER R L,SIRKISOON S,ZHU D Q,et al.Combined inhibition of AKT and HSF1 suppresses breast cancer stem cells and tumor growth[J].Oncotarget,2017,8(43):73947-73963.
[12]BARNA J,CSERMELY P,VELLAI T.Roles of heat shock factor 1 beyond the heat shock response[J].Cell Mol Life Sci,2018,75(16):2897-2916.
[13]DAYALAN NAIDU S,DINKOVA-KOSTOVA A T.Regulation of the mammalian heat shock factor 1[J].Febs J,2017,284(11):1606-1627.
[14]DU P Z,DAI F J,CHANG Y W,et al.Role of miR-199b-5p in regulating angiogenesis in mouse myocardial microvascular endothelial cells through HSF1/VEGF pathway[J].Environ Toxicol Pharmacol,2016,47:142-148.
[15]KUBO M,LI T S,KURAZUMI H,et al.Heat shock factor 1 contributes to ischemia-induced angiogenesis by regulating the mobilization and recruitment of bone marrow stem/progenitor cells[J].PLoS One,2012,7(5):e37934.
[16]盧鹏.热休克转录因子1在人肝细胞癌中的表达及意义[D].西安:第四军医大学,2012.
[17]马薇,张书勤,魏柏,等.HDGF、VEGF与肝肿瘤组织MVD水平的关系及对肝癌病人预后的影响[J].蚌埠医学院学报,2018,43(2):178-180.
[18]YE R F,DAI N G,HE Q K,et al.Comprehensive anti-tumor effect of Brusatol through inhibition of cell viability and promotion of apoptosis caused by autophagy via the PI3K/Akt/mTOR pathway in hepatocellular carcinoma[J].Biomedecine Pharmacother,2018,105:962-973.
[19]JUNG K H,CHOI M J,HONG S,et al.HS-116,a novel phosphatidylinositol 3-kinase inhibitor induces apoptosis and suppresses angiogenesis of hepatocellular carcinoma through inhibition of the PI3K/AKT/mTOR pathway[J].Cancer Lett,2012,316(2):187-195.
[20]VYDRA N,TOMA A,WIDLAK W.Pleiotropic role of HSF1 in neoplastic transformation[J].Curr Cancer Drug Targets,2014,14(2):144-155.
(收稿日期:2020-12-09 修回日期:2021-04-12)
(编辑:梁明佩)
