霜疫霉侵染对不同荔枝品种果皮苯丙烷类代谢的影响
2021-08-04陈浩孙进华王树军李焕苓王果王家保
陈浩 孙进华 王树军 李焕苓 王果 王家保

摘 要:荔枝霜疫霉病是荔枝生產过程中的主要病害之一,严重影响荔枝品质和产量。本文以霜疫霉病抗病品种‘黑叶和感病品种‘桂味成熟果实为材料,研究霜疫霉悬浮孢子接种后果皮中苯丙烷类代谢通路相关酶活性及代谢产物含量的变化,分析苯丙烷代谢通路与荔枝对霜疫霉侵染抗性的关系。研究结果表明:抗、感病品种接种霜疫霉菌后,其苯丙氨酸解氨酶(PAL)和过氧化物酶(POD)活性均有不同程度的提高,且抗性品种‘黑叶的POD活性高于感病品种‘桂味。与之相反,‘桂味的β-葡萄糖苷酶(BGLU)活性高于‘黑叶。抗性品种‘黑叶的总酚、类黄酮和花色素苷含量高于感病品种‘桂味,而‘桂味的香豆素含量高于‘黑叶。接种霜疫霉菌后,总酚、类黄酮和花色素苷含量随贮藏时间的延长而逐渐下降,香豆素含量则有一定程度的升高。相关分析表明,上述指标与病情指数显著相关,暗示它们与荔枝对霜疫霉侵染的抗性密切相关。
关键词:荔枝霜疫霉病;苯丙烷类代谢;苯丙氨酸解氨酶;过氧化物酶;β-葡萄糖苷酶;香豆素
中图分类号:S436.67.1 文献标识码:A
Effects of Phenylpropanoid Metabolism in Different Litchi Varieties During the Infection of Phytophthora litchii
CHEN Hao1,2, SUN Jinhua1, WANG Shujun1, LI Huanling1, WANG Guo1, WANG Jiabao1
1. Environment and Plant Protection Institute, Chinese Academy of Tropical Agriculture Sciences, Haikou, Hainan 571101, China; 2. College of Plant Sciences and Technology, Huazhong Agricultural University, Wuhan, Hubei 430070, China
Abstract: Litchi downy blight is the most serious disease in litchi, which leads to the yield and quality loss of fruit. In this work, the mature fruits of the disease-resistant variety ‘Heiye and the disease-susceptible variety ‘Guiwei inoculated with Phytophthora litchii infection were used to test the changes of enzymatic activities and metabolisms involved in phenylpropanoid metabolic pathway. The results indicated that the PAL (phenylalanine ammonia lyase) and POD (peroxidase) activity of the resistant and susceptible varieties increased following the infection of P. litchii. The activity of the two enzymes was higher in the resistant variety than that in the susceptible one. In contrast, the BGLU (beta-glucosidase) activity in ‘Guiwei was higher than that in ‘Heiye. The contents of total phenols, flavonoids and anthocyanins in ‘Heiye were higher than that in ‘Guiwei, and the contents of all the three types of metabolites in the two varieties decreased gradually with the extension of storage time. However, the content of coumarin increased in both cultivars. Correlation analysis showed that the enzyme activity and the content of phenylpropanoid metabolites were significantly correlated with the disease index, which suggested that the biosynthesis of phenylpropanoid metabolites is closely related to the resistance of litchi against P. litchii.
Keywords: litchi downy blight; phenylpropanoid metabolism; phenylalanine ammonia lyase; peroxidase; beta-glucosidase; coumarin
DOI: 10.3969/j.issn.1000-2561.2021.06.026
荔枝霜疫霉病(litchi downy blight)由荔枝霜疫霉(Phytophthora litchii)侵染引起,是荔枝(Litchi chinensis Sonn.)主要病害之一,在荔枝生长的各阶段均可发生,主要侵染荔枝的嫩叶、幼茎、花和果实,严重时可导致荔枝减产80%,危害极其严重[1]。近年来,有关研究发现苯丙烷类代谢通路及其代谢产物对植物抵御病原菌的入侵发挥重要作用。植物体在受到生物因素与非生物因素胁迫时,苯丙烷类代谢中一系列中间产物、转化产物(如木质素、黄酮类、香豆素、绿原酸等)及关键性酶类(如苯丙氨酸解氨酶、过氧还物酶、肉桂醇脱氢酶等)在植物生理活动中起着重要调控作用[2-3]。植物受到生物胁迫与非生物胁迫时,其苯丙氨酸解氨酶(PAL)活性一般会增加,因而,PAL通常视为植物抗性的生理标记[4]。过氧化物酶(POD)能够催化多种酚类和非酚类化合物发生氧化还原,与植物防御功能紧密相关。诸多植物,如玉米、大豆、柠檬在真菌和病毒侵染过程中均显示出过氧化物酶在防御反应中的作用[5]。植物中β-葡萄糖苷酶(BGLU)能将木质素水解形成葡萄糖,是该过程的关键限速酶,关系着植物细胞壁的建构[6]。总酚、类黄酮和花色素苷是苯丙烷类代谢中重要的次生代谢产物。研究发现,海棠在锈斑和邻近组织中黄酮类、花色素苷的积累使得着色加深,表征防御机制的启动[7]。酚类植物抗毒素表现出抗生素和抗真菌活性,在植物生长发育中起着重要作用[8]。植物受到病虫害胁迫会分泌香豆素参与抗性过程,一方面作为植物抗毒素,自身特殊的气味能防止病虫危害;另一方面香豆素作为木质素合成前体,在植物受到外界胁迫时有利于细胞壁的木质化,提高植物的抗性作用[9]。目前,关于荔枝的霜疫霉病发病机制尚不清楚。前期研究发现,不同荔枝品种果实对霜疫霉侵染表现出不同抗性,通过评价鉴定得出‘黑叶和‘桂味分别对霜疫霉表现为稳定抗病和稳定感病[10]。本文研究霜疫霉侵染后,‘黑叶和‘桂味果皮中苯丙烷类代谢有关酶的活性及代谢产物含量的变化差异,探究苯丙烷类代谢在荔枝抗霜疫霉病中的作用,为进一步揭示荔枝对霜疫霉病的抗病机制,研发防控技术提供依据。
1 材料与方法
1.1 材料
采集‘黑叶和‘桂味八成熟果实,在1 d内运往实验室进行预处理。挑选成熟度一致、无损伤的健康果实,用蒸馏水清洗2次,室温条件下晾干10 min,备用。
将长满培养皿的霜疫霉菌(菌株HK-Ⅰ,本实验室分离保存)轻轻刮入纯水中,计算孢子浓度,配置浓度为4106个/mL孢子悬浮液。通过悬浮孢子液浸泡果实人工接种霜疫霉菌于上述果实,以不接种果实为对照。处理和对照果实置于保鲜盒中,每20个果实放置1个保鲜盒,果实之间彼此分开,均匀分布。
分别在接种后0、24、48、72、96 h时取样,每个时间点3个生物学重复,每个生物学重复20个果实。用干净的解剖刀小心剥离病健交界处果皮,使之不粘连果肉与果汁,液氮速冻,在高速研磨仪上研磨成粉,置于–80 ℃下冷冻保存备用。
1.2 方法
1.2.1 病情调查与统计 以接菌0 h的果实为准,每24 h观察1次果实发病情况,依据病情分级标准(表1)统计果实发病严重程度(果实病斑面积占果实面积比例),计算病情指数,至大部分果实发病。
病情指数=∑(s×n)/(N×S)×100(注:s为各级病情级别,n为各级别病果数,N为总果数,S为最高病情级别)。
1.2.2 提取液的制备 研钵先用液氮预冷,果皮粉末在液氮条件下继续研磨。取研磨后的果皮粉末样品1.0 g于10 mL离心管,低温条件下加入5.0 mL预冷的0.1 mol/L硼酸缓冲液(pH为8.8含0.1 g PVPP),涡旋震荡30 s,12 000 r/min、4 ℃下离心30 min,收集上清液用于酶活性测定。
取上述研磨过的果皮粉末样品0.5 g于5 mL离心管中,低温条件下加入1 mL预冷80%甲醇水溶液,涡旋震荡30 s,4 ℃条件下127 r/min摇床震荡提取12 h,然后12 000 r/min、4 ℃下离心10 min,将上清液转入10 mL离心管中。将第一次提取残渣重复上述步骤提取一次,收集最后提取液并定容至相同体积,最后提取液过0.22 μm滤膜,滤液用于香豆素含量测定。
1.2.3 测定方法 苯丙氨酸解氨酶(PAL)、过氧化物酶(POD)、β-葡萄糖苷酶(BGLU)、总酚、类黄酮、花色素苷的测定方法参照曹建康等[11]的方法;香豆素的测定方法参照马杰等[12]的方法。
1.3 数据处理
使用DPS数据软件进行数据分析处理[13],采用Excel软件进行绘制图表。
2 结果与分析
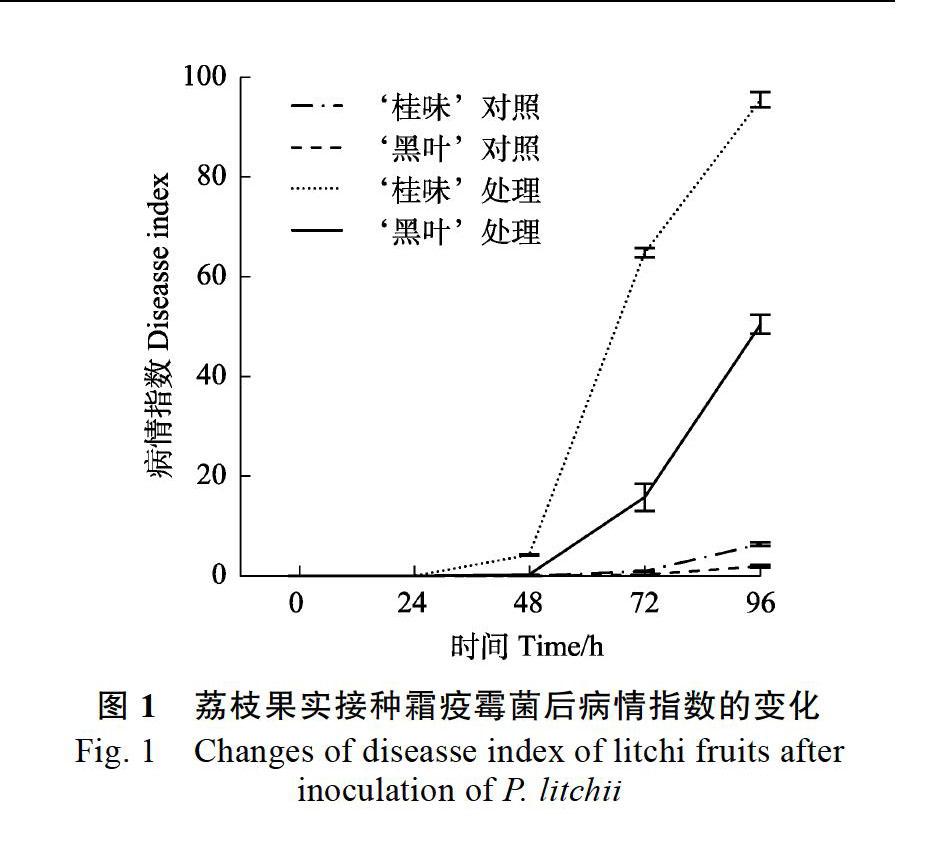
2.1 接种霜疫霉菌后荔枝病情指数的变化
荔枝未接种霜疫霉菌时,‘黑叶与‘桂味病情指数随时间变化不大。接种霜疫霉菌后,‘黑叶与‘桂味的病情指数均随时间呈逐渐上升趋势;2个品种的病情指数均在48 h开始急剧上升,此后均显著高于对照,96 h达到最大值。总体而言,接菌处理后,‘桂味病情指数的升高幅度明显大于‘黑叶(图1)。
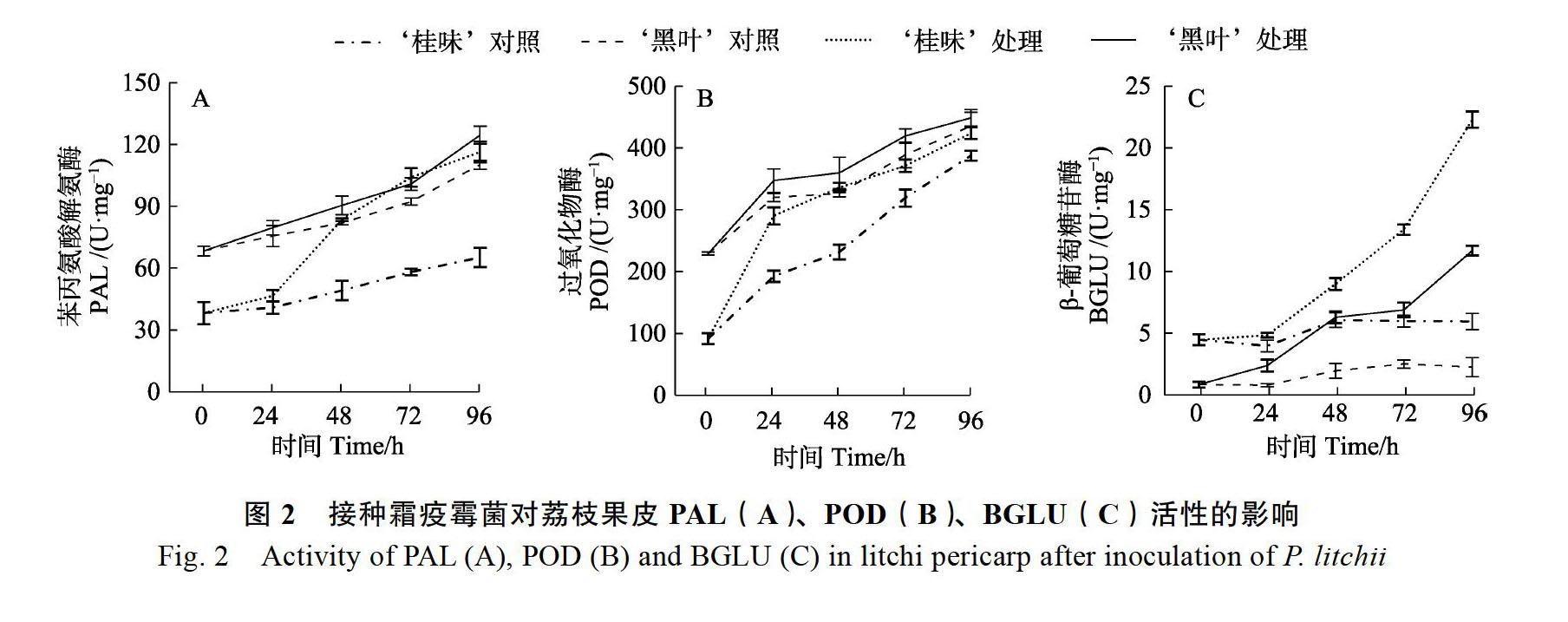
2.2 接种霜疫霉菌对荔枝果皮PAL、POD、BGLU活性的影响
2.2.1 PAL活性的变化 未接种霜疫霉菌的对照果实中,‘黑叶与‘桂味果皮的PAL活性均随时间平稳上升,但‘黑叶的PAL活性高于‘桂味。接种霜疫霉菌后,‘黑叶与‘桂味的PAL活性均呈逐渐上升趋势,且高于对照;‘桂味果皮PAL活性在24~48 h迅速上升,72 h时的PAL活性与‘黑叶相当,此后PAL活性继续缓慢升高;‘黑叶果皮PAL活性的變化幅度小于‘桂味(图2A)。
2.2.2 POD活性的变化 未接种霜疫霉菌的对照果实中,‘黑叶与‘桂味果皮的POD活性均随时间平稳上升,但‘黑叶的POD活性高于‘桂味。接种霜疫霉菌后,‘黑叶与‘桂味的POD活性均呈逐渐上升趋势,且高于对照;‘桂味果皮的POD活性在0~24 h迅速升高,96 h时的POD活性与‘黑叶接近;‘黑叶果皮POD活性的变化幅度小于‘桂味(图2B)。POD与病情指数呈正相关(r=0.425*,P<0.05)。
2.2.3 BGLU活性的变化 未接种霜疫霉菌的对照果实中,‘黑叶与‘桂味果皮的BGLU活性均随时间平稳上升,但‘桂味的BGLU活性高于‘黑叶。接种霜疫霉菌后,‘黑叶与‘桂味的BGLU活性均呈逐渐上升趋势,且高于对照;‘桂味果皮的BGLU活性在24~48 h迅速升高,此后BGLU活性继续缓慢上升,‘桂味的BGLU活性明显高于‘黑叶;‘桂味果皮BGLU活性的变化幅度大于‘黑叶(图2C)。
2.3 接种霜疫霉菌对荔枝果皮总酚、类黄酮、花色素苷含量的影响
2.3.1 总酚含量变化 未接种霜疫霉菌的对照果实中,‘黑叶与‘桂味果皮的总酚含量均随时间逐渐降低,但‘黑叶的总酚含量高于‘桂味。接种霜疫霉菌后,‘黑叶与‘桂味的总酚含量均呈逐渐下降趋势,且低于对照;96 h时2个品种果皮的总酚含量均达最低值;‘黑叶的总酚含量总体高于‘桂味(图3A)。总酚含量与病情指数呈负相关(r=-0.720**,P<0.01)。
2.3.2 类黄酮含量变化 未接种霜疫霉菌的对照果实中,‘黑叶与‘桂味果皮的类黄酮含量
随时间变化不大,但‘黑叶的类黄酮含量高于‘桂味。接种霜疫霉菌后,‘黑叶与‘桂味的类黄酮含量均呈逐渐下降趋势,且低于
对照;‘黑叶果皮的类黄酮含量在0~24 h迅速下降,此后,2个品种的果皮类黄酮含量均缓慢下降;‘黑叶果皮类黄酮含量均高于‘桂味(图
3B)。类黄酮含量与病情指数呈负相关(r=-0.698**,P<0.01)。
2.3.3 花色素苷含量变化 未接种霜疫霉菌的对照果实中,‘黑叶与‘桂味果皮中花色素苷含量均随时间逐渐下降,但‘黑叶的花色素苷含量高于‘桂味。接种霜疫霉菌后,‘黑叶与‘桂味的花色素苷含量均呈逐渐下降趋势;在接种霜疫霉菌48 h后,2个品种的果皮花色素苷含量均开始急剧下降,且低于对照,96 h时2个品种的果皮花色素苷含量均达最低值;‘黑叶的花色素苷含量高于‘桂味(图3C)。花色素苷含量与病情指数呈负相关(r=-0.633**,P<0.01)。
2.4 接种霜疫霉菌对荔枝果皮香豆素含量的影响
未接种霜疫霉菌的对照果实中,‘桂味果皮的香豆素随时间平稳上升,而‘黑叶的香豆素含量则无明显变化,但‘桂味的香豆素含量高于‘黑叶。接种霜疫霉菌后,‘黑叶与‘桂味的香豆素含量均呈上升趋势;在接种霜疫霉菌24~48 h,‘黑叶果皮的香豆素含量迅速上升;48 h时,2个品种的香豆素含量相当,此后,黑叶的香豆素含量呈缓慢下降趋势,而‘桂味的香豆素含量则持续上升,96 h时达最大值。总体而言,接种霜疫霉后,2个品种果皮香豆素含量均高于对照,‘桂味的香豆素含量高于‘黑叶(图4)。香豆素含量与病情指数呈正相关(r=0.637**,P<0.01)。
3 讨论
PAL、POD、BGLU是苯丙烷类代谢中的关键性酶类。PAL和POD与植物抗病性联系紧密,可以作为反映植物抗性水平的重要指标[14]。植物抗病性研究中植物细胞壁是抵御外來生物与非生物因子胁迫的第一道防护屏障,BGLU在其中起重要作用:一方面,参与植物细胞壁木质化的过程,从而影响植物对外界病虫生物的防御;另一方面,它使得植物中的激素和芳香化合物得以释放[15-16]。植物中的BGLU活性高有利于植物形成木质素和香豆素共同构建防御病原菌的结构与物质安全防护层,有效抑制病原菌在植株中的扩展和为害[17]。接种霜疫霉菌后,抗病品种‘黑叶的POD、PAL、BGLU活性随发病程度的加深而逐渐升高,而感病品种‘桂味的PAL、POD、BGLU酶活性则快速上升,酶活性的变化幅度较大,由于自身物质代谢基础弱,需要合成具有杀菌或抑菌活性的香豆素,因此对病原菌的侵染表现敏感。
植物通过分泌植物抗毒素——香豆素,散发出一种特殊气味,能有效防止病虫的危害,生物合成香豆素对植物抵御真菌病害发挥着重要作
用[18]。受到霜疫霉菌侵染后,感病品种‘桂味的抗性关键酶活性大幅提升,加快合成发挥主要抗菌作用的物质——香豆素;抗病品种‘黑叶受到霜疫霉菌侵染后抗性关键酶活性上升,但变化幅度不大。抗病品种‘黑叶植株体内原始积累的总酚、类黄酮、花色素苷高于感病品种‘桂味,这类物质对霜疫霉有很好的抗性,因此在抗病品种‘黑叶中香豆素并不是发挥主导作用的抗菌物质。
总酚、花色素苷等酚类物质在植物果皮中大量存在,且具有较高的生物活性和抑菌作用[19]。通过研究发现,荔枝及龙眼果实中活性氧及酚类代谢中POD活性增加,总酚和花色素苷含量明显下降[20-21]。本研究发现,接种霜疫霉菌后,抗、感病荔枝品种果皮的总酚、花色素苷、花色素苷含量均呈递减趋势,且低于对照,抗病品种的总酚、类黄酮、花色素苷含量高于感病品种。由此表明,酚酸类物质对植物抗病性的作用主要体现在荔枝品种本身的酚酸类物质含量有关,而与荔枝接菌后酚酸类物质含量的变化关系不紧密。
相关性分析显示,病情指数与PAL、POD、BGLU活性呈极显著正相关,与类黄酮、花色素苷、总酚含量呈极显著负相关,而与香豆素含量呈极显著正相关。说明这些酶活性和物质含量的变化显著影响了荔枝果实的发病进程,2个品种接种霜疫霉菌后发病进程不同,与这些物质含量和酶活性在成熟果皮中的本底大小及接种后的变化有关。
综上分析,感病品种‘桂味接种霜疫霉菌后,随着发病程度加深,抗性关键酶迅速调控香豆素的生物合成,并与总酚、类黄酮、花色素苷迅速联合作用参与对病原菌的防御,表现出对病原菌侵染较敏感;抗病品种‘黑叶主要依靠自身原始积累的高含量总酚、类黄酮、花色素苷进行积极防御,表现出较强抗性。抗、感病荔枝品种受到霜疫霉菌侵染后,果实发病越严重,苯丙烷类代谢中关键性酶变化和代谢产物生物合成趋向抵御不良生物因素方向发展,不同荔枝品种苯丙烷类代谢产物生物合成侧重点因品种抗性差异而不同。
参考文献
[675] Liu J, Liu A, Chen W. Studies on the biological characteristics of lychee downy blight[J]. Acta Horticulturae, 2005(665): 415-420.
[676] Ngadze E, Icishahayo D, Coutinho T A, et al. Role of polyphenol oxidase, perodase, phenylalanine ammonia lyase, chlorogenic acid and total soluble phennols in ressistance of potatoes to soft rot[J]. Plant Disease, 2012, 96(2): 186-192.
[677] Kamila K. The role of phenolic compounds in plant resistance[J]. Biotechnology and Food Sciences, 2016, 80(2): 97-108.
[678] Pandey V P, Bhagat P K, Prajapati R, et al. A defense associated peroxidase from lemon having dye decolorizing ability and offering resistance to heat, heavy metals and organic solvents[J]. Biochemistry & Analytical Biochemistry, 2016, 5(3): 1-10.
[679] Minaevaa O M, Akimovaa E E, Tereshchenkoa N N, et al. Effect of Pseudomonas bacteria on peroxidase activity in wheat plants when infected with Bipolaris sorokiniana[J]. Russian Journal of Plant Physiology, 2018, 65(5): 717-725.
[680] Lu Y F, Chen Q, Bu Y F, et al. Flavonoid accumulation plays an important role in the rust resistance of malus plant leaves[J]. Front Plant Science, 2017, 8(5): 1286.
[681] 孫明霞, 王宝增, 范 海, 等. 叶片中的花色素苷及其对植物适应环境的意义[J]. 植物生理学通讯, 2003(6): 688-694.
[682] 丁 锐. 国外花色素苷的研究现状与进展[J]. 汉中师范学院学报(自然科学), 2004(6): 73-78.
[683] 王富刚, 陈 花, 艾银婷, 等. 香豆素在植物Priming过程中的作用[J]. 基因组学与应用生物学, 2017, 36(5): 2094-2096.
[684] 曹璐璐, 孙进华, 王家保. 荔枝果实对霜疫霉侵染抗性评价体系建立及初步应用[J]. 热带作物学报, 2017, 38(1): 126-130.
[685] 曹建康, 姜微波, 赵玉梅. 果蔬采后生理生化试验指导[M]. 北京: 中国轻工业出版社, 2007: 123-135.
[686] 马 杰, 胡文忠, 毕 阳, 等. 鲜切果蔬苯丙烷代谢的研究进展[J]. 食品工业科技, 2012, 33(15): 391-393.
[687] Tang Q Y, Zhang C X. Data Processing System (DPS) software with experimental design, statistical analysis and data mining developed for use in entomological research[J]. Insect Science, 2013, 20(2): 254-260.
[688] Zhang C Z, Wang X, Zhang F, et al. Phenylalanine ammonia-lyase2.1 contributes to the soybean response towards Phytophthora sojae infection[J]. Scientific Reports, 2017, 7(6): 323-329.
[689] Vaiyapuri Balasubramanian, Divya V, Jean C, et al. Plant β-1,3-glucanases: Their biological functionsand transgenic expression against phytopathogenic fungi[J]. Biotechnology Letters, 2012, 34(11): 1983-1990.
[690] James R, Asim E. β-Glucosidases[J]. Cellular and Molecular Life Sciences, 2010, 67(20): 3389-3405.
[691] 李庆亮, 李 捷, 李夏鸣, 等. 细胞壁降解酶在苹果霉心病菌致病过程中的作用研究[J]. 中国农学通报, 2015, 31(31): 90-95.
[692] 張珊珊, 翟伟卜, 郭慧敏, 等. 香豆素合成途径关键酶基因Ghpal、Ghc4h和Gh4cl在棉花抗链格孢菌中的作用[J]. 植物病理学报, 2017, 47(2): 214-223.
[693] 吕泽芳, 江 东, 于 杰. 若干锦橙品种果皮酚类物质及其抗氧化与抑菌作用[J]. 果树学报, 2017, 34(2): 215-223.
[694] Wang J B, Wang X S, Xu B Y, et al. Physiological changes during the process of pericarp browning in the postharvest lithchi[J]. Agricultural Science & Technology, 2010, 11(5): 10-16.
[695] 林河通, 席玙芳, 陈绍军. 龙眼果实采后失水果皮褐变与活性氧及酚类代谢的关系[J]. 植物生理与分子生物学学报, 2005, 31(3): 287-297.
责任编辑:谢龙莲
