外周神经脱髓鞘病变在糖尿病神经病理性疼痛发生发展中的作用*
2021-07-30廖华宝胡江建张笑丹黄瑞紫宋学军
廖华宝 胡江建 张笑丹 黄瑞紫 宋学军△
(1 南方科技大学疼痛医学中心,深圳 518055;2 南方科技大学医院围术期医学部,深圳 518055)
糖尿病、癌症和心血管疾病位列我国乃至全球发病率最高的三大疾病,严重威胁人类健康。近年来,我国糖尿病患病率急剧上升,给社会发展带来严重挑战[1]。糖尿病神经病 (diabetic neuropathy) 是糖尿病中晚期常见的并发症。临床上,近50%糖尿病病人伴随神经病变,其中有25%~50%病人会产生糖尿病神经病理性疼痛 (diabetic neuropathic pain, DNP)[2]。DNP 症状包括针刺样疼痛、灼烧感、痛觉过敏、痛觉超敏、自发痛、感觉缺失等。DNP的发生发展机制包括高血糖引起血管病变和神经损伤。高血糖通过激活多元醇通路,造成山梨醇和果糖的大量堆积,形成胞内高渗透压,导致血管内皮细胞、神经细胞变性以及死亡。氧化应激和氮化应激产生大量活性氧和一氧化氮,增加血管通透性,促进糖尿病疼痛发展。高血糖引发晚期糖基化终末产物 (advanced glycation end products, AGEs) 聚集以及线粒体功能障碍,引起血管和神经病变[3,4]。神经病变多体现在轴突功能异常、轴突再生障碍、纤维密度降低、脱髓鞘病变,以及胶质细胞活性改变等。髓鞘是保护轴突,维持正常神经传导的结构基础[5]。在中枢或外周神经系统中,髓鞘病变都会导致神经功能异常和缺失[5,6]。研究表明,外周神经脱髓鞘病变是DNP 发生发展和维持的重要原因[6~8]。然而,针对DNP 的机制研究和临床治疗依然非常有限。传统的镇痛药对DNP 具有一定的疗效[9~11],但缺乏针对性,因此其效果有限。同时,这些药物的使用受到安全性、成瘾性和耐受等问题限制。
在研究糖尿病及其疼痛机制时,必须注意到临床上有一部分晚期糖尿病病人并不会出现明显的疼痛症状[12]。同样,在糖尿病实验模型中,并非所有高血糖个体都出现痛敏,但这一现象以及背后的机制在既往的研究中往往被忽视,直到最近证明并明确指出这个问题[13]。在糖尿病疼痛模型中,与正常组相比,具有两个变量—高血糖和疼痛。而糖尿病疼痛组与糖尿病非疼痛组之间,仅仅单一变量—疼痛,分析疼痛个体与非疼痛个体间的差异和关系,这对研究DNP的发生和发展机制至关重要。本研究着重探讨高血糖疼痛和高血糖非疼痛动物,在外周神经中的理化特性的差别及其对应的临床疼痛症状,为糖尿病疼痛的机制研究提供更精准可靠的动物实验模型分析。
方 法
1.药物、试剂和仪器
链脲佐菌素(sigma,美国),vonFrey filament(Aesthesio,美国),共聚焦荧光显微镜(Nikon,日本),RNA 提取试剂(Total RNA miniprep kit, Axygen),cDNA 合成试剂(AT311-03, Transgene),MBP抗体 (ab40390, Abcam),Alexa Fluor 488 (4412s, CST),透射电子显微镜(日立,日本)。
2.动物造模及分组
雄性C57BL/6 小鼠,体重20~25 g;雄性SD大鼠,体重220~250 g,购买自广东省医学动物中心,SPF 环境饲养,自由进食。本研究涉及的所有动物操作,均严格遵循南方科技大学动物伦理委员会的相关规定(伦理批准号SUSTC-JY2019144,SUSTC-JY2019095),由通过实验动物实验操作考核的人员参与执行。禁食12 h 后,实验组腹腔注射链脲佐菌素 (streptozocin, STZ),小鼠连续注射5 天,每天40 mg/kg;大鼠单次注射,剂量为70 mg/kg。对照组注射溶剂枸橼酸钠缓冲溶液。最后一次注射记为第0 天,此后每周测量动物空腹血糖,连续2 周血糖值高于13.8 mM(小鼠)[14]和16.7 mM(大鼠)[15],即视为成功的糖尿病模型,并根据其痛阈是否降低,分组如下:糖尿病疼痛组 (STZ-pain)、糖尿病非疼痛组 (STZ-nonpain)和对照组 (Control)。第42天取材。
3.机械痛阈值
造模前1 天和造模后第7、14、21、28、35、42 天测试机械痛阈。动物鼠置于金属网架的透明格子中,适应20 min,用vonFrey filament 测试。小鼠使用0.07 g~2 g 的纤维丝 (0.07 g、0.16 g、0.4 g、0.6 g、1.0 g、1.4 g、2.0 g),从0.6 g 开始使用。大鼠使用2 g~15 g 的纤维丝 (2 g、4 g、6 g、8 g、10 g、15 g),从2 g 开始,刺激动物后足底中部2~3 s,出现快速缩足或舔足反应,记为阳性 “1”,反之,为阴性 “0”。两次刺激之间至少间隔15 s。机械痛阈值计算在结果图中换算成力学单位毫牛顿 (mN)。
4.免疫荧光染色检测坐骨神经髓磷脂碱性蛋白
小鼠经异氟烷麻醉后,从心脏灌注0.1 M 的PBS 和4% PFA,取坐骨神经置于4% PFA 中固定24 h,随后置于30%蔗糖溶液脱水2 天,OCT 胶包埋组织并冰冻切片,切片厚度为20 μm,加入5%BSA(含0.3% TritonX-100)室温封闭1 h,然后使用MBP 一抗(1:100),4℃孵育过夜(> 18 h),次日用0.1 M PBS 洗涤5 min×3 次,加入二抗Alexa Fluor 488 (1:500),室温孵育1 h。之后用0.1 M PBS洗涤5 min×3 次。封片剂封片。共聚焦显微镜下拍摄。
5.坐骨神经mRNA 分析检测
小鼠经异氟烷麻醉后,心脏灌注0.1 M 的PBS,取坐骨神经,约1 cm 长,用RNA 提取试剂盒提取总RNA,并反转录成cDNA,用q-PCR 检测MPZ, MAG 和SOX 10 的mRNA 表达水平。
6.坐骨神经电镜观察
取坐骨神经,在2.5%戊二醛固定液中4℃过夜;更换新的2.5%戊二醛,后固定4 h;0.1 M 的PBS 漂洗15 min×3 次;1% 四氧化锇液固定2 h,PBS 漂洗15 min×3 次;乙醇和丙酮逐级脱水,每次10 min;置入环氧丙烷中30 min;纯包埋液37℃浸透2~3 h;包埋剂中4℃下固化2~3 天;制成超薄切片(厚度50 nm);最后依次用醋酸铀和枸橼酸铅染色,各30 min,电镜拍摄。统计各组的纤维厚度,髓鞘厚度以及g-ratio 值。g-ratio = 纤维内径/外径,g-ratio 值越大,表示髓鞘越薄。
7.统计学分析
采用GraphPad Prism 8.0软件统计并生成图表,Image J 软件统计免疫荧光的强度。所有计量数据均采用均数±标准误(±SEM)表示,行为数据采用two-way ANOVA 分析,Western blot、电镜、Q-PCR 以及免疫荧光结果多组间的比较采用one-way ANOVA分析。P< 0.05 为差异有统计学意义。
结 果
1. STZ 诱导血糖增高和机械痛阈值降低
腹腔注射STZ 后,小鼠体重增长缓慢甚至下降(见图1A),血糖逐渐升高,在第14 天达到峰值并趋于稳定,第42 天,78%的小鼠发展成糖尿病(见图1B,表1)。同时,第7 天起,部分小鼠机械痛阈显著下降(即STZ-pain);第14 天及之后,小鼠痛阈稳定,持续至实验结束;至第42 天,约72%的糖尿病小鼠出现显著机械痛敏,占总数56%(见图1C,表1)。但仍然有28%的糖尿病个体痛阈不变 (STZ-nonpain),占总数的22%(见图1C,表1)。
在SD 大鼠实验中,同样发现注射STZ 后第42天,95%动物发展成糖尿病(见图1D,1E,表1)。第12 天起,部分个体机械痛阈显著下降 (STZ-pain);第42 天,46%的糖尿病大鼠出现显著痛敏,占动物总数的43.8%,而54%的糖尿病大鼠的机械痛阈无显著变化 (STZ-nonpain),占动物总数51.3%(见图1F,表1)。这些结果表明,STZ 诱导的大小鼠糖尿病模型中,依然有相当一部分动物不出现明显的疼痛行为学症状。
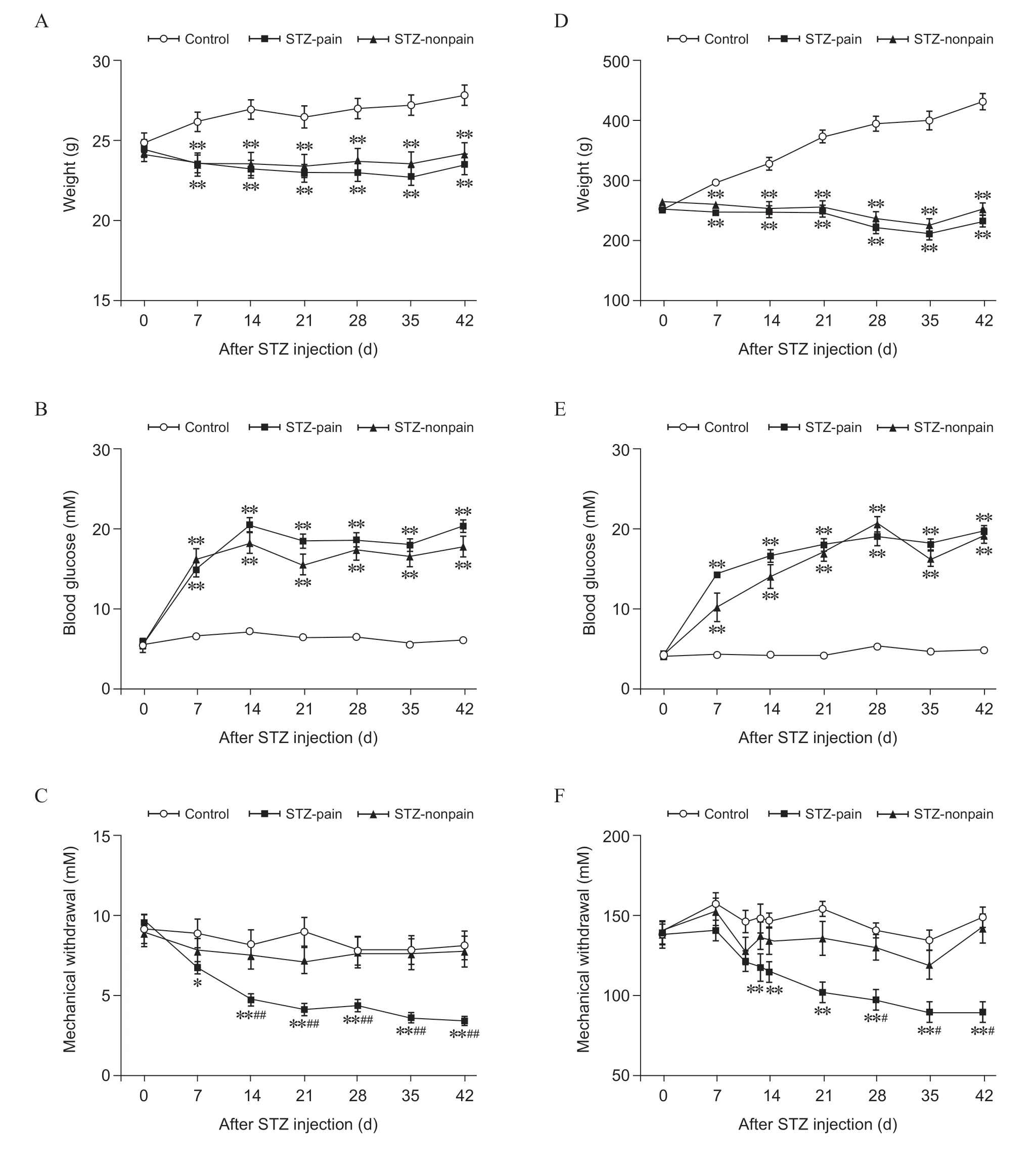
图1 STZ 诱导的糖尿病模型机械痛阈值改变(±SEM)Fig. 1 STZ-induced hyperglycemia and mechanical hypersensitivity (±SEM)

表1 STZ 诱导糖尿病性高血糖和机械性疼痛发生率Table 1 Incidence of STZ-induced hyperglycemia and mechanical allodynia in rats and mice
2.糖尿病神经病理性疼痛小鼠坐骨神经脱髓鞘病变
髓鞘病变导致神经功能异常和缺失,包括躯体感觉异常。对比糖尿病疼痛组(STZ-pain)和糖尿病非疼痛组(STZ-nonpain)小鼠的坐骨神经纤维形态可知,STZ 诱导的糖尿病疼痛组(STZ-pain)的g-ratio值显著大于对照组(Control)和非疼痛组(STZ-nonpain),而STZ-nonpain 组坐骨神经的形态无显著变化(见图2 A-C)。这些结果表明,糖尿病疼痛小鼠的坐骨神经髓鞘厚度显著低于对照组和糖尿病非疼痛组。在病理条件下,有髓鞘的传入神经纤维中,Aβ 和Aδ 纤维都参与伤害性信息的传递,特别是与机械痛敏密切相关[12]。在STZ-pain 组的坐骨神经中,直径小于5 μm 的纤维的g-ratio 值显著升高,即髓鞘厚度显著下降。而直径在5 μm 以上的纤维的g-ratio 值没有显著变化。STZ-nonpain 组中,g-ratio值虽有微弱升高,但并不显著(见图2D)。
对各组坐骨神经中的神经纤维内径(髓鞘以内的轴突直径)、外径(含髓鞘)以及髓鞘厚度进行统计分析结果表明,各组纤维的平均内径无差别(见图2E)。与对照组相比,STZ-nonpain 小鼠神经纤维的外径无显著变化(见图2F),髓鞘的绝对厚度降低,但仍显著高于STZ-pain 组(见图2G)。STZ-pain 组的外径和厚度均显著降低,且显著低于STZ-nonpain 组(见图2F,2G)。因此,STZ 诱导糖尿病后,机械痛敏小鼠的坐骨神经发生显著的脱髓鞘,但非疼痛个体无此病变。
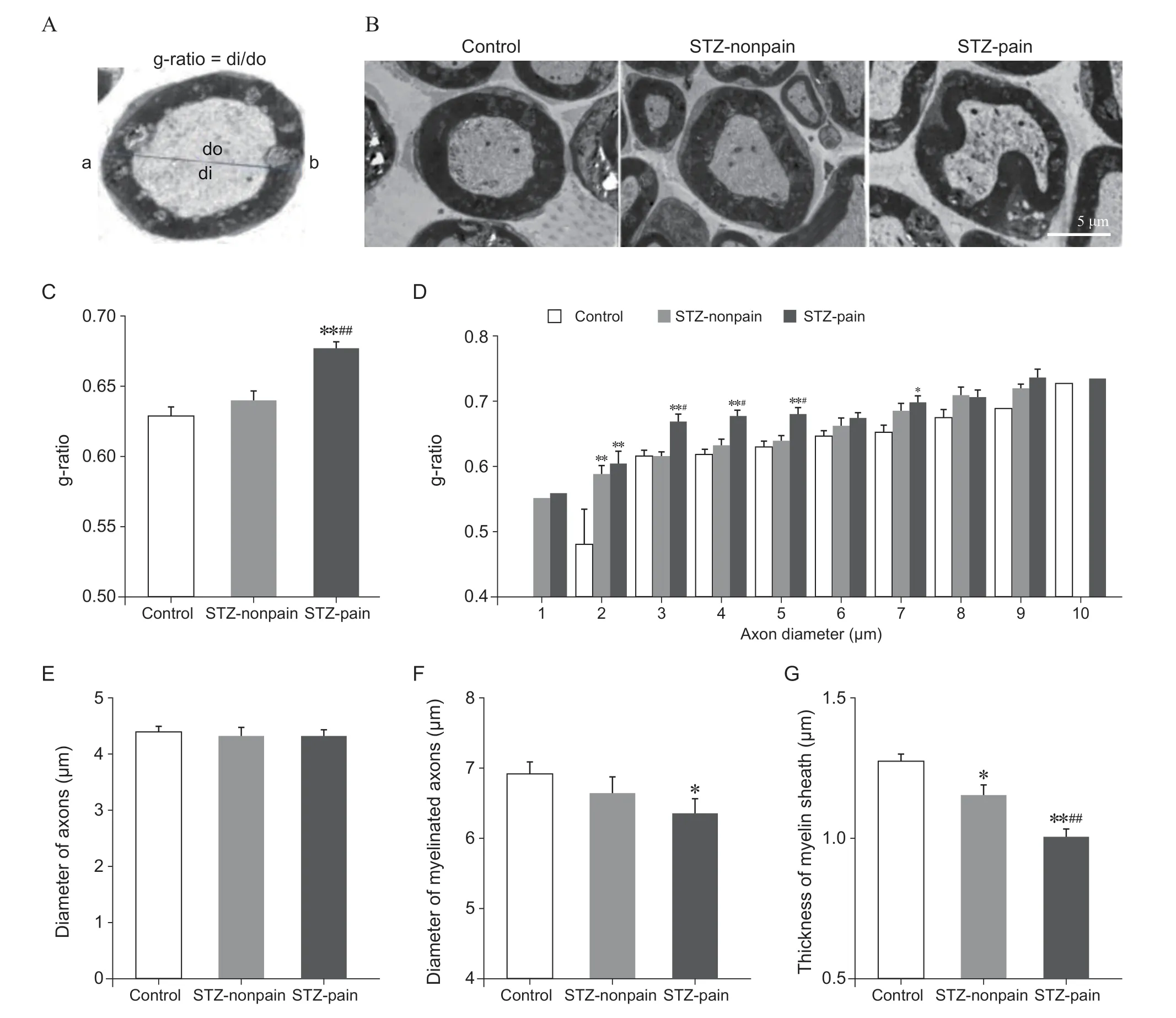
图2 STZ 诱导的糖尿病神经病理性疼痛小鼠坐骨神经脱髓鞘(±SEM)Fig. 2 STZ-induced demyelination of the sciatic nerves in STZ-pain mice (±SEM)
3. STZ 诱导的糖尿病神经病理性疼痛模型的坐骨神经髓鞘相关蛋白表达降低
髓鞘碱性蛋白 (myelin basic protein, MBP) 是一种富集在中枢神经系统少突胶质细胞和外周神经系统中的髓鞘膜蛋白,对髓鞘形成起着重要作用。免疫组化结果显示,STZ 注射后第42 天,STZ-pain和STZ-nonpain 组的MBP 蛋白表达量均下调(见图3A,3B)。与对照组相比,STZ-pain 组的MBP表达水平下降近41%,STZ-nonpain 组MBP 下调不足20%(见图3B)。
髓鞘蛋白P0 (myelin protein zero, MPZ)是外周髓鞘的一种主要结构组分,MPZ 基因的破坏会导致髓鞘形成减少和轴突的降解。髓鞘相关糖蛋白(myelin associated glycoprotein, MAG)在外周神经系统中由施万细胞形成,它与髓磷脂和髓鞘上其他分子之间的相互作用为轴突长期稳定所必需。STZ 诱导的STZ-pain 小鼠坐骨神经MPZ 和MAG 的mRNA 含量减少,而STZ-nonpain 组并无变化(见图3C,3D)。SOX10 作为髓鞘的标记分子,STZ 诱导高血糖及疼痛后,其mRNA 表达并未改变(见图3E)。综上结果表明,MBP 蛋白下降以及MPZ 和MAG 的mRNA 含量降低,与髓鞘的破坏呈正相关。
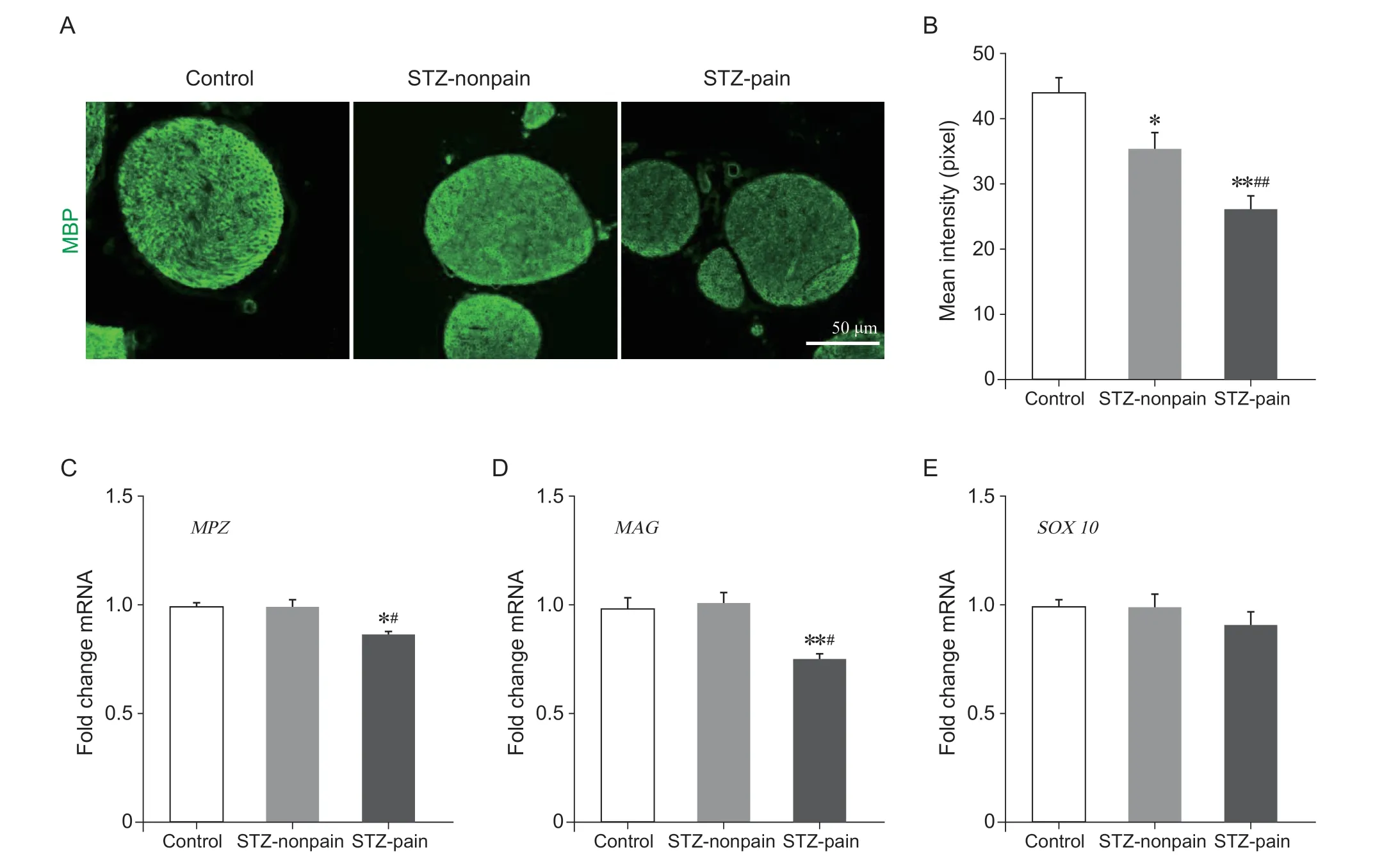
图3 STZ 诱导的糖尿病神经病理性疼痛小鼠的坐骨神经中MBP、MPZ 和MAG 表达变化(±SEM)Fig. 3 STZ-induced alteration of expression of MBP, MPZ, and MAG in the sciatic nerves in STZ-pain mice (±SEM)
讨 论
晚期糖尿病病人有明显的血管病变和神经病变,这些病变多发生于远端,尤其是四肢,并伴随严重的疼痛,这类疼痛与神经病变密切相关。同时,自发或STZ 诱导的糖尿病动物模型中,有相当比例动物并没有痛敏症状,这与临床观察病例情况是很相似的。既往有关DNP 的基础研究中,常进行简单的对照和治疗组间的比较分析,忽略糖尿病中很多个体存在疼痛和无疼痛的差别。DNP 组与正常组之间存在诸如血糖浓度、痛阈等多种变量,使研究结果的分析复杂化,结论不够明确或者模糊不清。本研究区分糖尿病鼠中疼痛和非疼痛个体,发现STZ 诱导的大小鼠糖尿病模型中,仅半数出现机械痛阈下降。小鼠糖尿病模型中,78%出现持续高血糖。但仅56%的个体高血糖并伴随痛阈降低。大鼠糖尿病模型中,95%出现持续高血糖,只有43.8%痛阈下降,另51.3%痛阈不变。本研究大鼠和小鼠采用不同的STZ 注射方式,他们的高血糖发生率差别较大,这可能提示大鼠和小鼠对STZ 的反应以及抵抗程度不同,其具体原因尚待探究。根据糖尿病动物的痛阈差异,将动物分成糖尿病疼痛和非疼痛个体,进一步分析了其外周神经的病变情况。
外周神经系统中,施万细胞包裹着轴突,并形成髓鞘。已有报道糖尿病病人常伴随有外周神经损伤,例如轴突损伤、纤维缺失、髓鞘的降解。糖尿病性神经病变更易损害感觉神经,直到晚期才发生运动神经(有髓鞘)和功能的损伤[16],这揭示了无髓鞘的神经纤维更易受到侵害损伤,最终导致轴突损伤甚至丧失。本研究分析了糖尿病疼痛和非疼痛个体的坐骨神经髓鞘的变化,发现糖尿病疼痛组的髓鞘g-ratio 高于非疼痛组,髓鞘厚度降低;主要传递伤害性信息传入的中小直径纤维的髓鞘降低更加显著。同时,糖尿病非疼痛组的神经髓鞘并无显著变化。为进一步探讨引起髓鞘改变的原因,检测了与坐骨神经髓鞘生成和维持相关的分子 (MBP, MPZ和MAG) 的表达情况。STZ 注射后第6 周,相比糖尿病非疼痛组,糖尿病疼痛组的MBP 蛋白下调,MPZ 和MAG 的mRNA 显著下降,这与坐骨神经脱髓鞘现象一致。MBP 等分子的表达减少可以引起施万细胞损伤,进而引起髓鞘缺损和厚度降低。轴突失去髓鞘保护后,容易受到来自病变组织和血液中炎性因子和ROS 等分子的攻击,导致轴突损伤甚至缺失[17]。同时,生理状态下施万细胞参与葡萄糖代谢,产生乳酸,可以为轴突供能;高血糖状态下,施万细胞产生过量乳酸,引起轴突酸中毒,激活酸敏感通道和TRPV1 等,引起疼痛[18]。这些结果更加准确地表明,外周神经髓鞘的病变和缺失对DNP的发展和维持至关重要。
本研究并未深入探索脱髓鞘的关键分子机制和改善方案,以及在糖尿病疼痛的发生发展过程中髓鞘的动态变化,髓鞘的改变在糖尿病的发生和发展阶段的作用有待进一步研究。治疗糖尿病疼痛的药物很多,包括5-羟色胺再摄取抑制剂、三环类抗抑郁药、抗惊厥药、吗啡、以及辣椒碱等局部用药。前四类为全身用药,不良反应多,而局部用药不良反应小。基于糖尿病神经病及疼痛成因的复杂性,单独用药效果并不理想,现多应用联合用药缓解和治疗糖尿病疼痛。已知甲钴胺、生长因子、维生素等营养类药物可以促进磷脂的合成,修复髓鞘,促进神经修复,缓解神经病变和疼痛[19~21]。因糖尿病外周神经病变多发生于四肢末端,可考虑局部用药,促进髓鞘再生和神经修复。结合本研究结果,修复髓鞘是减轻DNP 的治本性有效策略。
综上所述,本研究强调糖尿病疼痛个体和非疼痛个体的差别,将分析的变量控制为单一因素—痛觉异常,通过比较糖尿病疼痛组和非疼痛组的髓鞘特性,更精确地说明了坐骨神经脱髓鞘在DNP的发展和维持阶段的重要作用,进一步为DNP 的药物研究和临床治疗提供理论依据。
