基于附壁生长病理特征的肺腺癌研究进展
2021-07-30周慈航何帆樊剑胡珍丽韩一平
周慈航 何帆 樊剑 胡珍丽 韩一平
1海军军医大学附属长海医院全科,上海 200433;2海军军医大学附属长海医院呼吸内科,上海 200433;3中国人民解放军 73021部队,杭州 310007
肺癌不仅是全球最常见的恶性肿瘤之一,也是癌症死亡的首要原因[1]。2020 年全球肺癌死亡180万例(18%),远超其他癌症类型[2]。腺癌是非小细胞肺癌(non-small-cell lung cancer,NSCLC)中最常见亚型,在分子生物学、病理学、放射学和外科学等领域都取得飞速进展,这些研究需要转化并整合到临床中,以改善患者预后。普遍认为,附壁生长模式的腺癌细胞是非侵袭性成分[3],生物学行为与其他肺腺癌迥然不同。本文结合2021年WHO 最新公布的第5 版肺肿瘤分类,对肺腺癌的附壁生长特征做一综述,为临床选择合理的诊疗策略提供借鉴和帮助。
一、病理分类
附壁生长是指肿瘤细胞沿着完整的肺泡壁表面增殖,没有间质、血管或胸膜侵犯[4] (图1)。“lepidic”源于拉丁语,意指衬覆在肺泡壁上,呈“贴壁状”外观。附壁生长可被分为不典型腺瘤样增生(atypical adenomatous hyperplasia,AAH)、原位腺癌(adenocarcinoma in situ,AIS)、微浸润性腺癌(minimally invasive adenocarcinoma,MIA)以及附壁型腺癌(lepidic adenocarcinoma,LA)(表1)。
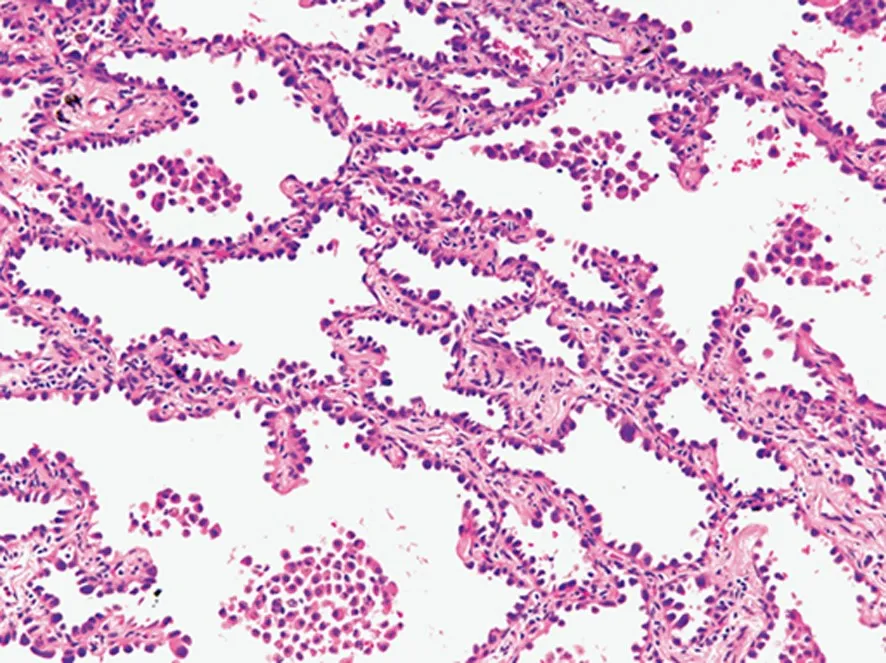
图1 附壁生长 HE ×200
(一)肺腺癌分类发展简史
“lepidic”一词的起源,人们已经进行了广泛讨论。Liebow[5]于1960年命名“细支气管肺泡癌(bronchioloalveolar carcinoma,BAC)”一词,用来描述一种分化良好的腺癌。但他的定义仍然过于模糊,对于BAC 的病理诊断容易引起混淆。2004年,WHO 发布指南[6],将BAC 定义为沿肺泡壁呈附壁生长的腺癌,无间质、血管或胸膜侵犯,包括黏液性和非黏液性亚型。此外,他们详细描绘了混合型肺腺癌,即腺癌同时伴有细支气管肺泡癌和间质浸润性成分。
随着影像学、组织学和免疫组织化学的不断发展,明确非小细胞肺癌亚型越来越重要。然而,侵袭性成分的范围不明确,使肺腺癌的亚分类一直很困难。在这种背景下,2011年国际肺癌研究协会、美国胸科学会和欧洲呼吸学会(IASLC/ATS/ERS)联合提出新的肺腺癌分类系统[7],为多学科管理提供了统一的术语和诊断标准,得到2015年WHO 肺腺癌分类的采纳[8]。然而,该分类不再使用“BAC”的名称[9],无法体现出附壁生长的良性生物学行为特点。因此,第5 版肺肿瘤分类[10]进行了重大调整,把AAH 和AIS与腺癌分开大类列出。此次WHO将肺原位腺癌剔除出肺恶性肿瘤,从基础研究到临床诊疗都必将产生一系列深远影响。
(二)组织形态学
目前,肺腺癌的发病率已经明显超出鳞癌而成为肺癌中发病率最高的类型,肺腺癌的组织学类型包括附壁型、腺泡型、乳头状型、实体型及变异型(黏液腺癌、胶样癌、胚胎性癌、肠型腺癌)。附壁生长的腺癌在所有NSCLC 中发病率为15%~20%[11]。越来越多的证据表明,肺腺癌的组织学不均一性意味着肿瘤个体的预后也存在差异[12-13]。例如,具有微乳头状或实体型的混合亚型肿瘤的预后明显比其他亚型差[14-15]。
1、不典型腺瘤样增生与原位腺癌
第5版肺肿瘤新分类将AAH 和AIS共同列入腺体前驱病变,而不再称为浸润前病变。这里一并作述。
AAH 是一种局限性的、通常≤0.5 cm、轻度到中度的非典型增生,Ⅱ型肺细胞和/或Clara细胞排列在肺泡壁上呈附壁生长,替代呼吸终末单位的正常细支气管肺泡上皮。AIS是一种小到中等直径(≤3 cm),单纯附壁生长的孤立性肿瘤病变,最接近原来的非黏液性BAC。AIS 典型细胞学特征呈立方状或柱状,相对一致,轻至中度异型,细胞核淡、小、单形,染色质细,核仁不明显。肿瘤细胞排列整齐的条带和小的扁平单层细胞沿着肺泡壁“钉突样”生长也是AIS的一个特征[16]。
在AAH 和AIS之间存在连续的形态学变化,使得这两种实体的鉴别具有一定的挑战性。总的来说,细胞密度、多型性和细胞大小有助于区分。在AIS中,细胞异型性可能比AAH 更明显。AIS病变通常>0.5 cm,细胞异型性通常比AAH 更明显。AIS又分为黏液性和非黏液性两种,虽然大多数AIS病变是非黏液性AIS,但也有一些黏液性AIS病例报道[17]。多项研究表明,AIS 的5 年无病生存率为100%[3,16]。此外,AAH 须与反应性肺细胞增生相鉴别。

表1 肺腺癌附壁生长病理类型及特点
2、微浸润性腺癌
MIA 是一个中等大小的孤立性病变(≤3 cm),浸润灶直径≤5 mm,呈附壁生长和局限性侵袭。侵袭性病灶可以是单灶或多灶性的[17]。浸润性成分包括除附壁生长以外的任何组织学模式(即腺泡状、乳头状、微乳头状或实性等),或由浸润肌纤维母细胞间质的单个肿瘤细胞巢构成[18]。MIA 不适用于侵犯淋巴管、血管或胸膜的肿瘤或含有坏死的肿瘤。当有多个独立的肿瘤存在时,AIS和MIA 只有在病变为同步原发灶而不是肺内转移时才应该被诊断。大约1/3的肺腺癌具有明显的附壁生长成分,其中近1/3 被认为是MIA[19]。多个研究中MIA 已经被证明拥有100%的5年无病生存率[16,19-20]。
3、附壁型腺癌
LA 是指在附壁生长的腺癌中浸润灶≥5 mm,或有血管、胸膜或淋巴管浸润或坏死的间质浸润迹象。如存在多个浸润灶,则采用浸润灶的百分比之和乘以肿瘤最大径,如其数值>5 mm 即可诊断[21]。LA 的诊断仅适用于非黏液性腺癌。如果肌纤维母细胞间质含有侵袭性肿瘤细胞,则诊断为LA 而不是MIA。LA 中附壁生长成分比例的范围从40%~85%,平均约50%[22]。多项回顾性研究报道,LA 的5年无病生存率介于85.7%和100%之间[22-24]。从AAH、AIS发展到MIA,再发展为LA 的附壁生长模式在腺癌中最具典型(图2),其生长缓慢,预后好于其他浸润性腺癌。
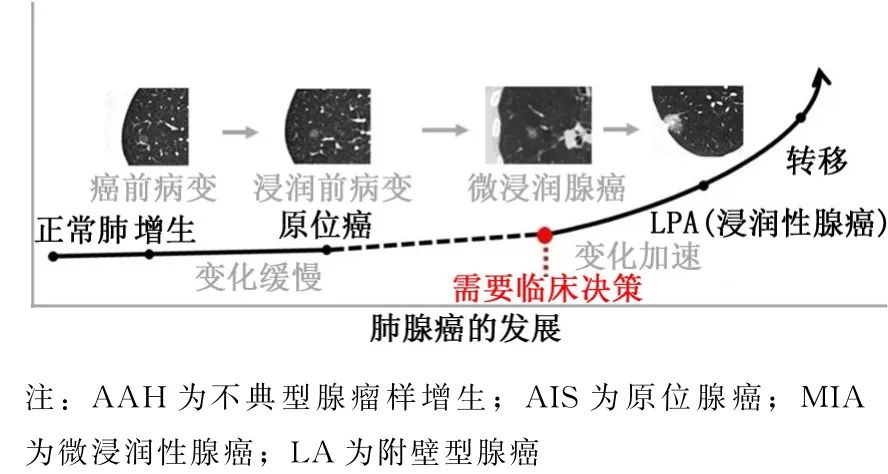
图2 附壁生长 (AAH→AIS→MIA→LA)
二、临床症状、影像学表现
临床研究发现,肺腺癌以女性或非吸烟者多见,且显示出逐渐年轻化趋势。高达2/3的肺腺癌患者就诊时无明显临床症状,而是影像学检查偶然发现;咳嗽是最常见的症状,出现在25%~30%的患者中[24-25];当疾病发展到一定阶段可出现刺激性干咳、胸痛与胸部不适、咳痰与咯血、发热等。
凭借图像清晰、分辨率高、后处理功能强大等优点,电子计算机断层扫描(computed tomography,CT)逐渐成为肺癌检查的“金标准”[26]。许多研究报道了腺癌的组织病理学和CT表现之间的相关性[16,27-29]。附壁生长模式的腺癌在高分辨率CT 上多显示肺磨玻璃样影[17,29],即边界清楚或不清楚的云雾状密度增高影,其中走形的血管及支气管隐约可见。相反,乳头状、腺泡状和实体腺癌在CT 上通常表现为实性结节[28,30]。因此,CT 影像在一定程度上可以预测附壁生长模式。与肿瘤生物学行为相关的影像学特征可能具有临床转化的意义,有助于诊断和判断预后。例如,与实性或微乳头状为主的腺癌相比,附壁生长型腺癌的预后更好,且较少淋巴结转移[31]。
三、分子遗传学
近年来肺腺癌分子生物学领域的进展突飞猛进,生物标志物检测为肺癌分层治疗带来革命性变化,以表皮生长因子受体(epidermal growth factor receptor,EGFR)、鼠类肉瘤病毒癌基因(kirsten rat sarcoma viral oncogene,KRAS)和间变性淋巴瘤激酶(anaplastic lymphoma kinase,ALK)突变为代表的单基因改变是部分肺腺癌最显著的分子学特征[32]。这些基因突变是治疗干预的特定分子靶标,具有重要的临床价值。
(一)EGFR
EGFR 是一种具有酪氨酸激酶活性的跨膜受体[33],具有多种特异性配体,表皮生长因子与EGFR 结合,启动涉及细胞凋亡、血管生成和细胞增殖的信号通路,从而可能促进与癌变相关的特性[34]。2004年以来,EGFR 突变被广泛研究,并已确定在女性、从不吸烟和亚裔人群中更为普遍[35]。我国人群中EGFR 基因的突变率为40%~60%,以19号外显子缺失(Ex19)和21 号外显子L858R 点突变(Ex21)最为常见,占85%~90%[34]。在过去的研究中EGFR 突变阳性肺腺癌具有附壁生长模式[33,36],但也有研究指出EGFR突变阳性肺腺癌与腺泡状、乳头状或微乳头状生长相关[24,37]。Yoshizawa等[36]研究发现附壁生长的腺癌在Ex21 突变中更为常见。多数研究都表明EGFR 突变型肺腺癌相关预后优于EGFR 野生型[38]。IPASS、WJTOG3405和NEJ002等大规模随机对照研究,奠定了吉非替尼等酪氨酸激酶抑制剂(tyrosine kinase inhibitors,TKI)在晚期EGFR阳性NSCLC中一线治疗的地位,拉开了肺癌靶向治疗的序幕,从此靶向药物如雨后春笋、日新月异,肺癌进入精准治疗时代。
(二) 间变性淋巴瘤激酶 (anaplastic lymphoma kinase,ALK)
棘皮动物微管相关蛋白样4(echinoderm microtubule associated protein-like 4,EML4)与ALK 形成的融合基因,通常称为ALK 融合基因,2007年Soda 等[39]首次发现。ALK 融合阳性的NSCLC占所有肺癌的2%~5%[40],肺腺癌患者中ALK 融合基因的总发生率为5.2%~11.2%[41]。实体型或腺泡状、筛网状结构、黏液细胞(如印戒细胞或杯状细胞)在ALK 阳性腺癌中更为常见[33],而较少出现附壁生长模式[37]。随着克唑替尼、阿来替尼和劳拉替尼等被批准上市,ALK 突变腺癌的预后得到显著地改善。ALK-TKIs显著延长了无进展生存期和总生存期,极大地改变了NSCLC的临床实践。
(三)KRAS
KRAS是一种鼠类肉瘤病毒癌基因,突变型KRAS导致蛋白功能异常,在无EGFR 活化信号刺激下仍处于激活状态,使细胞内信号传导紊乱,细胞增殖失控而癌变[24,34]。KRAS 突变在肺腺癌中发生率较高(20%~30%)[42]。目前,KRAS突变临床和遗传特征尚无定论,与组织学亚型的关联仍然存在争议。de Melo等[43]发现KRAS 突变与腺泡亚型显著相关。有研究报道[44],浸润性黏液腺癌与KRAS突变显著相关。Jiang等[45]荟萃分析发现,KRAS突变在浸润性黏液腺癌中更为常见,而在附壁生长和腺泡为主的亚型中较少见。Kadota等[46]发现KRAS突变是总生存期的独立预后因素,可能与预后较差相关。2项Meta分析认为KRAS突变为EGFR-TKIs反应的负性预测生物标记物[41]。KRAS突变可能预示着对EGFR 靶向治疗的耐药性,成为NSCLC 患者的不良预后因素。不同类型的KRAS突变其预后价值不尽相同,需要未来的进一步研究来证实。
(四)其他
随着新一代测序和全外显子组测序等技术的出现,更多的新颖突变和融合伴侣基因被发现。ROS1重排在1%~2%的NSCLC中报告[47],相比于西方国家,ROS1基因融合在亚洲(中国、日本和韩国)患者中出现频率较高[48]。少数研究中C-ROS癌基因1(C-Ros oncogene 1,ROS1)重排的肺腺癌被描述为具有附壁生长模式[49]。ERBB2突变在2%~4%的NSCLC 中被发现[50-51],而在EGFR/KRAS/ALK 均野生型的腺癌中可达到6%[52]。Ding 等[53]检测到一些罕见突变,如BRAF、MET 以及RET,FGFR1和ALK 融合伴侣等。然而,这些少见突变和新型融合伴侣的临床意义仍有待进一步研究。分子途径及相关机制的研究深入,必将有助于了解肺腺癌的分子生物学特征并为临床决策提供依据。
四、治疗与预后
目前外科手术切除仍是早期NSCLC 的标准治疗手段[54]。肺癌手术方式首选解剖性肺叶切除和淋巴结清扫,但由于肿瘤或患者耐受性等因素,又有扩大切除和局部切除。研究证实,附壁生长型腺癌术后预后良好,AIS 术后5 年无病生存率为100%,MIA 接近100%,远高于浸润性腺癌的5年无病生存率40%~85%[20,55-56]。多项研究表明,附壁状生长模式的高百分比与低复发风险相关,LA 中附壁生长成分的比例具有较高的预后价值[57]。临床预后的差异为制定个体化治疗方案提供重要依据。一项大型试验[58]发现,CT 检查直径≤10 mm 或体积≤500 mm3的纯GGO 可考虑进行密切随访,而不是立即切除。第5版WHO 肺肿瘤分类并未再将肺原位癌归类于肺腺癌,可能会改变临床医生对这类病变的处理方式[59],至少需要重新斟酌、考虑是否手术,仍有待探讨。
然而,肿瘤异质性可能是预测预后和治疗反应的限制因素。其中一些病变能否通过有限切除治疗是一个普遍存在的问题,需要深入研究。尽管大多数AIS或MIA 病例可通过完全切除治愈,但仍有一小部分LA 会复发[23]。因此,在多学科背景下进一步认识这些病变潜在的特征显得尤为重要。
尽管近十年中肺癌的诊断和治疗取得许多进展,但它仍然是全世界最常见的癌症死亡原因;我国肺癌患者的5 年生存率仍然只有10% ~20%[20,41]。同时,肺癌是一个异质性的疾病,其细胞类型、分子生物学特征、病理特征复杂多样,给临床诊断和治疗带来一定挑战。本文综述了对附壁生长这一病理亚型肺腺癌的认识过程和研究现状,重点介绍了其临床病理特征及其与驱动突变(EGFR、ALK 和KRAS等)的关系。虽然肺腺癌的发生机制尚不清楚,但更好地了解此类病例中的肿瘤发生和进展可能有助于全方位解析肺癌的不同的生物学特征,并制定相应的预防、筛查和治疗策略。
利益冲突所有作者均声明不存在利益冲突
