雌激素对牙周膜细胞修复重建牙周组织调节机制的研究进展
2021-07-23黎祺王贺黄紫君韩倩倩
黎祺, 王贺, 黄紫君, 韩倩倩
1.肇庆医学高等专科学校口腔医学院 国家基层医疗服务应用技术协同创新中心,广东 肇庆(526020); 2.南方医科大学口腔医院牙体牙髓病科,广东 广州(510280); 3.南方医科大学口腔医院牙周病科,广东 广州(510280)
牙周病是口腔最常见的疾病之一,特点是牙周组织破坏、吸收、牙齿松动、脱落,牙周组织再生修复是牙周病治疗的热点和难点[1]。牙周组织由牙周膜、牙槽骨、牙骨质及牙龈组成,牙周膜纤维束的两端分别埋入牙根表面的牙骨质和牙槽窝表面的固有牙槽骨,使牙体稳固在牙槽窝中。牙周组织在形态改建和组织修复的过程中,牙槽骨会不断吸收和重建,新的牙周膜纤维也会重新附着在牙根表面,形成继发性牙骨质[2],这个过程主要依赖牙周膜细胞及其胞外基质蛋白的生物学行为,并可受到雌激素的调控和影响。本文就雌激素对牙周膜细胞增殖、分化、合成分泌胞外基质蛋白的调控机制,以及雌激素调控下牙周膜细胞及其胞外基质主要蛋白修复重建牙周组织的机制进行综述。
1 牙周膜细胞及其胞外基质
牙周膜细胞包括牙周膜干细胞(periodontal ligament stem cells,PDLSCs)、牙周膜成纤维细胞(human periodontal ligament fibroblasts,HPLFs)、成牙骨质细胞、成骨细胞、破骨细胞、骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)。其中HPLFs是牙周膜最主要的细胞,具有独特且高效的合成和分解胞外基质中胶原蛋白的能力,对于维持牙周组织正常改建和损伤后修复有重要意义[3]。而PDLSCs 的重要潜能是向HPLFs、成牙骨质细胞、成骨细胞和破骨细胞分化[4],BMSCs 也是具有多向分化潜能的干细胞,PDLSCs 和BMSCs 是雌激素调控牙周组织再生修复的重要上游细胞。
牙周膜细胞的胞外基质是牙周膜细胞合成和分泌的,由结构蛋白、蛋白聚糖、粘连糖蛋白和水组成的复杂的网架混合结构[5]。细胞可通过改变胞外基质各种蛋白和反应因子的合成、降解和组织结构来重建胞外基质环境,胞外基质环境变化又对细胞行为产生重要影响。因此,牙周膜细胞的增殖、分化等生物学行为与其胞外基质蛋白、反应因子之间互相调节,是牙周组织形态改建、组织修复和功能维持的基础,而这些生物学行为可受雌激素调控。
2 雌激素调控牙周膜细胞增殖和分化
雌激素是一种生物学活性广泛的甾体类固醇激素,不仅对生殖系统、骨骼、心血管系统的功能有调节作用,还影响牙周组织的生长发育,人体中雌激素包括雌二醇、雌三醇和雌酮,其中雌二醇(17β-estradiol,E2)发挥主要作用[6]。临床研究证明,绝经后骨质疏松女性使用外源性雌激素治疗,可使牙槽骨吸收减缓,牙周附着丧失和牙龈出血减轻[7]。
雌激素主要是通过牙周膜细胞的雌激素受体(estradiol receptor,ER)对细胞的增殖和分化起调控作用。人体HPLFs、PDLSCs、BMSCs、成牙骨质细胞、成骨细胞和破骨细胞的细胞膜上均含有ERα和ERβ[3-4]。两型ER 功能不同,在不同的组织和细胞中表达的浓度也不一样,如ERβ 在HPLFs 中占主导地位,而在PDLSCs 中ERα 的表达高于ERβ,两型ER 可以感受人体中雌激素水平的变化并做出相应的反应[3]。
在细胞增殖和分化方面,雌激素与PDLSCs、BMSCs 的细胞膜ERα 和ERβ 结合后,刺激雌激素靶基因启动子的DNA 序列——雌激素应答元件调控细胞内的信号表达,促进细胞增殖并向HPLFs、成骨细胞和成牙骨质细胞分化[4,8-10]。PDLSCs、BMSCs 的增殖分化机制含有诸多通路,其中以Wnt/β-catenin 通路的研究最多,国内外学者研究发现雌激素调控下,PDLSCs、BMSCs 细胞的Wnt/βcatenin 通路被激活,糖原合成酶激酶-3β 被磷酸化而丧失活性,β-catenin 蛋白在细胞内聚集,并转移至胞核内与转录因子/淋巴增强因子结合,调节下游靶基因细胞周期素D1 的表达,从而调控干细胞的增殖、分化、凋亡等代谢活动[8,10-11]。雌激素还可通过调节Notch 信号通路促进成牙骨质细胞增殖、分化、矿化和牙骨质形成[10]。
核因子κB 受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL)是诱导破骨细胞分化、生长的一种跨膜蛋白,主要由成骨细胞合成和分泌[12]。雌激素可通过ERα 诱导成骨细胞生成护骨素,护骨素与RANKL 结合后抑制破骨细胞形成、分化和激活[12]。而雌激素缺乏则上调破骨细胞RANKL 的表达,抑制骨分化和Notch 信号通路,诱导破骨细胞形成和溶骨活性提高[13-14]。雌激素还可抑制成骨细胞分泌白介素1、白介素6、肿瘤坏死因子α 等破骨细胞激活因子,诱导破骨细胞凋亡,从而抑制骨吸收[9,12]。
3 雌激素调控牙周膜细胞合成分泌蛋白
大量研究发现,雌激素在促进PDLSCs、BMSCs向其他牙周膜细胞分化和增殖的同时,还能促进PDLSCs、BMSCs、HPLFs、成骨细胞、成牙骨质细胞合成,并往胞外基质中分泌胶原蛋白I 型(collagen I,COLI)、骨桥蛋白(osteopontin,OPN)、骨涎蛋白(bone sialoprotein,BSP)、骨 钙 蛋 白(osteocalcin,OCN)等[4,8-11],它们是支持、修复、重建牙周组织结构和调节牙周膜细胞增殖、分化、迁移、黏附、功能表达等生物学过程的重要因子[15-20]。动物实验研究发现,浓度为10-7mol/L 的E2 能使PDLSCs、BMSCs 等牙周膜细胞的COLI、OPN、BSP、OCN 合成增多,提高细胞成骨分化和胞外基质的沉积、矿化能力[9,11]。
HPLFs 合成COLI 并分泌到胞外基质中与蛋白酶反应后自我组装成胶原纤维,是牙周膜纤维的主要组成部分[2,18]。COLI 也分布在牙槽骨板层骨小梁和新形成编织骨的网状组织中,是骨矿化的主要基质,为胞外基质的沉矿化积提供网状结构支架[21]。E2 通过调控BMSCs、HPLFs 的ERα、ERβ表达影响COLI 的合成,加强ERβ 的转录和表达可增加细胞COLI mRNA 及蛋白的表达[4],提高COLI的合成与活性,而ERα 的表达增强反而降低COLI合成[3]。
HPLFs、BMSCs、骨细胞、成骨细胞、成牙骨质细胞、破骨细胞均可合成分泌OPN。E2 通过减少牙周膜细胞内的细胞因子信号抑制因子-2 介导的反馈而扩增生长激素信号途径,激活OPN 基因启动子区域的SFl 反应单元序列(SFl-responsive element,SFRE)而 诱 导OPN mRNA 的 转 录 与 表达[22]。OPN 是一个含300 个氨基酸残基的分泌型粘性糖蛋白,能与羟基磷灰石、COLI 结合,参与骨基质矿化和吸收、炎症反应和创面愈合[23]。
牙周膜细胞成骨诱导末期,BSP 合成和分泌增多,E2 通过成骨细胞和成牙骨质细胞的ERα 刺激BSP 转录启动元件环腺苷酸反应组件(cAMP response element,CRE)和激活蛋白因子1(the activator protein 1,AP-1)元件的活动,提高成骨细胞中BSP mRNA 的基因转录和表达水平[24]。BSP 是一种由317 个氨基酸组成的磷酸化非胶原糖蛋白,可调控HPLFs、成牙骨质细胞、成骨细胞与羟基磷灰石结合,诱导羟基磷灰石聚集成核;另一方面BSP又可吸附于羟基磷灰石晶体表面抑制晶体生长,在骨组织钙化中表现双重调节作用[23]。
OCN 的表达水平也通常在成骨晚期升高[9,21]。OCN 又称骨钙素和骨R-羟基谷氨酸蛋白,是一种由49 个氨基酸组成的维生素K 依赖性蛋白质,可由成骨细胞和成牙骨质细胞合成,并将其作为羟基磷灰石晶体储存在骨矿物基质中,是骨形成标志[18]。OCN 启动子中有3 个ERα 反应元件,该部位与E2 结合形成激素-受体复合物后,与过氧化物酶体增殖物激活受体γ 辅激活物-1α 协同作用提高OCN 启动子的活性,激活OCN 的基因表达[25]。OCN 能促进HPLFs 和成骨细胞的矿化,启动和参与骨的改建[21]。
4 雌激素调控下牙周膜细胞及其胞外基质主要蛋白修复重建牙周组织的机制
笔者在整合、分析、归纳国内外文献基础上,建立了雌激素调控下牙周膜细胞及其胞外基质主要蛋白修复重建牙周组织的机制模型(图1)。在一定浓度的雌激素调控下,PDLSCs、BMSCs 增殖、分化能力增强,牙周膜细胞数量增多,合成分泌COLI、OPN、BSP、OCN 增多,与胞外基质中的纤维粘连蛋白(fibronectin,FN)、牙骨质附着蛋白(cementum attachment protein,CAP)等互相链接、结合形成多种链合物并相互调节,进而促进牙周膜细胞生长、迁移、黏附和纤维化,使牙周膜胶原纤维骨架修复并与新生牙骨质和固有牙槽骨重新黏附。
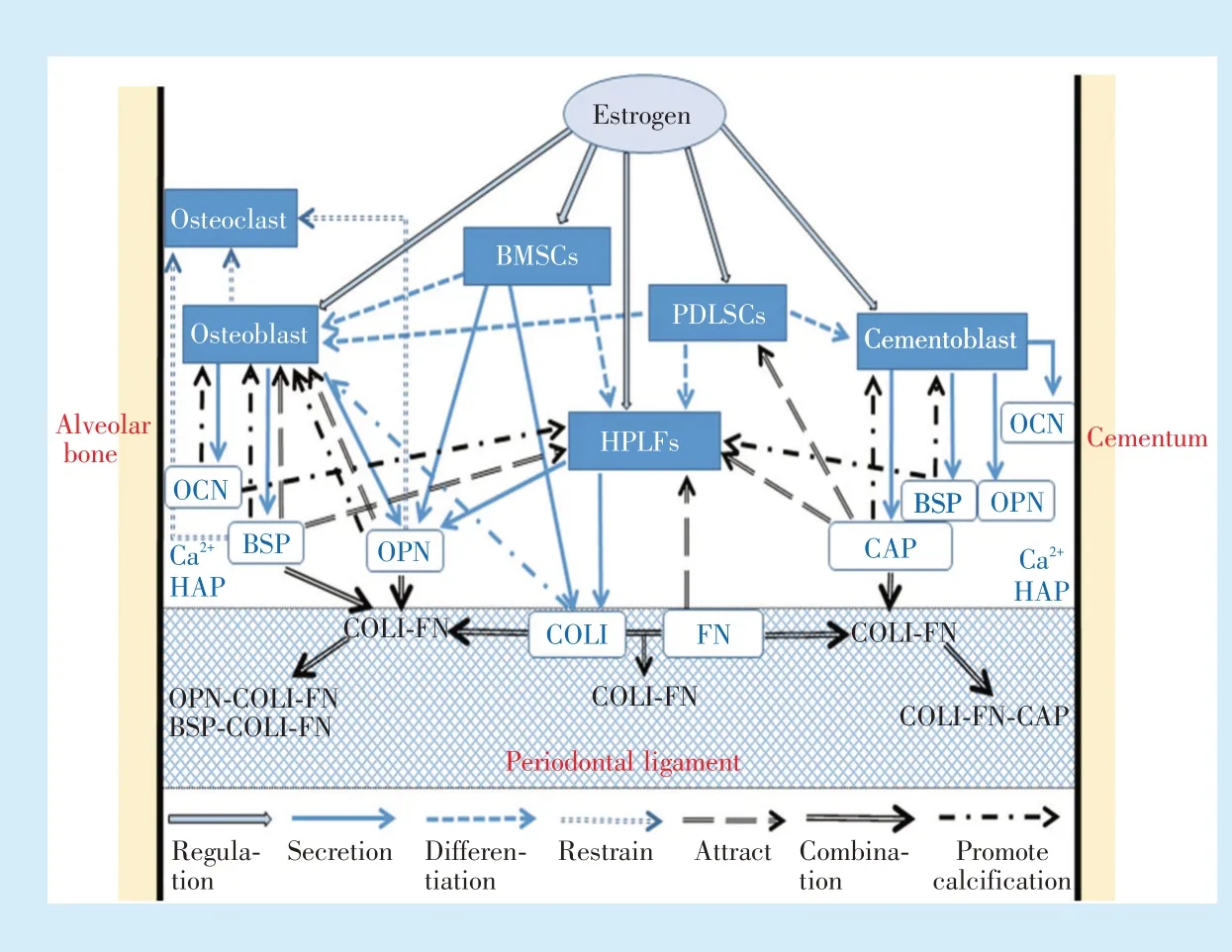
Figure 1 Mechanistic model of the periodontal ligament cells and extracellular matrix proteins in periodontal tissue repair and reconstruction under estrogen regulation图1 雌激素调控下牙周膜细胞及其胞外基质主要蛋白修复重建牙周组织的机制模型
4.1 牙周膜胶原纤维骨架的修复
HPLFs 在一定浓度的雌激素调控下分泌胶原增多,其中以COLI 最明显,是成骨分化的早、中期标志物[9]。COLI 和胞外基质中的FN 相互诱导、结合、沉积形成COLI-FN 链合物,构成结构稳定的胶原网络。FN 是存在于各种动物的血液、体液和组织中,分子量约为450 KD 的黏附性非胶原糖蛋白,是牙周细胞外基质中细胞间、细胞与基质之间的重要黏附因子[20]。FN 是由两个亚基组成的二聚体,每个亚基上有与胶原、细胞表面受体高亲和结合的位点[20],FN 通过自身结构的精氨酸-甘氨酸-天冬氨酸三肽序列(arginine-glycine-aspatic acid,RGD)与HPLFs 的细胞膜表面一类整合素结合[26],使更多的HPLFs 识别、迁移和附着于COLI-FN 网状链合物上,HPLFs 持续不断地分泌胶原对牙周膜胶原纤维进行改建,从而修复胶原纤维骨架,并作为胞外基质蛋白沉积、链接和矿化的底物基础[21,27]。雌激素缺乏可使胶原纤维成分减少并导致排列结构紊乱[4]。
4.2 牙周膜胶原纤维与新生牙骨质重新黏附
CAP 是一种相对分子质量为55 000 的蛋白,是牙骨质再生的重要趋化因子,参与牙周新附着的形成[20]。COLI 不与CAP 直接结合,但FN 对CAP 有极强的亲和力,可与FN 结合形成FN-CAP 链合物,COLI 与FN 结合形成COLI-FN 链合物后,FN 作为中介物调控CAP 与COLI-FN 链合物,再结合形成COLI-FN-CAP 链合物,使CAP 牢固结合到牙周膜纤维组织上[28]。CAP 可选择性结合HPLFs、PDLSCs等牙周膜细胞,使这些细胞在牙根表面迁移和黏附,并分化为成牙骨质细胞,同时CAP 对羟基磷灰石有高亲和力,促进成牙骨细胞外基质羟基磷灰石晶体形成、矿化[29]。因此,COLI-FN-CAP 链合物将牙周韧带纤维的一端在新生牙骨质中重新黏附。此外,牙周膜细胞外基质中的牙骨质蛋白1(cementum protein 1,CEMP1)和釉基质蛋白(enamel matrix proteins,EMPs)也可诱导PDLSCs 增殖,并向成牙骨质细胞分化,促进牙骨质羟基磷灰石晶体在有序成核方面发挥调节作用[20]。
4.3 牙周膜胶原纤维埋入重建的固有牙槽骨
牙周膜细胞外基质中的BSP 和OPN 主要由BMSCs、成骨细胞合成分泌,BSP 和OPN 在胶原上有特异的定向结合位点,多位于胶原纤维网靠近固有牙槽骨的“孔区”[30]。雌激素调控下OPN 在成骨分化的早期表达增多,OPN 与COLI、FN 均可结合,三者形成OPN-COLI-FN 链合物,并通过OPN 端的RGD 序列吸引更多的成骨细胞黏附[31]。而BSP是成熟骨标志性蛋白,BSP 与COLI、FN 结合形成BSP-COLI-FN 链合物[22-23],通过BSP 端的RGD 序列与更多的HPLFs、成骨细胞黏附,大量成骨细胞被吸引,定向移行至“孔区”后,分泌骨基质并矿化,最终将牙周膜胶原纤维靠近牙槽骨的一端埋入重建的固有牙槽骨中。
在牙槽骨和牙骨质基质矿化的过程中,旧骨破坏吸收后释放的OCN 在维生素K 依赖转录后形成羧基谷氨酸蛋白,部分氨基酸残基羧化凸向同一方向排列形成一个紧密的α-螺旋结构,与羟基磷灰石具有高亲和力[25]。OPN 和BSP 也作为重要调节因子调节骨基质羟基磷灰石核晶的启动、形成和矿化[32-33],OPN 和BSP 还能够结合破骨细胞膜αvβ3 整合素,抑制破骨细胞激活因子生成,降低骨吸收[23]。
5 小 结
综上所述,一定浓度的雌激素可促进牙周膜细胞增殖、分化、基质蛋白合成分泌增加和活性增强,使牙周膜纤维修复并重新黏附在新生的牙骨质和重建的牙槽骨中。但目前雌激素对牙周膜细胞外基质中FN、CAP 等调控机制尚不明确,牙周膜细胞增殖和成骨分化的路径和调节因子还待不断被发现和验证。
【Author contributions】Li Q and Huang ZJ wrote the article,Wang H and Han QQ revised the article. All authors read and approved the final manuscript as submitted.
