椰子球蛋白多肽-亚铁螯合物的制备工艺
2021-07-20郑亚军史攀琪王国龙王贤李艳刘乐李桂峰
郑亚军 史攀琪 王国龙 王贤 李艳 刘乐 李桂峰

摘 要:为提高椰子加工副产物的利用, 对椰子球蛋白进行限制性水解制备多肽,并采用Sephadex G-25凝胶柱层析对多肽进行纯化,然后以椰子球蛋白多肽为原料与亚铁离子反应制备肽-亚铁离子螯合物。重点分析水解度、温度等因素对椰子球蛋白多肽亚铁离子络合能力的影响,并优化制备工艺。结果表明,用碱性蛋白酶结合风味蛋白酶制备的多肽的水解度最高(14.71%),产物的亚铁离子螯合能力也最高(24.66%);Sephadex G-25凝胶柱层析中分离出3个多肽组分,其中组分C的络合能力最高(28.67%);椰子球蛋白多肽C螯合亚铁离子最佳条件是多肽浓度1 mg/mL、40 ℃、 pH 7.0、亚铁离子浓度0.5 mg/mL、时间0.5 h,此时螯合率为30.67%。荧光光谱、红外光谱等分析表明,椰子球蛋白多肽通过氨基、羧基和亚甲基与亚铁离子配位而形成螯合物。研究结果表明,用椰子球蛋白多肽为原料制备肽-亚铁螯合物切实可行,该螯合物可以应用于功能食品中来改善铁营养缺乏。
关键词:椰子球蛋白;多肽-亚铁螯合物;制备;Sephadex G-25凝胶色谱;优化
中图分类号:S667.4;TS255.4 文献标识码:A
Abstract: To improve the utilization of coconut processing byproduct, peptides were obtained from coconut globulin using limited enzymatic hydrolysis technology and purified by Sephadex G-25 chromatography in this study. Then the selected coconut globulin peptides were reacted with ferrous to prepare peptides-ferrous chelate. The effects of hydro-lysis degree, pH, time, ferrous ion concentration and temperature on the chelating ability of coconut globulin peptides were studied. Moreover, the chelating conditions were optimized using an orthogonal test. Results showed that both hydrolysis degree (14.71%) and ferrous chelating ratio (24.66%) were the highest when coconut globulin was hydro-lyzed by alcalase and flavourzyme. There were three peptides peaks through Sephadex G-25 chromatography, of which the fraction C showed the highest chelating ability (28.67%). The result of the orthogonal test demonstrated that the optimum preparation conditions were peptide concentration 1.0 mg/mL, 40 ℃, 0.5 h, pH 7.0 and ferrous ion concentration 0.5 mg/mL, then the chelating ratio of coconut globulin peptides was 30.67%. The results of fluorescence spectroscopy and infrared spectroscopy indicated that coconut globulin peptide could chelate iron with amino groups, carboxyl groups and methylene groups. The results showed that it is feasible to prepare peptide-iron chelate using co-conut globulin. Moreover, the coconut globulin peptide-iron chelate could be used as functional food ingredient to im-prove iron deficiency status.
Keywords: coconut globulin; peptide-ferrous chelate; preparation; Sephadex G-25 chromatography; optimum
DOI: 10.3969/j.issn.1000-2561.2021.05.038
鐵是机体正常生命活动中必不可少的微量元素,当机体对铁的需求量增加,而机体本身铁的含量无法完全满足正常红细胞的生成,就使得血清中的铁浓度以及铁蛋白同时发生下降的情况,从表面可观察到皮肤系统以及黏膜没有血色等贫血表现[1]。缺铁性贫血是当前全人类面临的营养问题之一。由于食物中的铁主要以三价铁形式存在,在体内的吸收利用率低,因此改善缺铁性贫血的有效方法是摄入适量的补铁剂。补铁剂从早期对人体刺激大、吸收效果差的无机盐补铁剂,逐渐发展成为现在无毒副作用、吸收作用较好的生物性补铁剂[2]。其中,食源性肽-亚铁螯合物由于能够保证铁以亚铁离子的形式被机体吸收,同时具有干扰小、能耗低、吸收途径独特、无毒副作用、来源广泛和成本低等优点,成为最具潜力的新型补铁剂[3]。椰子(Cocos nucifera L.)为木本油料作物之一,是来源丰富的植物蛋白质资源。球蛋白在椰子蛋白质中占61%,由于其富含含硫氨基酸、丝氨酸和二硫键,更兼产量巨大,因此椰子球蛋白是制备肽-亚铁螯合物的潜在原料。然而,目前国内外对于椰子球蛋白多肽-亚铁螯合物制备工艺的相关研究极少[4-7]。本研究采用复合酶法水解椰子球蛋白,采用凝胶色谱技术对酶解多肽进行分离纯化和筛选,以活性最高的多肽制备肽-亚铁螯合物,通过单因素试验分析水解度、温度、pH、时间、亚铁离子浓度对络合率的影响,并以正交试验优化其制备工艺。此项研究,可以有效提高椰子副产物的利用率,具有良好的应用前景。
1 材料与方法
1.1 材料
1.1.1 材料与试剂 植物原料:脱脂椰麸,购于海南文昌南椰食品有限公司。
主要试剂:考马斯亮蓝、磷酸氢二钠、磷酸二氢钠、氯化亚铁、盐酸羟胺、邻菲啰啉、乙酸钠等均为分析纯,上海素培生物科技有限公司;碱性蛋白酶(200 U/mg)、木瓜蛋白酶(800 U/mg)、风味蛋白酶(20 U/mg)、胰蛋白酶(250 U/mg)、溴化钾(光谱级)和维生素C,上海源叶生物科技有限公司。
1.1.2 仪器与设备 H-2恒流泵,上海沪西仪器设备有限公司;PHS-3CpH计,上海仪电科学仪器股份有限公司;SHA-B双功能数显恒温震荡器,湖南衡阳仪器有限公司;TGL-15B离心机,山东博客仪器有限公司;101-3AB干燥箱,天津创新仪器有限公司;UV-1800PC紫外可见分光光度计,北京析元仪器有限公司;F9700荧光分光光度计,天津里安精密仪器公司;660 IR傅里叶变换红外光谱仪,美国Varian公司。
1.2 方法
1.2.1 椰子球蛋白的提取 参考Li等[7]的方法,将脱脂椰麸在45 ℃下干燥,粉碎,过100目筛,得到脱脂椰麸粉。取50 g脱脂椰麸粉,加入500 mL浓度为0.4 mol/L NaCl溶液,35 ℃下搅拌提取2 h,过滤,重复提取3次,将合并的滤液在12 000 r/min下离心20 min,收集上清液,装入透析袋(MW为3500 Da)中,4 ℃下透析24 h,每隔2 h换一次蒸馏水(dH2O)。将透析后的蛋白液冷冻干燥,得到椰子球蛋白(coconut globulin, CG)。蛋白浓度的测定采用考马斯亮蓝法[8]。
1.2.2 椰子球蛋白多肽的制备及各种酶的影响 参考Li等[6]的方法,取等份的椰子球蛋白溶液(2 g/100 mL),分别用碱性蛋白酶(Alcalase)、胰蛋白酶(Trypsin)、木瓜蛋白酶(Papain)和复合酶(碱性蛋白酶+风味蛋白酶)水解120 min,然后在100 ℃加热10 min以灭酶,冷却至室温后,将水解液离心(12 000 r/min,15 min),收集上清液。取6 mL上清液,用甲醛滴定法测定水解度[9]。同时,将上清液真空冷冻干燥后即得到椰子球蛋白多肽(coconut globulin peptides, CGP)。比较各种酶制备椰子球蛋白多肽的水解度和亚铁离子螯合率,选择螯合能力最强的椰子球蛋白水解肽进行下一步试验。
1.2.3 椰子球蛋白多肽的纯化 参考文献[9]进行椰子球蛋白多肽的纯化。将复合酶水解制备的椰子球蛋白多肽复溶于蒸馏水中(1 mg/mL),使其在Sephadex G-25凝胶柱层析系统中进行分离纯化。将Sephadex G-25浸泡于dH2O中,65 ℃下放置48 h,然后加入NaCl 溶液(0.4 mol/L),平衡24 h。超声波脱气20 min后,装入层析柱(1.6 cm×100 cm)中,流动相为0.4 mol/L NaCl溶液,流速0.8 mL/min,平衡24 h后,上样1~2 mL。每5 min收集1次,检测波长220 nm,绘制洗脱曲线。将各峰分别收集,冷冻干燥后,测定各组椰子球蛋白多肽对亚铁离子的螯合能力,以螯合能力最高的椰子球蛋白多肽為原料,制备多肽-亚铁螯合物。
1.2.4 亚铁离子螯合率的测定方法 采用邻菲啰啉比色法[10],取0.5 mL样品加入9.5 mL蒸馏水,之后加入0.01 g维生素C、1 mg/mL氯化亚铁溶液,在一定水浴温度下螯合60 min。取出后从中吸取100 μL,稀释50倍,取1 mL稀释液置于50 mL容量瓶中,依次加入1 mol/L盐酸1 mL、10%盐酸羟胺1 mL、0.12%邻菲啰啉1 mL、10%乙酸钠5 mL,用蒸馏水定容,于510 nm 处比色。空白对照用蒸馏水替代样品,样品对照组用蒸馏水替代氯化亚铁。
式中:A1为样品组吸光值;A2为样品对照组吸光值;A0为空白对照组吸光值。
1.2.5 单因素试验 (1)不同温度对椰子球蛋白多肽螯合亚铁离子能力的影响。取等份的椰子球蛋白多肽溶液(1 g/100 mL),加入氯化亚铁溶液(0.5 mg/mL),在pH 8.0、不同温度(20、30、40、50、60 ℃)下反应30 min,反应结束后测定反应液中游离亚铁离子的浓度,考察温度对螯合率的影响。
(2)不同pH对椰子球蛋白多肽螯合亚铁离子能力的影响。取等份的椰子球蛋白多肽溶液(1 g/100 mL),用0.1 mol/L NaOH或0.1 mol/L HCl分别滴定至pH 6.0、7.0、8.0、9.0、10.0后,各加入氯化亚铁溶液(0.5 mg/mL),搅拌均匀,在40 ℃下反应30 min,反应结束后测定反应液中游离亚铁离子的浓度,测定不同pH对螯合率的影响。
(3)不同亚铁离子浓度对椰子球蛋白多肽螯合亚铁离子能力的影响。取等份的椰子球蛋白多肽溶液(1 g/100 mL),分别加入浓度为0.25、0.50、0.75、1.00、1.25 mg/mL的氯化亚铁溶液,搅拌均匀后,置于恒温振荡器中,在40 ℃、pH 8.0下反应30 min,反应结束后测定反应液中游离亚铁离子的浓度,测定不同亚铁离子浓度下椰子球蛋白多肽对亚铁离子的螯合率。
(4)不同时间对椰子球蛋白多肽螯合亚铁离子能力的影响。取等份的椰子球蛋白多肽溶液(1 g/100 mL),加入氯化亚铁溶液(0.5 mg/mL),在40 ℃、pH 8.0下分别反应30、60、90、120、150 min,反应结束后测定反应液中游离亚铁离子的浓度。
1.2.6 椰子肽-亚铁螯合物制备工艺的优化 在单因素实验的基础上,采用L9(34)正交试验对椰子肽-亚铁螯合物的制备工艺进行优化,各因素水平见表1。
1.2.7 椰子肽-亚铁螯合物的性质鉴定 按照1.2.6中所得最佳工艺条件,将椰子球蛋白多肽组分C与FeCl2螯合来制备椰子肽-亚铁螯合物,冷冻干燥后,用于性质分析与鉴定。
(1)紫外光谱扫描。参考文献[11]进行,分别对椰子多肽溶液(1 mg/mL)和椰子肽-亚铁螯合物溶液(1 mg/mL)进行紫外光谱扫描,波长范围190~390 nm。
(2)荧光光谱扫描。分别对椰子多肽组分C和肽-亚铁螯合物进行荧光扫描。激发波长280 nm,扫描波长范围为300~600 nm,激发和发射光狭缝分别为10 nm和5 nm。
(3)傅里叶变换红外光谱扫描。参考文献[2]进行,取约0.2 mg椰子多肽和肽-亚铁螯合物粉末,分别与干燥的KBr(约200 mg)混合、研磨,压制成厚度约为1 mm的透明薄片,然后在傅里叶红外光谱仪上进行扫描,扫描范围4000~ 400 cm?1。
1.3 数据处理
采用DPS 7.0软件对数据进行分析,各实验至少重复3次,取平均值,多重比较采用邓肯新复极差法。
2 结果与分析
2.1 不同酶对椰子球蛋白水解度的影响
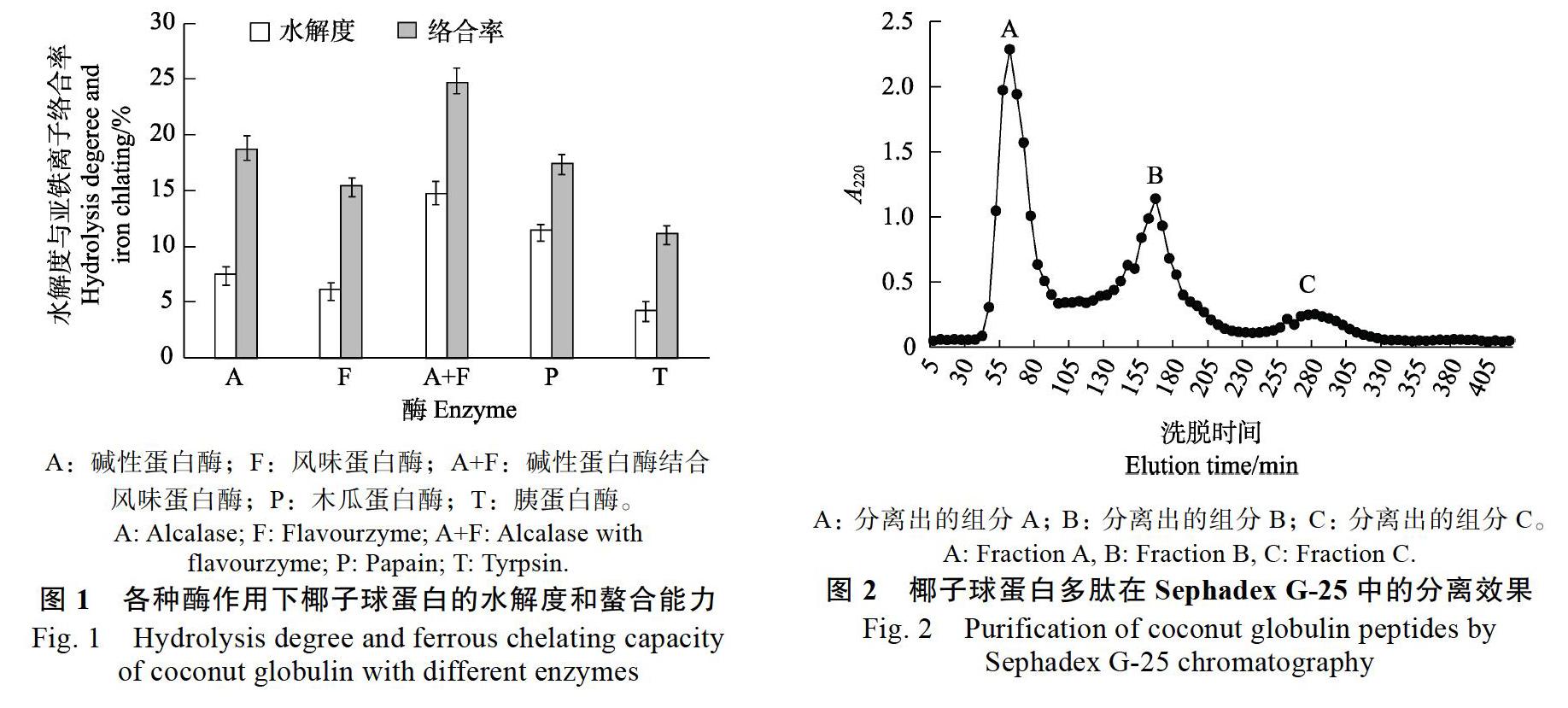
各种酶对椰子球蛋白的水解度与亚铁离子螯合能力的影响见图1。从图1可以看出,所用5种酶中,用胰蛋白酶水解椰子球蛋白时所得水解物的水解度和亚铁离子螯合能力最低;而采用复合酶(A+F)对椰子球蛋白进行水解时,水解程度最高,水解产物的亚铁离子螯合能力也最高。这可能是因为,胰蛋白酶无法有效水解椰子球蛋白的氨基酸链,不能使链上的活性基团充分暴露,从而使椰子球蛋白水解物表现出较低的络合能力。而碱性蛋白酶和风味蛋白酶分别属于内肽酶和外切酶,能够分别从不同位点对椰子球蛋白的氨基酸链进行水解,释放出更多的活性片段,从而表现出较高的水解度和亚铁离子螯合能力。
此外,分别单独使用碱性蛋白酶、风味蛋白酶和木瓜蛋白酶时,椰子球蛋白的水解度和亚铁离子螯合能力都明显低于采用复合酶(A+F)时的。这表明碱性蛋白酶和风味蛋白酶在水解椰子球蛋白时,可能有协同效应。段秀[2]的研究也表明,罗非鱼蛋白经复合酶碱性蛋白酶和风味蛋白酶水解后,释放出大量的谷氨酰胺、天冬氨酸和谷氨酸,由于这些氨基酸具有大量的侧链羧基,容易螯合金属离子,因此使酶解产物的金属螯合能力极大地提高。因此,选择复合酶(A+F)为水解椰子球蛋白时的最佳酶。
2.2 椰子球蛋白多肽的纯化
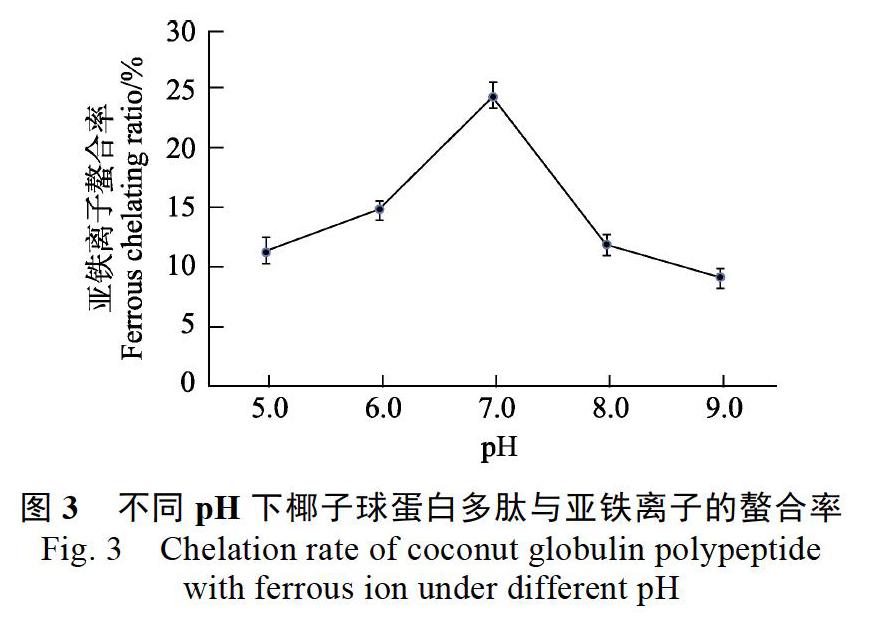
由图2可知,椰子球蛋白多肽在Sephadex G-25凝胶柱层析中分离为3个组分:A、B和C。其各自的亚铁离子螯合率分别为19.35%、22.43%和28.67%,因此选择组分C为制备肽-亚铁螯合物的原料。由于Sephadex G-25凝胶柱层析中决定蛋白质流出次序的主要是分子量差异,即分子量较大的先被洗出,而分子量较小的后被洗出,因此组分C的分子量最小。研究表明,影响多肽螯合金属离子能力的因素主要是其多肽链上氨基酸序列和分子量[11]。例如,当多肽链上谷氨酸、半胱氨酸和甲硫氨酸含量较高时,多肽的羧基或巯基数量较多,这些基团能够直接或者通过氢键与亚铁离子连接在一起,形成螯合物[12]。现有的研究表明,具有螯合活性的多肽大多数是分子量較小的三肽和四肽。本研究的结果再次验证了这一点。
2.3 椰子肽-亚铁螯合物制备工艺单因素试验
2.3.1 pH对椰子球蛋白多肽与亚铁离子螯合率的影响 从图3看出,在pH 5.0~7.0时,随着pH的升高,椰子球蛋白多肽的亚铁离子螯合能力随之变大,并在pH7.0时达到最高值。而在pH 7.0~ 9.0的范围内,随着pH的升高,椰子球蛋白多肽的亚铁离子螯合能力反而下降。pH对多肽亚铁离子螯合率的影响主要通过3个方面进行:(1)pH变化对蛋白质溶解度的影响。椰子球蛋白为盐溶性蛋白,pH较低时其溶解度较低;而当pH从5.0升高到7.0时,椰子球蛋白的溶解度增大,有更多的椰子球蛋白质分子与亚铁离子反应中,从而表现出更高的螯合率。(2)pH变化对亚铁离子的影响。在pH 5.0时,反应体系中的H+会与Fe2+争夺多肽的供电子基团,导致螯合率较低;随着pH的升高,参与争夺的H+逐渐减少,使多肽对亚铁离子的螯合能力提高;而当pH升高到8.0~ 9.0时,OH?逐渐等多。OH?与Fe2+反应形成金属盐沉淀,导致亚铁离子不能螯合到多肽链上,降低螯合率[13]。(3)pH对螯合反应体系中重要稳定剂维生素C(Vc)的影响。Vc是良好的还原剂,可以使反应体系中的铁离子保持在二价铁状态。Vc在弱酸性条件下稳定,但在碱性环境中容易失活,失去稳定亚铁离子的功能。在pH 8.0~9.0时,Vc失活,大量Fe2+被氧化为Fe3+,导致椰子球蛋白多肽与Fe2+的络合率下降。因此,在这3方面的综合作用下,椰子球蛋白多肽的亚铁离子螯合能力在pH 7.0时最高。
2.3.2 螯合温度对椰子球蛋白多肽与亚铁离子螯合率的影响 由图4可知,温度从20 ℃升高至30 ℃时,椰子球蛋白多肽对亚铁离子的螯合率呈现出上升趋势,说明温度适当提高可增加椰子球蛋多肽与亚铁离子的相互作用,有效提高螯合率。而在30~60 ℃的范围内,随着温度继续升高,椰子球蛋白多肽对亚铁离子的螯合率降低,可能是由于温度升高,维系亚铁离子价态稳定的重要物质Vc被破坏,使Fe2+被氧化为Fe3+,螯合率下降[3]。
2.3.3 反应时间对椰子球蛋白多肽与亚铁离子螯合率的影响 由图5可知,反应时间从0 h到1 h,椰子球蛋白多肽对亚铁离子的螯合率随时间延长而升高;在1.0~2.5 h内,椰子球蛋白多肽的螯合率随时间延长而逐渐下降,可能是部分原来被络合的亚铁离子重新成为游离状态,使螯合率降低。
2.3.4 亚铁离子浓度对椰子球蛋白与亚铁离子螯合率的影响 从图6可以看出,在较低的浓度范围内,随着亚铁离子浓度的增大,与椰子球蛋白多肽发生反应的亚铁离子数量增多,使螯合率上升,且当浓度达到0.75 mg/mL时,螯合率最大。之后,亚铁离子的浓度虽然进一步增大,但由于椰子多肽上的螯合位点已经饱和,因此螯合率趋于稳定。
2.4 螯合工艺的优化
在上述单因素试验结果的基础上,选择四因素三水平L9(34)的正交试验对整个工艺进行优化,以亚铁离子螯合率为指标,正交试验的结果见表2,方差分析结果见表3。
根据表2中的极差分析可知,各因素对螯合率的影响大小排列为:D(亚铁离子浓度)>C(pH)>A(温度)>B(时间)。根据表3中方差分析可知,亚铁离子浓度和pH对螯合率均有显著影响(P<0.05),而温度和时间对螯合率的影响均不显著(P>0.05)。最佳试验方案是A3B1C2D1,即螯合温度为35 ℃、螯合时间为0.5 h、pH 7.0、亚铁离子浓度为0.5 mg/mL。验证试验结果表明,在此条件下,椰子球蛋白肽对亚铁离子的螯合率为30.67%。
2.5 椰子肽-亚铁螯合物鉴定
2.5.1 紫外全波长扫描 分别对椰子球蛋白多肽组分C和椰子肽-亚铁螯合物进行紫外全波长扫描,结果见图7。从图7可以看出,椰子球蛋白水解肽组分C的特征吸收峰为230 nm,而椰子肽-亚铁螯合物的特征吸收峰为224 nm,表明椰子肽-亚铁螯合物是1种区别于椰子球蛋白的新物质。多肽中的羧基、氨基等基团可通过氢键或离子键与亚铁离子结合,使多肽的空间构象发生改变,从而影响其特征吸收波长[11]。
2.5.2 荧光光谱扫描 分别对椰子球蛋白多肽组分C和椰子肽-亚铁螯合物进行荧光扫描,结果见图8。从图8可以看出,椰子球蛋白多肽组分C在499 nm处出现最大荧光强度。与之相比,椰子肽-亚铁螯合物的最大荧光强度变弱,最大吸收荧光波长也发生了红移(迁移到508 nm)。Fe2+与多肽的结合会引起发射光谱的移动,并使荧光强度改变[3]。该结果再次证实了椰子肽-亚铁螯合物是不同于椰子球蛋白多肽的新物质。原洪等[14]的研究也证明,与亚铁离子结合可以改变花椒多肽的荧光吸收特征波长。
2.5.3 红外光谱分析 椰子球蛋白多肽组分C和椰子肽-亚铁螯合物的傅里叶红外变换光谱图见图9。
从图9可以看出,椰子球蛋白多肽组分C表现出典型的蛋白质红外光谱图,分别在3411、1656和1434 cm?1处出现吸收峰。其中1434 cm?1处的吸收峰对应多肽中羧基(COO?)的振动伸缩,1656 cm?1处的吸收峰对应羰基(C=O)的振动伸缩,而3411 cm?1处的吸收峰对应多肽中氨基(—NH)的振动伸缩。羧基、氨基和羰基是多肽中主要基团。与椰子球蛋白多肽组分C的红外光谱相比,椰子肽?亚铁螯合物的吸收峰和吸收强度均发生了变化。其中,椰子多肽-亚铁螯合物中—NH振动吸收峰由3411 cm?1蓝移到3497.1 cm?1,羧基振动吸收峰由1656 cm?1蓝移到1672.4 cm?1,而羰基振动吸收峰由1434 cm?1蓝移到1468 cm?1;同时,各吸收峰的强度都减弱。这表明,椰子球蛋白多肽链中的氨基和羧基都参与对Fe2+的络合而形成肽-亚铁螯合物。此外,与椰子球蛋白多肽相比,椰子肽-亚铁螯合物在2978 cm?1处的吸收强度明显变弱,而2978 cm?1处的吸收峰对应亚甲基(—CH2)的伸缩振动。因此,椰子球蛋白多肽中的亚甲基也可能参与了对Fe2+的络合。前人的研究[2, 11-14]大多表明其他植物多肽主要由氨基和羧基与Fe2+配位而形成螯合物,本研究的结果表明椰子球蛋白多肽中部分亚甲基也参与螯合物的形成。由于多肽中亚甲基的数量更多,因此这可能是利用椰子球蛋白制备肽-亚铁螯合物的优势之一。然而,椰子球蛋白多肽与Fe2+的螯合机理,还需要借助分子模拟等技术做进一步的研究。
3 讨论
与已报道的植物蛋白多肽-亚铁螯合物相比,椰子球蛋白的来源更加广泛、成本更低。由于椰子球蛋白中大量存在二硫键、氨基和谷氨酸,经适当水解后,可以将这些基团暴露出来,使之与亚铁离子迅速螯合,而制备的肽-亚铁螯合物也更稳定;此外,椰子球蛋白还具有低抗原、高消化吸收率、营养价值较高等优点。因此,椰子球蛋白是制备肽-亚铁螯合物的理想原料。同时,采用Sephadex G-25凝胶柱层析对蛋白质多肽进行分离纯化,可以筛选出活性更高、纯度更高的多肽组分,提高肽-亚铁螯合物的制备率。本研究结果表明水解度、温度、pH、亚铁离子浓度、时间等因素对椰子球蛋白多肽的亚铁离子螯合能力都有影响。其中,亚铁离子浓度和pH对螯合率的影响显著(P<0.05)。椰子球蛋白与亚铁离子螯合的最佳条件为椰子球蛋白多肽溶液浓度为1 g/100 mL、40 ℃、时间0.5 h、pH 7.0、亚铁离子浓度为0.5 mg/mL,此时的螯合率为30.67%。经荧光光谱和傅里叶红外光谱鉴定表明,椰子球蛋白多肽主要通过分子中的氨基、羧基和亚甲基与亚铁离子配位而形成络合物。该肽-亚铁螯合物可作为功能食品的成分,应用于改善人们铁营养缺乏的状况。
参考文献
[1] 李晓丽, 何万领, 吕 林, 等. 动物肠道铁吸收、转运及其调节的分子机制[J]. 中国畜牧杂志, 2013, 49(7): 83-87.
[2] 段 秀. 羅非鱼皮胶原蛋白肽亚铁螯合修饰及生物活性研究[D]. 昆明: 昆明理工大学, 2014.
[3] 杜 芬, 侯 虎, 姜丹丹,等. 基于Caco-2细胞模型评价鳕鱼源钙、铁螯合肽促钙、铁转运吸收特性[J]. 中国食品学报, 2018, 18(4): 51-57.
[4] Huang J, Liu X, Lan Q, et al. Proteomic profile of coco-nuts[J]. Europe Food Research Technology, 2016, 242: 449- 455.
[5] 郑亚军, 陈 华, 李 艳, 等. 椰子分离蛋白质提取工艺的研究[J]. 食品工业科技, 2009(1): 226-227, 230.
[6] Li Y, Zheng Y J, Zhang Y L, et al. Purification, characteri-zation, synthesis, in vivo and in vitro antihypertensive activity of bioactive peptides derived from coconut (Cocos nucifera L.) cake globulin hydrolysates[J]. RSC Advances, 2016, 6(95): 92688-92698.
[7] Li Y, Zheng Y, Zhang Y, et al. Antioxidant activity of coco-nut (Cocos nucifera L.) protein fractions[J]. Molecules, 2018, 23(3): 707.
[8] Bradford M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[9] 闭秋华, 孙 宁, 白文娟, 等. 水牛奶乳清蛋白制备抗氧化活性肽工艺的研究[J]. 食品科技, 2012, 37(6): 89-94, 97.
[10] 王 平, 翟新怀, 孙胜奇. 邻菲罗啉分光光度法测定磁铁原矿中铁含量[J]. 中国钼业, 2006(4): 46-47, 56.
[11] 李玉珍, 肖怀秋, 赵谋明, 等. 冷榨花生粕蛋白多肽-亚铁螯合物制备工艺优化及结构分析[J]. 中国粮油学报, 2017, 32(4): 64-69.
[12] 王常瞵, 王升光, 刘晓美, 等. 蚌肉肽-锌螯合物制备工艺及其保肝作用研究[J]. 食品与机械, 2019, 35(10): 103- 107.
[13] Sun N, Cui P, Jin Z Q, et al. Contributions of molecular size, charge distribution and specific amino acids to the iron- binding capacity of sea cucumber (Stichopus japonicus) ovum hydrolysates[J]. Food Chemistry, 2017, 230(5): 627- 636.
[14] 原 洪, 柴麗琴, 王立霞, 等. 花椒籽肽-铁螯合物的制备及其理化性质[J]. 食品与发酵工业, 2018, 44(6): 164- 14171.
责任编辑:崔丽虹
