基于“教、学、评”一体化的教学研究探析
2021-07-11林强
林强
摘 要:本文以“离子键”这节课为实例,论述在高中化学学科的常规课堂教学过程中如何做到“教、學、评”一体化,如何提升高中学生的化学学科核心素养。对教学背景和目标评价进行研析,详实展现了教学流程,并且对教学的效果进行即时的评价与深刻的反思。“教、学、评”一体化的教学关键在评价的及时性,方式的多样性、内容的针对性。
关键词:教、学、评一致性;案例;离子键
1 问题的提出
2014年国家提出的“核心素养”教学体系,明确立德树人的育人目标。针对化学学科《普通高中化学课程标准(2017年版)》指出化学学科的核心素养就是要培养学生正确的价值观、掌握必备的化学学科知识和提升化学学科关键能力[ 1 ]。而学科核心素养的落实方法是学科知识提升为能力和价值观的关键,课堂教学就是十分重要的一个途径。相较于旧版的《普通高中化学课程标准》,2017版课标的一个显著变化就是倡导“教、学、评”一体化。认为化学学习评价的重要表现形式之一是“化学日常学习评价”,同时也是落实“教、学、评”一体化教学的核心所在,这就要求教师潜心研究开展化学日常学习评价的有效方式、策略和途径等。“教、学、评”一体化的提出能有效地解决我们日常教学中“教”与“学”不一致;有教无评、有评无促;课堂教学高耗低能等问题。只有在“教、学、评”一体化的引领下,教学融评,“教、学、评”三者向同一方向作用才能真正提升课堂的有效性,发展学生的核心素养。
2 背景分析
“离子键”作为新版苏教版教材第一册课程中的一个重要内容,本节课的学习是以学生已经学的原子结构、元素周期律和元素周期表的知识为基础。“离子键”的学习有利于对前面所学的物质结构理论有一个系统性的理解,提升学生对“位、构、性”的理解。同时也为后期学习选择性必修“物质结构与性质”做好了知识储备。新版苏教版教材将这部分内容进行了适当的调整,将原来的必修二专题一调整为新教材化学第一册的专题五,将原本高一下学期学习的内容提前到高一上学期来学习,优化了教材知识结构,其具体内容部分没有大的变化。
3 教学目标与评价目标分析
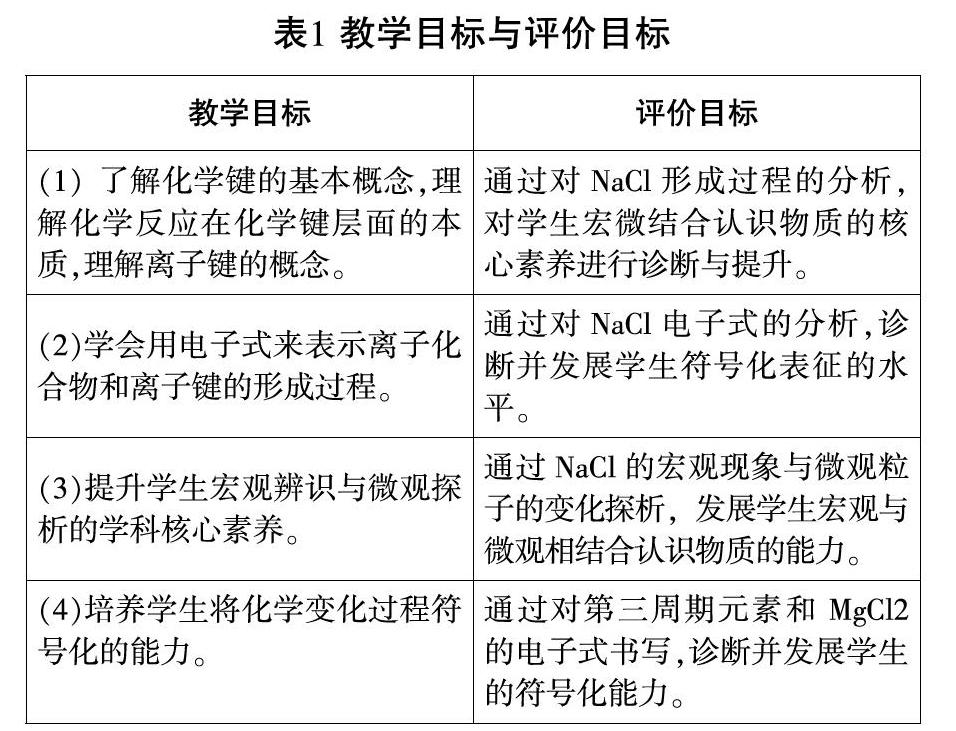
《普通高中化学课程标准(2017版)》对“化学键”的要求是认识构成物质的微粒之间存在相互作用,结合典型实例认识离子键的形成,建立化学键概念,认识化学键的形成与断裂过程中能量的变化[ 2 ]。根据课程标准要求和学生具体学习情况制定如表1的教学目标及评价目标。
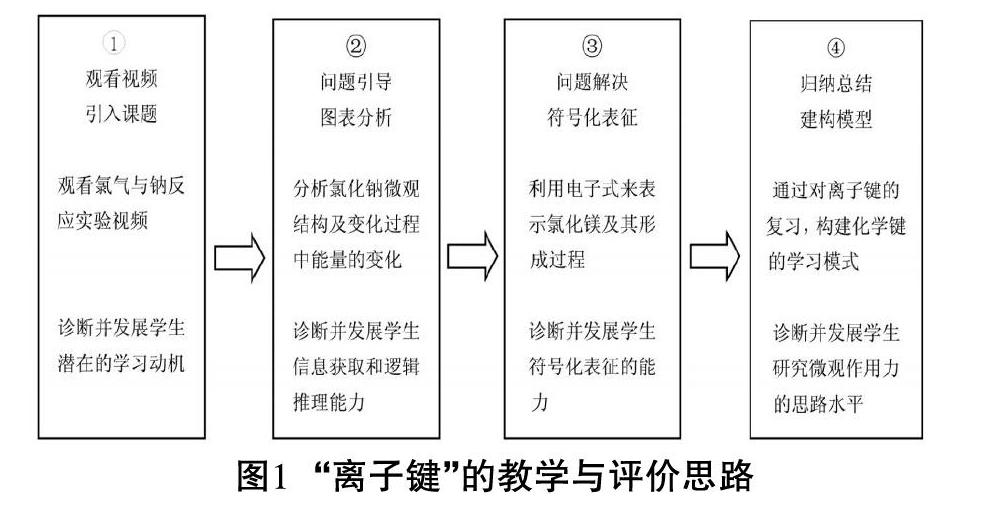
4 教学与评价思路
“离子键”的教学与评价思路如图1。
5 教学过程
【导入】从前面对元素周期表和元素周期律的学习我们知道,在周期表中目前已经发现的元素只有一百多种,而由这些元素组成的物质的种类数目却十分庞大。而这些元素的原子是怎样结合在一起的呢?这些原子在结合过程中发生了怎样的变化?又是受到了怎样的作用才会结合到一起的呢?
环节一:氯化钠的组成。
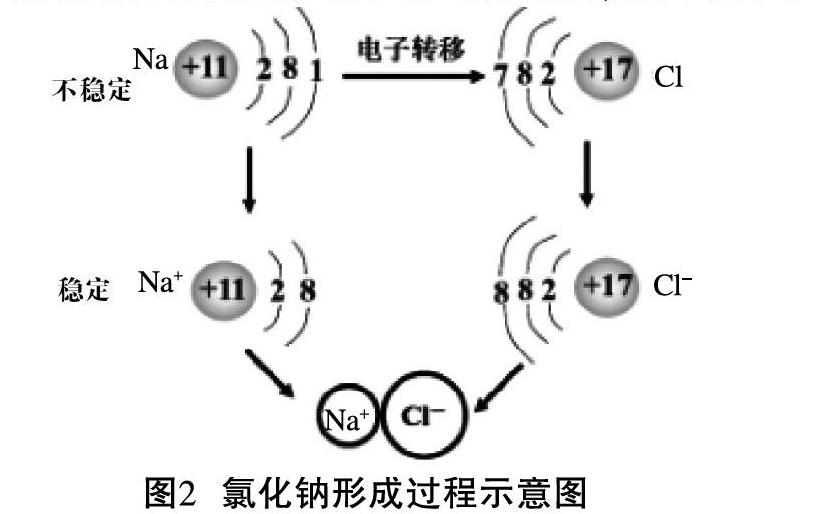
【师】请同学们认真观看钠在氯气中燃烧的视频,讨论并交流下列几个问题。
问题1:氯化钠是由什么微粒构成的?
问题2:钠原子和氯原子通过什么途径达到稳定结构?
设计意图:对学生原子结构相关知识的掌握情况进行评价,学会从氯原子和钠原子的原子结构特点分析得出原子间的结合过程就是一个为了达到稳定结构的过程,即使最外层电子形成8电子或2电子结构,如图2所示。
【思考与交流】请参照氯化钠的形成过程并结合已学的元素周期表相关知识,推测出哪些元素之间还可能通过电子的转移达到稳定结构。
设计意图:通过对元素周期律相关知识的评价过程进而推测出可能形成离子键的元素(ⅠA族、ⅡA族的金属元素,ⅦA族及ⅥA族非金属元素),发展学生的逻辑思维能力,能做到由“一个”到“一类”的能力进阶,透析化学键与原子结构的关系。
环节二:Na+与Cl-是如何形成氯化钠?
问题1:形成Na+与Cl-后是否就形成了氯化钠?
问题2:Na+与Cl-在相互靠近过程中存在哪些作用力?
【师】解析:阴离子与阳离子之间存在着静电作用(异性相吸),在静电引力作用下,钠离子与氯离子相互靠近使体系能量逐渐降低进而达到最低值(图3),而后钠离子和氯离子继续靠近时能量出现突增,则是由于离子之间的静电斥力(主要来自于电子与电子之间和原子核与原子核之间的同性相斥)造成的。当体系能量达到最低时,此时钠离子与氯离子之间的静电引力和静电斥力达到了平衡,因此才产生了稳定的氯化钠。
钠离子(氯离子)可以对周围各个方向上的氯离子(钠离子)起到吸引的作用,因此会堆积出如图4所示的氯化钠结构模型,所以“NaCl”并不表示“分子”而只表示“化学式”。
【阶段小结】由此可见,Na+和Cl-之间的作用力本质是“静电作用”,既包括静电引力又包括静电斥力。像这种物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做“化学键”,其中像氯化钠这种存在于阴阳离子之间的相互作用力称为离子键[ 3 ]。其模型可类比于我们教室门上的“插销”和“合页”。
设计意图:以生活中的真实模型“插销”、 “合页”形象直观的建立学生脑海中“化学键”的模型,加强对化学键的直观认识。运用图表分析的形式来培养学生获取、加工信息的学科关键能力。
【师】请各位同学阅读教材128页中关于离子键与离子化合物的定义,并交流讨论下列问题。
问题1:离子化合物由什么微粒组成?
问题2:单质会形成离子键吗?
问题3 :在HCl、H2SO4、MgCl2、NaOH中哪些属于离子化合物?
设计意图:即时评价,深化理解,以学生为主体,在理解的基础上建立学生对离子化合物多种维度辨别的规律总结,培养学生对所学知识的应用能力,发展学生的逻辑推理能力并提升化学学科核心素养。
环节三:变化过程符号化。
【师】阅读教材128页第二段,并交流讨论下列问题。
问题1:电子式为什么只表示出最外层电子?
问题2:用“ · ”或“×”有何差别?
问题3:电子标注的位置有什么要求?
问题4:以第三周期为例,写出该周期上的元素原子的电子式?
设计意图:通过阅读及利用已有的元素周期律知识,理解并掌握第三周期元素的电子式的意义及表示方法,即应用知识,在纠错的过程中深化知识的理解,做到讲练有机结合。
【师】以氯化钠的形成过程为例,详细讲评用电子式表示化合物形成过程的详细步骤及各种注意事项(如图5)。
【即时评价】请用电子式表示MgCl2的形成过程;写出Na2O的电子式。
设计意图:以氯化钠为样本促使学生举一反三理解用电子式表示简单离子化合物的形成过程,用MgCl2来对学生的学习效果做实时评价,在纠错过程中加深对知识的理解。
【小结】如图6所示:
6 教学效果与反思
6.1 知识的衔接性
本案例从已有的知识出发,旧知新思,从氯气和钠反应的表面现象出发,引发学生对这一现象背后的微观本质变化的思考,运用已学的元素周期律知识对形成离子键的常见元素的推理,既学习了新知,又能使已有的元素周期律知识得以巩固。
6.2 注重模型的直观化
本节课内容属于相对抽象的知识,本案例注重将模型直观化。利用图像直观(氯化钠晶体微观结构图)帮助学生理解离子化合物的形成特征。结合生活中的“插销”和“合页”这类生活中的实物模型类比抽象的“化學键”模型,让学生更快地理解和接受“化学键”这一陌生且抽象的知识模型。
6.3 注重“教、学、评”一致性
新课标所倡导“素养为本”的评价观,旨在提倡学生的自我评价、同学间的相互评价、教师的实时评价相融合。本案例紧扣化学学科核心素养,通过提问、点评、即时训练等方式对学生进行评价,充分做到教学融评,教、学、评相互促进,形成合力,很好的培育了学生的核心素养。
参考文献:
[1]王圆圆.素养为本的高中化学主题教学设计与实施研究 [D].聊城:聊城大学, 2019.
[2] 张晓红,柳军法.高中化学核心素养的培养[J].教育实践与研究,2018(9).
[3] 王霞.基于学科观念的高中化学“问题探究”教学实践研究[D].南京:南京师范大学,2014.
