氮磷氯共掺杂碳量子点用于食品中柠檬黄的快速检测
2021-07-06刘凌飞孙慧娟钱敏捷杨振泉何海林赵盛燕肖丽霞
刘凌飞,孙慧娟,钱敏捷,胡 钦,杨振泉,何海林,赵盛燕,肖丽霞
(扬州大学,食品科学与工程学院,江苏扬州 225001)
柠檬黄(Tartrazine)是应用最广泛的偶氮类合成染料之一,为橙黄色粉末,无臭,易溶于水,微溶于乙醇,不溶于油脂[1]。在食品的生产、加工、运输过程中,为适应人们对食品的感官需求,通常用柠檬黄对食品进行调色[2]。然而,过量食用柠檬黄会严重危害人体健康。研究表明,柠檬黄的过量摄入会引起DNA 损伤和干扰DNA 合成以致胎儿畸形[3];甚至会转换为致癌物质,引发皮下肉瘤、肝癌、肠癌等[4]。我国食品安全国家标准规定,柠檬黄在果冻、饮料、糖果、固体复合调味料中的最大使用量分别为0.05、0.1、0.3、0.2 g/kg[5]。因此,食品中柠檬黄含量的检测十分必要。目前,用于柠檬黄检测的常用方法有紫外分光光度法[6]、高效液相色谱法[7]、电化学法[8]和毛细管电泳法[9]。但是,这些方法大多需要繁琐的样品预处理、昂贵的设备、严格的操作条件和较长的分析时间,限制了它们的进一步应用。因此,迫切需要开发简单、快速、低成本的柠檬黄检测新方法。近年来,快速、灵敏、低成本的荧光分析法[10]开始用于柠檬黄的测定,特别是基于碳量子点(CDs)的荧光法在柠檬黄检测中展现出高灵敏度和高准确性。例如,Thulasi 等[11]以汽车尾气为原料制备氮掺杂碳量子点(N-CDs)用于检测饮料中的柠檬黄,检测限为26.0 nmol/L。Liu 等[12]以间苯二胺为原料,通过水热法制备氮掺杂碳量子点(N-CDs),检测饮料、糖果等食品中的柠檬黄,检测限为12.4 nmol/L。Chatzimitakos 等[13]以柑橘和柠檬皮为碳源制备碳量子点,在柠檬黄的检测中获得了200.0 nmol/L 的检测限。
CDs 是一种新型碳纳米材料,通常呈类球形且尺寸小于10.0 nm[14]。基于其高荧光稳定性、低毒性、高水溶性和良好的生物相容性等特点,CDs 在食品添加剂的快速检测方面展现出巨大优势[15-17]。CDs 的制备方法简单、成本低廉,可通过水热法[18]、微波法[19]、超声法[20]等方法制备。据报道,通过选择不同的合成材料和制备方式,可以调控CDs 的发光颜色和化学结构,提升CDs 荧光探针的灵敏度[21]。现有的用于柠檬黄检测的CDs 大多只掺杂了N,其检测性能仍有较大提升空间,因此,需要通过改变CDs 掺杂元素提升其对柠檬黄的检测性能。本研究以葡萄糖为碳源,乙二胺、浓磷酸、盐酸为杂原子供体,采用酸碱中和自放热法制备氮磷氯共掺杂碳量子点(N,P,Cl-CDs)。基于柠檬黄可以有效猝灭N,P,Cl-CDs 的荧光,构建了一种简单、灵敏的柠檬黄快速检测方法;优化了N,P,Cl-CDs 用于柠檬黄检测的反应条件,测试了该方法的线性范围、选择性和抗干扰性,探究了柠檬黄对N,P,Cl-CDs 荧光的猝灭机理;并将该方法用于实际食品样品中柠檬黄的检测。
1 材料与方法
1.1 仪器与试剂
HT 7800 透射电子显微镜TEM,日本日立高新技术公司;Cary 5000 紫外-可见-近红外吸收光谱仪UV,美国Varian;Cary 610/670 显微红外光谱仪IR,美国Varian;F-320 荧光分光光度计,天津港东科技股份有限公司;Agilent 1260 高效液相色谱仪,美国安捷伦科技有限公司。
本实验使用试剂包括葡萄糖、乙二胺、H3PO4、浓盐酸、柠檬黄、蛋氨酸、丝氨酸、组氨酸、L-甲硫氨酸、酪氨酸、甘氨酸、亮氨酸、谷氨酸、丙氨酸、色氨酸、天冬氨酸、还原型谷胱甘肽、抗坏血酸、叶酸、栀子苷、NaH2PO4、Na2HPO4、Na3PO4、K2C2O4、KBr、Na2SO3、NaHSO3、NaNO2、NaF、AgNO3、KH2PO4、NaCl、FeSO4、ZnCl2、CdCl2、MgSO4,所用试剂均为分析纯,购自国药集团化学试剂有限公司;实验用水均为超纯水,取自Milli-Q-RO4 超纯水净化系统,美国Millipore 公司;食品样品,包括果冻、糖果、汽水、能量饮料和固体调味料,购自江苏省扬州市的当地超市。透析膜(MWCO=500~1 000 Da),美国Spectrum 公司;醋酸纤维膜(0.22 μm,13 mm 内径),天津津腾有限公司。
1.2 N,P,Cl-CDs 的制备
以葡萄糖为碳源,采用酸碱中和自放热方法制备N,P,Cl-CDs。称取0.4 g 葡萄糖置于50.0 mL 玻璃烧杯中,依次向烧杯中加入6.0 mL 乙二胺、2.0 mL H3PO4(质量浓度85%)和2.0 mL 浓盐酸。反应产物自然冷却至室温,通过透析膜在1.0 L 玻璃烧杯中用超纯水透析,每24 h 更换超纯水,历时3 d,得到深棕色N,P,Cl-CDs 溶液。冷冻干燥后得到深棕色N,P,Cl-CDs 粉末,置于干燥器中备用。
1.3 反应条件优化
对包括N,P,Cl-CDs 溶液浓度、pH 值、反应时间在内的可能影响柠檬黄猝灭N,P,Cl-CDs 荧光效率(F0/F)的反应条件进行优化。在没有特殊说明的情况下,N,P,Cl-CDs溶液采用超纯水配制。N,P,Cl-CDs 溶液浓度设置为0.01、0.03、0.05、0.1、0.3、0.5、1.0 mg/mL,PBS 缓冲液的pH 值设置为(pH 2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0),反应时间设置为0、1、2、3、4、5、6、7、8、9、10、15、20、25、30、35、40 min,记录加入10.0 μmol/L 柠檬黄后F0/F 随反应时间的变化。设置激发波长(λex)和发射波长(λem)分别为370 nm 和447 nm,每组试验重复5 次,取平均值。
1.4 线性范围测定
将不同量的柠檬黄添加至2.0 mL、0.1 mg/mL 的N,P,Cl-CDs 溶液中,N,P,Cl-CDs 溶液中的柠檬黄浓度在0~100.0 μmol/L 范围内。记录不同浓度柠檬黄存在下N,P,Cl-CDs 溶液的荧光猝灭效率F0/F,绘制F0/F与N,P,Cl-CDs 溶液中柠檬黄浓度的线性关系图,其中F0和F分别为添加柠檬黄前后N,P,Cl-CDs 溶液的荧光强度。设置λex 和λem 分别为370 nm 和447 nm,每组实验重复5 次取平均值。
1.5 选择性及抗干扰性测试
为研究N,P,Cl-CDs 用于柠檬黄检测的选择性,向2.0 mL、0.1 mg/mL 的N,P,Cl-CDs 溶液中分别添加实际食品样品中可能存在的干扰物质,包含11 种氨基酸(蛋氨酸、丝氨酸、组氨酸、L-甲硫氨酸、酪氨酸、甘氨酸、亮氨酸、谷氨酸、丙氨酸、色氨酸、天冬氨酸)、4 种小分子(还原型谷胱甘肽、抗坏血酸、叶酸、栀子苷)、7 种阴离子(CH3COO-、Br-、SO32-、HSO3-、NO2-、F-、NO3-)、6 种阳离子(K+、Na+、Fe2+、Zn2+、Cd2+、Mg2+),N,P,Cl-CDs 溶液中干扰物质的浓度为10.0 μM,记录添加干扰物质前后的F0/F。设置λex和λem分别为370 nm 和447 nm,每组试验重复5次,取平均值。
为研究N,P,Cl-CDs 用于柠檬黄检测的抗干扰性,向2.0 mL、0.1 mg/mL 的N,P,Cl-CDs 溶液中加入柠檬黄,再分别添加上述实际食品样品中可能存在的干扰物质,N,P,Cl-CDs 溶液中柠檬黄和干扰物质的浓度均为10.0 μmol/L,记录添加柠檬黄和干扰物质前后的F0/F。设置λex和λem分别为370 nm 和447 nm,每组试验重复5次,取平均值。
1.6 实际样品测试
选取果冻、糖果、汽水、能量饮料和固体调味料作为实际食品样品进行加标回收实验。对于固体样品,包括果冻、糖果和固体调味料,每种样品分别称取1.0 g,转移至15.0 mL 离心管中,加入10.0 mL 超纯水,超声20.0 min以充分混合,12 000 r/min 离心10.0 min,取上清液。对于液体样品,包括汽水和能量饮料,每种样品量取10.0 mL转移至15.0 mL 离心管中,超声20.0 min 以除去气泡,准确量取1.0 mL 转移至10.0 mL 离心管中,加入超纯水稀释至10.0 mL。上述样品提取液均通过醋酸纤维膜过滤。向2.0 mL、0.1 mg/mLN,P,Cl-CDs 溶液中加入20.0 μL 过滤后的样品提取液,充分混合,记录添加样品提取液前后的F0/F。设置λex和λem分别为370 nm 和447 nm,每组试验重复5 次,取平均值。
采用高效液相色谱法[7]测定上述食品样品中的柠檬黄含量,考察N,P,Cl-CDs 用于柠檬黄检测的准确性。色谱柱为Agilent C18(150 mm×4.6 mm id stainless steel,5 μm),柱温30 ℃,进样量20 μL,流速为1.0 mL/min,检测波长为426 nm,流动相A 乙腈∶B 乙酸铵(20.0 mmol/L)=20∶80。
1.7 数据处理
TEM 图像采用Nano Measurer 软件分析,其他数据均采用Origin Pro 8.0 软件分析。
2 结果与讨论
2.1 N,P,Cl-CDs 的表征
采用TEM 图对N,P,Cl-CDs 的形貌和尺寸分布进行表征(图1A)。如图所示,制备的N,P,Cl-CDs 呈类球形且保持较好的分散性。图1A 中插图是通过随机计数TEM图像中40 个颗粒的大小,得到的粒径分布直方图,N,P,Cl-CDs 的粒径分布在2.40~6.28 nm 范围内,平均粒径为(4.04±0.5)nm。
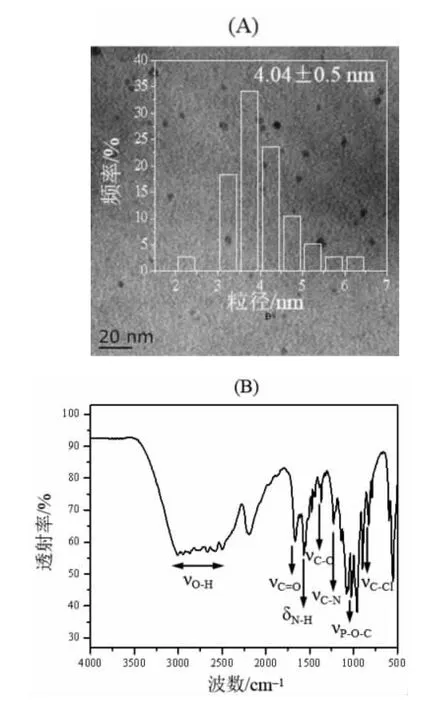
图1 N,P,Cl-CDs 的(A)TEM 图,插图为粒径分布直方图和(B)FTIR 图Fig.1 (A) TEM image and particle size distribution histogram and (B) FTIR spectrum of N,P,Cl-CDs.
采用傅里叶红外光谱(FTIR)对N,P,Cl-CDs 表面的官能团进行表征(图1B)。如图所示,2 505~3 006 cm-1处的宽吸收峰对应-OH 伸缩振动,1 666 cm-1和1 558 cm-1处的强吸收峰分别归因于C=O 伸缩振动和N-H 弯曲振动,在1 368 cm-1和1 228 cm-1处分别观察到对应C—O、C—N 伸缩振动的吸收峰,955 cm-1和828 cm-1处的吸收峰分别归属于P—O—C 伸缩振动和C—Cl 伸缩振动。以上结果表明,N、P、Cl 被成功掺杂进CDs 中。
采用紫外吸收-可见光光谱(UV-Vis)对N,P,Cl-CDs的紫外吸收性质进行表征(图2A)。如图所示,N,P,Cl-CDs 的UV-Vis 光谱在275 nm 和365 nm 处分别有吸收峰,前者是C=O 键n→π*跃迁导致的,后者是N、P 和Cl 杂原子引起的表面激发态的结果[22]。采用荧光光谱法对N,P,Cl-CDs 的荧光性质进行表征,N,P,Cl-CDs 的激发光谱在370 nm 处有激发峰;如图2A 中N,P,Cl-CDs 在370 nm 激发波长下的发射光谱所示,观察到在447 nm处有发射峰。图2B 为N,P,Cl-CDs 在不同激发波长下的荧光发射光谱,当激发波长从300 nm 增加至480 nm 时,N,P,Cl-CDs 的荧光发射峰随之变化,表现出典型的激发波长依赖性。由图2B 插图可见N,P,Cl-CDs 溶液在365 nm紫外光的照射下呈现蓝色荧光。

图2 (A)N,P,Cl-CDs 的紫外-可见吸收光谱、荧光激发光谱和发射光谱;(B)N,P,Cl-CDs 在不同λex 下的荧光发射光谱Fig.2 (A) UV-Vis absorption,fluorescence excitation and emission spectra of N,P,Cl-CDs;(B) Fluorescence emission spectra of N,P,Cl-CDs under different λex
2.2 反应条件优化
2.2.1N,P,Cl-CDs 溶液浓度对F0/F 的影响
不同浓度的N,P,Cl-CDs 溶液对柠檬黄猝灭N,P,Cl-CDs 荧光效率F0/F的影响见图3A。由图可知,N,P,Cl-CDs 溶液浓度在0.07~1.0 mg/mL 范围内时,F0/F 较高且随浓度变化不大;N,P,Cl-CDs 溶液浓度为0.1 mg/mL时,F0/F达到最大值。因此,选择0.1 mg/mL 为N,P,Cl-CDs的最佳浓度。
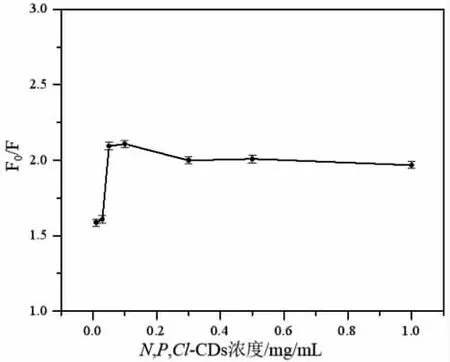
图3 N,P,Cl-CDs 浓度对柠檬黄检测的影响Fig.3 Effects of N,P,Cl-CDs concentration on tartrazine detection
2.2.2 pH 值对F0/F的影响
不同pH 值对柠檬黄猝灭N,P,Cl-CDs 荧光效率F0/F的影响见图4。由图可知,在pH 2.0~5.0 范围内,F0/F较为稳定;在pH 6.0~11.0 和以超纯水(pH 5.8)为溶剂的反应体系中,F0/F随pH 值变化且在pH 9.0 时达到最大值;而在以超纯水为溶剂的反应体系中,F0/F与最大值与之相差不大,因此为简化测试工作,本工作选用超纯水作为N,P,Cl-CDs 的溶剂。
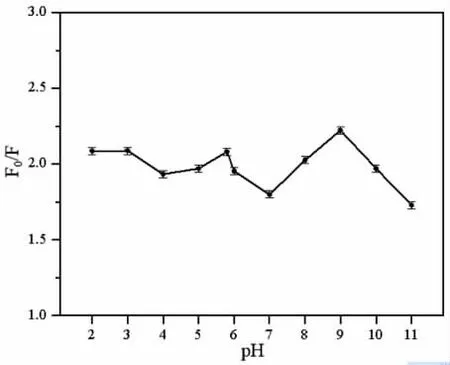
图4 pH 对柠檬黄检测的影响Fig.4 Effects of pH on tartrazine detection
2.2.3 反应时间对F0/F的影响
反应时间对柠檬黄猝灭N,P,Cl-CDs 荧光效率F0/F的影响见图5。由图可知,柠檬黄对N,P,Cl-CDs 荧光的猝灭作用在1.0 min 内迅速完成,F0/F达到最大值且随着时间增加无明显变化。因此,本工作选择1.0 min 为最佳反应时间。
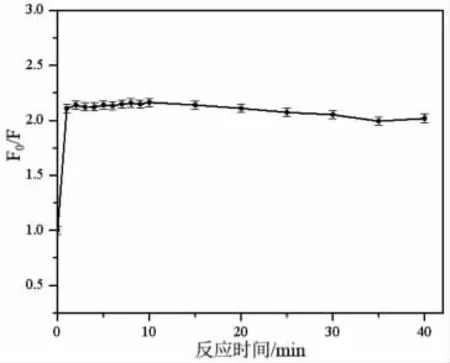
图5 反应时间对柠檬黄检测的影响Fig.5 Effects of reaction time on tartrazine detection
2.3 柠檬黄的不同添加浓度对F0/F 的影响
在上述最佳反应条件下,考察了不同浓度柠檬黄对N,P,Cl-CDs 荧光强度的影响(图6)。随柠檬黄浓度的增加,N,P,Cl-CDs 的荧光强度不断降低,表明柠檬黄可以有效猝灭N,P,Cl-CDs 的荧光。柠檬黄浓度在0.01~15.0 μmol/L 范围内与N,P,Cl-CDs 的荧光猝灭效率F0/F呈良好线性关系,对应的检出限为9.3 nmol/L,远低于现有的基于CDs 的荧光检测法[11-13]。
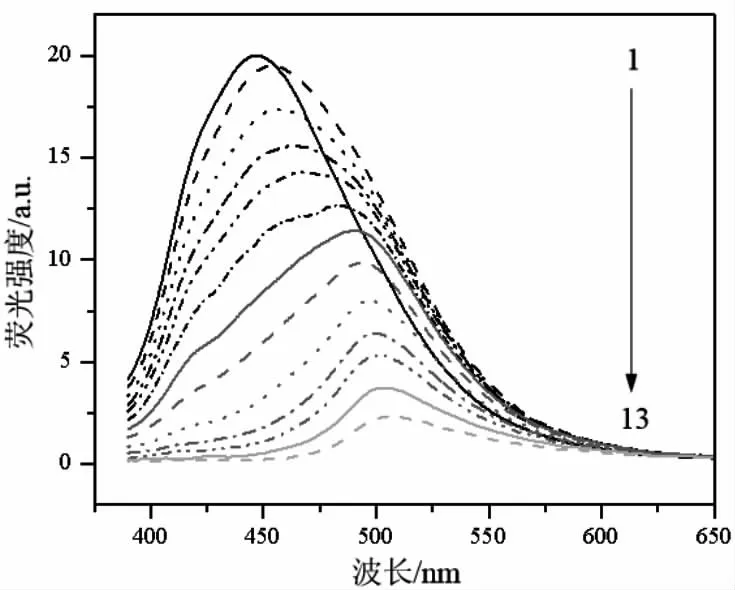
图6 柠檬黄浓度对N,P,Cl-CDs 荧光强度的影响,Fig.6 Influence of tartrazine concentration on the fluorescence intensity of N,P,Cl-CDs
2.4 选择性与抗干扰性
考察了N,P,Cl-CDs 对柠檬黄和实际食品样品中可能存在的干扰物质(各类氨基酸、小分子及阴阳离子等)的选择性(图5A)。N,P,Cl-CDs 溶液中柠檬黄和其他可能存在干扰物质的浓度均为10.0 μmol/L。如图所示,加入柠檬黄时,N,P,Cl-CDs 的荧光显著猝灭,而加入其他可能存在干扰物质时,N,P,Cl-CDs 的荧光强度几乎无变化。研究表明,N,P,Cl-CDs 对柠檬黄检测具有高选择性。
考察了基于N,P,Cl-CDs 的柠檬黄检测方法对上述实际食品样品中可能存在的物质的抗干扰性(图5B)。N,P,Cl-CDs 溶液中柠檬黄和其他可能存在干扰物质的浓度均为10.0 μmol/L。如图所示,在单独加入柠檬黄和同时加入柠檬黄与干扰物质时,N,P,Cl-CDs 的荧光猝灭效率无明显变化。因此,基于N,P,Cl-CDs 的柠檬黄检测方法具有良好的抗干扰性。
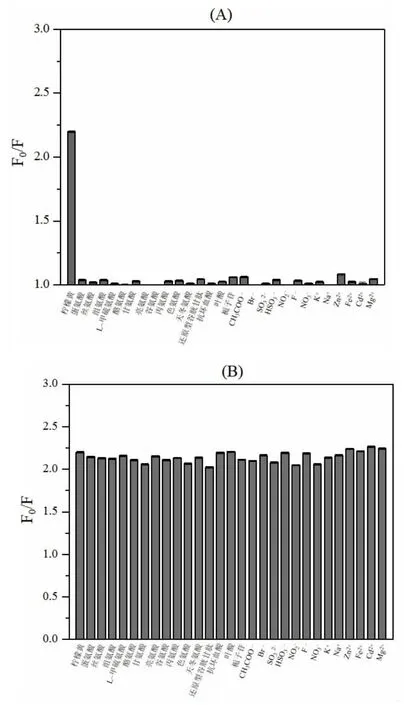
图7 N,P,Cl-CDs 对柠檬黄和各类氨基酸、小分子及阴阳离子等的(A)选择性和(B)抗干扰性Fig.7 (A) Selectivity and (B) anti-interference ability of N,P,Cl-CDs for various amino acid,small molecules,cations and anions et al
2.5 柠檬黄对N,P,Cl-CDs 的荧光猝灭机理研究
为探究柠檬黄对N,P,Cl-CDs 的荧光猝灭机理,表征了柠檬黄的紫外吸收光谱、N,P,Cl-CDs 的荧光激发光谱和发射光谱(图8A)。如图所示,柠檬黄的紫外吸收光谱与N,P,Cl-CDs 的荧光激发光谱和发射光谱在290~650 nm 范围内有明显重叠,表明柠檬黄对N,P,Cl-CDs 的猝灭作用是由荧光内滤效应引起的。
此外,荧光猝灭通常分为静态猝灭和动态猝灭,静态猝灭中荧光基团的荧光寿命不发生改变,而动态猝灭中猝灭剂的存在导致荧光寿命缩短[23]。本工作考察了柠檬黄对N,P,Cl-CDs 荧光寿命的影响,图8B 为添加柠檬黄前后N,P,Cl-CDs 的荧光衰减曲线,表1 为通过荧光衰减曲线双指数拟合(I(t)=A1exp(-t/τ1)+A2exp(-t/τ2),τ1和τ2分别为两个辐射衰减通道的时间常数,A1和A2分别为相应的振幅)获得的荧光寿命。研究表明,添加柠檬黄后N,P,Cl-CDs 的荧光寿命无明显变化,表明柠檬黄对N,P,Cl-CDs 的猝灭作用是静态猝灭。
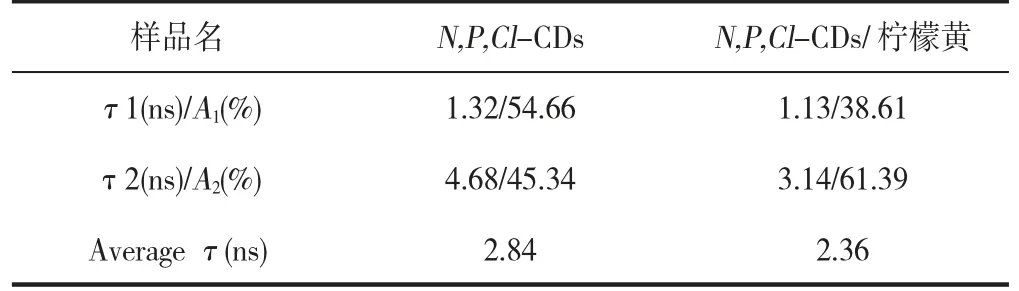
表1 N,P,Cl-CDs 和N,P,Cl-CDs/柠檬黄荧光衰减曲线的双指数拟合结果Table 1 Double-exponential fitting of N,P,Cl-CDs and N,P,Cl-CDs/Tartrazine decay curves
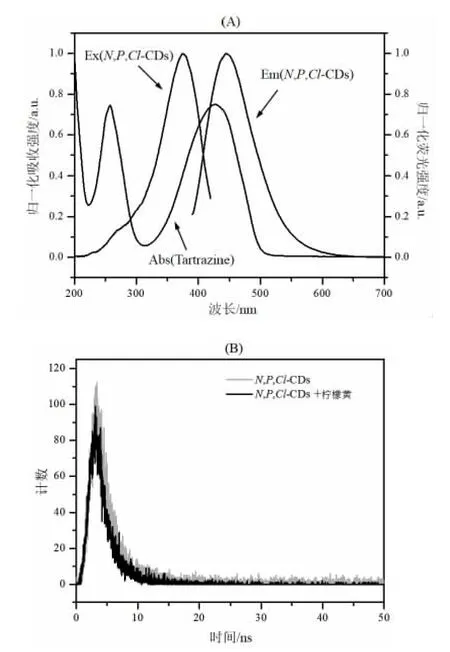
图8 (A)柠檬黄的紫外-可见吸收光谱,N,P,Cl-CDs 的荧光激发光谱和发射光谱;(B) 柠檬黄引入前后N,P,Cl-CDs 的荧光衰减曲线Fig.8 (A) The UV-vis absorption spectrum of tartrazine,and the fluorescence excitation and emission spectra of N,P,Cl-CDs.(B) The fluorescence decay curves of N,P,Cl-CDs in the absence and in the presence of tartrazine
2.6 实际样品测试
考察了基于N,P,Cl-CDs 的柠檬黄检测方法在实际食品样品检测中的可行性和准确性,结果见表2。果冻、糖果、汽水、能量饮料和固体调味料的提取液中柠檬黄的含量分别为0.09、0.06、0.10、0.08、0.09 μmol/L,样品中柠檬黄的原始浓度分别为0.05、0.03、0.05、0.04、0.05 g/kg,加标回收率在97.03%~105.41%范围内,相对标准偏差在0.96%~3.29%范围内。采用高效液相色谱法(HPLC)检测上述食品样品中柠檬黄的含量,如表2 所示,两种方法获得的检测结果具有一致性。结果表明,基于N,P,Cl-CDs 的柠檬黄检测方法在实际食品样品的柠檬黄检测中具有高准确性。
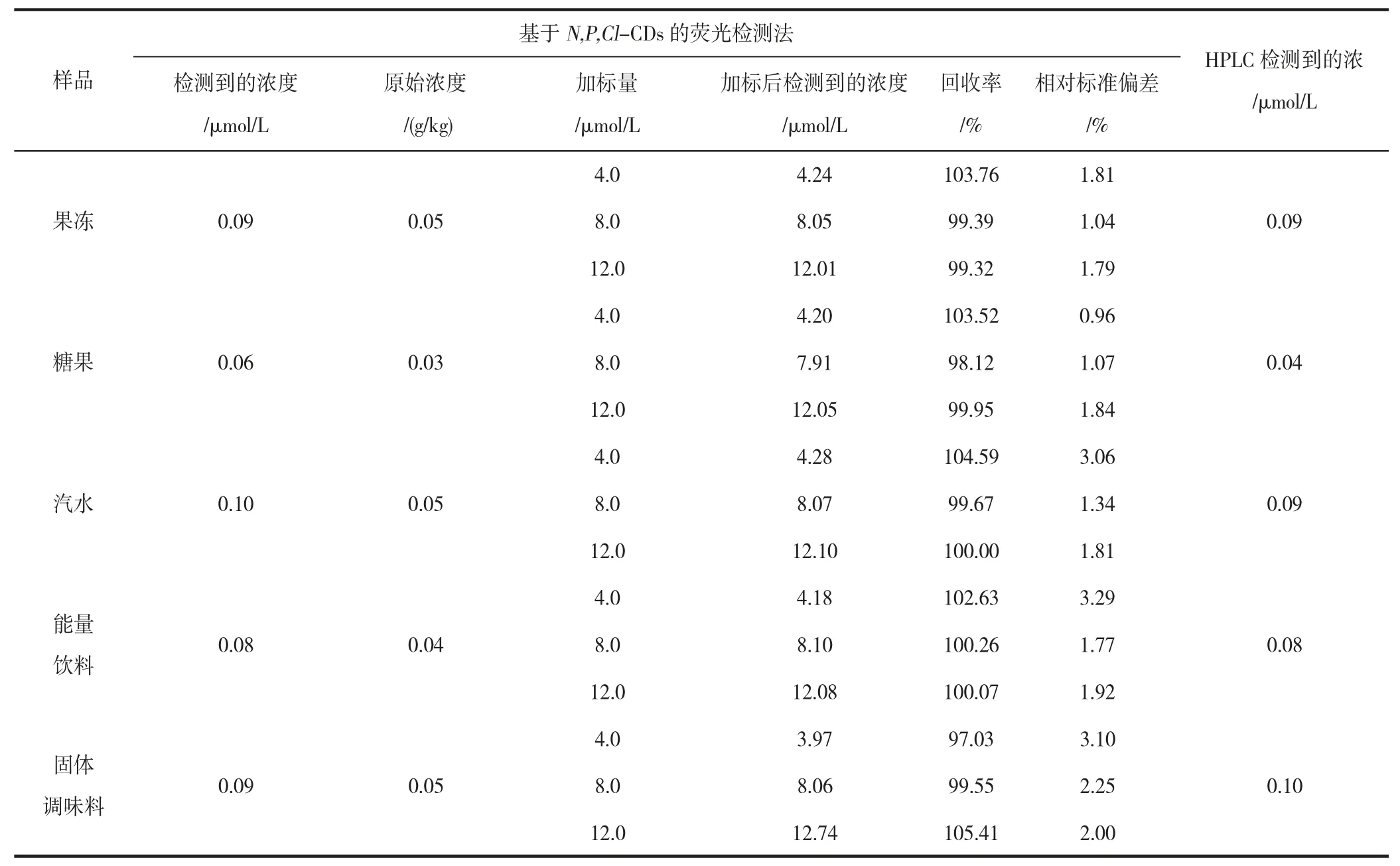
表2 食品样品中柠檬黄的检测Table 2 Detection of tartrazine in various food samples
3 结论
本研究以葡萄糖、乙二胺、盐酸、磷酸为原料,采用酸碱中和自放热法制备N,P,Cl-CDs,开发了基于N,P,Cl-CDs 的柠檬黄快速检测方法。该方法具有选择性好、抗干扰性强、灵敏度高的优势,在0.01~15.0 μmol/L 范围内有良好线性关系,检测限低至9.3 μmol/L。将本方法用于实际食品样品中柠檬黄的检测,加标回收率为97.03%~105.41%,相对标准偏差在0.96%~3.29%范围内,与高效液相色谱法获得的检测结果具有一致性,准确性较高。研究结果表明,本试验基于N,P,Cl-CDs 的柠檬黄检测方法在实际食品样品中柠檬黄的检测方面具有广阔的应用前景。
