亚热带不同演替阶段森林土壤可溶性有机氮与酶活性特征
2021-07-03常月丁咸庆侯红波项文化彭佩钦
常月,丁咸庆,侯红波,项文化,彭佩钦*
(1. 中南林业科技大学环境科学与工程学院,湖南 长沙 410004;2. 中南林业科技大学生命科学与技术学院,湖南 长沙 410004)
中国亚热带地区以潮湿和温暖的季风气候为特征,天然林中树木种类繁多,并且在演替后期一直由常绿阔叶林所主导[1-2]。但亚热带地区人为干扰强烈,大多数常绿阔叶林已转变为人工林或次生 林[3]。根据干扰程度和特定土壤类型和气候条件下的恢复程度,亚热带次生林沿梯度变化可以划分为针阔混交林、落叶阔叶林和常绿阔叶林等不同恢复演替阶段。在植被恢复过程中,土壤酶活性和土壤养分变化已受到众多研究者的高度关注。土壤酶活性和土壤氮素是森林植被恢复过程中生态系统健康水平的重要指标[4-5]。可溶性有机氮(soluble organic nitrogen, SON)是森林N流失主要形式,是土壤N运移的重要指标[6-7]。SON作为森林土壤氮状况和土壤酶活性的敏感指标,在很大程度上决定着生态植被恢复的成效。因此,研究不同森林类型土壤SON和酶活性特征及其联系对维持森林生态系统氮循环及森林更新方式的选择具有重要意义。
有研究表明,SON受多重因素影响,生物因素如植被类型、土壤微生物和土壤酶活性等,非生物因素包括气候环境、土壤母质、土壤养分、土壤理化性质和林分管理措施等,因此SON在不同森林类型下的数量、质量和生物降解性上均应存在显著不同[8]。植物和土壤微生物可以直接吸收利用土壤中的SON,这一过程中土壤酶参与SON的生成和利用,但两者之间的联系还认识有限[9]。亚热带地区阔叶林土壤SON量明显高于针叶林[10],而温带地区不同植被类型土壤SON并没有显著差异[11]。土壤SON随森林演替的变化特征,有待进一步明确。植物根系和微生物在土壤中,会大量分泌胞外酶来辅助养分吸收[12],通过对土壤酶活性进行定量可反映植物微生物对土壤养分的利用特征[13-14]。同时,土壤酶的活性也会受地表凋落物和土壤养分的显著影响[15-17]。土壤酶中,葡萄糖苷酶、木糖苷酶主要参与土壤碳循环过程,乙酰氨基葡糖苷酶参与氮循环,而磷酸酶主要参与磷循环。这几种酶的活性在土壤养分循环中均发挥着重要且代表性作用。由于土壤中碳氮磷元素循环是强烈耦合的过程,土壤SON可能同时受到碳氮磷相关酶活性的潜在影响。因此,对这几种降解酶活性的了解,可以为了解不同森林类型土壤SON及养分循环的差异提供信息,而且能表征土壤养分转化能力。
森林演替与土壤氮素转化是生态系统的关键过程。森林不同演替阶段土壤可溶性有机氮(SON)的数量和生物降解性上均受到碳氮磷转化相关酶活性的影响。我国亚热带地区在植被恢复过程中,发生着明显的森林演替过程。森林演替过程与土壤肥力动态变化规律尤其是矿质养分动态的关系研究较多[18-19],但土壤N(尤其是SON)和酶活性如何变化以及两者之间的关系尚不清晰。因此,本研究以亚热带不同演替阶段林地(针叶林、落叶阔叶林和常绿阔叶林)为对象,采集表层土壤样品,分析亚热带常绿阔叶林演替序列森林土壤SON和酶活性特征,探讨其特征及其与土壤理化性质的关系,研究SON在养分循环中扮演的角色,可以为揭示植被 类型与土壤氮库的动态耦合关系,为植被恢复、森林生态系统管理及其可持续发展提供了科学依据。
1 材料与方法
1.1 研究区域概况
研究点位于湖南省长沙市大山冲森林公园(113°17'~113°19' E,8°23'~28°24' N)。该区域为典型低山丘陵,属亚热带季风湿润气候,海拔高度在55~350 m之间,年均温度16.7~17.6 ℃,极端高温40 ℃,极端低温-11 ℃,雨量充沛,相对湿度较大,年降雨量在1 412~1 559 mm之间。土壤为由板页岩母质发育而成的红壤,地带性代表植被为亚热带常绿阔叶林。该园区现存三种主要自然演替的次生林,分别是马尾松针叶林(初期)、南酸枣落叶阔叶林 (中期)和石栎—青冈常绿阔叶林(晚期),这三种次生林代表了森林植被恢复三个阶段的主要森林植被类型。选取设置在三种林地的1 hm2长期观测样地[6],地理植被信息见表1。

表1 采样地信息Table 1 Characteristics of investigated forests
1.2 样品采集与处理
2016 年11月,在每个样地按上中下三个坡位沿对角线多点采样,分别采集3个土壤混合样品。土壤样品采集时,先去除地面凋落物,用铁锹挖取0~20 cm表层土壤。样品带回实验后,自然风干2周后,剔除可见石砾和根系,木棒碾碎过100目的尼龙筛,用于测定土壤总有机碳(TOC)、全氮(TN)和全磷(TP)等。同时按相同方法每个样地采集土壤鲜样各3个,样品鲜重1~2 kg。土壤鲜样回实验室后立即过20目网筛,充分混匀,置于4 ℃保存。新鲜土壤样品用于测定可溶性有机氮(SON)含量与葡糖胺糖苷酶(NAG)、葡萄糖苷酶(BG)木糖苷酶(BX)和磷酸酶(AP)4种土壤酶活性。
1.3 测定方法
采用2 mol/L KCl溶液浸提鲜土样,并用凯氏定氮法测土壤可溶性总氮(TSN)、铵态氮和硝态氮,SON含量通过土壤可溶性总氮与土壤无机氮的差值得到[6]。采用重铬酸钾—浓硫酸外加热法,测定土壤总有机碳含量[20];采用凯氏定氮法消解土壤全氮和全磷,并用间断化学分析仪(Easychem plus,意大利希思迪)分析测定[21]。土壤微生物生物量碳(MBC)和微生物生物量氮(MBN)采用新鲜土氯仿熏蒸-K2SO4提取法[22-23]。以熏蒸土样与不熏蒸土样的提取测定浸提液中的总碳差值乘以转换系数KC(2.64)计算得到微生物生物量碳(MBC),以熏蒸土样与不熏蒸土样的提取测定浸提液中的总氮差值乘以转换系数KN(2.22)计算得到微生物生物量氮(MBN)。采用酸度计(pHS-3C)测定土壤pH,水土比为2.5(超纯水)∶1。土壤含水率采用重量法 (铝盒)测定,105 ℃烘干至恒重,计算烘干前后质量差。
土壤酶采用96微孔酶标板荧光分析法。方法如下:取1 g新鲜土壤,用125 ml 50 mmol/L的醋酸盐缓冲液(pH=5)提取,用磁力搅拌器搅拌5 min使其均质化,用移液器取200 μL移于96孔微孔板。用伞形酮作为底物标示水解酶活性。微平板置于暗环境下经过20 ℃恒温培养后,用多功能酶标仪测定其荧光度。分别测得碳转化酶活性(葡萄糖苷酶BG:4-Methylumbelliferyl-β-D-glucosid;木糖苷酶BX:4-Methylumbelliferyl-β-D-xylopyranoside),底物为4-甲基伞形酮-β-D-葡萄糖苷、氮转化酶活性(乙酰葡糖胺糖苷酶NAG:4-Methylumbelliferyl-N-Acctyl-β-D-Glucosaminide),底物为4-甲基伞形酮-2-乙酰氨基-2-脱氧-β-D-吡喃葡萄糖苷,以及磷转化酶活性(磷酸酶AP:4-Methylumbelliferyl phosphate),底物为4-甲基伞形酮-磷酸酶等四种酶动力学活性[24]。
采用米氏方程(The Michaelis-Menten equation)确定酶活性参数:
式中:V为酶促反应速率(nmol/g/h);Km为酶半饱和反应浓度(μmol/g);Vmax为最大酶促反应速率(nmol/g/h);S为底物浓度(μmol/g)。
1.4 数据分析
使用软件SPSS 22.0进行统计分析,并采用Tukey’s test进行显著性差异分析。对土壤酶活性采用Origin 8.5中米氏方程进行拟合分析。采用CANACO 5.0以土壤酶活性为响应变量,同时以土壤养分以及土壤基本理化性质为解释变量做RDA分析,并绘制排序图。
2 结果与分析
2.1 三种森林类型土壤SON分析
三种森林类型中,常绿阔叶林土壤SON和无机氮均高于其他两种次生林(P<0.05)。而且3种林分中针叶林的SON、NH4+-N、NO3--N、MBN、TN均低于常绿阔叶林和落叶阔叶林(P<0.05,表2),说明在相同母质下针叶林土壤肥力低于常绿阔叶林和落叶阔叶林,由于常绿阔叶林的地表凋落物较针叶林分解速率更快且分解量大,常绿阔叶林和落叶阔叶林凋落物质量较高,含N量高且C/N比低,易分解,归还土壤的养分较多。针叶林土壤SON占可溶性总氮的比值SON/TSN显著高于常绿阔叶林和落叶阔叶林(P<0.05),因为阔叶林凋落物高于针叶林,且针叶林凋落物中含有相对较多的难以分解的化合物。土壤SON占全氮的比值SON/TN表现为常绿阔叶林>针叶林>落叶阔叶林。这一指标可以反映土壤SON被分解利用的难易程度,针叶林较阔叶林土壤全氮更难以被利用。

表2 三种森林类型土壤N组分含量及所占比Table 2 Content and proportion of soil N component in three forests
2.2 三种森林类型土壤酶活性分析
四种酶活性随底物浓度呈现的动力学变化,可以看出,与碳转化有关的葡萄糖苷酶和木糖苷酶的活性,落叶阔叶林和常绿阔叶林及随底物上升速率均高于针叶林,且以落叶阔叶林最大;葡糖胺糖苷酶活性,亦有类似表现,但其上升速度缓慢(图1)。说明落叶阔叶林更有利于葡糖胺糖苷酶、葡萄糖苷酶和木糖苷酶的活性的提高。而三种森林类型土壤磷酸酶活性差距较小,上升速度无明显差异。说明植被演替与碳氮转化相关酶活性更加密切。
对四种酶进行米氏方程拟合后,动力学参数见表3。其中,土壤葡糖胺糖苷酶、葡萄糖苷酶和木糖苷酶活性最大速率均基本表现为:针叶林<常绿阔叶林<落叶阔叶林,而土壤磷酸酶活性表现为:常绿阔叶林<落叶阔叶林<针叶林,但无显著差异(表3)。四种酶的半饱和反应浓度中,土壤葡萄糖苷酶、木糖苷酶活和磷酸酶活性表现为:落叶阔叶林<针叶林<常绿阔叶林,而葡糖胺糖苷酶活性表现为:针叶林<落叶阔叶林<常绿阔叶林。四种酶与底物亲和力系数,土壤葡糖胺糖苷酶、葡萄糖苷酶和木糖苷酶活性表现为:针叶林<常绿阔叶林<落叶阔叶林,土壤磷酸酶亲和力系数表现为:常绿阔叶林<落叶阔叶林<针叶林。酶活性和酶的亲和力表现一致,说明土壤底物(有机质)决定了酶反应速率。
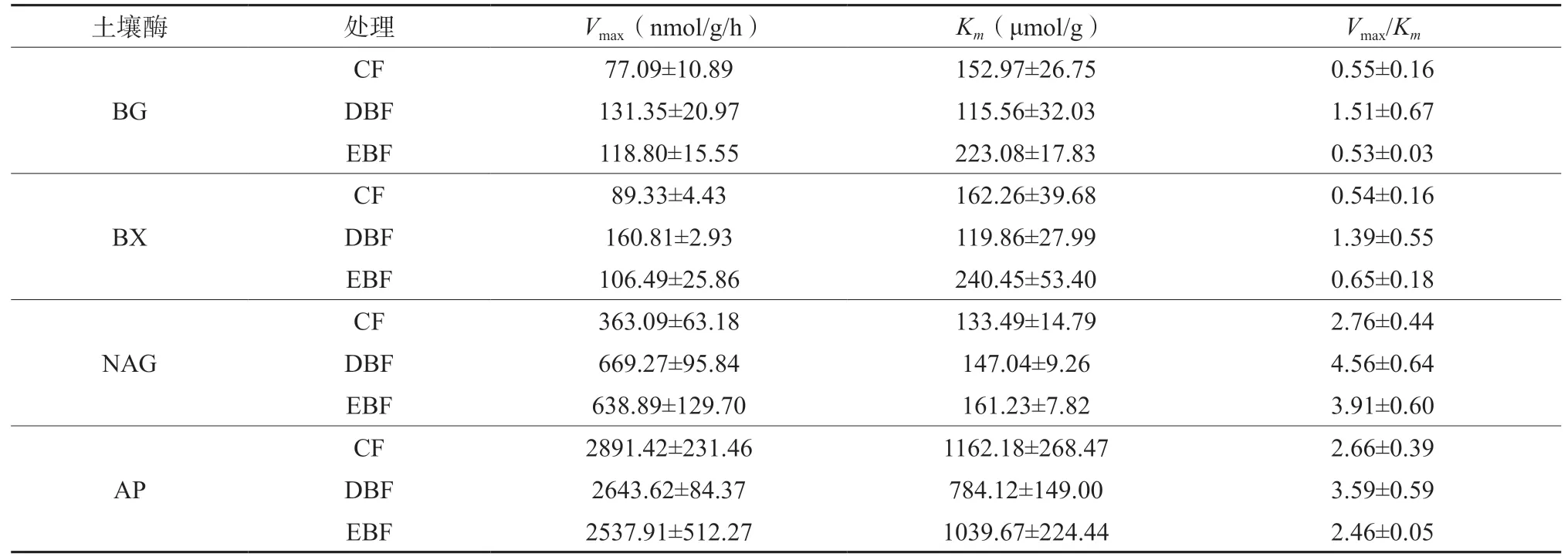
表3 三种森林类型土壤酶动力学参数Table 3 Kinetic parameters of soil enzymes in three forests
2.3 土壤各指标间相关性分析
可溶性氮各组分间均呈极显著正相关(P<0.01), 并且与土壤总氮显著正相关(P<0.05),与pH显著负相关(P<0.05,表4)。土壤葡糖胺糖苷酶、葡萄糖苷酶和木糖苷酶之间均呈极显著正相关(P<0.01),但与磷酸酶相关不显著(P>0.05)。土壤葡糖胺糖苷酶、葡萄糖苷酶和木糖苷酶均与土壤微生物生物量碳、微生物生物量氮和总氮显著正相关(P<0.05), 葡糖胺糖苷酶与总有机碳显著正相关(P<0.05)。磷酸酶与总磷呈正相关关系,但不显著。SON与pH呈极显著负相关(P<0.01),但与酶活性相关不显著(P>0.05)。

表4 三种森林类型土壤各指标之间的相关系数Table 4 Correlation coefficients among soil indicators of three forest types
2.4 土壤酶活性变化的RDA分析
以4种土壤酶活性为响应变量,以土壤理化性质和有效养分为解释变量,对3种林分表层土壤酶活性进行冗余分析,从而探究土壤理化性质、有效养分和土壤酶活性之间的相关关系。酶活性第一排序轴主要受土壤葡糖胺糖苷酶和葡萄糖苷酶两种酶控制,第一轴可以解释酶活性变化的72.06%,酶亲和力第一排序轴主要受土壤葡萄糖苷酶和木糖苷酶两种酶控制,第一轴可以解释酶亲和力变化的83.72%。微生物生物量氮是影响土壤酶活性的主要因素。土壤SON与土壤氮组分、土壤含水率、黏粒、总有机碳、总氮、微生物生物量碳和微生物生物量氮均存在显著正相关关系。SON与土壤葡糖胺糖苷酶、葡萄糖苷酶和木糖苷酶呈正相关,而与土壤容重、pH和砂粒呈显著负相关。磷酸酶与总磷呈正相关,与土壤葡糖胺糖苷酶、葡萄糖苷酶和木糖苷酶相关性不强。土壤葡糖胺糖苷酶、葡萄糖苷酶和木糖苷酶亲和力之间均呈显著正相关,葡糖胺糖苷酶亲和力与土壤总氮、微生物生物量碳和微生物生物量氮均显著正相关(图2)。该结果与土壤理化性质和酶活性相关性分析结果具有一致性。
3 讨论
3.1 森林类型对土壤SON的影响
土壤SON来源众多[25],其主要来源于土壤有机质、微生物、根系代谢产物和外源氮输入等[26]。不 同森林植被类型下,树种通过有机物的输入和对微生 物和土壤理化性质的影响,进而影响土壤SON[6-7]。本研究中,不同演替阶段的三种森林类型土壤SON含量基本表现为常绿阔叶林>落叶阔叶林>针叶林,说明土壤SON随着植被的正向演替而逐渐增加,有利于生态系统功能的恢复,受植被类型和土壤性质等影响明显。
因植被组成、树种数量、生物量、地表凋落物量以及凋落物质量不同,这些是造成SON不同的重要影响因素[27]。张琴和范秀华[28]研究发现,常绿阔叶林的地表凋落物较针叶林,分解速率更快且分解量大。由于阔叶林凋落物质量较高,含N量高且C/N比低,容易分解,归还土壤的养分较多,并且土壤微生物生物量高,而针叶林凋落物养分含量低,其中含有单宁、蜡质等物质较多难分解,造成土壤微生物生物量低,这些因素都会导致SON的直接来 源量不同,因此阔叶林和针叶林土壤SON差异明显[29-30]。三种森林类型中,针叶林土壤SON/TSN所占比表现为显著高于阔叶林(P<0.05),说明针叶林土壤SON较难分解,并且由于微生物量低,更多的比例SON没有被利用[31]。由于常绿阔叶林的现存地表凋落物量高于落叶阔叶林[32-33],土壤微生物生物量碳也以常绿阔叶林最高。尽管落叶阔叶林微生物生物量氮较高,但由于N转化速率也更快,造成SON的消耗,因此常绿阔叶林土壤SON量较落叶阔叶林多。
本研究发现,SON与铵态氮、硝态氮、可溶性总氮和总氮等各养分之间均有显著或极显著的相关,与丁咸庆等[34]和鲍勇等[35]的研究一致。这表明了SON重要N来源和去向,并且SON是可溶性总氮的主要组成部分。You等[36]对本研究区域这三种类型森林的降水、茎流和地表径流中的可溶性总氮研究发现,地表径流中可溶性总氮浓度随森林的演替而显著增加,即从针叶林到落叶阔叶林再到常绿阔叶林。SON是N流失的重要组成部分,未来研究将更多关注于SON在这其中扮演的重要角色。三种森林土壤SON与pH显著负相关(表4),与张丹丹等[37]研究一致,说明土壤酸度会影响SON的量。有研究认为土壤pH可以通过影响与土壤微生物而致SON发生变化[38],随着大气氮沉降输入氮的增加,土壤趋于酸化,这可能导致加速SON的流失[39]。
3.2 不同森林土壤酶活性差异及其与SON的联系
土壤酶活性是土壤养分周转的重要驱动因素,对于酶活性随森林不同演替阶段发生着怎样的变化还了解不多。已有研究表明,土壤酶作为催化土壤众多生化反应的主要承载体,受到多种因素的影响,如土壤理化性质、微生物种类与数量、土壤养分状况、植被组成和土壤地形地貌等[31,40]。其中植被组成不同势必会导致凋落物、植被根系数量和质量的改变,引起土壤养分的变化,因此森林类型对土壤酶活性有着重要的影响。部分研究结果发现亚热带森林土壤微生物生物量碳和微生物生物量氮随植被正向演替呈现先增加后降低的趋势[41]。本研究结果与Feng等[41]的结果相似:3个演替阶段中土壤微生物生物量氮表现为落叶阔叶林>常绿阔叶林>针叶林,这进一步证实了阔叶树种比例增加会提高土壤微生物活性。
对于土壤酶活性在植被演替过程中的变化特征,有研究发现,草丛向乔灌阶段演替时土壤磷酸酶活性显著增加,但乔灌向原生林演替时,磷酸酶活性略有下降或平稳增加,但差异均不显著[42]。对温带森林土壤葡糖胺糖苷酶活性的研究结果表明,在人工林向天然更新林演替阶段该酶活性显著增 加[31]。随植被演替葡萄糖苷酶活性随着植被演替的变化规律更为复杂[43]。本研究结果表明,常绿阔叶林和落叶阔叶林土壤中葡糖胺糖苷酶、葡萄糖苷酶和木糖苷酶活性是明显高于针叶林,而针叶林中磷酸酶活性略高。这是因为阔叶林土壤中易分解碳多,促进了微生物对易分解碳的利用,这体现了土壤底物即有机质与酶活性之间的正相关关系。而磷酸酶与全磷显著正相关,说明针叶林可能更需要磷。土壤SON与土壤葡糖胺糖苷酶、葡萄糖苷酶和木糖苷酶均呈正相关(图2)。这说明,土壤SON受土壤碳氮转化相关酶的影响,并且土壤碳氮转化相关酶是强烈互相关联的。土壤葡糖胺糖苷酶活性和亲和力均与土壤全氮和微生物生物量碳氮均显著正相关,表明了葡糖胺糖苷酶的重要来源,也为SON潜在来源提供驱动力。
土壤微生物生物量、微生物活性和微生物群落组成是影响土壤酶活性的关键因素[44]。酶活性伴随着森林土壤微生物群落组成不同而造成差异,而来自凋落物层释放的SON会引起土壤微生物群落结构的改变[45-46]。有研究发现,土壤SON与土壤酶活性之间具有很好的相关性[11],这些结果表明土壤SON受土壤酶的强烈影响。而本研究中土壤SON与土壤酶活性没有显著相关性,说明土壤酶对SON的影响可能更多取决于微生物生物量、微生物种类和活性。有研究证实,土壤SON周转是土壤氮循环的重要途径[47],而SON是微生物最易利用的有机氮源,相关酶的活性有利于SON产生和代谢,因此SON和土壤酶相互关联。亚热带是氮趋于饱和区[48],但土壤转化酶活性(尤其是葡糖胺糖苷酶)仍然比较高,表明森林土壤养分周转速率依然很快。这其中,植物和微生物为了获得更多的碳氮磷等营养元素,通过促进相关酶活性,增加分解土壤有机质来满足需求。季节变化和微生物群落变化也会影响土壤氮含量和酶活性[16],因此,还需对季节动态和微生物做进一步研究,以便更好地探究土壤SON含量与酶活性的联系,从而为揭示森林更替后不同林分对土壤氮循环的影响机制提供科学依据。
4 结论
亚热带不同演替阶段的森林土壤中,阔叶林土壤SON、微生物生物量氮和土壤全氮明显高于针叶林,而针叶林土壤SON和可溶性总氮显著高于阔叶林,表明阔叶林比针叶林在保持土壤氮(特别是SON)方面更有效。阔叶林土壤中葡糖胺糖苷酶、葡萄糖苷酶和木糖苷酶活性均明显高于针叶林,随着植被恢复,土壤酶活性随植被正向演替逐渐增大。土壤SON与葡糖胺糖苷酶、葡萄糖苷酶和木糖苷酶均呈正相关关系,表明随着森林的正向演替,土壤SON含量呈上升趋势且更易被利用。亚热带不同演替阶段森林土壤可溶性有机氮和酶活性差异明显,随植被正向演替,SON含量增加,SON转化相关的酶活性增强,研究表明森林植被正向演替伴随着土壤氮素养分快速循环过程。
