红霉素软膏微生物限度试验方法的验证
2021-07-01刘玲薛建国
刘玲 薛建国

摘 要 目的:建立红霉素软膏的微生物限度检查方法。方法:用3个批号的红霉素软膏进行微生物限度试验的验证,确定适合红霉素软膏的微生物限度检查方法。结果:所采用的方法能有效消除红霉素的抑菌成分,使实验结果能真实反映产品微生物污染的情况。结论:可采用薄膜过滤法对红霉素软膏进行微生物限度试验。
关键词 红霉素软膏 微生物限度 薄膜过滤法
中图分类号:R986; R927.1 文献标志码:A 文章编号:1006-1533(2021)07-0078-03
Verification of microbial limit test method for erythromycin ointment
LIU Ling1*, XUE Jianguo2
(1. Xinyang Institute for Food and Drug Control, Henan Xinyang 464000, China; 2. Xinyang Food Supervision Office, Henan Xinyang 464000, China)
ABSTRACT Objective: To establish a method for microbial limit test in erythromycin ointment. Methods: According to the microbial limit standard of the test product, the verification test was conducted with three batches of erythromycin ointment to investigate the test method for determining microbial limit of erythromycin ointment. Results: The method used could effectively remove the bacteriostatic components in erythromycin ointment, so that the experimental results could truly reflect the situation of contaminated bacteria. Conclusion: The microbial limit of erythromycin ointment can be examined by membrane filtration.
KEy WORDS erythromycin ointment; microbial limit; membrane filtration
红霉素软膏为白色至黄色软膏,为皮肤科用药类非处方药。本品每克含主要成分红霉素1万单位[1]。用于脓疱疮等化脓性皮肤病、小面积烧伤、溃疡面的感染和寻常痤疮。微生物限度检查是评价非终端灭菌制剂受微生物污染程度的有效方法[2],是药品安全性检查的重要项目[3]。根据中华人民共和国药典2015年版四部要求,供试品检查时,应根据供试品理化特性和微生物限度标准等因素选择合适的方法检查,所选方法须经验证[4],为此,作者对红霉素软膏的微生物限度检查方法进行了验证试验。
1 材料与方法
1.1 仪器
BHC-1300ⅡA2型生物安全柜(苏净集团苏州安泰空气技术有限公司);250B 型数显生化培养箱(江苏金坛荣华仪器制造有限公司);LRH-250型智能生化培养箱(郑州生元仪器有限公司);SPX-150型生化培养箱(扬州惠科电子有限公司);Htysteritest 601集菌仪(杭州泰林生物技术设备有限公司)。
1.2 样品及集菌器
红霉素软膏(批号:170301、160412、161102,新乡华青药业有限公司);FY220一次性使用集菌过滤培养器(生产批号:FY2181108,滤膜孔径0.45 μm,温州维科生物实验设备有限公司)。
1.3 培养基及稀释液
pH 7.0无菌氯化钠-蛋白胨缓冲液、胰酪大豆胨液体培养基中(TSB)、沙氏葡萄糖液体(SDB)培养基、沙氏葡萄糖琼脂培养基(SDA)、胰酪大豆胨琼脂培养基(TSA)、甘露醇氯化钠琼脂培养基、溴化十六烷基三甲胺琼脂培养基,均购自北京三药科技开发公司,他们均通过培养基适用性检查。0.9%无菌氯化钠溶液(NS),由信合援生制药股份有限公司提供。
1.4 菌种
金黄色葡萄球菌(Staphylococcus aureus)[CMCC(B)26003]、銅绿假单胞菌(Pseudomonas aeruginosa)[CMCC(B)10104]、枯草芽孢杆菌(Bacillus subtilis)[CMCC(B)63501]、白色假丝酵母(Candida albicans)[CMCC(F)98001]、黑曲霉(Aspergillus niger)[CMCC(F)98003],均来源于中国食品药品检定研究院。
1.5 试验菌液的制备
按照《中华人民共和国药典2015年版四部》通则1105要求制备[4]。
1.6 供试液的制备
从4支软膏中取样品10 g,置含无菌玻璃珠的输液瓶中,加入20 ml无菌十四烷酸异丙酯,振摇使溶解。再加入45 ℃ pH 7.0无菌氯化钠-蛋白胨缓冲液100 ml,振摇10 min,静置,取下面水层作为1∶10的供试液。
1.7 需氧菌总数计数法的验证
1)试验组[4-7] 取1∶10的供试液2 ml,加入适量的NS中,混匀,过滤,用NS冲洗,每次冲洗量100 ml,总冲洗量:900 ml/膜,在最后一次冲洗液中分别加入金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌菌悬液各2 ml,滤干,立即贴膜于TSA平板上。
2)供试品对照组 取上述制备好的供试液,以稀释液代替菌液,同试验组操作,测定供试品本底菌数。
3)菌液对照组 取相应稀释液替代供试液,按试验组操作加入试验菌液并进行微生物回收试验。
用于细菌检测的平皿于35 ℃培养3~5 d,逐日观察结果。
1.8 霉菌和酵母总数计数法的验证
验证方法[4-7]同需氧菌总数计数法的验证,总冲洗量为:500 ml/膜。贴膜于SDA平板上,于25 ℃培养5~7 d,逐日观察结果。
1.9 控制菌检查方法的验证
1)试验组[8] 取1∶10供试液20 ml,加入100 ml NS中,滤过,再用NS冲洗3次,每次100 ml,在最后一次冲洗液中加入50~100 cfu的金黄色葡萄球菌(或铜绿假单胞菌),滤过后,灌注100 ml的TSB,32 ℃培养18~24 h后,划线接种于甘露醇氯化钠琼脂培养基(溴化十六烷基三甲胺琼脂培养基)的平板上,按照金黄色葡萄球菌(或铜绿假单胞菌)的检查方法进行检查。
2)阳性对照组 取相应稀释液替代供试液,按试验组操作加入试验菌液,平板上应有控制菌典型菌落生长。
3)供试品对照组 取上述制备好的供试液,以稀释液代替菌液,同试验组操作。
4)阴性对照组 以相应稀释液替代菌液和供试液,同试验组操作。
培养物于35 ℃培养至规定时间,逐日观察结果。
2 结果
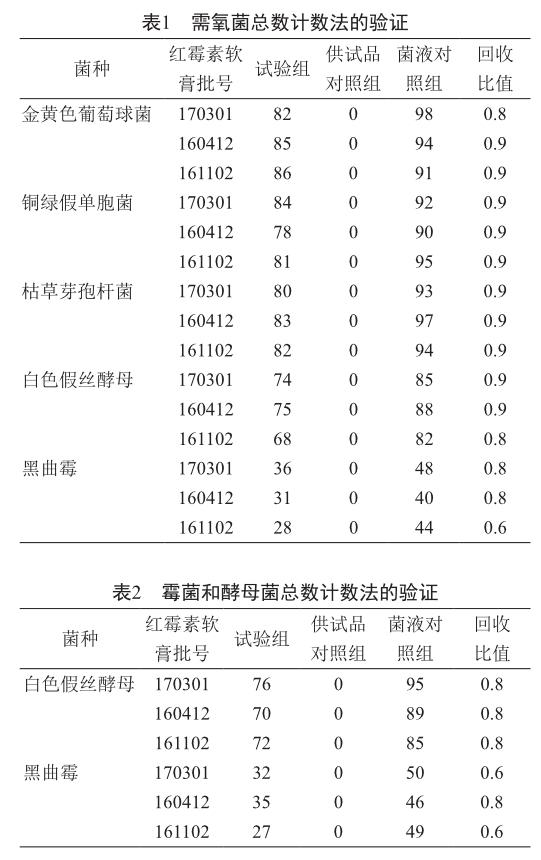
2.1 需氧菌、酵母和霉菌总数计数法的验证
各需氧菌、酵母和霉菌的加菌回收比值均在0.5~2范围内(表1~2),表明采用薄膜过滤法,能有效地消除红霉素软膏对这些试验微生物菌株的抑制作用。
2.2 控制菌檢查方法适用性试验
按照验证方案的要求进行试验,发现试验组与阳性对照组均检出金黄色葡萄球菌的(或铜绿假单胞菌)典型阳性菌落,阴性对照组未见菌生长(表3),则可确认本法适用于金黄色葡萄球菌的(或铜绿假单胞菌)检查。红霉素软膏可照此验证过的供试液制备方法及金黄色葡萄球菌的(或铜绿假单胞菌)检查方法进行检查。
验证过程中若存在和发现任何的偏差和漏项,都应详细记录,并按规定进行调查和处理。
3 讨论
药品检验是目前保证药物质量和安全性的一个有效手段,其中,药品的微生物检验和控制是药品安全性保障的一项重要措施[9]。红霉素具有很强的抑菌效果,为了消除其抑菌作用,笔者按照中国药典2015年版四部要求,采取先用十四烷酸异丙酯充分溶解样品,然后再用萃取、多次冲洗的办法才能有效地消除其抑菌作用,而不影响样品中微生物污染的检测。
根据样品的微生物限度标准(需氧菌总数、霉菌及酵母菌总数均为100 cfu/g)以及供试液的稀释倍数及冲洗量较大,供试液的取样量可以适当加大倍数,以免产生误差过大。
供试液制备时,样品中加入20 ml无菌十四烷酸异丙酯后,应当充分振摇使溶解。再加入45 ℃ pH 7.0无菌氯化钠-蛋白胨缓冲液100 ml后,振摇时幅度不要太大,否则会乳化,难分层。
参考文献
[1] 胡昌勤, 刘炜. 抗生素微生物检定法及其标准操作[M]. 北京: 气象出版社, 2004: 27-36.
[2] 李玉芹. 浅谈目前无菌检查和微生物限度检查存在的问题[J]. 中国药事, 2007, 21(12): 1011-1012.
[3] 许华玉, 杜鹃, 汤杨. 药品中微生物污染检测方法验证的必要性[J]. 中国药品标准, 2005, 6(4): 46-48.
[4] 国家药典委员会. 中华人民共和国药典2015年版四部[M]. 北京: 中国医药科技出版社, 2015: 140-151.
[5] 中国药品生物制品检定所. 中国药品检验标准操作规范[M]. 北京: 中国医药科技出版社, 2010: 1-65.
[6] 杨晓莉, 李辉, 马英英, 等. 中国药典2015 年版非无菌产品微生物限度检查: 微生物计数法解读[J]. 药物分析杂志, 2016, 36(6): 1101-1107.
[7] 国家药典委员会. 中国药典分析检测技术指南[M]. 北京:中国医药科技出版社, 2015: 564-573.
[8] 杨晓莉, 李辉, 马英英. 中华人民共和国药典2015 年版非无菌产品微生物限度检查: 控制菌检查法解读与对策法解读[J]. 中国药师, 2016, 19(4): 748-752.
[9] 胡昌勤. 药品微生物控制现状与展望[J]. 中国药学杂志, 2015, 50(20) : 1747-1751.
