威百亩熏蒸后土壤微生物群落重建及功能恢复
2021-06-29赵鹏宇燕平梅赵晓东白雪
赵鹏宇 燕平梅 赵晓东 白雪
摘要 :本研究旨在科學评价威百亩熏蒸对土壤微生物生态系统的影响,为环境友好型消毒剂的选择提供理论线索。本研究以实验室威百亩熏蒸的土壤为材料,通过高通量测序技术,研究威百亩熏蒸对土壤细菌群落的影响及熏蒸后土壤微生物群落重建及功能修复的机制。结果表明:高通量测序总共测得1 062 241个高质量序列,共比对出5 882个细菌分类单元(OTUs)。熏蒸处理后不同阶段土壤细菌群落结构在门水平上较为类似,但是在种水平差异显著。威百亩熏蒸处理对微生物群落结构和功能造成很大影响,使得细菌群落α多样性、群落构建的驱动因素、共发生网络关系以及碳水化合物代谢、氨基酸代谢、能量代谢等代谢活性在熏蒸处理后的初、中期阶段表现出上升或者下降的趋势,并在处理后的中后期迅速恢复并趋于平稳。以上结果表明,威百亩处理对细菌群落造成强烈的“生态扰动”,导致细菌群落表现出“抑制激活恢复”的阶段性特征。微生物群落的稳定性与群落的抵抗力和恢复力密切相关。本研究为科学评价威百亩土壤消毒对土壤微生态系统的影响提供理论支撑,为环境友好型消毒剂的选择提供线索。
关键词 :土壤消毒; 威百亩; 土壤微生物群落; 功能重建
中图分类号:
Q 939.96
文献标识码: A
DOI: 10.16688/j.zwbh.2020461
Reconstruction and functional recovery of soil microbial community
after fumigation of metam-sodium
ZHAO Pengyu*, YAN Pingmei, ZHAO Xiaodong, BAI Xue
(Department of Biology, Taiyuan Normal University, Jinzhong 030619, China)
Abstract
The purpose of this study is to scientifically evaluate the impact of metam-sodium fumigation on the soil micro-ecosystem and provide theoretical clues for the selection of environment-friendly disinfectants. The influence of metam-sodium fumigation on soil bacterial community and the mechanism of reconstruction and functional restoration of soil microbial community after fumigation were studied in the laboratory through high-throughput sequencing technology using metam-sodium fumigated soil as the material. A total of 1 062 241 high-quality sequences were obtained by high-throughput sequencing,among which a total of 5 882 bacterial taxa (OTUs) were identified. The soil bacterial community structures were similar at the phylum level at different stages after fumigation treatment,but show significant difference at the species level. Metam-sodium fumigation had a great impact on the structure and function of the microbial community, the alpha diversity of bacterial community, the driving factors of community construction, the co-occurring network relationship and the metabolic activity showed an increase or a downward trend at the initial and middle stages after metam-sodium fumigation, but quickly recovered and stabilized in the later period after the application of metam-sodium. The above results indicated that the application of metam-sodium caused a strong “ecological disturbance” to the bacterial community, resulting in phase characteristics of “inhibition-activation-recovery” in the bacterial community. The stability of microbial community was closely related to the resistance and resilience of the community. This study provides a theoretical support for the scientific evaluation of the impact of soil disinfection with metam-sodium on the soil micro-ecosystem and provides clues for the selection of environment-friendly disinfectants.
Key words
soil disinfection; metam-sodium; soil microbial community; functional reconstruction
土壤消毒可以有效控制作物连作条件下的土传病害和地下害虫,是保护农田种植行之有效的生产技术。土壤熏蒸剂是利用其挥发时产生的气体来毒杀有害生物的一类农药。然而,由于熏蒸剂作用效果的广谱性,在施用过程中不可避免地会对土壤中非目標微生物的组成及功能活性造成影响,进而改变整个土壤生态系统的结构和功能,尤其是养分转化过程[1]。与其他二硫代氨基甲酸盐农药一样,威百亩通过干扰病原菌呼吸酶(如丙酮酸脱氢酶)来发挥其生物活性。异硫氰酸甲酯是威百亩的降解产物,也是熏蒸过程的关键生物活性物质[25]。从施用效果上看,威百亩熏蒸对土传病害、地下害虫及杂草的防治效果能够替代溴甲烷,但其是否是优良的环境友好型熏蒸剂目前尚未见报道。
土壤熏蒸引起的土壤微生物群落结构的破坏可以视为一种生态上的“扰动”。土壤熏蒸对土壤生态系统“扰动”的程度与多种因素有关,主要包括熏蒸剂种类、剂型与施用量[6]、本底微生物群落组成[7]、土壤施肥历史、土壤理化因子[8]及其质地[9]等,并且与施肥策略[10]也有很大的关系。一方面,威百亩处理造成的生态“扰动”对土壤微生物群落造成强烈的环境胁迫,是研究农药施用对土壤微生物群落影响的理想实验模型;另一方面,这种特殊的“扰动”可以用于设计微宇宙试验,研究“扰动”后土壤微生物生态系统的重建过程。因此,熏蒸可以作为一种研究手段来深入探讨土壤生态系统的“扰动抗逆恢复平衡”过程,研究“扰动”对随后的群落重建和功能恢复的影响机制。
本研究以实验室威百亩熏蒸处理的土壤为试验材料,通过高通量测序技术,探究威百亩熏蒸对土壤细菌群落的影响及 “扰动”后土壤微生物群落重建及功能恢复情况,以期科学评价威百亩土壤熏蒸对土壤微生态系统的影响,为环境友好型消毒剂的选择提供理论线索;并为土壤生态系统的维稳机制提供一定的理论支持。
1 材料和方法
1.1 材料
供试土壤为山西省太原市小店区黄瓜大棚连作3年以上的土壤。土壤为沙壤土,其理化性质为:碱解氮50.08 mg/kg,有机质27.85 g/kg,全氮1.27 g/kg,速效钾223 mg/kg,有效磷43.96 mg/kg,pH 6.98。
药剂:42%威百亩水剂(AS),大连染料化工有限公司。
1.2 微宇宙的设置以及取样设置
微宇宙试验在一个含有300 g土的广口瓶中进行。42%威百亩AS的剂量设置为70 mg/kg(参考文献[11],略有改动),共设置6个重复,以加入等量的蒸馏水为对照,对照设置3个重复。试验时先用灭菌蒸馏水调整土壤湿度至田间最大持水量的60%,之后将药剂均匀施加到土壤中,立即使用瓶塞和凡士林封闭瓶口,然后放置在25℃的黑暗条件中恒温培养7 d。7 d后移除瓶塞,瓶口用透气塑料膜再次封好,以避免空气中的杂菌污染土壤。
移除瓶塞后在微生物的重建过程中定期加入灭菌水来弥补土壤中水分的损失。分别于移除瓶塞后3 d(本研究简写为F),15 d(S),40 d(T)从每个广口瓶中取1 g土壤样本,尽量保持土壤完整,避免破坏性取样。部分用于分析土壤物理化学参数;剩余部分储存在-80℃冰箱中用于后续核酸的提取。
1.3 DNA提取、PCR扩增和测序
使用E.Z.N.A.Soil DNA Kit(Omega,USA)提取土壤DNA。用酶标仪Infinite200 PRO(TECAN,Switzerland)测定DNA的纯度和浓度。DNA的A260/A280在1.8~2.0时可用于下一步试验。
扩增体系(25 μL):5 U/μL Plantium Taq 0.5 μL,10×EasyTaq Buffer(Mg2+ Plus)5.0 μL,dNTPs 40 μL,50 μmol/L引物0.5 μL,DNA模板5.0 μL,加入无菌水至25 μL。PCR反应条件:95℃ 3 min;95℃ 30 s,62℃30 s,72℃ 30 s,30个循环;72℃ 5 min。
从每个土壤样品中提取3个DNA样品,将其PCR产物充分混匀后送上海美吉生物技术工程有限公司,通过Illumina Miseq测序平台,对16S rDNA高变区V3-V4区进行测序。
1.4 群落构建过程分析
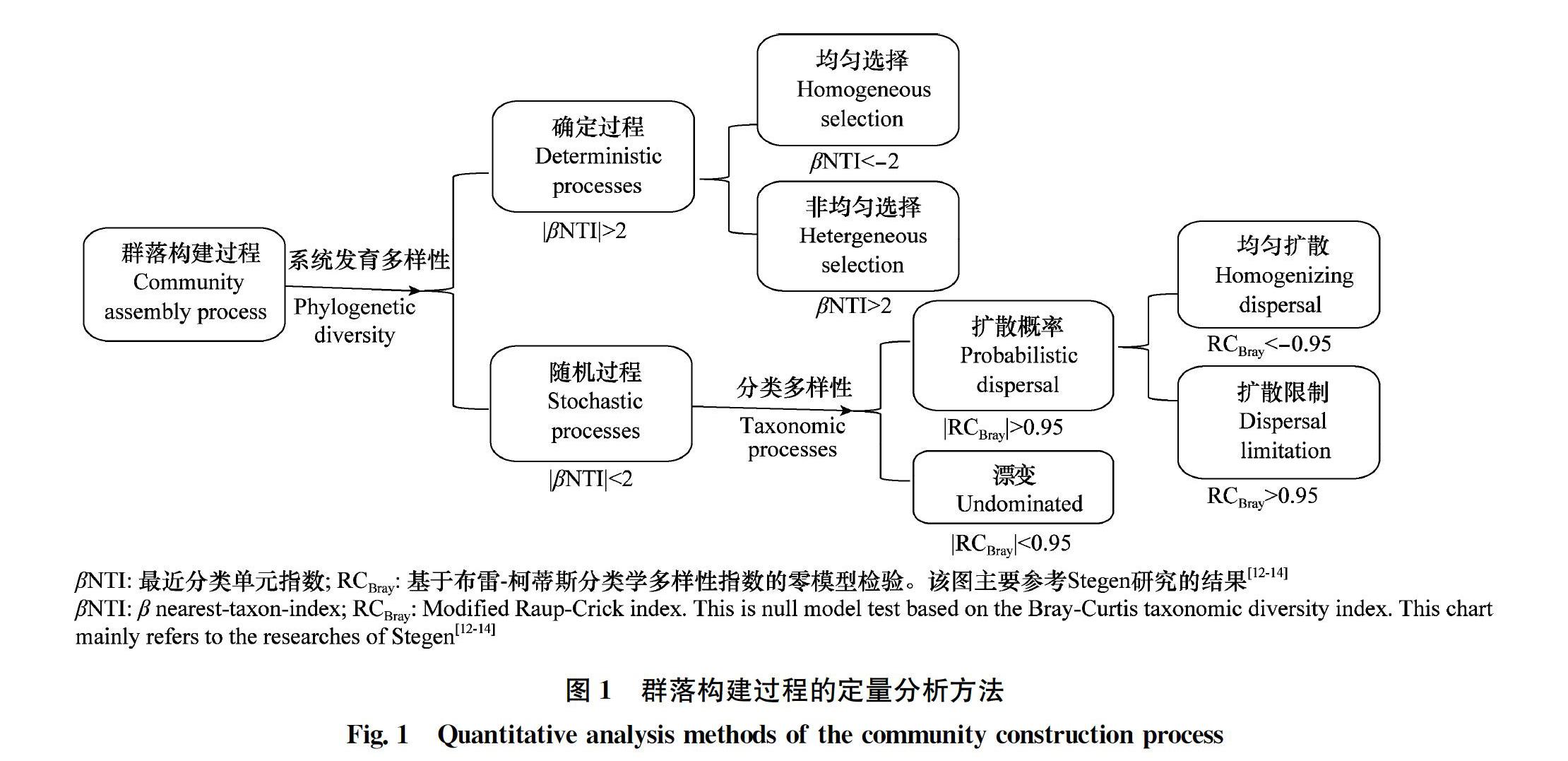
为了观察群落构建过程的驱动因素,参考Stegen等[1214]提出一种基于系统发育结构的分析方法(图1)。
1.5 统计分析
采用单因素方差分析(ANOVA)评估威百亩熏蒸处理后不同阶段细菌群落α多样性、优势类群、群落构建的驱动因素、共发生网络关系以及功能预测的差异。利用非度量多维尺度分析(NMDS)对熏蒸处理后不同阶段的细菌群落进行排序分析。共发生网络分析是基于OTU丰度,利用斯皮尔曼等级相关矩阵(Spearman correlation matrix)评估变量之间的相关性,筛选出相关系数大于0.6且呈显著相关的OTUs(否则,剔除)。然后采用false discovery rate(FDR<0.05)校正P值。网络分析的参数运算使用R语言中igragh程序包,并且在Gepih软件中可视化(https:∥gephi.org/)。物种的共存格局(co-occurrence pattern)是由嵌套程度和离散程度共同决定,因此使用WNODF指数来评估群落中物种的嵌套程度(degree of nestedness);使用C值来判定群落的聚集/分离(aggregation/segregation)程度。使用PICRUSt2针对样本中微生物群落的功能组成进行功能预测。
2 结果与分析
2.1 威百亩熏蒸对土壤细菌群落结构和多样性的影响
高通量测序总共获得1 062 241个高质量序列,比对出5 882个细菌分类单元(OTUs)。测序的覆盖度指数为99.19%~99.75%,这表明所比对的序列能够涵盖绝大部分土壤样品中的细菌序列。
共有3 439个OTUs(58.46%)是在威百亩熏蒸处理后不同阶段(CK、处理后3、15 d和 40 d)所共有的(图2)。其中,14个(0.23%)、29个(0.49%)、63个(1.07%)和144个(2.44%)OTUs分别只在CK、处理后3、15 d和40 d中检测出。并且,CK组的OTUs数相对最小,而处理后40 d(T阶段)的OTUs相对最多。
本研究相对丰度大于0.01%的细菌门总共比对出13个(图3)。威百亩熏蒸处理后不同阶段,放线菌门Actinobacteria的相对丰度最高(平均相对丰度32.05%),其次是变形菌门Proteobacteria(2224%)和绿弯菌门Chloroflexi(15.80%)。其中,放线菌门在熏蒸处理后3 d的相对丰度最高(33.68%),在CK组的相对丰度最低(26.35%);变形菌门在熏蒸处理后3 d的相对丰度最高(2398%),在15 d的相对丰度最低(21.97%);绿弯菌门在熏蒸处理后40 d的相对丰度最高(1718%),在15 d的相对丰度最低(14.33%)。并且,如图4所示,放线菌门和Bacteroidota菌群在处理后不同阶段的相对丰度有显著差异(P<0.05),而其他菌群的相对丰度在处理后不同阶段无显著差异(P>0.05)。
使用非度量多维尺度分析(NMDS)对熏蒸处理后不同阶段的处理组与对照组细菌群落结构(种水平)进行排序分析(图5)。结果表明,土壤细菌群落结构在处理后相同阶段内相似程度高,而在不同阶
段差异较大。组间差异显著性分析(ADONIS, P<0.01)表明,微生物群落结构在不同阶段有显著
差异。综上,在熏蒸处理后不同阶段,细菌群落结构在门水平上较为类似,但是在种水平上差异显著。
2.2 熏蒸处理后不同阶段的细菌群落多样性及其多样性维持机制
如图6所示,威百亩熏蒸处理后,土壤微生物群落的多样性受到很大影响。Sobs指数、ACE指数和Chao指数在CK组分别为3 104、4 158和4 200,处理后3 d分别降低为2 678、3 780和3 840;处理后15 d分别升高为3 105、4 144和4 134,且处理后3 d和15 d存在显著差异(P<0.05);处理后40 d Sobs指数(3 246)、ACE指数(4 235)和Chao指數(4 228)和15 d时基本持平,两者间无显著差异(P>0.05)。另一方面,Shannon指数和Simpson指数,在CK、处理后3、15 d和40 d均没有显著差异(P>0.05)。综上,土壤微生物多样性(尤其是丰富度)在处理后不同阶段呈现出先下降后上升再平稳的阶段性特征。
群落多样性的维持机制就是群落构建的驱动机制,即群落构建机制。根据熏蒸处理后不同阶段土壤细菌群落结构betaNTI值的结果(图7),参考Stegen等的群落构建划分方法[12],推断群落构建过程在CK、处理后3 d和40 d更多地受到变量选择的影响(heterogeneous selection),其betaNTI值(箱线图中的中位数)大于2(图7)。并且,在处理后15 d,betaNTI值为1.85,表明细菌群落在处理后15 d更多地受到随机过程的驱动(|betaNTI|<2)。
2.3 熏蒸处理后不同阶段土壤细菌群落共发生网络分析
细菌群落共发生网络分析(co-occurrence network)主要反映某一环境条件下微生物群落的共存格局,可以在一定程度上反映群落的种间关系。通过微生物群落共发生网络分析,相比于熏蒸处理后各阶段,CK组的边数量(1 648)、节点数量(232)、聚集系数(0.51)、模块数(6)和平均度(14.16)都是最小的;而在熏蒸处理后3 d,节点数量(282)、聚集系数(0.56)和模块数(16)都是最大的;15 d和40 d的节点数量、聚集系数和模块数处于两者之间。这表明,细菌群落的共发生网络关系也具有一定的阶段性特征。
通常将除外围节点(peripherals)外的其余3种类型的节点(connectors、module hubs和network hubs)归为关键节点,而网络关系中的关键节点是群落中起关键作用的核心物种[15]。本研究通过微生物共发生网络的模块内连通度(Zi)和模块间连通度(Pi)来鉴定核心物种(图9),结果表明,熏蒸处理后3 d的核心物种数量更多,而CK组的核心物种数量较少。这表明,群落的核心物种在熏蒸后呈现出先上升后下降的阶段性特征。
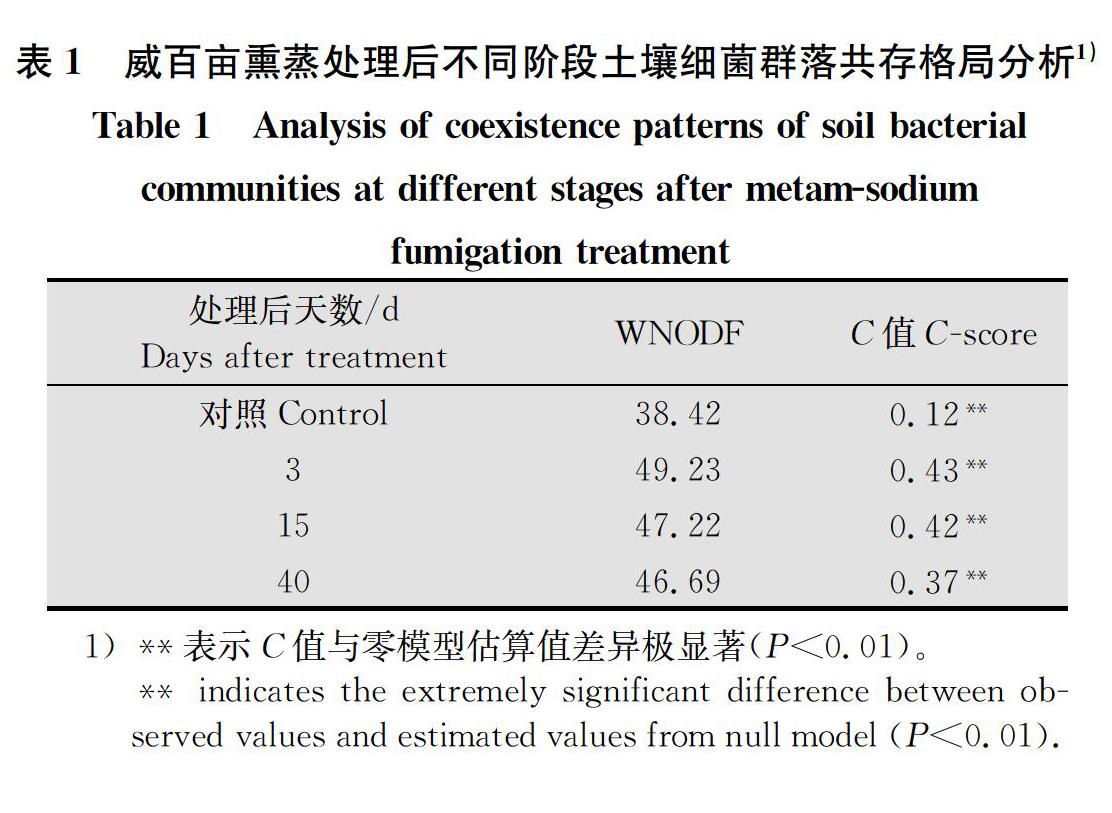
为了揭示细菌群落的共存格局(co-occurrence patterns),本研究计算了群落中物种的嵌套指数WNODF值与C值(表1)。结果表明,处理后3 d的WNODF值最大(49.23),CK组的WNODF值最小(38.42),这表明群落在处理后3 d的嵌套结构更明显。另一方面,由于处理后3 d的C值最高(043,P<0.01),表明细菌群落在处理后3 d具有更显著的离散格局(segregated pattern)。综上,细菌群落的共存格局在处理后也有一定的阶段性特征。
2.4 熏蒸处理后不同阶段的代谢活性分析
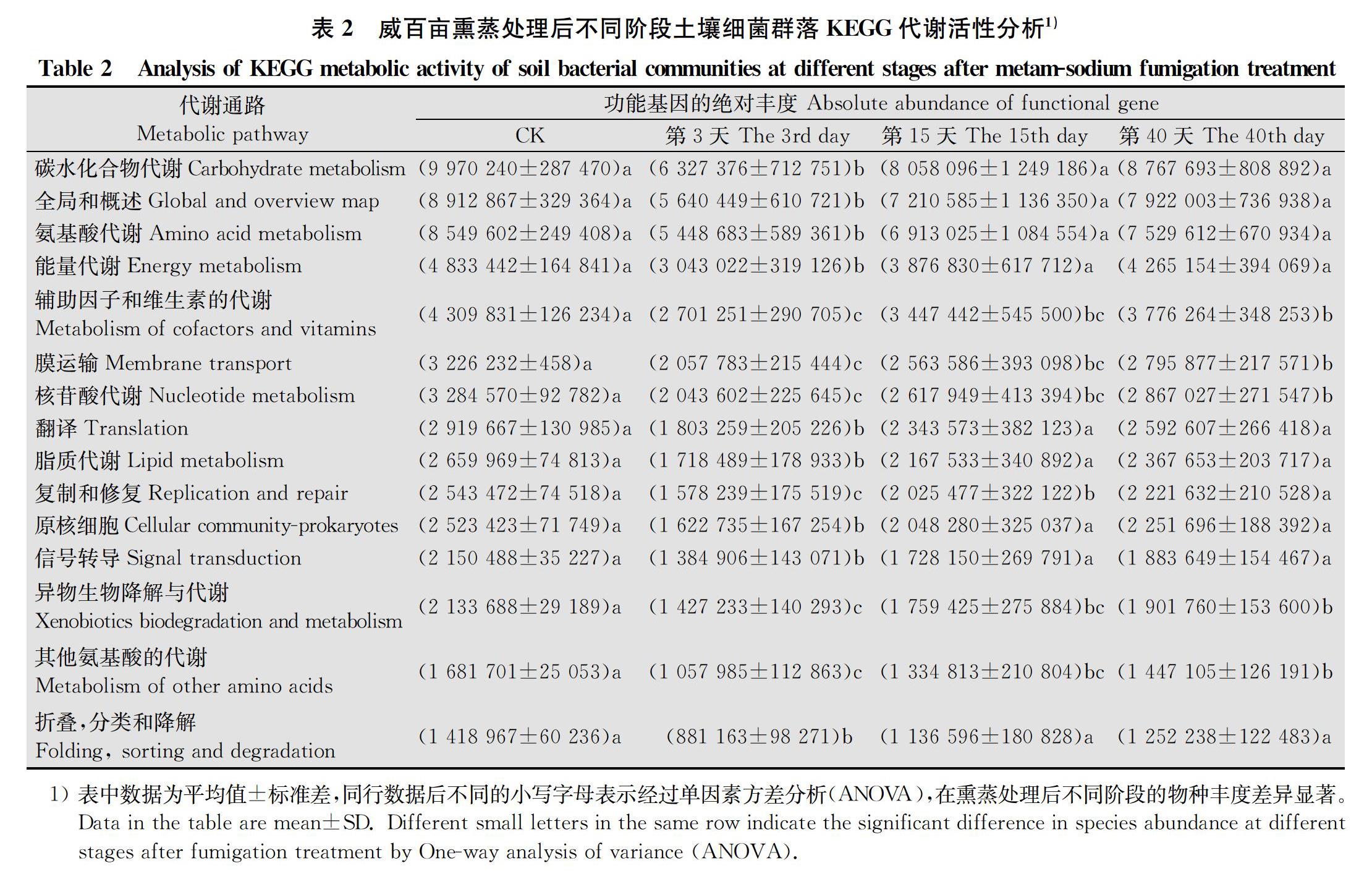
通过PICRUSt2对KEGG Pathway level 2进行单因素方差分析(表2),筛选出代谢活性前15的微生物群落代谢通路,其中碳水化合物代谢、氨基酸代谢、能量代谢、辅助因子和维生素的代谢、膜运输、核苷酸代谢、翻译、脂质代谢、复制和修复、信号转导、异种生物的生物降解和代谢、降解等在3 d的活性都是最小的。但是,在15 d和40 d又会显著升高,且和CK组的基本持平。进一步推断可知,细菌群落的代谢活性在熏蒸处理后不同阶段呈现出先下降再上升的阶段性特征。
3 讨论
当前我国针对农田种植正大力倡导减肥减药,土壤熏蒸技术是行之有效的解决手段。然而,土壤熏蒸在极大程度上杀死病原微生物的同时,也不可避免地会显著改变土壤细菌[1617]、真菌[18]及线虫[19]的群落组成,对土壤生态系统造成“扰动”。
威百亩作为溴甲烷的替代品之一,因其具有良好的土壤熏蒸效果而在农业领域得到了广泛应用[20]。威百亩熏蒸会对土壤的生物地球化学循环、土壤生态系统产生深远影响[11]。本研究结果表明,威百亩熏蒸处理后不同阶段的土壤细菌群落结构在门水平上较为类似,但是在种水平上差异显著。Li等[21]研究发现,威百亩熏蒸后土壤中细菌群落和优势菌群发生了改变,但是在门水平上样本之间差异却不明显。本研究中,土壤细菌群落的多样性(尤其是丰富度)在熏蒸处理后3 d显著降低,但是在熏蒸处理后15 d和40 d又显著升高,表现出先下降后上升的阶段性特征,这种变化趋势与卜东欣等[22]的研究结果类似。这可能是因为威百亩对土壤细菌群落产生强烈的毒性效应,可杀死大部分的细菌类群。但是,少数耐药性较强的菌群可存活下来。另外,威百亩打破了原来土壤微生物群落的平衡,使微生物群落形成一个短暂的“生态真空期”,为这些耐药性强的细菌菌群提供了丰富的营养物质和生存空间,使其迅速增殖达到一定的平衡。这就解释了本研究细菌群落在熏蒸处理后具有阶段性特征的原因。土壤细菌群落对这种强烈的 “生态扰动”表现出“抑制激活恢复”的趋势[22]。
本研究得出的群落构建机制也从另一方面佐证了细菌群落在熏蒸处理后表现出的“抑制激活恢复”的阶段性特征。施用威百亩而造成的“扰动”会导致土壤理化因子和质地的剧烈变化,增加了环境异质性,导致细菌群落的相异性增加,这就是变量选择对群落的驱动作用[1214]。本研究结果也表明,在熏蒸处理后第3天群落的结构、多样性、共发生网络关系以及功能属性等变化都是最大的。而在熏蒸处理后第15天由于耐药性菌群的大量增殖,随机过程(扩散、漂变和多样化)可能占据主动地位。而在熏蒸处理后40 d,细菌群落达到平稳状态,这时又会受到环境异质性以及种内排斥等的限制,变量选择对群落的驱动作用增加。
本研究结果表明:熏蒸处理后3 d时节点数量、聚集系数和模块数都是最大的。在微生物共发生网络分析中,模块化程度越高(modularity),网络越密集,表明微生物群落越复杂[23]。这可能是因为细菌群落在熏蒸处理后3 d受到变量选择的驱动作用,群落的相异性增加,因而此阶段的群落共发生网络关系也就越复杂。另外,菌群在熏蒸处理后第3天表现出更加显著的嵌套结构(WNDF值最大)和离散格局(C值最大,且P<0.01),这可能也是变量选择驱动的结果。在随后的15 d和40 d,群落的节点数量、聚集系数和模塊数略微降低,可能是变量选择的驱动作用减小,群落的相似性增加的结果。但是,共发生网络关系的变化趋势并没有微生物群落结构、多样性和功能活性变化那么明显,可能是因为微生物群落中物种数极多,代际周期短,并且存在一定程度的功能冗余。
微生物群落的结构组成可以在时间或者空间上展现出复杂的变化,例如,在不同的海水层[24]或者亚高山森林的海拔梯度上[25],这些变化最终会影响其所执行的群落功能[26]。本研究结果表明,威百亩熏蒸处理后微生物群落代谢活性呈现出先下降后上升的特征,也表现出“抑制激活恢复”的阶段性特征。并且群落功能活性的变化趋势也与群落结构的变化大致相同。
本研究中微生物群落在熏蒸处理后表现出的阶段性特征与微生物生态系统的稳定性密切相关。而微生物生态系统的稳定性又与微生物群落的抵抗力(resistance)和恢复力(resilience)密切相关。抵抗力指微生物群落自身具备的抵抗自然或者环境因子胁迫并维持原来状态不变的能力。土壤经过威百亩熏蒸处理后,遭受强烈的“生态扰动”,微生物群落的抵抗力被打破,微生物菌群受到强烈的胁迫。胁迫带来的选择压力可以促进初始群落迅速进化,而这种迅速进化是微生物群落的结构和功能对特定胁迫尤其是长期胁迫产生抵抗力和恢复力的重要机制[27],带来的直接效应就是群落中的土壤细菌群落丰富度、多样性迅速减小。另一方面,恢复力是指系统受到自然或人为环境因子的胁迫后恢复至原有状态的能力[28]。微生物群落较强的适应性能够保证其在变化的环境中迅速恢复稳定。有研究指出真菌群落和丛枝菌根真菌在不同的环境条件和农业管理措施下,对水分限制都表现出显著的抵抗力和恢复力[29]。
4 结论
本研究以实验室威百亩熏蒸处理的土壤为材料,通过高通量测序技术,研究威百亩熏蒸处理对土壤细菌群落结构和功能的影响,也探究了“扰动”后土壤微生物群落重建及功能恢复的机制。结果表明,在威百亩处理后,微生物群落多样性、结构、群落构建机制、种间关系和功能都表现出“抑制激活恢复”的阶段性特征。
参考文献
[1] 李青杰, 方文生, 颜冬冬,等. 熏蒸剂对土壤微生物的影响研究进展[J]. 农药学学报, 2019, 21(S1): 780786.
[2] 胡洪涛, 朱志刚, 焦忠久,等. 棉隆土壤消毒对高山甘蓝根肿病土壤细菌群落结构的影响[J]. 中国农学通报, 2020, 36(16): 120127.
[3] 燕平梅, 李娜, 赵文婧,等. 威百亩熏蒸对土壤硝化作用及amoA型硝化细菌群落结构的影响[J]. 植物保护学报, 2019, 46(6): 13571363.
[4] 王峰, 吕艺, 刘洋,等. 氯化苦土壤消毒对三七种植后细菌群落多样性及烤烟轮作的影响[J]. 昆明理工大学学报(自然科学版), 2019, 44(4): 9096.
[5] FANG Wensheng, WANG Qiuxia, HAN Dawei, et al. The effects and mode of action of biochar on the degradation of methyl isothiocyanate in soil [J]. Science of the Total Environment, 2016, 565(4): 339345.
[6] 曹坳程, 张文吉, 刘建华. 溴甲烷土壤消毒替代技术研究进展[J]. 植物保护, 2007,33(1): 1520.
[7] DICKENS H E, ANDERSON J M. Manipulation of soil microbial community structure in bog and forest soils using chloroform fumigation [J]. Soil Biology & Biochemistry, 1999, 31(14): 20492058.
[8] DUNGAN R S, IBEKWE A M, YATES S R. Effect of propargyl bromide and 1,3-dichloropropene on microbial communities in an organically amended soil [J]. FEMS Microbiology Ecology, 2003, 43(1): 7587.
[9] COLLINS H P, ALVA A, BOYDSTON R A, et al. Soil microbial, fungal, and nematode responses to soil fumigation and cover crops under potato production [J]. Biology and Fertility of Soils, 2006, 42(3): 247257.
[10]GRIFFITHS B S, HALLETT P D, KUAN H L, et al. Biological and physical resilience of soil amended with heavy metal-contaminated sewage sludge [J]. European Journal of Soil Science, 2010, 56(2): 197206.
[11]燕平梅, 魏愛丽, 乔宏萍,等. 威百亩熏蒸对土壤反硝化作用及nirS型反硝化细菌群落结构的影响[J]. 植物保护学报, 2019, 46(2): 393400.
[12]STEGEN J C, LIN Xueju, FREDRICKSON J K, et al. Estimating and mapping ecological processes influencing microbial community assembly[J/OL]. Frontiers in Microbiology, 2015, 6: 370. DOI:10.3389/fmicb.2015.00370.
[13]STEGEN J C, LIN Xueju, KONOPKA A E, et al. Stochastic and deterministic assembly processes in subsurface microbial communities [J]. ISME Journal, 2012, 6(9): 16531664.
[14]STEGEN J C, LIN Xueju, FREDRICKSON J K, et al. Quantifying community assembly processes and identifying features that impose them [J].ISME Journal, 2013, 7(11): 20692079.
[15]DENG Ye, JIANG Yihuai, YANG Yunfeng, et al. Molecular ecological network analyses[J/OL]. BMC Bioinformatics, 2012, 13(1): 113. DOI:10.1186/1471-2105-13-113.
[16]程新胜, 杨建卿. 熏蒸处理对土壤微生物及硝化作用的影响[J]. 中国生态农业学报, 2007, 15(6): 5153.
[17]HOSHINO Y T, MATSUMOTO N. DNA-versus RNA-based denaturing gradient gel electrophoresis profiles of a bacterial community during replenishment after soil fumigation [J]. Soil Biology & Biochemistry, 2007, 39(2): 434444.
[18]HOSHINO Y T, MATSUMOTO N. Changes in fungal community structure in bulk soil and spinach rhizosphere soil after chemical fumigation as revealed by 18S rDNA PCR-DGGE [J]. Soil Science & Plant Nutrition, 2010, 53(1): 4055.
[19]WANG K H, MCSORLEY R, KOKALIS-BURELLE N. Effects of cover cropping, solarization, and soil fumigation on nematode communities [J]. Plant & Soil, 2006, 286(2): 229243.
[20]TRIKY-DOTAN S, AUSTERWEIL M, STEINER B, et al. Generation and dissipation of methyl isothiocyanate in soils following metam sodium fumigation: Impact on verticillium control and potato yield [J]. Plant Disease, 2007, 91(5): 497503.
[21]LI Jun, HUANG Bin, WANG Qiuxia, et al. Effects of fumigation with metam-sodium on soil microbial biomass, respiration, nitrogen transformation, bacterial community diversity and genes encoding key enzymes involved in nitrogen cycling [J]. Science of the Total Environment, 2016, 598(1): 10271036.
[22]卜东欣, 张超, 张鑫, 等. 熏蒸剂威百亩对土壤微生物数量和酶活性的影响[J]. 中国农学通报, 2014, 30(15): 227233.
[23]OLESEN J M. The modularity of pollination networks[J]. Proceedings of the National Academy of Sciences, 2007, 104(50): 1989119896.
[24]BARBERN A, FERNNDEZ-GUERRA A, BOHANNAN B J M, et al. Exploration of community traits as ecological markers in microbial metagenomes [J]. Molecular Ecology, 2012, 21(8):19091917.
[25]SILES J A, MARGESIN R. Abundance and diversity of bacterial, archaeal, and fungal communities along an altitudinal gradient in alpine forest soils: what are the driving factors?[J]. Microbial Ecology, 2016, 72(1): 207220.
[26]LOUCA S, JACQUES S M S, PIRES A P F, et al. High taxonomic variability despite stable functional structure across microbial communities [J]. Nature Ecology & Evolution, 2016, 1(1): 1517.
[27]COHAN F M. What are bacterial species?[J]. Annual Review of Microbiology, 2002, 56(1): 457465.
[28]賀纪正, 李晶, 郑袁明. 土壤生态系统微生物多样性稳定性关系的思考[J]. 生物多样性, 2013,21(4): 411420.
[29]FURZE J R, MARTIN A R, NASIELSKI J, et al. Resistance and resilience of root fungal communities to water limitation in a temperate agroecosystem [J]. Ecology and Evolution, 2017, 7(10): 34433454.
(责任编辑:杨明丽)
