龙牙楤木组培苗的高效诱导研究
2021-06-21陈爱华佟立君冯磊宋金柱
陈爱华,佟立君,冯磊*,宋金柱
(1.黑龙江省林业科学院牡丹江分院,黑龙江 牡丹江 157010;2.黑龙江省林业科学院,哈尔滨 150081;3.哈尔滨市丹青河实验林场,哈尔滨 154800)
龙牙楤木(Araliaelata(Miq.)Seem.),是中国传统的食药兼用植物,多年生落叶小乔木或灌木,又名刺嫩芽、辽东楤木、刺老鸦等,属于五加科(Araliaceae)楤木属(AraliaLinn.)[1]。龙牙楤木嫩茎叶鲜嫩清香可食,含有多种氨基酸和人体必需的微量元素[2];其根皮制药可用于治疗神经衰弱、风湿性关节炎、糖尿病、肝炎和慢性胃炎等疾病[3],多年来深受国内和东南亚国家消费者的青睐。
目前国内外对刺嫩芽在药用成分的提取、药理作用和经济林营建几个方面,已经取得了很多的成果[5-6]。在组织培养方面,2011年由香玲等经过分化产生体细胞胚,继而萌发成体胚苗[7],《龙牙楤木组织培养和快速繁殖的研究》[8]指出不同取材、培养方法及培养条件对愈伤组织的诱导率、增值率及再生率有显著影响。但是从前人的研究中[9],不难看出,普遍添加的外源激素种类较多,步骤稍显复杂,不利于产业化生产。因而,本实验设计并优化龙牙楤木组培的新方案,力求简单快速,以克服龙牙楤木细胞工程育种技术的不足,为龙牙楤木苗木产业化生产提供技术基础。
1 实验材料和方法
1.1 实验材料
1.1.1 材料前处理。龙牙楤木萌动枝条采自黑龙江省林副特产研究所的10株优树,采集时间为2015年的3月上旬(10日),室温水培3 d,每株树采3~5个顶芽,切下叶片、叶柄分类放入两瓶灭菌水中浸泡2 h。
1.1.2 外植体。取龙牙楤木幼嫩的叶片、叶柄用75 %酒精消毒30 s,冲洗一次后放入1 %次氯酸钠溶液消毒10 min,无菌水冲洗3 次,在超净台内的无菌培养皿中;叶片切去边缘胚,叶片表面轻划3刀,水平接种于愈伤组织诱导培养基上;叶柄同样方法。每瓶中接种4至5个外植体,一种外植体一个激素浓度是一个处理,每种处理接种5瓶,重复3 次,24±1 ℃下暗培养。在胚性愈伤组织诱导阶段的激素浓度筛选按株系等比混合随机选取。
1.2 实验方法
1.2.1 愈伤组织诱导。基础培养基为MS培养基,激素类采用的是2,4-D,浓度为0~3.0 mg/L五个浓度梯度,生长素浓度与材料种类之间采用的是正交组合设计。整个培养基要加入蔗糖20 g/L,凝胶强度为1200 g/m3的琼脂5.5 g/L,pH值调至5.8。
1.2.2 愈伤组织保持与增殖培养基。胚性愈伤组织保持与增殖培养基为1/2MS培养基,2,4-D浓度为1.0 mg/L。整个培养基要加入蔗糖20 g/L,凝胶强度为1200 g/m3的琼脂5.5 g/L,pH值用NaOH或HCL调至5.8。继代转接时,挑取最新分化的胚性愈伤组织,平铺开(直径为0.6 cm左右),每瓶放入5份。15 d 左右继代一次,24±1 ℃下暗培养。
1.2.3 成熟体细胞胚的培养。将胚性愈伤组织在添加IBA浓度为0~3.0 mg/L,蔗糖20 g/L,琼脂5.5 g/L的1/2MS培养基培养,得到成熟体细胞胚。在胚性愈伤组织诱导至体细胞胚成熟等各个阶段,在超净台中用电子天平称胚性愈伤组织重量。
1.2.4 再生植株的诱导。当体细胞胚,整个胚由浅白色变为浅黄色时,转入体细胞萌发培养基,诱导植株再生。体细胞胚萌发培养基为1/2MS培养基,IBA浓度为0.5~3.0 mg/L,附加蔗糖20 g/L ,琼脂5.5 g/L,pH调至5.8。
1.2.5 再生植株生根。将再生植株转入1/2MS培养基中培养生根,培养基中附加蔗糖20 g/L,琼脂5.5 g/L,pH调至5.8。继代培养。
1.2.6 组培苗移栽。(1)将生根后的培养瓶中的龙牙楤木再生植株,开瓶炼苗可以分阶段进行,即首先松盖(或塞)1~2 d,然后部分开盖1~2 d,最后完全揭去盖。在自然光下进行开瓶练苗,注意预防幼苗被灼伤。(2)取相同体积的腐殖土、草炭土或蛭石铺在多穴插秧盘中,用稀释10倍的MS培养液浇透。将组培苗用镊子夹出,自来水冲洗干净,避免伤根,栽植于穴盘中,1株/穴。将植入组培苗的插秧盘放入湿度为70%~90%,遮阳网覆盖的大棚里,遮阳率在40%~60%,两侧自然通弱风,两周后,随机选择100株左右,统计成活率和平均苗高,移栽到苗圃中。
2 结果
2.1 愈伤组织诱导
试验中采用的龙牙楤木外植体叶片和叶柄,都是水培后新发的幼嫩组织,在诱导第10 d随机抽取5瓶,统计结果,从下表1可以看出,在添加不同浓度梯度2,4-D的培养基中,都可以获得愈伤组织,但是效率不同,整体上来说,叶柄作为外植体诱导效率高且快速,当2,4-D浓度为1.0 mg/L,出愈率达到了100%,这说明龙牙楤木叶柄具有很好的再分化能力。叶片作为外植体,在2,4-D浓度为2.0 mg/L时,诱导效率达到最高,为96%。从这些结果中可见,龙牙楤木的再分化能力较其他物种更强。

表1 愈伤组织诱导情况
2.2 愈伤组织保持与增殖培养基
从愈伤组织诱导的结果表2中,我们看到,叶柄愈伤组织具有更好的再分化能力,因此我们选用叶柄的愈伤组织,继续在含有2,4-D浓度为1.0 mg/L的1/2MS培养基中增值培养,15 d时随机挑选5瓶统计,用天平称重,我们看到平均增殖重量达到了1.2666 g,平均增殖达到了4.583倍。
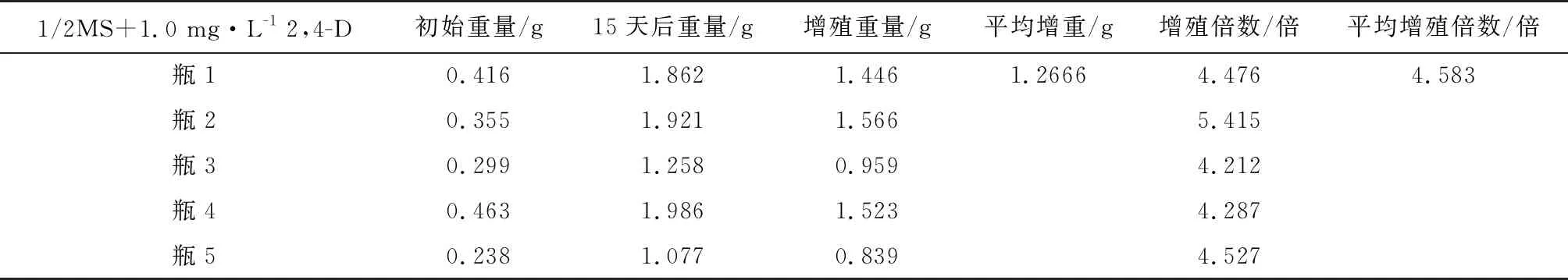
表2 愈伤组织增殖情况
2.3 成熟体细胞胚的培养和不定芽的诱导
将增殖的愈伤组织放于含有IBA的培养基培养上1周后,愈伤组织颜色由白变黄,镜下观察可见心形胚、鱼雷形胚和球形胚,标志着胚性愈伤组织的成熟,这与前人研究的结果相似。成熟的胚继续培养1周,开始生出不定芽。表3,是在含有IBA的1/2MS培养基中培养30 d,统计的结果,我们看到在添加IBA3.0 mg/L的培养基中成熟的体细胞胚诱导出最多的不定芽,诱导率达到80%以上。用SPSS 16.0在0.05水平上进一步分析结果差异的显著性,见表4,我们看到不同IBA的浓度对不定芽的诱导率具有显著的影响,不同浓度之间也具有显著差异,而其中IBA 3.0 mg/L的效果最好。

表4 IBA浓度对不定芽诱导率影响的方差分析
而在不定发生时间上,SPSS统计结果(表3、表5)分析显示,总体上来说IBA的浓度对不定的发生时间的影响并不显著,但有趣的是,当IBA浓度为1.0 mg/L时,与IBA浓度为3.0 mg/L时对不定芽发生的影响之间的差异时显著的,也就是说IBA浓度为3.0 mg/L诱导不定芽发生更快速,而IBA浓度为1.0 mg/L时诱导不定芽较慢。

表5 不同浓度IBA对不定芽发生时间的影响的显著性分析
2.4 组培苗移栽基质的优化选择
不定芽在生根培养基上诱导5 d左右生根,当根长为2 cm左右即可移栽到灭菌基质,将组培苗移栽到不同培养基上,当长出第一片新叶认为已经成活,一般需要一周左右,之后统计成活率。从下表6和表7显著性分析表明,不同的基质类型对组培苗成活率的影响是极显著的,而当基质为V腐殖土∶V蛭石=2∶3时,成活率最高达到97%。但是移栽入基质的组培苗在最初时生长速度很慢,但在移栽到室外大田时则生长迅速。
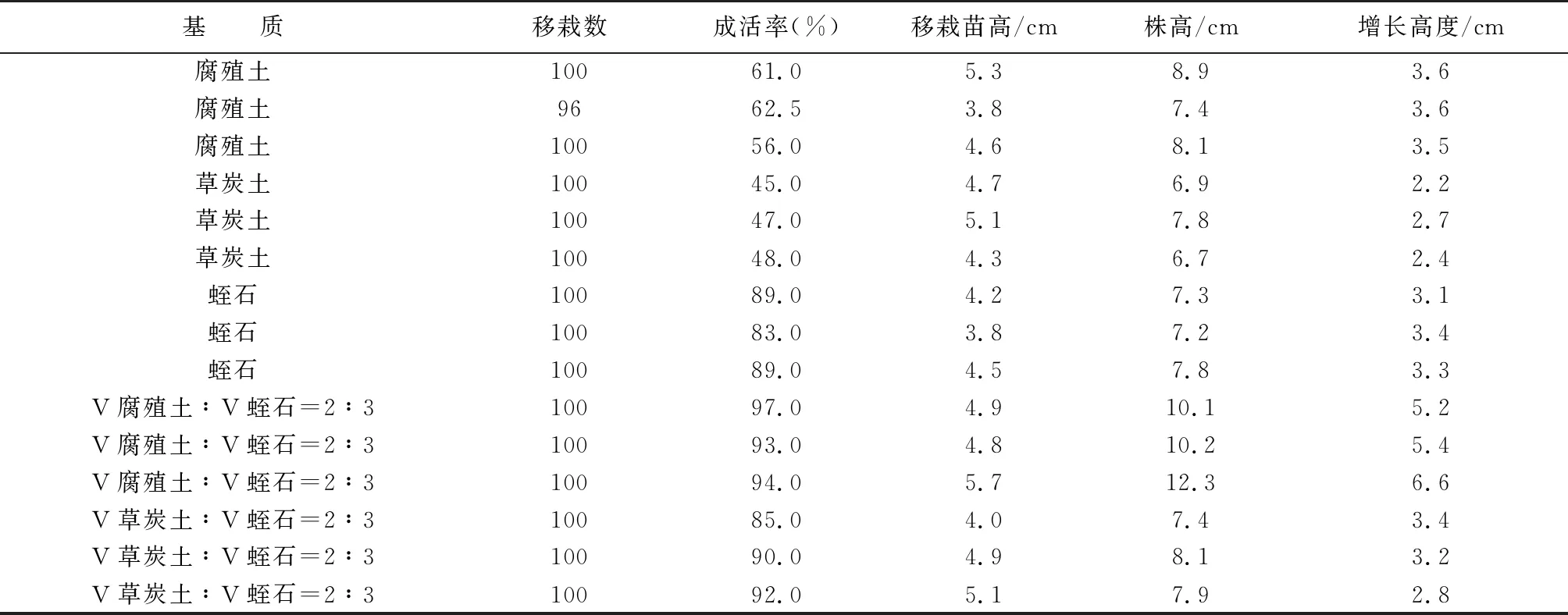
表6 不同基质对成活率及苗高的影响
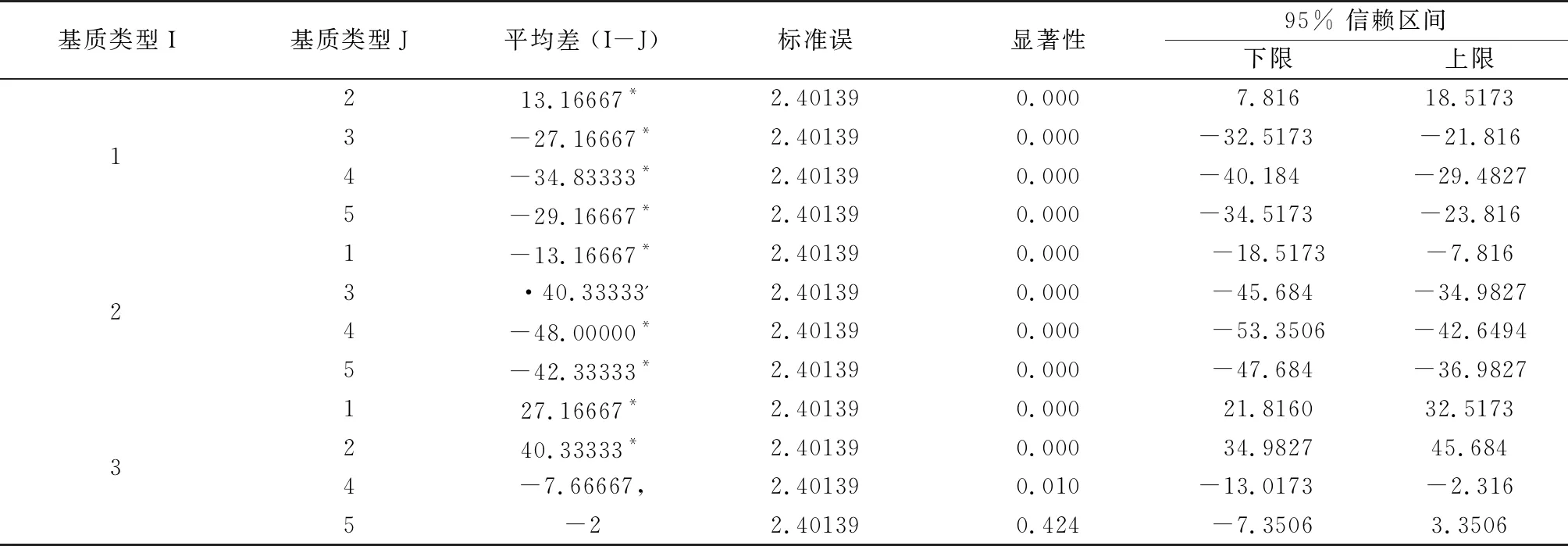
表7 不同类型基质对植株生活率的影响显著性分析

续表7

A为叶柄胚性愈伤组织的诱导;B为叶片胚性愈伤组织的诱导;C为龙牙楤木胚性愈伤组织的增殖和成熟;D 体胚诱导出不定芽;E再生植株生根。F为龙牙楤木组培苗移栽入基质。
3 结论
植物组织培养,也叫离体培养,利用的是德国著名植物学家Gcrtlieb Haberland 1902年提出的“细胞全能性”的理念,1958年,由Reinnert和Steward加以验证。目前有许多组织培养的苗木品种进入市场,比如说马铃薯和铁皮石斛、草莓、葡萄、枸杞等等。组织培养的主要影响因素是外植体类型和外源激素的使用。外植体的选用,一般要选去分化和再分化能力强的幼嫩材料,同时容易进行脱毒处理,一些植物材料,比如蛇足石衫但由于其有很多种的共生菌而很难进行组织培养。外源激素种类的添加直接影响再分化进程。组织培养是一个连续的过程,通常认为划分为几个阶段(图1),实验选取了幼嫩的叶片和叶柄来进行,外源激素的选择也为常见的2,4-D和IBA,既经济、简便又高效,最终确定了最优的技术方案为:以叶柄为外植体,在添加2,4-D 1.0 mg/L的MS培养基上诱导胚性愈伤组织,在含有IBA 3.0 mg/L的1/2MS培养基上诱导愈伤组织成熟和不定芽的产生,在不添加任何外源激素的1/2MS培养基中生根培养,生根率达100%,然后经过半开瓶和全开瓶炼苗共计5 d左右,室外移栽,在V腐殖土∶V蛭石=2∶3时生活率高达97%。
