复合护色剂抑制杏酒褐变的工艺优化
2021-06-19涂智鸿杨建飞黄雪芹
徐 佳,涂智鸿,杨建飞,黄雪芹,马 倩,易 媛,左 勇,,3,
(1.四川轻化工大学生物工程学院,四川宜宾 644000;2.四川师范大学生命科学学院,四川成都 610000;3.成都裕智果业有限公司,四川成都 610000)
杏是多年生木本植物的果实,广泛种植于我国的黄河流域各省[1]。杏肉棉软多汁,口感酸甜,风味独特,富含氨基酸、维生素、类胡萝卜素[2]、多酚及类黄酮[3]等营养物质。以杏果为原料酿造的杏酒,不仅具有丰富的香气,还可以将其大部分营养物质保留下来,得到了许多消费者的认可。但杏果极易氧化褐变,特别是在杏酒陈酿和灌装阶段,均会发生明显的褐变现象,导致杏酒的外观品质与营养价值严重下降。
研究表明,杏果中多酚氧化酶(polyphenoloxidase,PPO)和过氧化物酶(peroxidase,POD)引起的酶促褐变是导致杏酒褐变的主要原因[4]。所以,控制杏酒的酶促褐变成为抑制其褐变的关键,目前国内外有关鲜杏及其加工产品抑制褐变的方法集中在热处理[5]、可食性涂层[6]、高压二氧化碳技术[7]、食品护色剂[8]、工艺条件[9]和品种成熟度[10]等方面。其中物理方法被广泛应用于果蔬的褐变抑制,食品护色剂常用于果酒中的褐变抑制,但仅添加单一护色剂易造成使用浓度高、稳定性差以及效果不明显等缺点[11−12]。
本研究拟从6 种安全且常用的食品护色剂中,以褐变抑制率和色差值为指标,将前三种护色剂进行复配,得到最佳护色剂配方,可改善杏酒的褐变问题,为杏酒产品的褐变抑制提供一定的理论依据。
1 材料与方法
1.1 材料与仪器
新鲜杏果“凯特杏” 四川某杏果基地2019 年6 月采摘,该原料成熟度适中,果实饱满且无病害;D254 诺盟酵母 法国LAFFORT 公司;异抗坏血酸钠、L-半胱氨酸、植酸、EDTA-Na2、谷胱甘肽、氯化钙 国产食品级添加剂。
JYZ-E3 九阳原汁机 九阳股份有限公司;T6 紫外分光光度计 北京普析通用仪器有限责任公司;UitraScan VIS 台式色差仪 HunterLab(美国)有限公司;ME104E/02 电子分析天平 托利多仪器有限公司;STARTER 2C pH 计 奥豪斯仪器有限公司;GZ-250-HS11 恒温恒湿箱 韶关市广智科技设备有限公司;精密膜过滤器 烟台帝伯仕自酿机有限公司。
1.2 实验方法
1.2.1 杏酒加工 杏果→清洗去核→破碎打浆→接种→发酵→过滤→添加护色剂→陈酿→精滤澄清→装瓶
杏酒的发酵条件:调整杏浆料液比为4.5:1,初始糖度21%,接种1.2 g/L 的酵母,在25 ℃的条件下,发酵7 d。杏酒发酵结束后过滤,添加护色剂,于20 ℃的条件下放置15 d。再采用精滤设备进行过滤,最后将果酒装入消毒的空瓶中,加塞。在杏酒发酵结束到陈酿之间的过滤和转移过程,最易发生氧化褐变现象,所以选择此时研究添加护色剂的效果。
1.2.2 单因素实验 杏酒发酵结束过滤后,保留部分酒样做空白对照,再根据文献查阅和预试验处理结果向其他酒样中添加不同浓度的单一护色剂[13]:异抗坏血酸钠(0.2、0.4、0.6、0.8、1.0 g/L),L-半胱氨酸(0.3、0.6、0.9、1.2、1.5 g/L),植酸(0.01%、0.02%、0.03%、0.04%、0.05%),EDTA-Na2(0.2、0.4、0.6、0.8、1.0 g/L),谷胱甘肽(0.2、0.4、0.6、0.8、1.0 g/L),氯化钙(0.2、0.4、0.6、0.8、1.0 g/L)。在20 ℃的条件下放置15 d,分别测定杏酒褐变抑制率和色差值,探究护色剂对杏酒褐变的抑制效果。
1.2.3 正交试验 在单因素实验基础上,对六种护色剂进行六因素二水平正交试验,以杏酒褐变抑制率和色差值为指标,对试验结果进行分析,得到影响杏酒褐变抑制率和色差值的主次顺序,正交试验因素水平见表1。
1.2.4 响应面试验设计 在正交试验的基础上,选择对杏酒褐变影响最大的三种护色剂:异抗坏血酸钠(A)、植酸(B)、L-半胱氨酸(C),根据Box-Behnken 响应面设计原理,进行三因素三水平的中心组合试验,以褐变抑制率和色差值为指标,确定杏酒复合护色剂的最佳配比,因素水平见表2。
1.2.5 褐变度及褐变抑制率的测定 杏酒褐变度的测定参照Lopez-Toledano 等[14]的方法并稍作改进,取待测酒样上清液10 mL 作为待测样品。利用紫外分光光度计,以蒸馏水为空白,在420 nm 处测定杏酒上清液的吸光度A,即杏酒褐变度。杏酒褐变抑制率(R)按照下式进行计算:


表1 正交试验设计因素水平表Table 1 Variables and their levels used in orthogonal experimental design

表2 响应面试验因素水平设计Table 2 Factors and their levels designed in response surface design
式中:R 为褐变抑制率;A0为空白对照的杏酒褐变度;Am为护色剂处理后的杏酒褐变度。
1.2.6 色度的测定 采用色差仪测定杏酒的色度,以透射模式10°观察模式测定样品L*、a*、b*值;其中L*表示亮度值,a*表示绿红值,b*表示蓝黄值;用dE*(色差值)描述样品的颜色变化,以发酵结束的杏酒为参比标准溶液,计算色差值dE*,dE*越小表示待测样品与参比样品色泽越接近,反之则相差越大,计算公式如下[15]:
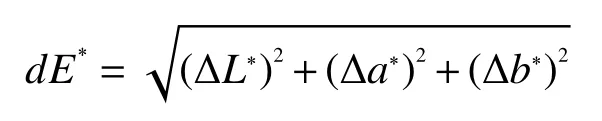
1.2.7 理化指标的测定 酒精度:采用分光光度计法测定[16],将5%的重铬酸钾与不同浓度的乙醇反应后,利用分光光度计测量吸光度(600 nm),绘制出酒精度的标准曲线,并以此计算样品的酒精度。
总酸、还原糖:根据GB/T 15038-2006[17]的方法进行测定。
1.3 数据处理
利用SPSS 20.0 进行单因素方差分析,并用OriginPro 2016 作图;利用正交设计助手II V3.1 分析正交试验结果;利用Design-Expert 8.0.6 进行响应面试验设计与数据处理。
2 结果与分析
2.1 单因素实验
2.1.1 异抗坏血酸钠浓度对杏酒褐变的影响 异抗坏血酸钠作为安全的食品添加剂,具有较强的还原性,可将体系中的醌类及其衍生物还原成无色的酚类物质,防止醌类物质聚合形成黑色素,从而达到抑制褐变的效果[18]。由图1 所示,随着异抗坏血酸钠浓度的升高,色差值呈下降趋势,而褐变抑制率呈先上升后缓慢下降的趋势。在异抗坏血酸钠浓度为0.6 g/L 时,褐变抑制率达到最高,为47.83%,显著高于其他浓度水平(P<0.05),与此同时,色差值下降趋势也开始逐渐放缓。原因可能在于,当异抗坏血酸钠浓度超过最佳范围后,它将醌还原为酚的同时,多余的抗坏血酸也被氧化,并与氨基酸反应导致非酶褐变的发生[19]。综合考虑色差值和褐变抑制率,异抗坏血酸钠最佳浓度范围为0.6~0.8 g/L。
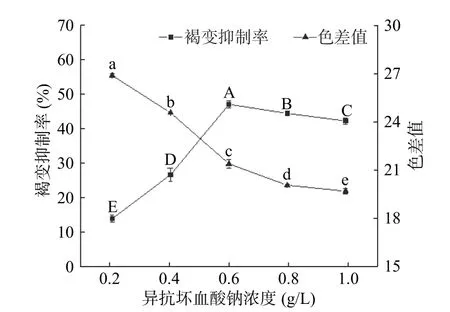
图1 异抗坏血酸钠的褐变抑制效果Fig.1 Effects of sodium isoascorbate on browning inhibition
2.1.2 L-半胱氨酸浓度对杏酒褐变的影响 半胱氨酸作为天然氨基酸,它能够抑制褐变的主要机理在于其含有具还原性的巯基,能够作为醌类物质的螯合剂,与醌作用生成稳定的无色化合物[20]。此外,它还可以直接作用于多酚氧化酶(PPO),降低其活性[21]。由图2 所示,随着L-半胱氨酸浓度的增大,杏酒的褐变抑制率先升高后稳定,而色差值则呈先下降后上升的趋势,可能是因为当浓度超过最佳范围后,杏酒自身发生了非酶促褐变,导致颜色加深[22]。在L-半胱氨酸的浓度为1.2 g/L 时,色差值最小,为23.02,此时褐变抑制率也趋于稳定,达到了45.58%。L-半胱氨酸虽具有一定的营养价值,但其具有氨基酸特有的味道,添加量过多会在一定程度上影响杏酒的香气。综合考虑色差值和褐变抑制率,L-半胱氨酸最佳浓度范围为0.9~1.2 g/L。

图2 L-半胱氨酸的褐变抑制效果Fig.2 Effects of L-cysteine on browning inhibition
2.1.3 植酸浓度对杏酒褐变的影响 植酸是从天然植物中提取的多功能食品添加剂,常作为果蔬护色剂,能与辅酶中的金属离子发生螯合,抑制PPO 和POD 活性,减缓酶促褐变和非酶褐变的发生[23−24];作为发酵促进剂,可增加菌体生长的酶系促进产物的生成[25];作为果酒的澄清剂,可阻止金属离子参与蛋白质、单宁等物质的缔合和絮凝[26]。由图3 所示,随着植酸浓度的增加,褐变抑制率呈先上升后下降的趋势,色差值呈先下降后上升的趋势,说明浓度过高的植酸会对褐变抑制造成负影响。当植酸浓度为0.02%时,褐变抑制率达到最高,为40.51%,色差值则降至最低,为25.07。综合考虑色差值和褐变抑制率,植酸最佳浓度范围为0.02%~0.03%。
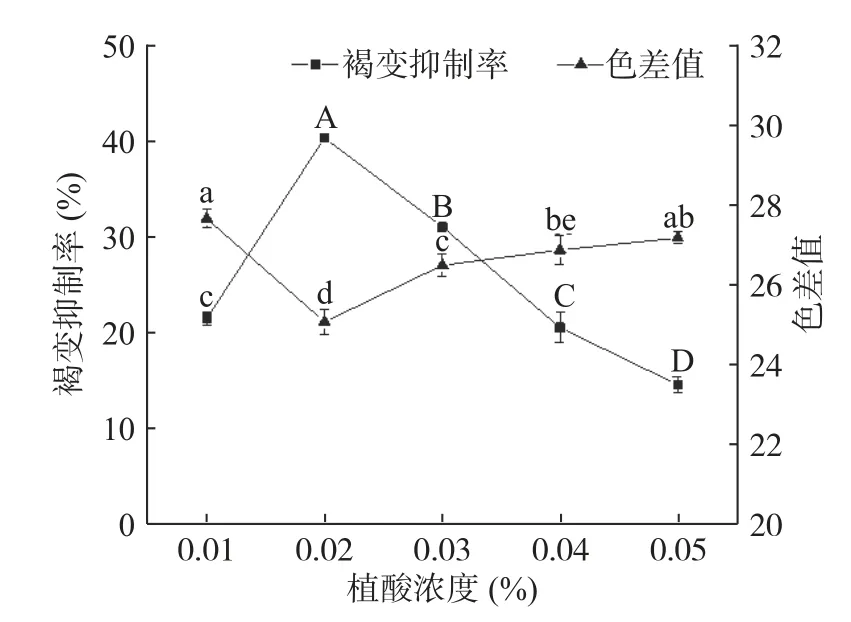
图3 植酸的褐变抑制效果Fig.3 Effects of phytic acid on browning inhibition
2.1.4 EDTA-Na2浓度对杏酒褐变的影响 EDTANa2是一种含有羧基和氨基的螯合剂,通过螯合体系中对褐变反应具有促进作用的金属离子,来达到抑制褐变的效果[12]。由图4 所示,随着EDTA-Na2浓度的增大,其褐变抑制率呈先上升后下降的趋势,在0.4 g/L时达到最高,为41.57%;色差值呈先下降后上升的趋势,在0.6 g/L 时降至最低,为24.98。EDTA-Na2的效果虽好,但其在水中的溶解度小,若在人体中不分解而排出,会造成人体缺钙等现象[27]。综合考虑色差值和褐变抑制率,EDTA-Na2最佳浓度范围为0.4~0.6 g/L。
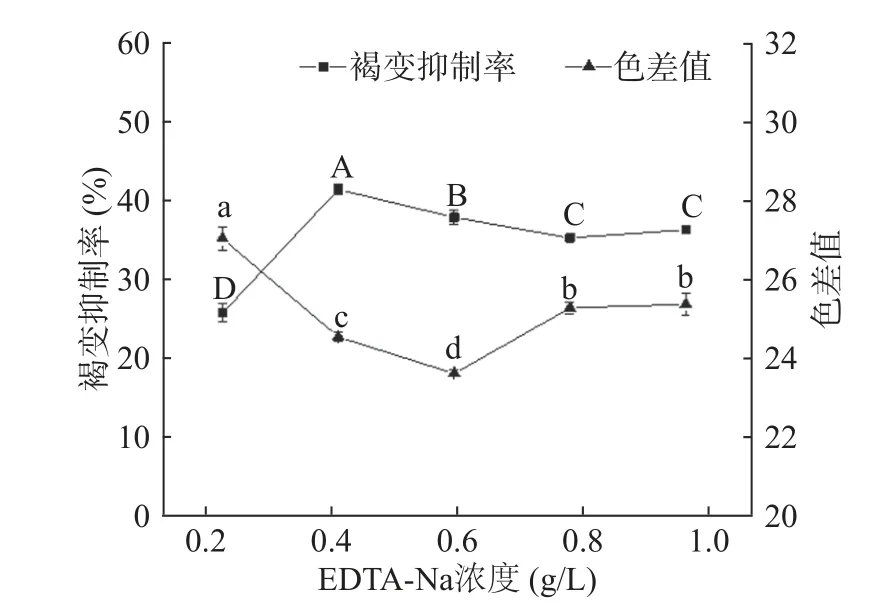
图4 EDTA-Na2 的褐变抑制效果Fig.4 Effects of EDTA-Na2 on browning inhibition
2.1.5 谷胱甘肽浓度对杏酒褐变的影响 谷胱甘肽是一种抗氧化物质,它抑制果酒褐变的机理在于它能够与醌类化合物发生聚合物反应[28]。也有研究表明[29−30],它可以通过提高抗坏血酸-谷胱甘肽循环中谷胱甘肽还原酶的活性,加强体系中活性氧的清除能力,从而降低氧化胁迫。由图5 所示,随谷胱甘肽浓度的增加,杏酒的褐变抑制率先上升后下降,色差值先下降后上升,这与徐俊南[31]在研究苹果酒时的结果相似。当谷胱甘肽浓度为0.6 g/L 时,杏酒褐变抑制率达到最高,为36.94%;色差值降至最低,为26.53。综合色差值和褐变抑制率并结合经济因素,谷胱甘肽的最佳浓度范围为0.4~0.6 g/L。

图5 谷胱甘肽的褐变抑制效果Fig.5 Effects of glutathione on browning inhibition
2.1.6 氯化钙浓度对杏酒褐变的影响 目前对氯化钙抑制褐变机理的解释有两种,一是氯化钙对细胞壁及细胞膜完整性的保护,能增强组织的硬度,从而减少多酚类物质外渗与酶类接触[16,32];二是Ca2+可竞争性地螯合酶中的Cu2+,从而抑制褐变[33]。如图6 所示,添加氯化钙,杏酒的褐变抑制率普遍较低,在氯化钙浓度为0.6 g/L 时达到最高,仅有26.24%;色差值先下降后趋于稳定,在0.4 g/L 最低,为28.15,与浓度在0.6 g/L 时的色差值相比并无显著性差异(P=0.142)。综合色差值和褐变抑制率,氯化钙的最佳浓度范围为0.6~0.8 g/L。
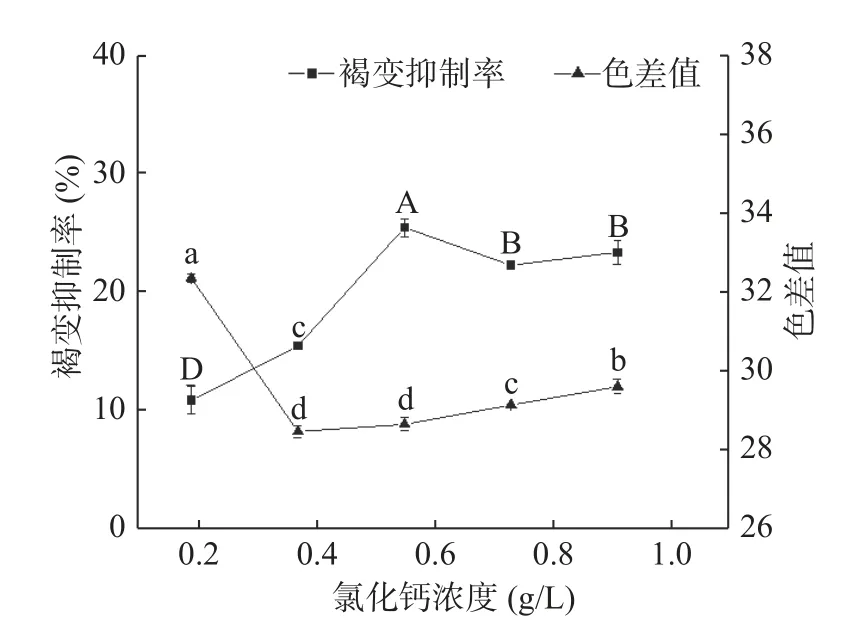
图6 氯化钙的褐变抑制效果Fig.6 Effects of CaCl2 on browning inhibition
2.2 正交试验
在单因素实验的基础上,将上述6 种护色剂选出两个水平,然后以L8(27)正交表进行试验,正交试验设计及结果见表3。通过极差分析,得到6 种不同护色剂对杏酒褐变抑制率与色差值影响的主次顺序,发现影响杏酒褐变抑制率的主次顺序为:A>C>B=E>D>F;影响杏酒色差值的主次顺序为:A>B>C>D>E>F。
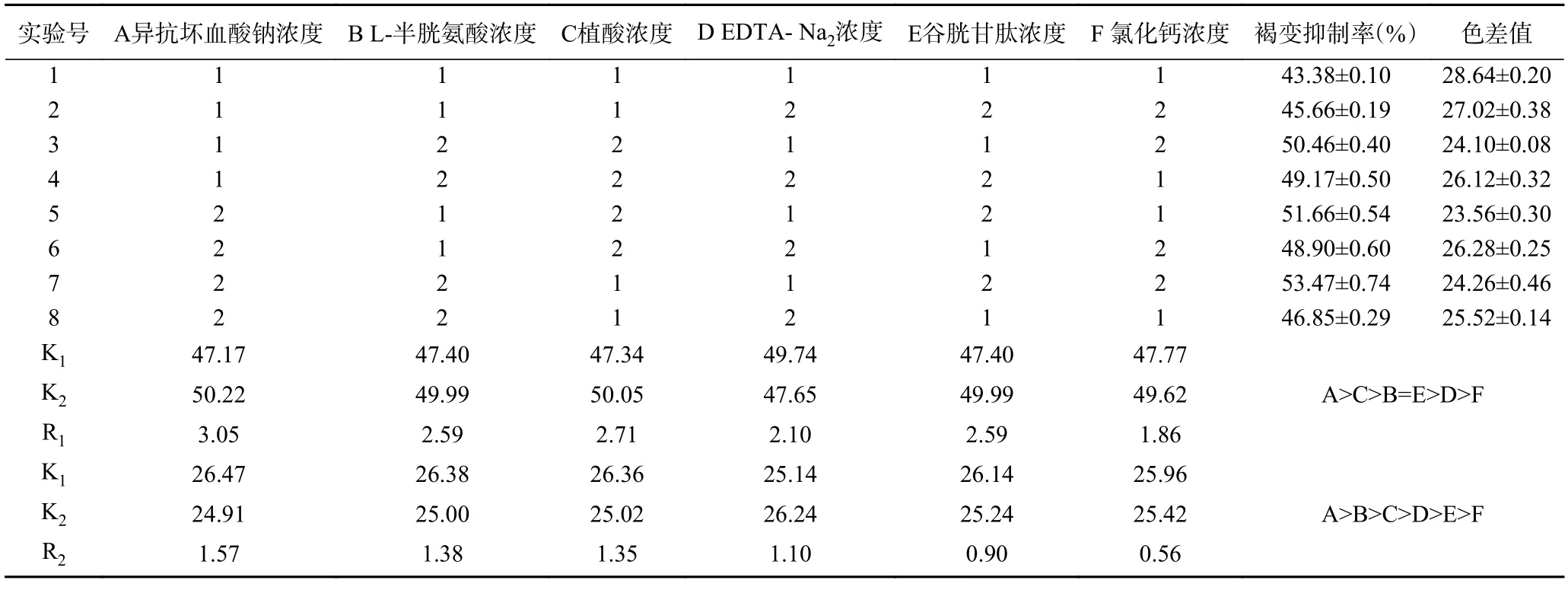
表3 正交试验设计与结果Table 3 Orthogonal experiment design and results
2.3 响应面试验
2.3.1 响应面试验设计及方差分析 根据正交试验结果,选择对杏酒褐变抑制率和色差值影响较大的3 种护色剂:异抗坏血酸钠、L-半胱氨酸、植酸,进行三因素三水平的响应面试验,其设计及结果见表4。再对响应面结果进行多元回归拟合分析,分析结果见表5、表6。

表4 响应面试验设计与结果Table 4 Response surface test design and results
根据试验结果,对自变量编码的因素A(异抗坏血酸钠)、B(L-半胱氨酸)、C(植酸)进行回归分析并建立模型,可以得到一个二次多项式回归方程:Y1(褐变抑制率,%)=49.73+1.62A−1.01B−1.72C+1.06AB−3.90AC+0.56BC−1.99A2−2.80B2−2.14C2
由表5 所示,回归模型P值<0.0001,说明该模型的回归方程是极显著的,在统计学上有意义。失拟项P值为 0.4018>0.05,说明失拟项不显著,无失拟因素存在。模型R2为 97.54%>85%,说明模型的拟合程度较好,可用该回归方程代替褐变抑制组合试验真实点对试验结果进行分析和预测[34]。
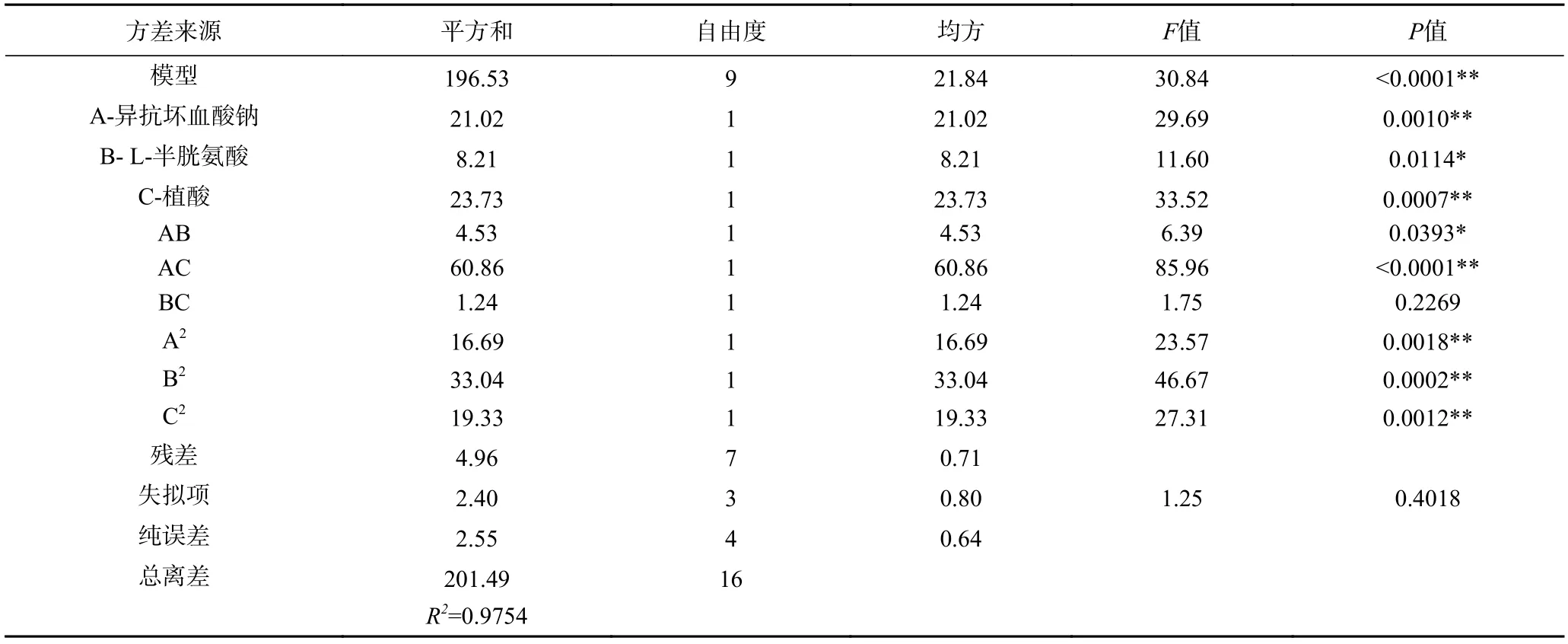
表5 褐变抑制率回归模型的方差分析Table 5 Analysis of variance for regression model of browning inhibition rate
在回归模型中,A、C,AC,A2、B2、C2对褐变抑制率影响为极显著(P<0.01);B 和AB 对褐变抑制率的影响显著(P<0.05);BC 的影响不显著(P>0.05)。由此表明各个试验因子与响应值之间的关系不是简单的线性关系。
根据试验结果,对自变量编码的因素A(异抗坏血酸钠)、B(L-半胱氨酸)、C(植酸)进行回归分析并建立模型,可以得到一个二次多项式回归方程:Y2(色差值)=21.47−0.41A+1.38B+0.70C−0.79AB+1.43AC−0.20BC+2.17A2+1.56B2+1.74C2
由表6 所示,回归模型极显著(P=0.0003<0.01),失拟项不显著(P=0.9853>0.05),模型R2为 96.23%>85%,说明模型的拟合程度较好,可利用该模型预测杏酒的护色剂配方。该模型中B,AC 和A2、B2、C2对色差值的影响是为极显著(P<0.01);C、AB 对色差值的影响显著(P<0.05);A、BC 对色差值影响不显著(P>0.05)。

表6 色差值回归模型的方差分析Table 6 Analysis of variance for regression model of the chromatism
2.3.2 因素间的交互影响 根据各指标与两个自变量间的等高线和响应面的形状,可反映交互效应的强弱,揭示交互项对杏酒褐变抑制率和色差值的影响。由图7~图8 可知,异抗坏血酸钠(A)和半胱氨酸(B)的等高线偏圆形,响应面较为陡峭,说明AB 间的交互作用对杏酒褐变抑制率和色差值的影响达到显著水平;异抗坏血酸钠(A)和植酸(C)的等高线呈现椭圆形,响应面更陡峭,说明AC 间的交互作用非常显著,且AC 的交互效应对于杏酒褐变抑制率和色差值的影响程度较高,所以适当调整A 和C 的含量,有利于提高杏酒的褐变抑制率,降低色差值。

图7 异抗坏血酸钠与L-半胱氨酸、植酸交互作用对杏酒褐变抑制率的影响Fig.7 Effects of the interaction of sodium isoascorbate with L-cysteine and phytic acid on the browning inhibition rate of apricot wine
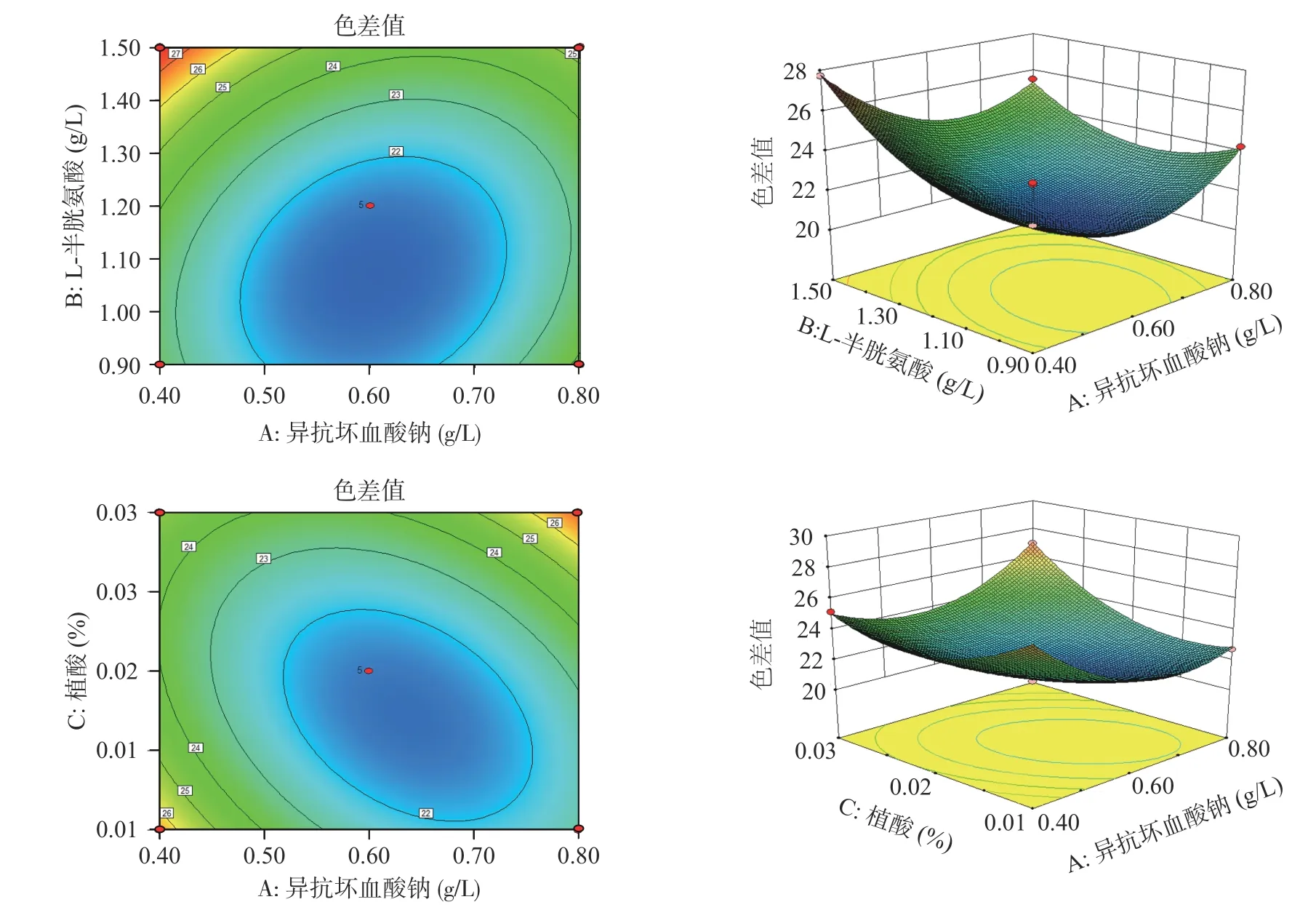
图8 异抗坏血酸钠与L-半胱氨酸、植酸交互作用对杏酒色差值的影响Fig.8 Effects of the interaction of sodium isoascorbate with L-cysteine and phytic acid on the chromatism of apricot wine
2.3.3 最佳护色剂的确定及验证试验 根据响应面试验,得到最佳的杏酒护色剂配方为:异抗坏血酸钠0.70 g/L、L-半胱氨酸1.13 g/L、植酸0.01%,在此条件下预测杏酒褐变抑制率为51.52%,色差值为21.42。考虑到试验的可操作性和可行性,确定最佳的杏酒护色剂配方为:抗坏血酸钠0.70 g/L、L-半胱氨酸1.10 g/L、植酸0.01%。在此条件下进行3 次验证试验,得出杏酒的褐变抑制率为53.11%,色差值为22.35,相对误差分别为:3.00%和4.16%,测得的酒精度为11.98%vol,还原糖为4.75 g/L,总酸为8.47 g/L,无护色剂添加的杏酒酒精度为12.15%vol,还原糖为4.63 g/L,总酸为8.87 g/L,两者无显著性差异。抑制结果与模型预测的理论值大致符合,说明通过响应面试验所建立的回归模型预测性良好,最佳护色剂配方可行,具有实际参考价值。
3 结论
本研究分别选用6 种护色剂进行单因素试验,通过分析褐变抑制率和色差值,发现不同护色剂对杏酒褐变的抑制效果差异较大,其中异抗坏血酸钠的褐变抑制效果最佳。经过6 因素2 水平的正交试验,并通过极差分析选择对褐变抑制率和色差值影响最大的三种护色剂:异抗坏血酸钠、L-半胱氨酸、植酸。通过采用响应面法优化护色剂配方,回归方程拟合较好,最佳护色剂配方为:异抗坏血酸钠0.70 g/L、L-半胱氨酸1.10 g/L、植酸0.01%。在此条件下,杏酒的酒精度为11.98%vol,还原糖为4.75 g/L,总酸为8.47 g/L,与对照组发酵的杏酒无显著性差异,测得其褐变抑制率为53.11%,色差值为22.35,与预测值吻合率达到97.00%和95.84%。本文对杏酒护色剂的研究,为控制杏酒褐变提供了有效途径,在今后的研究中,还可以从改善陈酿环境、加强非酶褐变的控制以及复合护色剂的互作机理等方面继续进行探究。
