‘黄樽’薄叶金花茶组培苗生根与移栽技术研究
2021-06-08吴丽君游云飞陈文荣李文芳
吴丽君,游云飞,陈 达,陈文荣,李文芳
(1.福建省林业科学研究院,福建 福州 350012; 2.福建省洋口国有林场,福建 顺昌 353211;3.国家林业和草原局南方山地用材林培育重点实验室,福建 福州 350012;4.福建省森林培育与林产品加工利用重点实验室,福建 福州 350012)
金花茶组植物(CamelliaSect.nitidissimaChi)是山茶科山茶属植物中唯一开金黄色花的珍稀观赏植物[1-4],素有“植物界的大熊猫”“茶族皇后”之美称[1],具有较高的观赏价值和育种价值;金花茶花、叶富含茶多酚、黄酮等对人体有益的天然营养物质,药用价值高[5]。
随着金花茶观赏、药用价值的不断开发和利用,金花茶人工种植面积逐年增长,种苗供不应求。组培快繁是植物良种快繁的主要技术途径,组培苗生根率和移栽成活率是组培产业化的重要技术指标。山茶科植物,组培生根及移栽成活率低[6]一直是金花茶组培产业化的瓶颈[7]。黄晓娜等[7]研究了金花茶试管苗瓶外生根技术,但生根成活率远低于生根率;李桂娥等[8]通过生长调节剂处理芽苗促进了金花茶组培苗不定根的发生,但操作复杂,难以普及推广。笔者以‘黄樽’薄叶金花茶(C.chrysanthoides‘Huangzun’)[10-12]为材料,在优选培养基的基础上,优化和提升生根培养和移栽技术,为金花茶组培产业化提供参考。
1 材料与方法
1.1 材料选取与处理
以‘黄樽’薄叶金花茶继代苗为原材料。‘黄樽’薄叶金花茶是福建省林业科学研究院于2017年通过审定的金花茶良种[9-11],省林木良种编号:闽R-SV-CC-027-2017。
选用培养60 d以上的继代苗,切取带顶芽、苗高2.0 cm以上的单芽为生根试验材料。每个单芽含3枚以上舒展叶片,叶长0.5 cm以上,叶片转绿或浅绿,苗径0.5 mm以上。金花茶组培苗叶片较大,为方便操作,接种时将苗基部1.0 cm以下的叶片切除。
1.2 基本培养基与植物生长调节剂组合的筛选
采用L9(33)设置基本培养基(1/2 B5、3/4 B5、B5)、ABT(0、0.5、1.0 mg/L)、吲哚丁酸(IBA)(0、0.5、1.0 mg/L)处理正交组合形成9种生根培养基[12]。每种培养基接芽苗30株,重复3次,转接60 d,统计生根率。培养基均附加15 g/L白糖、琼脂6.0 g/L,调制其pH为5.8[8]。
1.3 培养基质与附加物组合的筛选
以1/2 B5+ABT 0.5 mg/L+IBA 0.5 mg/L为基本培养基,2种培养基质[V细河沙∶V蛭石=1∶1(河沙蛭石基质)、琼脂]与2种附加物(白糖、活性炭)形成5种组合,即:①琼脂6.0 g/L+白糖0 g/L;②琼脂6.0 g/L+白糖15 g/L;③琼脂6.0 g/L+白糖15 g/L+活性炭3.0 g/L;④河沙蛭石基质+白糖0 g/L;⑤河沙蛭石基质+白糖15 g/L,调制pH为5.8[8]。每个组合接芽苗30株,重复3次,芽苗转接60 d,统计生根率,观察芽苗根系生长情况。
组合④的制备:将粒径1.0~2.0 mm细河沙经清水淘洗滤干,与粒径2.0~3.0 mm蛭石按体积比1∶1均匀混合制成河沙蛭石基质,用上述基本培养基溶液浸泡混合基质约30min后,滤去多余水分,装入培养瓶,经高温高压(温度121 ℃、压力1.1 kg/cm2)灭菌30 min[12]。组合⑤的制备参照④。
芽苗接种在河沙蛭石基质上,应先用接种针在基质上打出小孔,再将芽苗插入基质孔中,插入深度以苗高的1/3~1/2为宜;接种后,轻轻敦实基质,确保芽苗基部与基质接触良好。
1.4 补充白糖、K2HPO4
以组合④,即河沙蛭石基质+1/2 B5+ABT 0.5 mg/L+IBA 0.5 mg/L为生根培养基,培养35 d(此时部分芽苗基部发根),分别补充经灭菌的⑥白糖15.0 g/L、⑦K2HPO415.0 mg/L、⑧白糖15.0 g/L+K2HPO415.0 mg/L、⑨CK(对照组,不补充白糖和K2HPO4)形成4种处理。每个处理芽苗30株,重复3次。
生根培养60 d后,4种处理的生根苗经7~10 d炼苗后,移栽到移栽专用基质(V细河沙∶V蛭石=3∶1)上;栽后采用塑料薄膜和遮光率75%的遮阴网覆盖,保持拱棚内空气湿度85%、温度(24±4) ℃,直至小苗长出新叶,再逐渐打开遮阴网和薄膜[7,12]。
移栽前调查生根率、黄化率、平均茎粗;移栽60 d后,统计移栽成活率[11]。
1.5 生根培养条件
培养室温度为(24±2) ℃;生根培养前15 d,光照度150~300 lx;培养15~35 d,光照度1 200~1 500 lx;培养35~60 d,光照度1 800~2 300 lx;移栽前炼苗,可充分利用自然散射光,避免阳光直接照射[12]。
1.6 数据分析
数据采用SPSS软件分析,Tukey法多重比较。
2 结果与分析
2.1 基本培养基与植物生长调节剂组合对生根率的影响
9种(组合)培养基的生根率见表1,其方差分析结果为F培养基=70.3>F0.01(8,16)=3.89,P培养基=0.000 1;表明培养基对生根率的影响达极显著水平。依据生根率极差值(RABT>R基本培养基>RIBA)推断,对生根率影响大小依次为ABT、基本培养基、IBA。多重比较表明培养基2号和3号的生根率分别为42.2%和41.1%,与其他培养基生根率达极显著差异。因此,较优的培养基为1/2 B5+ABT 0.5~1.0 mg/L+IBA 0.5~1.0 mg/L。培养基7号、8号和9号的芽苗生根率低且叶片厚质化,这可能与基本培养基B5含较高浓度盐有关[13]。

表1 基本培养基与植物生长调节剂组合对生根率的影响
2.2 培养基质与附加物组合对生根率的影响
不同培养基质与附加物组合对生根率的影响情况见表2。5个组合中,平均生根率最高是组合④,其次为⑤,分别为84.4%和68.9%;平均生根率最低是组合③,为33.3%。河沙蛭石基质平均生根率均高于琼脂,且芽苗粗壮,叶片舒展,根系发达,须根多。可见,具有良好透气性和持水性的河沙蛭石基质较透气性差的琼脂更有利于根的诱导与生长[13]。无附加物的组合①和④的平均生根率均高于对应附加白糖或白糖+活性炭的组合②、③和⑤。肖玉兰[13]认为无糖培养基可以促进植株尽早生根,提高生根率;谭文澄等[14]认为白糖培养基较高的渗透势和活性炭的吸附性不利于芽苗生根。

表2 不同培养基质与添加物组合对生根率的影响

图1 琼脂上(A)和河沙蛭石基质上(B)的生根芽苗Fig.1 Rooting shoots on agar and substrate with sand and vermiculite
平均生根率方差分析结果为F组合=104.38>F0.01(4,8)=7.01,P组合=0.000 1;表明培养基质与附加物组合对生根率的影响达极显著水平。多重比较表明组合④即无附加物的河沙蛭石基质平均生根率最高,为84.4%,极显著高于其他组合,因此最优组合为④。
生根培养后期,组合④有部分芽苗叶片黄化易脱落,而组合⑤芽苗叶色正常,显然无糖的河沙蛭石基质有利于芽苗生根,但不利于芽苗后期生长。
2.3 补充白糖、K2HPO4对生根率、移栽成活率和黄化率的影响
补充白糖或K2HPO4等4种处理对芽苗生根率、移栽成活率和黄化率的影响见表3,芽苗生根率方差分析结果为F处理=2.695 表3 补充白糖与K2HPO4对芽苗生根率、移栽成活率和黄化率的影响 处理⑧和⑥未见芽苗黄化,对照组⑨和处理⑦芽苗均有黄化现象。植物异养条件下,糖是植物细胞代谢的主要能源,是植物离体培养必不可少的物质[13],因此生根培养后期补充白糖15.0 g/L利于芽苗后续生长。处理⑧的芽苗叶片浓绿、粗壮,平均茎粗2.16 mm,最大茎粗2.80 mm(图2);处理⑥的芽苗叶色淡绿;因此综合芽苗生根率、黄化率及长势,最佳处理是⑧。 另外,试验观察到无糖的河沙蛭石基质(V细河沙∶V蛭石=1∶1)上,芽苗污染率较琼脂培养基的芽苗污染率低,约0.5%。传统培养基中的糖和琼脂(或卡拉胶)是造成污染的主要原因[13],芽苗污染率通常为2%~5%[15]。 表3中,处理⑧和⑥的移栽成活率较高,分别为93.9%和90.1%;方差分析结果:F处理=211.5>F0.01(3,6)=9.78,P处理=0.000 1,表明4种处理的移栽成活率差异极显著。多重比较结果表明:处理⑧和⑥的移栽成活率与对照组⑨和处理⑦差异极显著;说明生根培养后期补充白糖可显著提高芽苗移栽率成活率。综合考量生根率、移栽成活率、芽苗黄化率和长势等指标,最佳处理是⑧,即生根培养后期补充白糖15.0 g/L+K2HPO415.0 mg/L。 图2 补充白糖+K2HPO4的生根芽苗及移栽情况Fig.2 Rooting shoots and transplantation situation on substrate added sugar and K2HPO4 ‘黄樽’薄叶金花茶在传统的白糖琼脂培养基上,未获得理想的生根效果,在优选的培养基1/2 B5+ABT 0.5~1.0 mg/L+ IBA 0.5~1.0 mg/L+白糖15 g/L+琼脂6.0 g/L上,培养60 d,生根率仅为42.2%~41.1%。 不同培养基质(河沙蛭石基质、琼脂)与附加物(白糖、活性炭)组合对‘黄樽’薄叶金花茶生根率影响极显著,以河沙蛭石基质替代培养基1/2 B5+ABT 0.5~1.0 mg/L+IBA 0.5~1.0 mg/L中的琼脂和白糖,平均生根率达84.4%,且芽苗粗壮、叶片舒展、根系发达。李桂娥等[8]通过液体滤纸桥培养法改善了根的诱导环境,提高了金花茶生根率,但该培养法不便于普及推广。因此对于组培生根困难植物,选择透气性基质结合无糖或低浓度糖培养,以改善根的诱导环境是提高生根率的有效方法[13]。此外,采用无糖的河沙蛭石基质生根培养,也可大幅度降低芽苗污染率。 在生根培养基(河沙蛭石基质)+1/2 B5+ABT 0.5 mg/L+ IBA 0.5 mg/L上培养35 d后,分别补充白糖15.0 g/L、K2HPO415.0 mg/L、白糖15.0 g/L+K2HPO415.0 mg/L及CK等4种处理对平均生根率的影响不显著,但对移栽成活率影响极显著;补充白糖15 g/L+ K2HPO415.0 mg/L,有效克服芽苗黄化,提高芽苗质量,进一步提高了芽苗生根率和移栽成活率,芽苗生根率和移栽成活率分别为91.1%和93.3%。参考对组培苗的培养优化措施[16],K元素能够促进植物生长健壮,保障各种代谢活动的顺利进行[17],K2HPO4或KH2PO4富含K离子,因此被广泛用于调控植物的生长发育。单妍[16]用KH2PO4处理香糯竹黄化组培苗,获得了较好效果。适宜浓度KH2PO4喷施桃叶和月季叶片可增加叶绿素含量和叶片干质量[18-19],对月季新梢的茎长和茎粗有明显的促进作用[19]。徐莉莉等[20]研究认为喷施KH2PO4能显著提高红叶桃的净光合速率。‘黄樽’薄叶金花茶生根培养时间长达60 d以上,较长时间的无糖培养势必因碳源缺失导致芽苗叶片黄化;因此,及时补充糖等碳源物和K2HPO4,对提高芽苗质量,进而提高芽苗生根率和移栽成活率是极为有利。 综上所述,‘黄樽’薄叶金花茶通过传统的白糖琼脂培养法,生根率低、芽苗长势差,且芽苗移栽成活率低;而用河沙蛭石基质(V河沙∶V蛭石=1∶1)+1/2 B5+0.5~1.0 mg/L+IBA 0.5~1.0 mg/L的无糖培养法,培养后期补充白糖15 g/L+K2HPO415.0 mg/L,是提高‘黄樽’薄叶金花茶生根率和移栽成活率的有效方法,也是其他组培生根困难的植物尤其是金花茶组植物离体培养可借鉴的培养方法。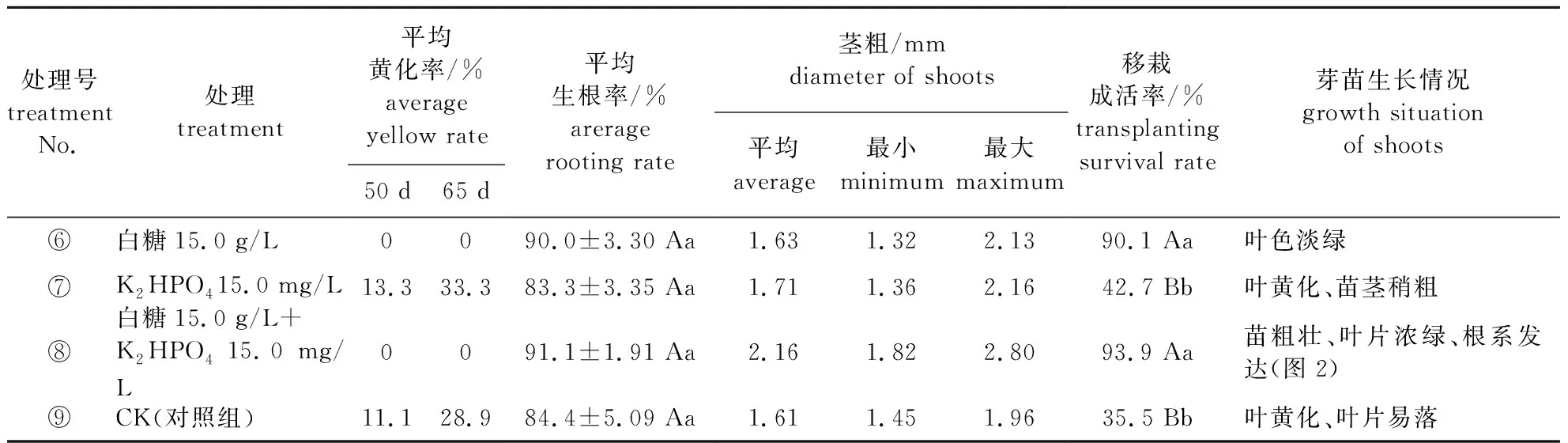

3 讨 论
