基于代谢组学分析平菇栽培用培养料发酵过程中代谢物的变化
2021-06-02刘皓皓刘芹崔筱靳荣线高玉千李亚楠孔维丽裴瑞杰邱立友
刘皓皓 刘芹 崔筱 靳荣线 高玉千 李亚楠 孔维丽 裴瑞杰 邱立友


摘 要:为了解发酵培养料制备过程中微生物代谢产物的组成和变化规律,采用非靶向代谢组学技术,检测分析发酵2、4、6、8和10 d时培养料的代谢组数据。结果表明:在正离子(POS)模式下,分别在T2 vs T1、T3 vs T2、T4 vs T3和T5 vs T4中筛选得到331、145、161和115种差异代谢物;在负离子(NEG)模式下,分别筛选得到251、159、106和76种差异代谢物。这些差异代谢物主要包括糖类及其衍生物、氨基酸、肽类及其类似物、脂肪酸类、维生素类、苯丙素类和聚酮类物质及其他次级代谢产物。此外,在发酵培养料中还含有植物生长调节剂(如吲哚-3-乙酸、茉莉酸和赤霉素)和抑菌物质(如绿原酸、抗生素、白藜芦醇)。该研究可为制备质量稳定的发酵培养料和掌握发酵培养料栽培平菇技术提供参考。
关键词:平菇;发酵料;代谢组学;差异代谢物
中图分类号:S646.1+4 文献标志码:A 文章编号:1673-2871(2021)04-021-10
Abstract: Non-targeted metabolomics technique was used to reveal the dynamic changes in the composition and variation of microbial metabolites in corncob composting for preparing cultivation medium of Pleurotus ostreatus. Results showed that 331, 145, 161 and 115 differential metabolites at POS mode were screened, including carbohydrates and derivants, amino acids, peptides, and analogues, fatty acids, vitamins, phenylpropanoids and polyketides, and other secondary metabolites, between T2 vs T1, T3 vs T2, T4 vs T3 and T5 vs T4, respectively. And 251, 159, 106 and 76 differential metabolites at NEG mode were screened, respectively. Furthermore, the fermentation materials contained plant growth regulators (such as indole-3-acetic acid, jasmonic acid and gibberellin) and antibacterial substances (such as chlorogenic acid, antibiotics, resveratrol). This study provided a reference for the preparation of quality-stable fermentation materials and the further understanding of the cultivation of Pleurotus ostreatus with fermentation materials.
Key words: Pleurotus ostreatus; Fermentation material; Metabolomics; Differential metabolites
平菇Pleurotus ostreatus (Jacq.) P. Kumm.,是世界上栽培最廣泛的食用菌之一[1-3],也是重要的食药用真菌[4-5]。平菇的栽培技术主要有3种:生料栽培、熟料栽培和发酵料栽培[6]。与生料和熟料栽培相比,发酵料栽培平菇由于具有低污染、低成本、工艺简单和经济效益高的优点而在世界范围内得到了广泛应用[6]。平菇栽培用发酵料是以秸秆、玉米芯等农业副产物为主要原料,加入少量的麸皮、石灰等,在微生物的参与下,经短期、好氧发酵而制备的[3]。玉米芯约占玉米产量的21%,是一种产量巨大的农副产品,来源广泛、价廉易得[7]。目前,玉米芯除用于制备糠醛、木糖醇等外,很大一部分被作为农业废弃物直接燃烧,造成资源浪费和环境污染。玉米芯组织均匀、硬度适宜、吸水性强,将其堆制发酵后用于平菇栽培,不仅有助于平菇产量和品质的提高,而且可以实现农业副产物的高效生物转化[8]。
笔者在前期的研究中发现:平菇玉米芯发酵培养料制备过程中,变形菌门Proteobacteria在早期阶段(T1)占优势(相对丰度35.67%~44.10%),在高温阶段(T2,T3),厚壁菌门Firmicutes成为新的优势门(相对丰度41.50%~48.52%),而在堆肥后期(T4、T5),变形菌门重新成为优势门(相对丰度33.55%~36.89%)[9]。这些微生物对发酵过程中植物秸秆中木质纤维素的降解起着至关重要的作用。Pearson相关分析表明,发酵培养料制备过程中的理化性质变化与其中微生物菌落的组成变化显著相关[9]。微生物能将培养料中复杂的有机质(纤维素、半纤维素、木质素等)进行降解,使其变成简单、易于利用的低分子物质;有些特定微生物如Actinobacteria、Thermus和Bacillus还可以产生抗菌、杀虫的物质,这可能是发酵培养料栽培平菇可以采用开放式接种的原因之一[10]。
目前对玉米芯发酵培养料的研究主要集中在栽培平菇[11-13]和制备过程中发酵培养料中微生物及其功能的演替方面[3],而对玉米芯发酵培养料制备过程中微生物代谢产物的研究还未见报道。代谢组学(metabolomics)是继基因组学、转录组学、蛋白质组学后出现的新兴组学技术,是系统生物学的重要组成部分[14]。代谢组学是从整体角度出发,运用现代检测技术对尽可能多的代谢产物进行分析检测[15]。目前,代谢组学在真菌领域的应用也日益广泛,为人们提供了一个了解真菌代谢的独特途径[14-16]。
因此,笔者通过采用非靶向代谢组学技术分析检测玉米芯发酵培养料制备过程中发酵微生物代谢产物的种类和含量,进而探讨制备过程中主要代谢物的组成及变化规律,为稳定发酵料质量提供理论基础。
1 材料与方法
1.1 发酵料
发酵料的质量分数配比为:玉米芯84%,麸皮10%,石灰5%,尿素1%;含水量68%。
1.2 试剂与仪器
玉米芯(中值粒径0.5 cm)、麸皮、石灰、尿素均购自本地农贸市场;LC-MC级甲醇、水、甲酸、醋酸铵(CNW Technologies GmbH, Germany)。
BSA124S-CW天平(Sartorius);1290 UHPLC 色谱仪(Agilent Technologies Inc., USA);Triple TOF 6600质谱仪(AB Sciex Pte. Ltd., USA);D3024R高速冷冻离心机(Scilogex, USA);JXFSTPRP-24全自动样品快速研磨仪(上海净信实业发展有限公司);GWB-1普析纯水仪(北京普析通用仪器有限责任公司);KS-7200DV超声仪(昆山洁力美超声仪器有限公司)。
1.3 发酵料制备和取样
该试验于2020年3—4月在河南省农业科学院现代农业科技试验示范基地进行。根据以往的报道[12],制备平菇发酵料。发酵料制备试验包含6个重复,每个重复包含250 kg原料(干质量)。玉米芯原料按照质量比为1∶2.4~2.5的料水配制,机械搅拌30 min,堆置1 d后进行建堆,堆高60 cm,宽1.5 m左右,长度不限。此时培养料的含水量约为70%,pH值9~10,颜色为金黄色。用直径5 cm的木棒在料堆上部、横竖间隔30~40 cm打通风孔,木棒要求插到料堆底部。发酵周期为10 d,第3天温度升至45~55 ℃开始翻堆,培养料温度升至70 ℃以上每隔1 d翻堆1次,共4次,直至发酵完成。分别在发酵2、4、6、8、10 d时采集样品,标注为T1、T2、T3、T4、T5。为了获得具有代表性的样本,分别从发酵料堆的9个不同位置采集子样本,然后将子样本进行混合得到一个样本[3]。
1.4 代谢组学分析
取发酵培养料样品进行代谢组学分析,按北京诺禾致源科技股份有限公司非靶向代谢组学分析方法提取代谢物、超高效液相色谱-四级杆串联飞行时间质谱(ultra performance liquid chromatography-quadrupole time-of-flight mass spectrometry,UPLC-QTOF-MS)分析代謝物,采用ProteoWizard和XCMS软件对代谢组下机数据(.raw)实施峰的识别、提取、积分及对齐等处理,利用mzCloud(https://www.mzcloud.org/)、mzVault和Masslist数据库进行峰比对,同时采用blank样本去除背景离子,进一步进行峰面积的批次归一化和自适换算标准化处理,从而得到代谢物的鉴定和定量结果。采用SIMCA软件(version 14.1, sartorius stedim data analytics AB, Umea, Sweden)对数据进行主成分分析(principal component analysis, PCA)和正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis, OPLS-DA)[17]。
1.5 数据处理分析
试验数据均采用Excel 2016进行记录整理,采用SPSS(version 20.0)进行Pearson相关性分析以及单因素ANOVA检验比较平均值,统计分析结果p<0.05为差异性显著,试验结果用平均值和SEM表示。
2 结果与分析
2.1 发酵培养料代谢物的主成分分析
基于非靶向代谢组学技术对发酵2、4、6、8、10 d的培养料样品进行检测,分别在正离子(POS)和负离子(NEG)模式下鉴定得到1208和472种代谢物,对所有代谢物进行PCA分析(图1)。从图1可以看出,培养料样品中的代谢物分成5组,组内样本均集聚良好,这说明5组培养料样品的微生物代谢物具有显著的差异。
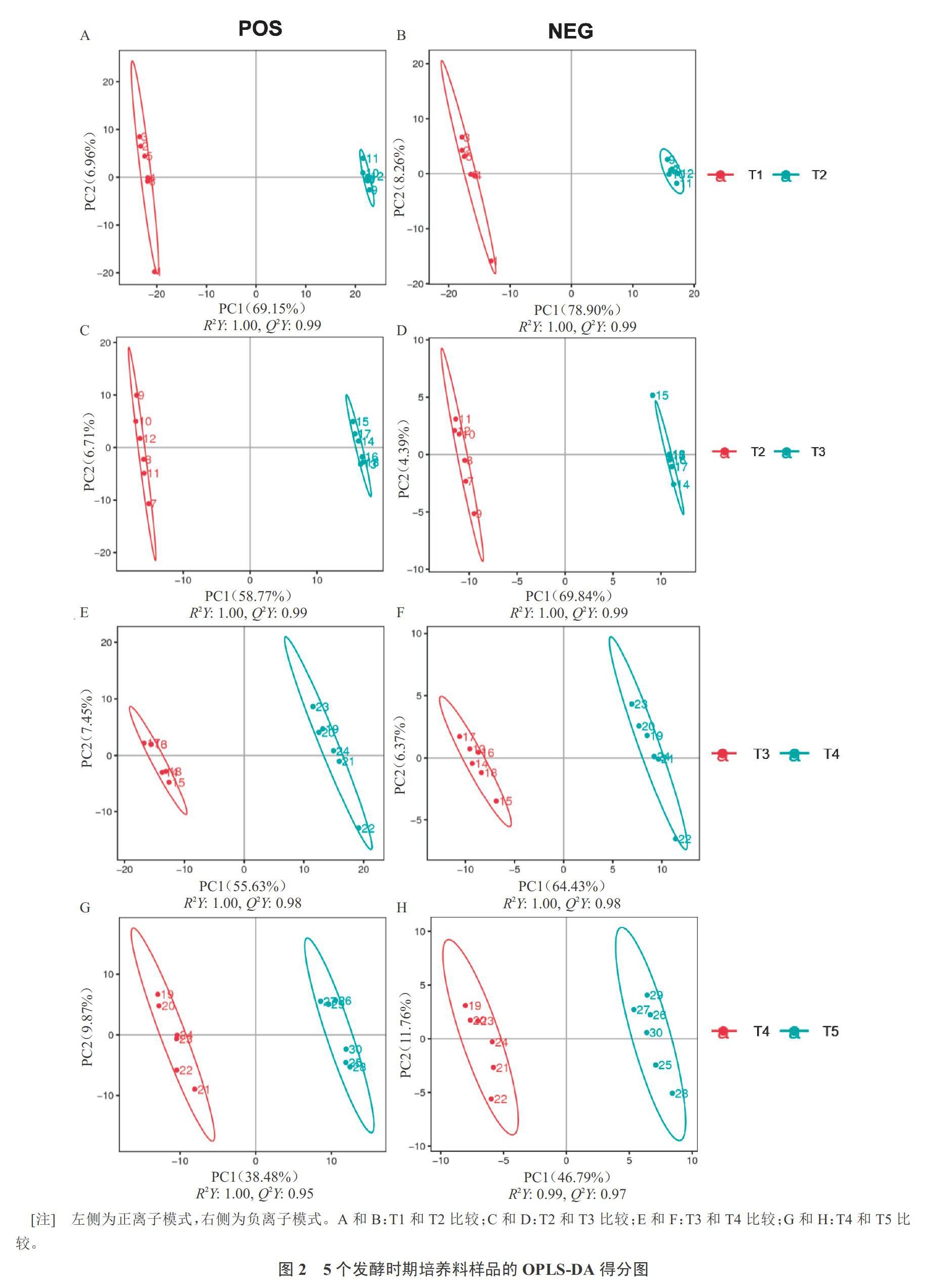
为更充分地提取不同发酵时期培养料样品中代谢物的差异信息,分析筛选不同组间的差异代谢物,因此进一步采用有监督的OPLS‐DA分析数据。由图2可知,T2 vs T1(图2-A~B)、T3 vs T2(图2-C~D)、T4 vs T3(图2-E~F)、T5 vs T4(图2-G~H)中的样品点均分布在不同的区域且明显分为两个簇,实现了两组样品间的完全分离。结果表明,不同发酵时期培养料样品中微生物代谢产物在种类和(或)含量上存在明显差异。POS模式下T2 vs T1、T3 vs T2、T4 vs T3、T5 vs T4的OPLS‐DA模型质量参数分别为:R2Y(cum)=1.00,Q2Y(cum)=0.99;R2Y(cum)=1.00,Q2Y(cum)=0.99;R2Y(cum)=1.00,R2Y(cum)=0.98;R2Y(cum)=1.00,Q2Y(cum)=0.95。NEG模式下分别为:R2Y(cum)=1.00,Q2Y(cum)=0.99;R2Y(cum)=1.00,Q2Y(cum)=0.99;R2Y(cum)=1.00,Q2Y(cum)=0.98;R2Y(cum)=0.99,Q2Y(cum)=0.97。R2Y和Q2Y均大于0.5,这表明依据两种采集模式所得数据建立的OPLS‐DA模型都具有较好的拟合性和较强的预测能力。
同时采用200次响应的置换检验来验证模型的过拟合现象,避免采用OPLS-DA方法分析时出现过拟合现象。由图3可知,Q2的回归直线与y轴的交点均在负半轴。POS模式下,T2 vs T1的R2Y(cum)(0,0.81),Q2(cum)(0,-0.68);T3 vs T2的R2Y(cum)(0,0.91),Q2(cum)(0,-0.67);T4 vs T3的R2Y(cum)(0,0.90),Q2(cum)(0,-0.67));T5 vs T4的R2Y(cum)(0,0.91),Q2(cum)(0,-0.73)。NEG模式下,T2 vs T1的R2Y(cum)(0,0.51),Q2(cum)(0.0,-0.85);T3 vs T2的R2Y(cum)(0,0.83),Q2(cum)(0,-0.74);T4 vs T3的R2Y(cum)(0,0.83),Q2(cum)(0,-0.79);T5 vs T4的R2Y(cum)(0,0.81),Q2(cum)(0,-0.87)。这说明建立的OPLS‐DA模型是稳健可靠的,不存在过拟合现象。因此,可以用来探索发酵培养料制备过程中,不同发酵阶段培养料样品中的微生物代谢产物的差异。
2.2 发酵料制备过程中的差异代谢物的筛选
以p<0.05和VIP>1为条件筛选出具有差异性表达的化合物,T2 vs T1、T3 vs T2、T4 vs T3、T5 vs T4,在POS模式下,分别得到331、145、161和115种差异代谢物;在NEG模式下,分别得到251、159、106和76种差异代谢物(图4)。
对检测到的代谢物进行log2处理后,在POS和NEG模式下变化最显著的20种(上调和下调)差异代谢物见表1。T2 vs T1时,发酵培养料样品中1-(2-呋喃基)戊烷-1,4-二酮、2-(4-氯苯基)-N,N-二甲基乙硫酰胺、D-氨基葡萄糖、N-(4-氯苯基)-N'-(2-苯氧基苯基)等物质相对含量显著增加;D-(+)-麦芽糖、5-羟赖氨酸、D-棉子糖、α,α-海藻糖等物质相对含量显著降低。T3 vs T2时,截短侧耳素、圣草酚、苯乙醛等物质相对含量显著增加;而黑色素、缩二脲、丁酸赖氨酸等物质相对含量显著降低。T4 vs T3时,阿魏酸、黄豆苷元、橙皮素等物质相对含量显著增加;对香豆酰胍丁胺、儿茶酚、原儿茶酸等物质相对含量显著降低。T5 vs T4时,L-正亮氨酸、7-羟基香豆素、环氧霉素等物质相对含量显著增加;儿茶酚、茶碱、2-氨基-1,3,4-十八碳三醇等物质相对含量显著降低。
2.3 不同发酵时期差异代谢物含量比较
对不同差异代谢物进行归类,T2和T1、T3和T2、T4和T3、T5和T4的之间的差异代谢物的比较见图5。在不同发酵时间的样品中检测出的差异代谢物主要有:糖类及其衍生物(棉子糖、蔗糖、核糖、乳糖、氨基葡萄糖、阿拉伯糖醇等),脂肪酸类(壬酸、戊酸、己酸、辛酸、顺式5,8,11,14,17-二十碳五烯酸、16-羟基十六烷酸等),氨基酸、肽类及其类似物(N-乙酰基天冬氨酸、甘氨酰-L-亮氨酸、L-谷氨酸、天冬酰胺、天冬氨酸、D-丙氨酰-D-丙氨酸等),维生素类(生物素、核黄素、烟酸、泛酸、吡哆醇等),抑菌物质类(绿原酸、截短侧耳素、土霉素、环氧霉素、橙皮素、白藜芦醇等),苯丙素类和聚酮类物质(3-(4-羟基苯基)丙酸、柚苷二氢查耳酮、香豆素、3,4-二羟基苯基丙酸等),核苷、核苷酸及类似物(黄嘌呤、尿苷、cGMP、鸟苷一磷酸、脱氧胞苷等)和其他代谢物(6β-羟基皮質醇、对香豆酰胍丁胺、1-(4-溴苯基)2-苯基乙-1-酮等)等。从代谢组数据中提取上述物质的相对峰面积,峰面积与含量成正比,可以用来表征代谢物的含量。其中糖类及其衍生物和氨基酸、肽类及其类似物的变化趋势相似,T2 vs T1和T3 vs T2,糖类及其衍生物的相对含量分别下降了5.00%和4.83%,而氨基酸、肽类及其类似物相对含量分别下降了3.36%和5.92%;T4 vs T3和T5 vs T4,糖类及其衍生物的相对含量分别上升了2.43%和5.05%,而氨基酸、肽类及其类似物相对含量分别上升了1.54%和6.03%。与T1相比,T2时期发酵培养料中的苯丙素类和聚酮类物质相对含量下降了4.39%,而T3、T4和T5时的苯丙素类和聚酮类物质相对含量分别比发酵前一时期(T2、T3和T4)高9.47%、0.91%和3.15%。抑菌物质和维生素类的相对含量均较发酵前一时期有所增加,其中T2、T3、T4和T5发酵料中抑菌物质相对含量较T1、T2、T3和T4分别上升了7.28%、13.84%、3.83%和3.81%;而维生素类相对含量分别上升了0.14%、13.66%、6.96%和4.77%。
2.4 不同发酵时期植物生长调节剂丰度变化
从图6可以看出,不同发酵时期培养料中吲哚-3-乙酸和赤霉素的相对峰面积变化趋势相似,在T5时期达到最高值,茉莉酸的相对峰面积随发酵时间的延长呈现出先升高后下降的趋势,在T2时达到最高值。脱落酸相对峰面积变化趋势与茉莉酸类似,最大值出现在T4。
3 讨论与结论
笔者在本研究中采用非靶向代谢组学技术对不同发酵时期的平菇培养料中的代谢物进行分析,差异代谢物总数最多的是T2 vs T1,其次是T3 vs T2,最少的是T5 vs T4。这与笔者前期对5个发酵时期培养料中微生物的代谢功能差异的分析结果基本一致[3]。发酵培养料中的漆酶、木聚糖酶和蛋白酶活性峰值出现在发酵降温阶段[3],表明木质纤维素和蛋白质的分解主要是在发酵后期发生,因此T2 vs T1和T3 vs T2时糖类及其衍生物和氨基酸、肽类及其类似物相对含量显著下降。这可能是因为发酵前期(T2和T3)微生物代谢旺盛,需要大量的糖类和氨基酸以满足其生长和繁殖所需,导致T2和T3时发酵料中的糖类和氨基酸含量均较发酵前一时期(T1和T2)有所下降;到发酵后期(T4和T5),木质纤维素降解酶和蛋白酶活性大幅升高,大量木质纤维素和蛋白质被降解生成低分子糖、肽类和氨基酸,因而其含量均比发酵前一时期(T3和T4)有所增加。发酵料中的Actinobacteria、Thermus和Bacillus属的微生物具有产生抑菌物质的能力[18]。发酵料中的抑菌物质含量随发酵进程逐渐增加,为后期平菇开放式接种创造了良好的条件。这与笔者前期研究结果一致,随着发酵时间的延长,发酵料浸提液对青霉和木霉的抑制作用也随之增强[19]。维生素可以作为辅酶因子参与多种重要的生化反应,是生物不可或缺的生长因子。不同微生物之间可能凭借维生素的种间传递而建立相互作用关系,对微生物群落结构形成和功能发挥起着重要作用[20]。与抑菌物质含量变化趋势相似,发酵培养料中的维生素含量也较发酵前一时期有所增加。在自然界中,木质纤维素可以被微生物分解成低分子的芳香族化合物,如水杨酸、阿魏酸等[21-22]。与T1相比,T2时期发酵培养料中的苯丙素类和聚酮类物质相对含量明显下降,这可能是因为微生物优先利用易降解的低分子物质,而T3、T4和T5时的苯丙素类和聚酮类物质相对含量分别比发酵前一时期有所增加,随着发酵的继续,玉米芯中易于降解的物质被利用完,微生物开始降解复杂高分子物质如木质素和酚类物质,进而生成了较多的低分子苯丙素类和聚酮类物质。研究表明,植物生长调节剂如吲哚乙酸、赤霉素、脱落酸可以促进平菇菌丝的生长[23-24]。笔者前期研究发现,T5时期发酵培养料浸提液对平菇菌丝生长促进作用最为明显,尤其是体积分数为80%时,平菇菌丝生长速度和生物量分别比对照增加0.53 cm·d-1和0.179 g[25]。这可能与发酵培养料中的植物生长调节剂如脱落酸、吲哚-3-乙酸和赤霉素的相对含量均在发酵后期达到最高值有关。
综上所述,不同发酵时期的玉米芯培养料中的微生物代谢产物具有明显的差异,并且其中含有丰富的抑菌物质和植物生长调节剂。该研究为平菇栽培获得稳定的发酵料质量提供了科学依据和理论基础。
参考文献
[1] NAM W L,SU M H,PHANG X Y,et al.Production of bio-fertilizer from microwave vacuum pyrolysis of palm kernel shell for cultivation of Oyster mushroom(Pleurotus ostreatus)[J].Science of The Total Environment,2018,624:9-16.
[2] JAYASINGHEARACHCHI H S,SENEVIRATNE G.Can mushrooms fix atmospheric nitrogen[J].Journal of Biosciences,2004 29(3):293-296.
[3] KONG W L,SUN B,ZHANG J Y,et al.Metagenomic analysis revealed the succession of microbiota and metabolic function in corncob composting for preparation of cultivation medium for Pleurotus ostreatus[J].Bioresource Technology,2020,306:123156.
[4] 戴玉成,杨祝良.中国药用真菌名录及部分名称的修订[J].菌物学报,2008,27(6):801-824.
[5] S?NCHEZ C.Cultivation of Pleurotus ostreatus and other edible mushrooms[J].Applied Microbiology and Biotechnology,2010,85(5):1321-1337.
[6] HERN?NDEZ D,S?NCHEZ J E,YAMASAKI K.A simple procedure for preparing substrate for Pleurotus ostreatus cultivation[J].Bioresource Technology,2003,90(2):145-150.
[7] 余敏佳,宋婷婷,范丽军,等.培养料中玉米秸和玉米芯的不同颗粒度对栽培双孢蘑菇效应[J].食药用菌,2018,26(5):289-293.
[8] 李秋月,冯占,金宇昌,等.不同产地玉米芯的持水率及其相关性分析[J].食药用菌,2020,28(6):412-417.
[9] KONG Z J,WANG X Q,WANG M M,et al.Bacterial ecosystem functioning in organic matter biodegradation of different composting at the thermophilic phase[J].Bioresource Technology,2020,317:123990.
[10] CARRASCO J,PRESTON G M.Growing edible mushrooms:a conversation between bacteria and fungi[J].Environmental Microbiology,2020,22(3):858-872.
[11] 刘志强.平菇发酵料袋栽技术[J].现代农业科技,2019(24):58-59.
[12] 孔维丽,崔筱,袁瑞奇,等.河南省适宜发酵料栽培的平菇优良品种筛选[J].中国食用菌,2019,38(11):23-28.
[13] 闻亚美,邵欣欣,丁亚通,等.7种平菇发酵料生产拌料用杀菌剂药效对比及安全性评价[J].中国瓜菜,2020,33(8):49-52.
[14] 雷露,吴天祥,王川南.基于UPLC-QTOF-MS代谢组学研究灰树花发酵的代谢差异[J].菌物学报,2020,39(10):1920-1932.
[15] BOLTEN C J,KIEFER P,LETISSE F,et al.Sampling for metabolome analysis of microorganisms [J].Analytical of Chemistry,2007,79(10):3843-3849.
[16] 尉杰,赵铖,陆瑞利,等.菌物研究中的代谢组学应用及存在的问题[J].菌物研究,2020,DOI:10.13341/j.jfr.2020.0003.
[17] 張萌,罗芳,王敏,等.奶牛分娩后早期血浆代谢物变化研究[J].生物技术通报,2020,36(6):191-199.
[18] ZHANG X,ZHONG Y,YANG S,et al.Diversity and dynamics of the microbial community on decomposing wheat straw during mushroom compost production[J].Bioresource Technology,2014,170:183-195.
[19] 崔筱,刘芹,丁亚通,等.平菇培养料发酵后对霉菌抑制作用机理研究[J].河南农业科学,2021,50(3):109-116.
[20] 葛磊鑫.基于B族维生素合成与利用特征的湖泊微生物种间关系分析[D].武汉:华中师范大学,2019.
[21] 欧阳光察,薛应龙.植物苯丙烷类代谢的生理意义及其调控[J].植物生理学通讯,1988,9(3):9-16.
[22] 王强.降解木质纤维素的侧耳属菌株的筛选及酶学特性研究[D].河北邯郸:河北工程大学,2019.
[23] 吴亚召,李峻志,李安利,等.脱落酸在平菇生产中的应用研究[J].中国食用菌,2011,30(4):36-37.
[24] 李辉,张志强,田昊.植物生长调节剂对平菇菌丝生长的影响[J].北方园艺,2013(23):158-160.
[25] 胡素娟,宋凯博,刘芹,等.玉米芯发酵料水浸提液促平菇菌丝生长的机理研究[J].河南农业大学学报,2021,https://doi.org/10.16445/j.cnki.1000-2340.20210323.001.