‘砀山酥梨’黄化叶复绿过程中内源IAA含量及其信号转导基因的表达量分析
2021-05-25郭国凌董炜昱张舒琴
贾 兵,郭国凌,余 桃,董炜昱,张舒琴,陈 猛,刘 莉
(安徽农业大学 园艺学院,合肥 230036)
中国是世界上梨栽培面积最大的国家,2017年梨树栽培总面积达96万hm2左右,总产量约1 653万t,分别占世界总面积和总产量的69.1%和68.4%[1]。‘砀山酥梨’具有适应性好、抗逆性强、产量高、耐粗放管理等优点,分布广泛,成为中国栽培面积最大的梨品种。黄河故道地区是中国梨主产区之一,其主栽品种‘砀山酥梨’缺铁黄化现象严重,制约着当地梨产业的发展。
吲哚乙酸(IAA)合成于植物幼嫩组织,参与包括植物衰老阶段的叶片黄化及叶内叶绿素的降解等在内的多种生理过程调控[2-3]。研究表明,内源IAA含量与叶片黄化密切相关。叶片内轭合态IAA含量大幅度提升,是早衰突变体psf衰老进程加快的一个重要生理特征[4]。竹子及水稻的相继研究证实,IAA在叶片衰老过程中,含量显著下降,且伴随着叶绿素的加剧降解,从而造成叶片黄化而脱落[5-6]。细胞分裂素类似物——N-苯基-N′-(2-氯-4-吡啶基)脲(4PU-30)处理水稻后能显著抑制叶内IAA含量的减少,延缓叶片的衰老[7];0.4%和0.6%高盐浓度处理均在导致水红三角梅多数叶片黄化而脱落的同时,也显著降低了其叶内IAA含量,而盐浓度越高,叶片黄化越严重,IAA含量越少,即IAA对叶片黄化及叶绿素降解具有抑制作用[8]。‘砀山酥梨’正常叶内IAA含量显著高于黄化叶,且缺铁黄化程度越深,其叶片内源IAA含量越低[9]。上述结果均说明,高IAA含量有利于叶片持绿。
IAA信号转导主要是通过细胞核中的TIR1-AUX/IAAs-ARFs通路进行。首先,位于细胞膜上的AUX1共转运体负责将活性IAA从细胞外运输到细胞内,并进一步与F-Box蛋白-TIR1(transport inhibitor response1)偶联,F-Box可与Cullin-like蛋白CUL1相互作用形成泛素连接酶(E3)复合物SCFTIR1,以调节转录抑制因子Aux/IAA蛋白(auxin/indole-3-acetic acid)的泛素降解,并将ARF(auxin response factors)从AUX/IAA-ARF二聚体中释放[10]。最后,ARF的转录激活将间接激活IAA初级响应基因AUX/IAA、GH3(gretchen hagen3)和SAUR(small auxin up RNA)3个主要家族的表达。在其共同作用下,植物体内IAA水平处于动态平衡状态。因此,AUX/IAA蛋白的降解和ARF蛋白的激活可引起强烈的IAA信号[11],进而影响细胞增大和植物生长,生长素信号转导途径如图1所示。
本实验室前期研究表明,叶面喷施一定浓度的FeSO4溶液,可诱导‘砀山酥梨’黄化叶复绿,其中以浓度0.2%效果最佳。迄今,国内外关于外源FeSO4诱导梨树黄化叶复绿的机理鲜见系统性研究。本试验以‘砀山酥梨’正常植株和缺铁黄化植株为试验材料,经黄化叶片叶面喷施0.2% FeSO4,观察其对黄化叶片的复绿效应,并通过测定叶片中Fe2+含量、内源IAA含量及其信号转导基因的相对表达量,试图揭示施用外源FeSO4对‘砀山酥梨’黄化叶复绿的效应及其机制。
1 材料和方法
1.1 试验材料及处理
试验于2020年5月进行,以安徽省砀山县园艺场15年生‘砀山酥梨’缺铁黄化植株与正常植株为试材,它们立地条件与栽培管理水平一致。于黄化梨树生长期全树叶面喷施浓度为0.2%的FeSO4溶液10 L,对照为喷施清水的正常植株叶片(CN)和黄化植株叶片(CC),共计3个处理,每个处理3株树,重复3次,共计27株。分别于FeSO4溶液处理前取对照正常叶片和黄化叶片叶样,于处理后第3、6、9 和12天取处理叶片样品(分别简称为CN、CC、T3 d、T6 d、T9 d、T12 d),于-80 ℃保存备用。
1.2 内源激素含量和Fe2+含量的测定
采用稀盐酸浸提法和邻菲罗啉比色法,测定叶片中Fe2+含量[12],采用ELISA(Enzyme-Linked Immunosorbent Assay,ELISA)酶联免疫法,测定叶片中IAA含量[13]。
1.3 总RNA的提取以及cDNA合成
RNA提取使用RN53-EASYspin Plus多糖多酚RNA快速提取试剂盒,合成cDNA采用PC54-TRUEscript RT kit (+gDNA Eraser) 反转录试剂盒(试剂盒均购自北京艾德莱生物科技有限公司。
1.4 实时荧光定量PCR
从梨基因组数据库中以及NCBI查询、获得了IAA信号转导相关基因的全长序列,并根据获得的序列使用Primer Premier 5.0软件设计实时荧光定量PCR(Quantitative Real-time PCR,qRT-PCR)引物(表1),扩增反应于ABI STEP-ONE(Thermal)荧光定量PCR仪上进行。反应总体系20 μL,包括上海东洋纺生物科技有限公司SYBR®Green Real-time PCR Master Mix 10 μL,模板cDNA 2 μL、正向引物和反向引物各0.8 μL、6.4 μL DEPC。反应程序为95 ℃预变性30 s,95 ℃变性5 s,60 ℃退火30 s,共40个循环,每个样品3次重复。以梨GAPDH基因作为内参,使用2-ΔΔCT法求待测样品基因相对表达量[14]。

表1 实时荧光定量PCR引物序列Table 1 The primers for qRT-PCR
1.5 数据分析
数据运用单因素方差分析(ANOVA)的方法,以Duncan多重极差法进行各处理的平均值检验,并以Excel 2019、GraphPad Prism 8和SPSS 23软件(SPSS Inc.,Chicago,IL,USA)在P<0.05 的水平上计算最小显著性差异(LSD)值,分析各处理间的差异显著性;关联性分析运用双变量分析的方法,以均值与标准差于P<0.05水平上进行双侧检验。
2 结果与分析
2.1 FeSO4处理对黄化叶片复绿的效应
‘砀山酥梨’黄化植株叶面喷施FeSO4溶液后,其叶片复绿情况如图2所示。其中,处理后第3天(T3 d),黄化叶出现不规则的复绿斑点;处理后第6天(T6 d),黄化叶复绿现象明显,叶面形成较多不规则复绿斑块;处理后第9天(T9 d),叶面出现大面积复绿,叶身留有少量没有复绿的不规则黄色斑块;处理后第12天(T12 d),黄化叶出现整叶复绿,但较对照组正常叶片相比,叶色不够浓绿并伴有不规则的黄色斑点。
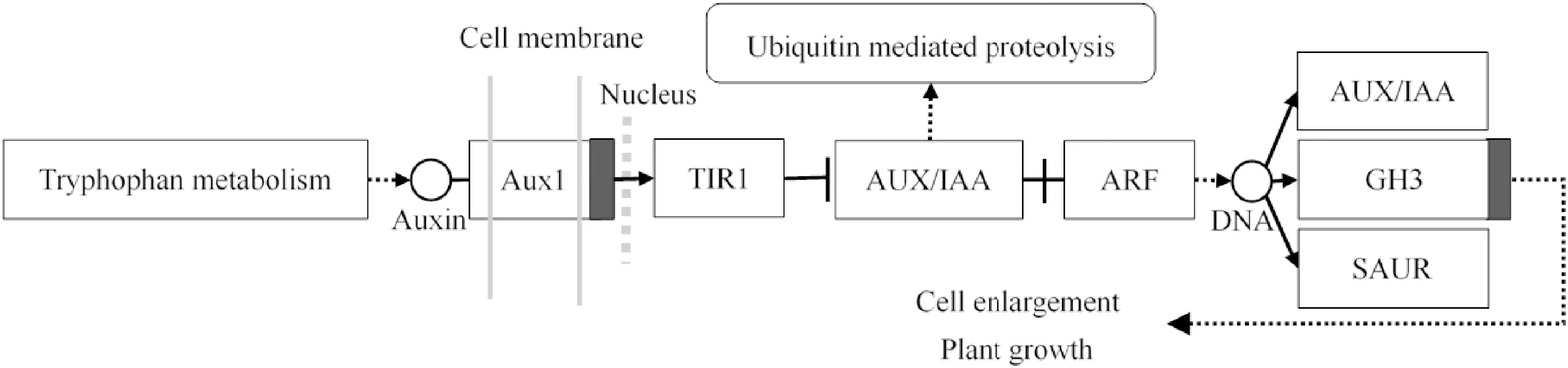
AUX1.生长素膜转运蛋白;TIR1.生长素受体蛋白;AUX/IAA.生长素/吲哚乙酸蛋白;ARF.生长素响应因子;GH3.生长素早期响应基因家族;SAUR.生长素早期响应基因家族图1 生长素信号转导途径示意图AUX1.Auxin influx transporter 1;TIR1.Transport inhibitor response gene 1;AUX/IAA.Auxin/indole-3-acetic acid protein in early auxin-response;ARF.Auxin response factor;GH3.Gretchen Hagen3 in early auxin-response;SAUR.Small auxin up RNA in early auxin-responseFig.1 Diagram of IAA transduction pathway
2.2 FeSO4处理对叶内Fe2+和IAA含量的影响
图3显示,对照组正常叶(CN)Fe2+含量显著高于黄化叶(CC),显著增加33.2%;FeSO4处理黄化叶后第3、6、9、12天,其叶片(T3 d、T6 d、T9 d、T12 d)Fe2+含量表现出逐渐增加趋势,且均显著高于CC和CN,较CC显著增加49.9%~93.8%(图3,A)。同时,叶片的IAA含量也以CC叶最低,CN叶显著高于CC叶,增幅为26.7%;FeSO4处理黄化叶(T3 d~T12 d)IAA含量均显著高于CN和CC,较CC显著增加60.0%~142.9%;在FeSO4处理组,T6 d和T9 d叶内IAA含量显著高于T3 d和T12 d,T6 d又较T9 d显著升高,而T3 d和T12 d之间无显著差异(图3,B)。因此,‘砀山酥梨’正常叶内Fe2+、IAA含量均显著高于黄化叶;较对照组黄化叶而言,外源FeSO4处理显著提高了复绿叶内Fe2+及IAA含量,且较正常叶也显著增加。

CN和CC 分别表示叶面喷施清水的正常叶和黄化叶(对照);T3 d、T6 d、T9 d、T12 d 分别表示叶面喷施0.2% FeSO4后第3、6、9和12 天的黄化叶(转绿叶);下同图2 ‘砀山酥梨’叶面喷施FeSO4后黄化叶片的复绿情况CN and CC indicate normal and chlorotic leaves (control) treated with distilled water,respectively;T3 d,T6 d,T9 d and T12 d indicate chlorotic leaves (converting to retrieved green) at the 3rd,6th,9th and 12th day after spraying 0.2% FeSO4,respectively;the same belowFig.2 Retrieved green performance of ‘Dangshansuli’ chlorotic leaves sprayed with FeSO4 solution

图3 FeSO4处理黄化叶内Fe2+和内源IAA含量的变化Fig.3 The endogenous IAA and Fe2+ contents in leaves with FeSO4 application
2.3 FeSO4处理对黄化叶内IAA信号转导基因表达的影响
首先,生长素膜上转运蛋白基因AUX1.1/1.2/1.3表达量在对照组均表现为黄化叶(CC)显著高于正常叶(CN)。在FeSO4处理组中,转绿叶AUX1.1表达量表现为逐渐增加趋势,其中T3 d、T6 d比CC显著降低,T9 d比CC稍高,T12 d比CC显著增加;转绿叶AUX1.2/1.3表达量表现为先增加后降低趋势,并均在T9 d中最高;AUX1.2表达量表现为T3 d比CC显著降低,T6 d比CC稍高,T9 d和T12 d均较CC显著增加;AUX1.3表达量则为T3 d~T12 d均不同程度地低于CC,但仅T3 d和T6 d降幅达到显著水平(图4,A)。受体蛋白基因TIR1.1/1.2/1.3表达量在对照组均表现为CC不同程度低于CN,但TIR1.1/1.2下降显著。在FeSO4处理组,各基因表达量均随着处理时间先升后降,并均在T6 d中达到最大值,且均在T3 d~T9 d中高于CC,在T12 d低于CC;其中,仅TIR1.1在T3 d~T9 d,TIR1.2在T6 d、T12 d,以及TIR1.3在T12 d中达显著差异性水平,各基因在其他各时期表达量均与CC无显著性差异(图4,A)。
其次,SAUR1/2/3/4表达量在对照组内均表现为黄化叶CC显著高于正常叶CN,且SAUR4表现最为突出。在FeSO4处理组内,各基因表达量随处理时间都先降后升,其表达量均显著低于相应的黄化叶CC,且均在T6 d叶达到最低值且与其他处理差异显著,在T3 d、T9 d叶居中,在T12 d叶中达到最大值并显著高于T9 d;其中,SAUR1/2/3/4基因在T12 d叶中表达量均显著高于正常叶片CN(图4,B)。
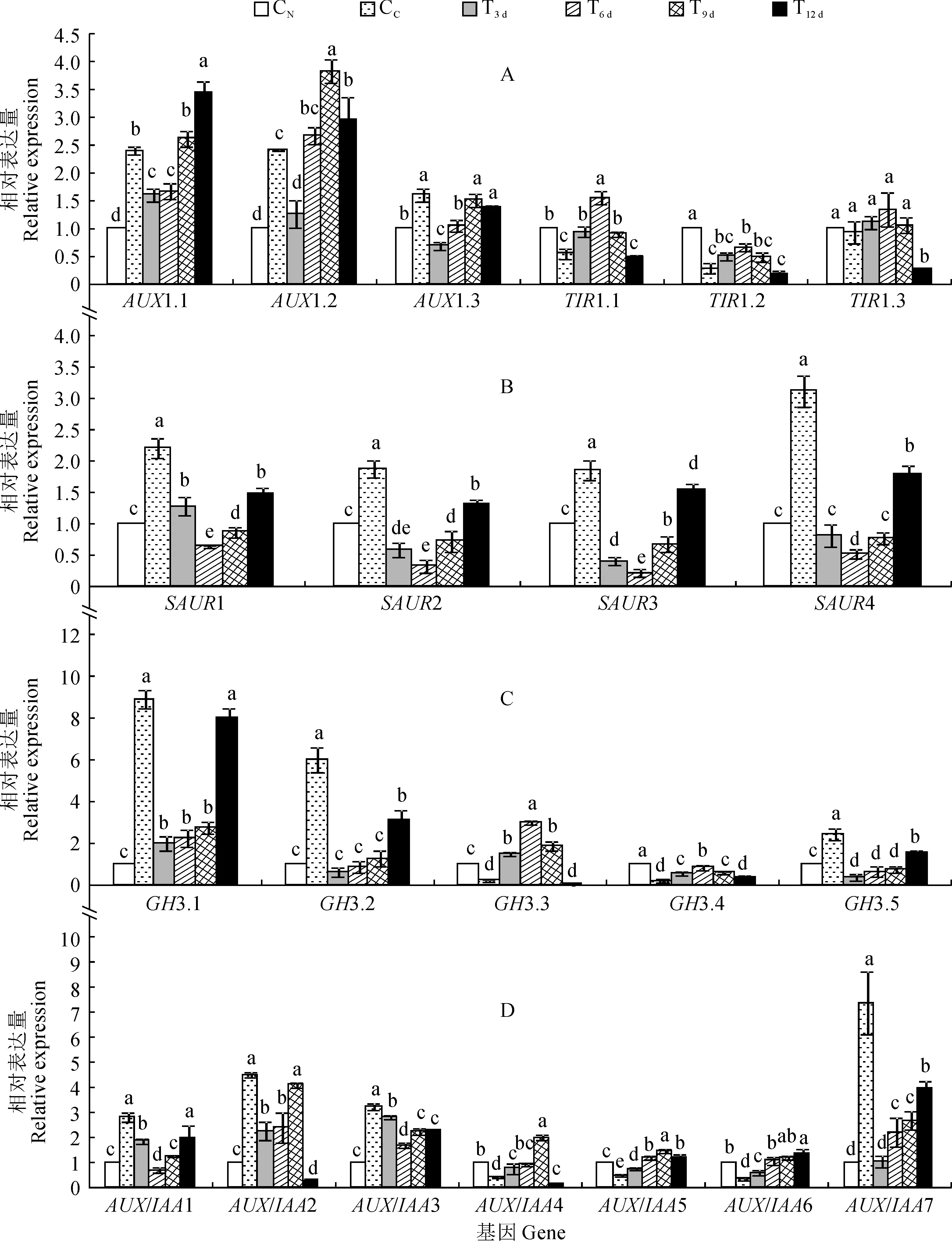
图4 FeSO4处理下黄化叶片IAA信号转导相关基因表达的变化Fig.4 The expression variation of IAA signaling genes in chlorotic leaves sprayed with FeSO4
再次,GH3.1/3.2/3.5表达量对照组内均表现为黄化叶CC显著高于正常叶CN,GH3.3/3.4的表达量则表现相反,CC均显著低于CN。在FeSO4处理组内,GH3.1/3.2/3.5表达量均随处理时间而增加,且T12 d显著高于其余处理时期。但各基因表达量在各时期大多较CC显著下降;GH3.3/3.4的表达量均随处理时间而先升后降,并均在T6 d时达到最大值,且显著高于其余时期,而两基因在T3 d~T9 d的表达量均显著高于CC(图4,C)。
另外,AUX/IAA1/2/3/7表达量在对照组中均表现为黄化叶CC显著高于正常叶CN,而AUX/IAA4/5/6的表达量则表现为显著低于正常叶CN的相反趋势。在FeSO4处理组内,AUX/IAA3/7表达量在各处理时期均较CC显著下降;AUX/IAA1/2表达量分别在T12 d和T9 d中与黄化叶无显著性差异,其他时期均较黄化叶CC显著下降;AUX/IAA4/5/6的表达量各处理时期均较黄化叶CC显著增加,并于T9 d时达到甚至显著超出CN水平;且除T12 d叶片的AUX/IAA6表达量与T9 d无显著变化外,T12 d叶片的AUX/IAA4/5表达量都较T9 d显著下降(图4,D)。
因此,‘砀山酥梨’正常叶与黄化叶之间的AUX1.1/1.2/1.3、TIR1.1/1.2、SAUR1/2/3/4、GH3.1/3.2/3.3/3.4/3.5、AUX/IAA1/2/3/4/5/6基因表达量均存在显著差异。总体而言,FeSO4处理在处理后第6、9 天时促进了TIR1.1、GH3.3/3.4、AUX/IAA4/5/6基因的表达,而抑制了AUX1.1/1.3、SAUR1/2/3/4、GH3.1/3.2/3.5、AUX/IAA1/3/7基因的表达。
2.4 FeSO4处理对黄化叶内IAA响应因子ARFs表达的影响
首先,IAA响应因子ARF1/2/11/12/13/14的表达量在对照组均表现为黄化叶CC显著高于正常叶CN(图5)。在FeSO4处理组内,ARF1/2表达量在T3d~T12d叶中均较黄化叶CC显著下降。ARF2表达量在各时期叶片之间无显著差异性,ARF1表达量则表现为T12 d>T6 d>T9 d>T3 d叶片,除后两者外各处理时期间均差异显著。与CC相比,ARF11/14表达量均在T3 d叶中无显著变化,而在T6 d~T12 d叶中显著降低,且T9 d叶又显著高于T6 d和T12 d叶。ARF12/13表达量在各处理时期均比黄化叶CC不同程度降低,且除T6 d叶外降幅均达到显著水平,在其余时期表现为T9 d>T3 d>T12 d,且三者之间均差异显著。
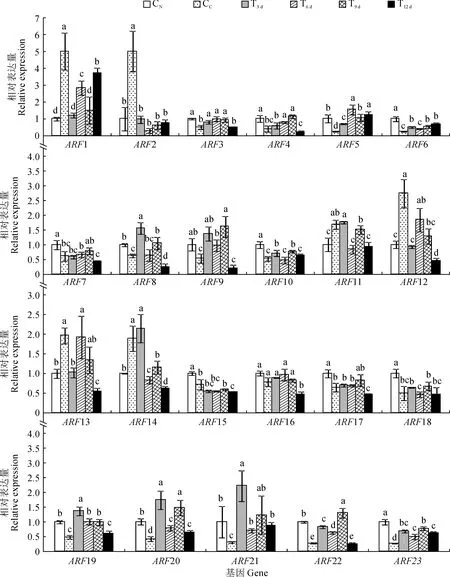
图5 FeSO4处理下黄化叶片ARFs基因表达量的变化Fig.5 The ARFs gene expression variation in chlorotic leaves sprayed with FeSO4
其次,IAA响应因子ARF3/4/5/6/7/8/9/10/15/17/18/19/20/21/22/23的表达量在对照组中均表现为黄化叶CC显著低于正常叶CN(图5)。在FeSO4处理组内,ARF7/18表达量在T3 d~T12 d叶中均与CC无显著性差异,ARF15/17表达量也在T3 d~T9 d叶中与叶CC均无显著性差异,但在T12 d叶中均较CC显著下降;ARF5/6/20/21/23表达量在T3 d~T12 d叶中均较CC显著增加;ARF3/9/19/22表达量在T3 d~T9 d叶中均较CC显著增加,而在T12 d叶中较T9 d叶显著下降,且与CC无显著性差异;ARF4表达量在T6 d和T9 d叶显著高于CC,而T3 d和T12 d叶与黄化叶无显著差异;ARF8表达量在T3 d和T9 d叶显著高于黄化叶,在T6 d叶中与黄化叶无显著差异,在T12 d叶中显著低于黄化叶;ARF10表达量仅在T9 d叶中显著高于黄化叶,在其余时期叶中均与黄化叶无显著差异。
另外,与前两类基因不同,ARF16表达量在正常叶CN与黄化叶CC之间并无显著性差异,且在FeSO4处理的T3 d~T9 d叶表达量并无显著性差异,且与CN、CC之间无显著变化,但T12 d叶表达量较其他时期及对照均显著下降。
因此,‘砀山酥梨’正常、黄化叶ARF基因表达量存在显著差异,且外源FeSO4处理显著促进了ARF3/5/6/9/19/20/21/22/23的表达,而抑制了ARF1/2的表达。
2.5 黄化叶片IAA含量与其信号转导基因表达量的相关性分析
‘砀山酥梨’黄化叶片Fe2+含量、IAA含量及其信号转导基因表达量之间相关性分析结果(图6)表明:一方面,FeSO4处理组转绿叶内的Fe2+含量较黄化叶CC和正常叶CN显著增加,从而诱导有相互促进作用的2个基因AUX/IAA5、AUX/IAA6 的表达;AUX/IAA5基因表达量的显著增加进一步显著上调了ARF5基因的表达,而AUX/IAA6表达量的增加则在上调ARF5表达的同时,抑制了ARF14基因的表达;在ARF5表达显著上调之后,AUX/IAA1、ARF2、ARF11、ARF14、SAUR1等5个基因的表达量反而显著下降。

红线表示显著正相关,黑线代表显著负相关,横线上数字代表两者之间在P<0.05水平上的相关系数,下同图6 ‘砀山酥梨’叶片Fe2+含量、IAA含量及其信号转导基因表达量间相关性分析结果示意简图Red lines indicate significant positive correlation,while black lines indicate significant negative correlation.The numbers above the lines represent the correlation coefficient between each other at P<0.05 level;the same as belowFig.6 Schematic diagram of correlation analysis among Fe2+ content,IAA content and its signaling genes expression level
另一方面,FeSO4处理组转绿叶内的IAA含量较黄化叶CC和正常叶CN显著增加,可能与其叶内显著上调的GH3.3、显著下调的SAUR1、SAUR2基因表达量密切相关。就GH3.3而言,其表达在受到TIR1.1的正反馈调节的同时,也受到SAUR1/2/3基因的负反馈调节。
此外,SAUR1基因表达量显著下降可能与ARF5基因的上调表达及AUX/IAA1的下调表达相关;而SAUR2基因表达量显著下调也与AUX/IAA1下调有关,同时也与TIR1.1的显著上调相关;其中,SAUR1与SAUR2存在着相互促进的作用。
因此,外源FeSO4可显著增加处理黄化叶内(转绿叶)Fe2+含量,并影响IAA的转导,间接影响IAA代谢,造成其叶内IAA含量的显著上升。其简要作用途径可分为3种:Ⅰ)Fe2+→AUX/IAA5、AUX/IAA6→(ARF14)→ARF5→SAUR1→IAA;Ⅱ)Fe2+→AUX/IAA5、AUX/IAA6→(ARF14)→ARF5→AUX/IAA1→SAUR2→IAA;Ⅲ)Fe2+→AUX/IAA5、AUX/IAA6→(ARF14)→ARF5→AUX/IAA1→TIR1.1→GH3.3→IAA,其作用简图如图7所示。
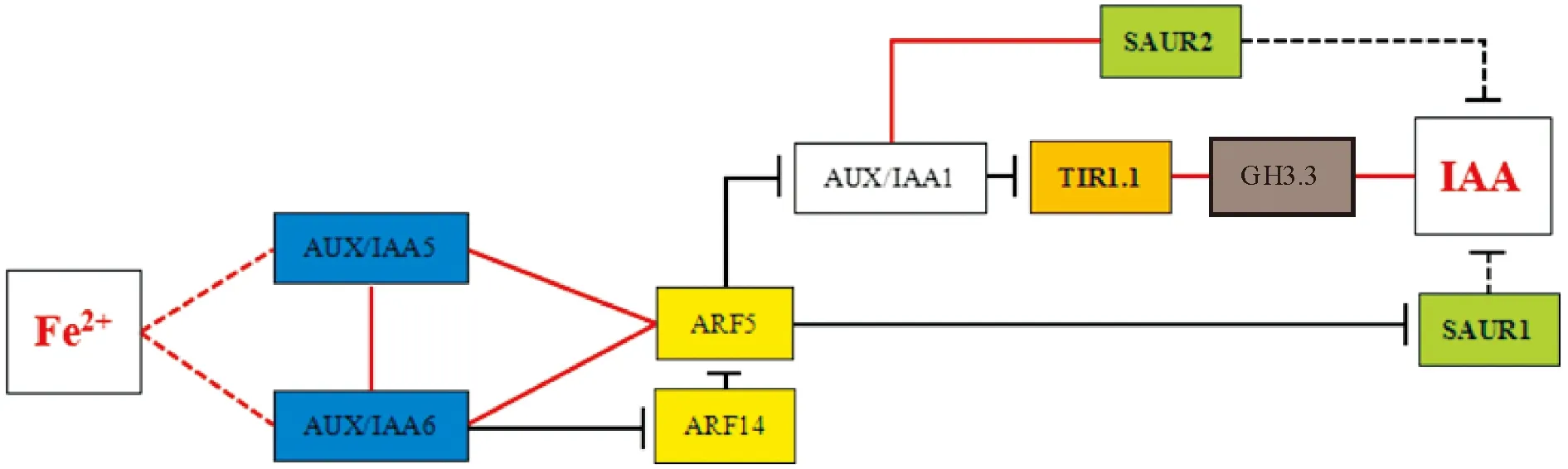
图7 Fe2+含量与IAA含量及其信号转导基因表达量的相关性作用示意简图Fig.7 Schematic sketch of the relevance between Fe2+ content with IAA content and its signaling genes expression
3 讨 论
Fe是植物体内重要的微量元素之一,影响着叶绿素分子组成成分卟啉的合成,从而参与叶绿素的合成,缺铁易导致植物黄化[15]。研究指出,叶面喷施低浓度铁肥可改善果树体内Fe2+含量,改善其失绿症[16];外源Fe2+处理也可使受缺铁胁迫的沙梨上部黄化叶片显著复绿,其叶绿素含量显著提升,转色延缓[17]。说明外源Fe2+处理利于植株叶内Fe2+积累,并诱导黄化叶复绿。本试验中,叶面喷施FeSO4可诱导‘砀山酥梨’黄化叶出现复绿斑块,甚至整叶复绿,与前人相关研究相符。另外,酸性溶液(pH=6.0)处理能延缓正常银杏叶片的转色[18],FeSO4也属于弱酸物质,这也可能是使‘砀山酥梨’黄化叶复绿的原因之一。
同时,本试验结果表明,‘砀山酥梨’正常叶内IAA含量显著高于黄化叶,FeSO4处理显著提高了黄化叶内IAA含量,说明FeSO4处理促进了IAA的合成。已有研究表明,正常叶内IAA含量显著高于黄化叶,且缺铁黄化程度越深,其叶内IAA含量越低[17],因此,高IAA含量利于叶片持绿。此外,6-BA处理能显著增加切花菊‘优香’叶内IAA含量,延缓叶绿素的降解,推迟叶片黄化[18],且在甘薯幼苗内IAA氧化酶活性提高的同时,其叶绿素含量也减少[19],说明IAA可抑制叶绿素降解。本试验研究结果均与之相符。但迄今关于FeSO4诱导IAA含量变化的作用机制未见报道。
前人研究指出,槟榔正常叶和黄化叶转录组显示的差异基因主要富集在激素信号转导等途径中,黄化叶中IAA信号转导相关的AsSAUR基因表达量显著上调,而AsAUX1、AsTIR1、AsARF基因表达量均显著下调[20];绝大多数IAA信号转导相关基因表达量在银杏叶片黄化过程中也显著下降[21]。说明IAA信号转导在叶片持绿过程中具有重要作用,且AsSAUR可能参与促进了叶片黄化症的形成,而AsAUX1、AsTIR1、AsARF在叶片黄化调控过程中的功能则与AsSAUR相反。在本试验中,‘砀山酥梨’对照组黄化叶内AUX1.1、AUX1.2表达量均显著高于正常叶,该结果可能是叶片的黄化应激所致;在FeSO4处理后第3天,这些基因表达量均较黄化叶显著下降,而处理后第9天显著增加而高于正常叶,处理后第12天较黄化叶显著增长,均与前期AUX1可促进叶片持绿的相关研究结果相符。同时,本研究中‘砀山酥梨’对照组黄化叶内受体蛋白基因TIR1.1/1.2表达量均显著低于正常叶片,而在FeSO4处理后第3、6、9天表达量显著增加。说明IAA含量及其转运体的显著增加促进了TIR1表达量的显著增加,增强了IAA效应,并进一步参与调控叶内叶绿素合成及‘砀山酥梨’的黄化复绿过程。即TIR1对于叶片的黄化复绿过程起正向调控作用,这与前人研究结果相符。
另据报道,过表达AtSAUR36加快了拟南芥叶片的衰老[22],且水稻老叶中OsSAUR39表达量较幼嫩组织高,其过表达水稻株系内的IAA含量减少,花青素、叶绿素含量降低,叶片提前衰老[23],说明SAUR与叶绿素降解及叶片衰老正相关。在本试验中,‘砀山酥梨’对照组黄化叶内SAUR1/2/3/4表达量均较正常叶显著升高,而FeSO4处理后各时期表达量均较黄化叶显著下降。说明高表达的SAUR可能是黄化叶形成的重要原因,而FeSO4处理所诱导的SAUR表达量显著下降是调控黄化叶复绿的重要因素,这与前人相关研究结果相符。
已有研究表明,茉莉酸(jasmonic acid,JA)能抑制FIT、bHLH38/39/100/101、IRT1和FRO2基因的表达,使拟南芥缺铁胁迫更加严重,黄化现象加剧[24];而施用JA或水杨酸(salicylic acid,SA)可促进叶片黄化基因及早衰基因的表达,使野生型拟南芥黄化而早衰[25-26]。说明JA与SA参与应答叶片黄化过程。而GH3基因家族可编码一类酰酸酰胺合成酶,促使氨基酸与JA和SA结合,并改变其生物活性[27]。本研究结果表明,‘砀山酥梨’对照组黄化叶内GH3.1/3.2/3.5表达量均显著高于正常叶;GH3.1/3.2/3.5表达量在FeSO4处理后第3、6、9 天均较黄化叶显著下降。由此说明GH3可能通过JA、SA信号途径而介导叶片的黄化复绿,但其功能具有冗杂性。
另一方面,本研究中‘砀山酥梨’对照组黄化叶中AUX/IAA1/2/3/7表达量均显著高于正常叶,AUX/IAA4/5/6的表达量显著低于正常叶;而FeSO4处理叶片AUX/IAA1/3/7表达量较黄化叶显著下降,AUX/IAA5/6表达量则较黄化叶显著增加。缺铁黄化症最先产生于幼叶,而相关研究也指出,PoptrAUX/IAA16.3/16.4基因仅在幼叶中表达,且幼叶中的PoptrAUX/IAAs表达量也显著高于成熟叶[28],这与本试验中黄化叶内AUX/IAA1/2/3的高表达现象相符,同时说明幼叶AUX/IAA的高表达可能是引起其缺铁的重要因素。
与GH3、AUX/IAA基因家族功能类似,ARF对于‘砀山酥梨’黄化复绿的作用也具有冗余性。已有研究表明,外源IAA处理可上调SlARF1/2/3/4/7/8.1/9/12/13/13.1/14/17的表达而抑制番茄花柄外植体的萎黄而脱落,但SlARF5/6/8/10/11/16/19却在黄化、脱落花柄中显著上调;然而,番茄SlARF2-RNAi植株叶片叶色鲜绿,与野生型在老化时大规模快速萎黄死亡相比,SlARF2-RNAi延缓了叶片老化,并抑制了促衰老基因SENU1和SENU5的表达[29];在拟南芥衰老叶片中,AtARF2/7/19的表达显著增加,叶绿素含量显著下降,而arf2突变体叶片衰老延迟,叶绿素降解过程减缓[30]即ARF对叶片叶绿素降解和黄化也起着重要调控作用。在本试验中,‘砀山酥梨’对照组黄化叶内ARF3/4/5/6/7/8/9/10/15/17/18/19/20/21/22/23表达量显著低于正常叶,其中的ARF3/5/6/9/10/19/20/21/22/23表达量在FeSO4处理后第3、6、9 天均较黄化叶显著增加。由此说明ARF3/5/6/9/10/19/20/21/22/23功能可能与SlARF1/2/3/4/7/8.1等基因功能相似,对叶片叶绿素降解及叶片黄化具有抑制作用。而较正常叶而言,‘砀山酥梨’黄化叶内ARF1/2/11/12/13/14表达量显著增加,再综合这些基因表达量在FeSO4处理后的变化规律来看,ARF1/2/11/12/13/14可能与AtARF2/7/19功能相似,起着降解叶内叶绿素及促进叶片黄化的作用。
综上所述,‘砀山酥梨’正常叶、黄化叶内Fe2+含量、IAA含量及其信号传导基因表达量存在显著差异;FeSO4处理在诱导黄化叶复绿的同时,也显著增加了叶内Fe2+含量及IAA含量。而IAA含量的增加可能与黄化叶复绿过程中Fe2+含量显著增加,从而显著增强IAA信号转导基因AUX1.2/1.3、TIR1.1/1.2、GH3.3/3.4、AUX/IAA4/5/6和ARF3/5/6/9/10/19/20/21/22/23的表达量相关,也与显著减少的GH3.1/3.2/3.5、AUX/IAA1/3/7、SAUR1/2/3/4以及ARF1/2表达量相关,且进一步的相关性分析结果表明了这些基因之间可能存在相互作用途径。叶片Fe2+含量的增加可促进AUX/IAA5、AUX/IAA6的表达,从而上调ARF5表达,而造成SAUR1、AUX/IAA1的表达抑制,因此SAUR2表达量下降,TIR1、GH3.3表达量上升,造成IAA含量显著增加,其简要作用途径可表示为Fe2+→AUX/IAA5、AUX/IAA6→(ARF14)→ARF5→SAUR1、AUX/IAA1→SAUR2/TIR1.1/GH3.3→IAA。本试验初步揭示了IAA及其信号转导与FeSO4所诱导的‘砀山酥梨’黄化复绿过程存在一定联系。
