花器官液泡pH调控花色形成的研究进展
2021-05-14张盖天祁惠杨锁宁褚志云田甜袁素霞刘春
张盖天 祁惠 杨锁宁 褚志云 田甜 袁素霞 刘春
(中国农业科学院蔬菜花卉研究所,北京 100081)
观赏器官形状、色彩以及香气是开花植物吸引传粉动物、维持繁衍进化基石中最重要的几个因素[1]。花色的成因背景十分复杂,由显色物质、着色细胞生理环境、着色细胞形状与外界环境如光照、雄蕊完整性及授粉情况等因素共同决定,其中显色物质被认为是最重要的因素[2-3],因此有关花色研究的大部分内容主要集中在显色物质上[4-6]。显色物质主要有类胡萝卜素、类黄酮(包括花青素)等色素及金属离子构成,其中色素,尤其是花青素是花和果实呈色的主要的显色物质[2]。花青素主要有6大种,分别为天竺葵素、矢车菊素、芍药花素、矮牵牛素、飞燕草素和锦葵花素,其中芍药素派生于矢车菊素,矮牵牛素与锦葵花素派生于飞燕草素。蓝花多含飞燕草素及其衍生物,红花往往含天竺葵素。花色苷修饰过程中,会先发生糖基化,后可在糖基化位点上经过酶促反应进一步酰基化,使花色苷本身更为稳定。此外,B-ring上羟基增多会使由花青素衍生出的色素颜色变蓝,而3′,5′羟基甲基化会使色素显红[7]。Noda等[8]进一步研究发现,在利用转基因技术培育蓝色菊花的过程中,在相同的遗传背景下,介导入相同的基因后,分别出现了紫罗兰色到蓝色的不同颜色的菊花,在蓝色的菊花中,飞燕草素-3′,5′-葡萄糖苷的占比要显著高于紫罗兰色的菊花。
花色苷单体在介质中会出现紫色而非蓝色,辅色素与花色苷形成共色素沉着后,能够维持显色物质结构稳定,可呈现出蓝色[9]。在体外模拟八仙花萼片成色实验中发现,不同辅色素在相同的溶液背景中,呈现出浅紫、深紫、蓝这3种不同的颜色[10],这说明不同辅色素结合其它色素物质后的成色并不相同。
部分植物金属离子可与沉着物螯合显示特异的颜色。部分粉色绣球花品种,在酸性土壤条件下施铝,萼片组织细胞就会吸收过量铝离子,为避免铝毒害,经铝调蛋白作用将铝离子转运至液泡内,铝离子在液泡内与共色素沉着物形成螯合物后,花瓣显现蓝色[11]。郁金香品种“Murasakizuisho”的花瓣基底部为蓝色,上半部为紫色,测定发现这两部分花色苷、辅色素、液泡pH均无显著性差异,但蓝色部分的Fe3+含量是紫色部分的25倍[12]。鸭跖草蓝花的色素物质,是由2个Mg2+结合6个飞燕草素花色苷、2个Mg2+结合6个类黄酮,而形成的的超分子配合物[13]。矢车菊兰花的色素类物质,是由1个Fe3+、1个Mg2+分别结合3个矢车菊花色苷、2个Ca2+分别结合3个芹黄素而形成的超分子配合物[14]。
液泡是由液泡膜包被的充满液体的区室,也是植物储存色素的器官,大而成熟的细胞中液泡体积占细胞体积的90%[15]。液泡内显色物质的稳定性及存在状态由着色细胞生理环境所决定[16]。研究表明,随着液泡pH的升高,部分植物花器官会出现由粉、红到紫、蓝的转变[17]。这种颜色变化现象的产生与花色苷类物质存在的状态密切相关,不同状态的花色苷类物质吸收光谱有不同的红移或蓝移效应[16]。
1 花器官液泡pH对花色的影响
在花青素类观赏植物中,显色物质组成相同,显色物质存在的状态不同,呈现的花色不同。保持这类植物显色物质稳定性的方式有花色苷的自缔合作用和花色苷与辅色素结合的共色素沉着作用。自缔合作用中多个花青素发色团叠加在同一个左旋轴上,不同角度的迁移导致分裂的圆偏光二色性曲线产生,即光谱有不同的红移或蓝移趋势[16](图1);共色素沉着是显色物质疏水堆积使结构稳定,对花色苷与辅色素浓度、种类有要求,即浓度越高,疏水力越强,显色物质越稳定,颜色可由红向蓝紫移动。这些全部依赖于一定的液泡pH,液泡pH改变时水合能力改变,着色物质为适应水合环境,调整自身使其稳定,颜色发生改变[10,18]。合适的花色苷与辅色素形成共色素沉着后,还可避免花色苷不稳定的无水碱基形成甲基醇从而不显色,且pH在3-6的区间内辅色素槲皮苷才能和花色苷、金属离子形成络合物[19]。
大豆紫花胞液pH为5.73-5.77,而蓝花胞液pH为6.07-6.10[20]。类似地,矮牵牛红色花花瓣匀浆pH在5.5左右,而紫色花瓣匀浆pH在6.0左右[21];飞燕草花瓣表皮组织在紫红色时pH为5.5,紫蓝色时pH为6.6[22]。另外,一些植物花瓣液泡的pH也显示出类似的变化趋势。日本牵牛从花蕾到绽放,花瓣液泡pH一直升高,花蕾时期紫红色的细胞液泡pH为6.6,而开花后蓝色细胞液泡的pH为7.7[23-24];同样,在八仙花上,用质子选择微电极精准测量着色细胞液泡,蓝色花的液泡pH均值为4.1,而红色花为3.3[25]。葡萄风信子的穗状花序上半部分为蓝色,下半部分为紫色,紫色部分的匀浆pH为5.84,蓝色部分为5.91[26]。葛根花序上同时有不同时间开放的花,新开的花为紫红色,pH为5.2,老花为紫罗兰色,pH为5.5[27]。
自然界中没有蓝色月季花,月季的DRF基因无法将二氢杨梅酮作为底物反应生成飞燕草素花色苷,致使无蓝色月季的诞生。研究人员在试验了多种月季品种后选择了辅色素含量和液泡pH均高的品种作为寄主,将三色堇的F3′5′H基因与荷兰鸢尾的DFR基因构建二元载体导入寄主,在月季DFR基因SiRNA表达的共同作用下,寄主花瓣最终呈现淡紫色。这对蓝色月季的培育具有里程碑式的意义[28]。由此可以得出结论,除飞燕草素花色苷外,较高的液泡pH与高含量的辅色素也是蓝色月季花形成必不可少的元素,这两个重要因子在在仙客来、菊花和康乃馨上同样有所印证[28-29]。
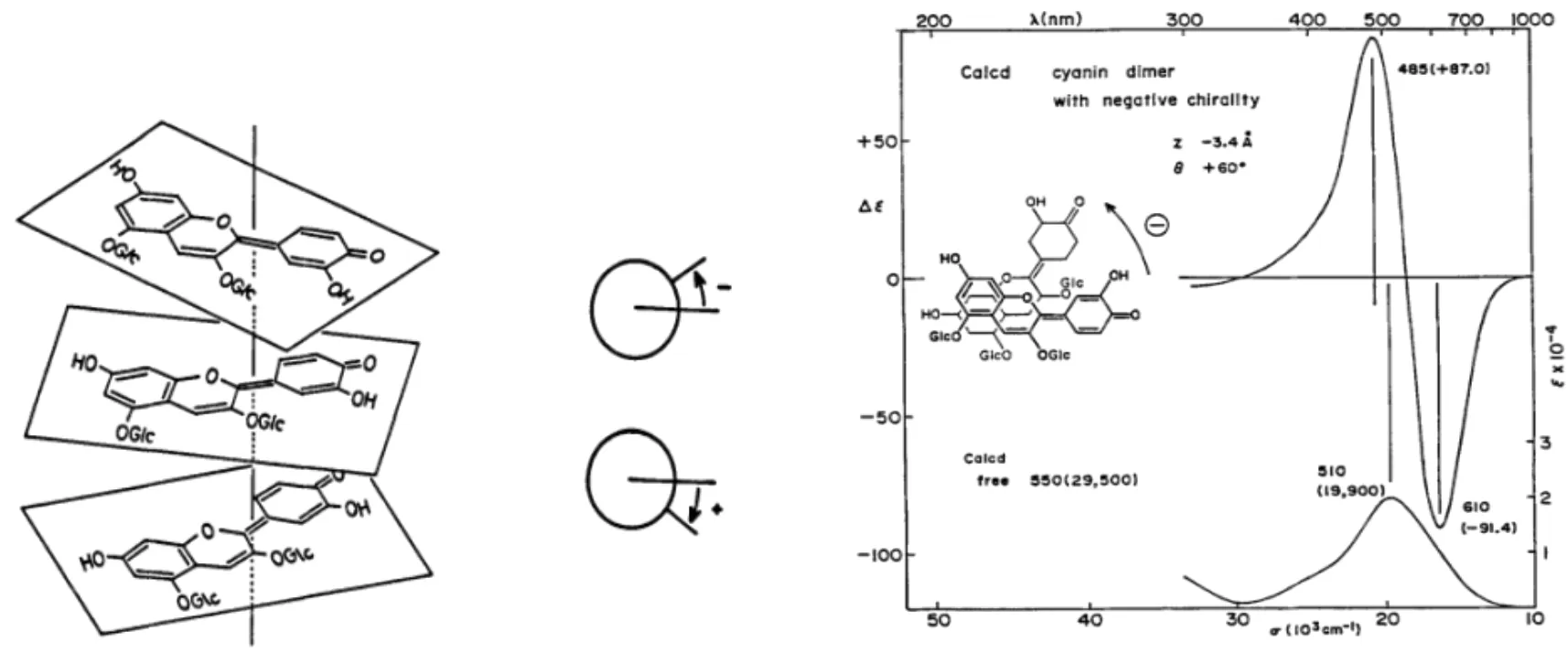
图1 花色苷堆积偏旋模式及CD曲线展示[17]Fig. 1 Anthocyanins stacking pattern and CD curve display[17]
2 调控花器官液泡pH的分子机理
Wilson等[30]在水稻和玉米上发现,将原来的pH为5.0的营养液调至pH为8.5,两种作物根部液泡pH均出现一定的下降趋势,5-10 min 后恢复原来的pH;在玉米营养液中加入NH3,使营养液pH升至8.5,玉米根部液泡pH由5.5左右升至6.1左右,并稳定下来;在水稻营养液中加入NH3,水稻根部液泡pH由5.4左右升至5.9左右,很快恢复至pH为5.4左右,并趋于稳定,这表明液泡具有一套隔离外界环境、独立调控内部pH的系统。
由于着色细胞液泡的pH在花色调控中起重要作用,因此研究调控花器官液泡pH的分子机理对于花色调控具有非常重要的价值。前人在调控着色细胞液泡pH的研究中,以日本牵牛与矮牵牛作为模式植物,阐明了着色细胞液泡碱化与酸化的分子机理[31]。
2.1 液泡酸化
野生型矮牵牛花冠呈红色,矮牵牛突变体出现与原有表型有色差的扇形色块,或花冠整体颜色偏紫。研究发现,不同颜色区域,其液泡pH也不同。
通过进一步分离杂交实验,共分离出PH1-PH7 7个调控着色细胞液泡pH酸化的基因[32-34]。其中PH4编码R2R3 MYB蛋白(myeloblastosis 蛋白),PH6(后更名为AN1)属于bHLH 蛋白(basic helixloop-helix 蛋白),这两个蛋白与WDR蛋白(WD是由40个氨基酸组成,以色氨酸W、天冬氨酸D结尾的结构域;WDR是WD重复)AN11结合,形成MBW(MYB-bHLH-WD)复合物,调节花青素晚期合成通路;PH4-AN1-AN11还激活PH3转录,PH3编码WRKY蛋白(含WRKYGQK 7个保守的氨基酸序列和16个氨基酸的锌指结构域的转录因子),可与AN11绑定,与PH4-AN1-AN11形成复合蛋白,在前馈环中转录PH5,同时,PH1也受PH4-AN1-AN11 以 及 PH3 的 调 控[20-21,35-37]( 图 2)。PH5 表达还受AN2转录激活调控;PH1、PH5表达均略晚于DRF基因的表达,可能是因为PH1、PH5表达需要花青素积累;PH1、PH5表达不影响花青素种类、数量及结构的变化,不影响细胞形状[38-40]。
矮牵牛在PH3调控下花冠呈红色,ph3突变体中,PH1、PH5表达减少,花冠表皮着色细胞液泡pH升高,颜色呈灰紫色。即使PH5过表达,也不足以使突变体表型恢复正常,但是当PH1也同时过表达时,ph3突变体可以恢复正常表型。这说明PH1、PH5形成复合体后,向花冠表皮着色细胞液泡泵入H+的能力成倍提高[40]。PH5编码一个P3AATPase质子泵,该质子泵主要负责向花冠表皮着色液泡泵入H+。PH1编码的P3B-ATPase,缺乏阳离子结合与易位的关键——保守天冬氨酸残基,故不能行使质子泵功能,故液泡酸化过程中作为PH5的辅因子,与PH5形成杂聚肽复合物,共定位于花冠表皮着色液泡上,增强PH5转运H+的能力,实现液泡高酸化[41]。PH1、PH5的同源基因广泛分布于被子植物中[31]。

图2 PH基因编码蛋白调控液泡酸化可能的模式图Fig.2 The possible pattern of vacuole reduced pH by PH genes encoded protein
除控制液泡酸化之外,PH基因还在花青素合成通路、花器官着色细胞小型液泡类似物vacuolino与中央大液泡融合以及花器官发育等其它方面起着特殊作用。
PH1与膜蛋白运输有关。Faraco等[42]在矮牵牛花冠着色细胞与月季的花瓣表皮着色细胞中,发现了一类在花器官表皮着色细胞中存在、而在叶肉细胞中并不存在的液泡类似物vacuolino。复合质子泵PH1-PH5出现在vacuolino膜上,中央大液泡上的蛋白受体识别PH1后,二者形成链栓结构,相互融合,PH1-PH5进入之前无这两种蛋白的中央大液泡,这是一种膜蛋白运输方式的分支。矮牵牛突变体ph3和ph4中,vacuolinos无法产生;ph1突变体中vacuolinos与中央大液泡无法融合。
矮牵牛PH3基因与拟南芥TTG2基因高度同源且功能上可以互相代替,由于TTG2参与植株毛状物的形成以及原花青素积累和液泡酸化,因此PH3基因除了液泡酸化功能外,也参与植株毛状物的形成以及原花青素积累[35]。
矮牵牛中纯合ph3会导致雌性不育,且会遏制F3′5′H基因的表达;花褪色显性等位基因Fa,只在ph3ph3和ph4ph4背景下表达[41];随着矮牵牛花冠的老化,变紫的背景下出现的红色斑点与扇区和ph7 有关[33]。
另外,PH基因还参与果实风味调控。从柑橘果实液囊中分离出CsPH5,CsPH5为PhPH5的同源基因,主要负责向果肉液囊中泵入氢离子,提高果实风味[43]。但甜瓜中的PH基因编码的蛋白相似性最高的蛋白是PINs家族的蛋白,即H+/auxin泵,且该蛋白定位于内质网中,基因沉默后并未发生生长素缺失的表型[44]。
对这两种调控植物花器官与果实器官酸度的不同基因家族的研究表明,不同植物、不同部位PH基因需要深入研究其功能与意义。
2.2 液泡碱化
NHX基因属于CPA(一价阳离子逆转蛋白)家族,该家族广泛的分布于细菌、真菌及高等动植物中,参与调控细胞周期与增殖,耐盐性,囊泡贩运与生物发生[45]。研究发现,NHX1基因编码的蛋白被定位于液泡上,可以使液泡外Na+/K+置换液泡内H+,使得液泡pH升高。此前有关NHX1的研究大多集中于抗盐胁迫,除此之外它还具备了调控植物花色的本领[46]。
日本牵牛从花蕾到开放颜色由粉至紫或蓝的过程中,色素类物质并不改变,仅液泡pH不断地在提高[47]。Fukada-Tanaka等[24]发现,日本牵牛花的Pr基因负责升高液泡pH使花冠变蓝,Pr基因与拟南芥和水稻Na+/H+交换器阅读框高度同源,且能补充酵母nhx1突变,故命名 Pr基因编码的蛋白为lnNHX1。lnNHX1也是第一个被鉴别出来调控液泡pH升高使花色变蓝的蛋白。lnNHX1基因在开花前12 h的花瓣中表达最丰富,开花0 h时lnNHX1所编码的蛋白含量最高,在这一液泡pH升高的过程中,并没有盐胁迫的情况发生[23]。
进一步的研究表明,仅在日本牵牛开花时的着色细胞液泡膜上观察到lnNHX1,其是使液泡碱化花瓣变蓝的主要原因[48]。实验结果也表明,除lnNHX1外可能没有其它主要基因在花期促进液泡碱化,尽管也有研究表明部分lnNHX1缺失突变体可以在开花时花枝颜色变紫,但这一现象被推测为是其它一些基因参与协作的结果。此外,lnNHX2主要在叶片、茎、根中表达,研究表明lnNHX2也可使牵牛花开放时部分细胞液泡碱化花瓣变紫[49],说明lnNHX2也具有液泡碱化的部分功能。
3 展望
花色研究一直是观赏植物研究的重点领域,花器官有色细胞液泡pH作为影响花色呈现的重要因素,其研究对象受限于以下两点:第一,试验材料颜色不同并非因色素类物质种类、含量不同;第二,试验材料颜色不同并非因有色细胞形状发生变化(如皱缩等)。所以,研究花器官液泡pH对花色影响的植物种类十分重要。目前,有关花器官液泡pH对花色的分子调控在日本牵牛和矮牵牛中的研究较为深入。在矮牵牛中,而PH1与PH5在液泡pH酸化过程中起关键作用;而在日本牵牛中,液泡的pH变化主要依靠NHX1行使功能。
但是,有色细胞液泡pH参与调控其他观赏植物花器官颜色变化的机理研究相关资料甚少,这导致我们对于有色细胞液泡pH变化的机理不甚了解。从现有研究来看,在矮牵牛中,有色细胞液泡pH调控的相关基因与花色苷形成和其育性密切相关[28-32]。这证明了在进化过程中,不论是有色细胞液泡pH调控还是花色苷形成均与植物繁殖有关。
综上所述,有关于调控花器官有色细胞液泡pH的基因及其功能,挖掘还不够全面,部分基因仅有名称报道,但未见功能验证,故有关的pH基因有待于进行深入研究,以期为进一步良种繁育以及创建花色形成的环境调控技术体系奠定理论基础。
随着基因工程育种体系的进一步发展,转基因技术在观赏植物上的应用逐渐增多,科研与商业化要求对基因在现有植株中的功能及物种进化中的作用需要有非常清晰的认知,以方便开展转基因及人为促进物种进化的相关工作。研究花器官着色细胞液泡pH对花色的调控,明确液泡pH相关基因功能及花色调控机制,在观赏植物的花色调控和分子育种中具有重要的意义。
