卵形鲳鲹生长抑素家族基因的全基因组鉴定及组织表达特征分析
2021-04-15余艳玲冯鹏霏潘传燕林勇宋漫玲张永德罗洪林
余艳玲 冯鹏霏 潘传燕 林勇 宋漫玲 张永德 罗洪林

摘要:【目的】明确卵形鲳鲹生长抑素(SST)家族基因的种类及其组织表达特征,为进一步揭示SST家族基因在其生长发育过程中的作用机制打下基础。【方法】采用HMMER 3.1对卵形鲳鲹全基因组数据进行搜索,然后通过Pfam、SMART及NCBI CDD等数据库确认搜索获得的基因是否属于SST家族基因;采用ProtParam和PSORT等在线软件进行生物信息学分析,并以实时荧光定量PCR检测SST家族基因在卵形鲳鲹不同组织中的表达情况。【结果】从卵形鲳鲹全基因组中共鉴定出4个SST家族基因(SST1、SST3、SST5和SST6),分别编码122、127、106和110个氨基酸残基,对应的编码蛋白分子量介于12249.3~14316.1 Da,理论等电点(pI)介于6.51~7.43,均定位于细胞外。4个卵形鲳鲹SST基因结构较简单且相似,均包含2个外显子和1个内含子;SST1和SST3基因位于7号染色体上,SST6和SST5基因则分别位于8号和23号染色体上;4个卵形鲳鲹SST氨基酸序列相似性的平均值为33.42%,以SST5氨基酸序列与SST6氨基酸序列的相似性最高(39.78%),SST3氨基酸序列与SST5氨基酸序列的相似性最低(28.16%)。SST家族基因在卵形鲳鲹脑、胃、性腺和肌肉等组织中均有不同程度的表达,SST1、SST3和SST6基因在脑组织中显著高表达(P<0.05,下同),而SST5基因在性腺和肌肉组织中显著高表达;此外,SST3、SST5和SST6基因在卵形鲳鲹卵巢中的相对表达量均显著高于在精巢中的相对表达量。【结论】从卵形鲳鲹基因组中鉴定出4个SST家族基因(SST1、SST3、SST5和SST6),其表达分布存在组织特异性和种属特异性,可能介导卵形鲳鲹的神经调节、性腺发育及性二型性等多种生理功能,且不同物种的SST基因功能可能存在差异。
关键词: 卵形鲳鲹;生长抑素(SST)家族基因;基因结构;基元(Motif);组织表达
中图分类号: S965.331 文獻标志码: A 文章编号:2095-1191(2021)12-3212-09
Genome-wide identification and tissue expression analysis of the somatostatin family genes in Trachinotus ovatus
YU Yan-ling, FENG Peng-fei, PAN Chuan-yan, LIN Yong, SONG Man-ling,
ZHANG Yong-de, LUO Hong-lin*
(Guangxi Academy of Fishery Sciences/Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy
Aquaculture, Nanning 530021, China)
Abstract:【Objective】To study the type of somatostatin (SST) family genes and their tissue expressions in Trachinotus ovatus, and to lay the foundation for further research on the role of SST family genes in the growth and development of T. ovatus. 【Method】 HMMER 3.1 was used to identify somatostatin family genes from the whole genome data of T. ovatus, and then Pfam, Smart and NCBI CDD were used to confirm the searched genes belong to SST gene family. Subbioinformatic analysis was performed using online software such as ProtParam and PSORT. The expression of SST family genes in different tissues of T. ovatus were quantitatively analyzed by real-time fluorescence quantitative PCR. 【Result】Four SST family genes (SST1, SST3, SST5 and SST6) were identified from the whole genome of T. ovatus, encoding 122, 127, 106 and 110 amino acids, respectively. The molecular weight of the corresponding coding protein ranged from 12249.3 to 14316.1 Da, theoretical isoelectric points (pI) ranging from 6.51 to 7.43, and the four gene products were all located outside the cell. The structures of the four SST genes were similar, including two exons and one intron. SST1 and SST3 genes were located on chromosome 7, while SST6 and SST5 genes were located on chromosome 8 and 23, respectively. The average similarity of the four SST amino acid sequences was 33.42%, among which the similarity between SST5 and SST6 was the highest (39.78%), and the similarity between SST3 and SST5 was the lowest (28.16%). The expression levels of the SST family genes were different in brain, stomach, gonad and muscle of T. ovatus. Among them, the expressions of SST1, SST3 and SST6 genes were significantly higher in brain tissue (P<0.05, the same below), while SST5 was significantly highly expressed in gonad and muscle tissues. In addition, the expression of SST3,SST5 and SST6 genes in the ovary were significantly higher than in the testis. 【Conclusion】Four SST family genes (SST1, SST3, SST5 and SST6) are identified from the genome of T. ovatus and the expression and distribution are tissue-specific and species-specific. SST genes may mediate a variety of physiological functions in neuroregulation, gonadal development, and sexual dimorphism of T. ovatus, and the function of SST genes in different species may differ.
Key words: Trachinotus ovatus; somatostatin (SST) family gene; gene structure; Motif; tissue expression
Foundation item: Guangxi Innovation Driven Development Project (Guike AA17204080-3, Guike AA18242031-2); Independent Project of Guangxi Key Laboratory of Aquatic Genetic Breeding and Healthy Aquaculture(17-A-01-02, 19-A-01-05)
0 引言
【研究意义】卵形鲳鲹(Trachinotus ovatus)隶属于鲹形目(Carangiformes)鲹科(Carangidae),是适合我国近海、远海集约化养殖的名贵水产品种之一,在我国南部沿海地区已得到迅速发展(Liu et al.,2010;黄小林等,2018;张永德等,2020a)。然而,近年来由于不规范的保种与选育,卵形鲳鲹已出现种质退化现象,主要表现为生长速率下降、群体整齐度低、畸形、抗病力低、病害发生频繁及鱼苗死亡率高等,且种群遗传多样性面临着丢失的风险(张永德等,2020b)。因此,开展卵形鲳鲹生长相关功能基因研究,对促进卵形鲳鲹种质资源的开发利用及其产业持续健康发展具有重要意义。【前人研究进展】对脊椎动物及硬骨鱼类而言,其生长主要受生长激素(GH)—胰岛素样生长因子-I(IGF-I)轴的调控。GH-IGF-I轴开始于下丘脑,在多种激素的调控下由垂体产生GH,GH通过血液循环与受体结合而刺激肝脏及其他部位的IGF-I合成分泌,IGF-I能与胰岛素样生长因子结合蛋白(IGFBP)结合,通过血液将其转运并发挥作用(Moriyama et al.,2000)。生长抑素(Somatostatin,SST)是调控GH分泌的激素种类之一,属于多肽激素家族,在动物生长、发育和代谢等方面发挥重要作用(Sheridan et al.,2000;Günther et al.,2018)。SST的表达主要集中在中枢神经系统和周围神经,其次是肠道、胃及胰腺(Gonkowski and Rytel,2019;Feng et al.,2020)。SST不仅直接抑制GH分泌,还通过降低对GH的敏感性及抑制IGF-1分泌,而以垂体外的方式影响机体生长发育(Sheridan and Hagemeister,2010;Wang et al.,2016)。在硬骨魚类中,SST以组织依赖性方式通过调节IGF-1的合成和分泌而发挥作用(Poppinga et al.,2007),除SST5外,均对金钱鱼肝脏中的IGF-1和IGF-2有明显抑制作用(冯培哲,2020)。SST还参与抑制胃肠道蠕动和分泌活性,以及调节神经元因子释放、肠血管中血流及胃肠道病理过程等,因此被称为抗炎药(Gonkowski and Rytel,2019),在治疗消化道出血和胰腺炎等方面已得到广泛应用(方圆和苑立博,2020;高世娇,2020;刘世明和任文生,2020)。目前,已研究证实几乎所有检测的脊椎动物和硬骨鱼类中均存在SST家族基因,包括6个成员:SST1、SST2、SST3、SST4、SST5和SST6(Tostivint et al.,2019;Feng et al.,2020)。SST家族基因是由两轮全基因组复制(1R和2R)和硬骨鱼类特异性基因组加倍(3R)形成(Dehal and Boore,2005;Putnam et al.,2008;van de Peer et al.,2010;Tostivint et al.,2019)。SST1、SST2和SST5基因出现在1R/2R中,且存在于现有脊椎动物的共同祖先中;硬骨鱼类的四倍体化(3R)期间存在SST4基因,而同期SST1和SST2基因的串联复制产生了SST3和SST6基因(Tostivint et al.,2004)。【本研究切入点】不同鱼类SST家族基因的种类和数量差异明显(Tostivint et al.,2019),深入了解不同物种SST基因的数量及结构功能,对揭示SST家族基因的进化关系及其功能具有重要意义,但至今未见有关卵形鲳鲹SST基因的相关研究报道,其在各组织中的表达特征也尚未明确。【拟解决的关键问题】根据SST的隐马尔科夫模型(HMM)对卵形鲳鲹SST家族基因进行全基因组鉴定分析,并通过实时荧光定量PCR检测SST基因在卵形鲳鲹不同组织中的表达情况,为进一步揭示卵形鲳鲹SST家族基因在其生长发育过程中的作用机制打下基础。
1 材料与方法
1. 1 试验材料
卵形鲳鲹取自广西北海同一人工养殖群体,雌雄各3尾,体重523~596 g,麻醉处死后分别采集其肌肉、脑、心脏、肝脏、脾脏、头肾、性腺(卵巢和精巢)、胃及肠道等组织样品,液氮速冻后-80 ℃保存备用。RNAsimple提取试剂盒购自天根生化科技(北京)有限公司;HiScript? III RT SuperMix、ChamQ Universal SYBR qPCR Master Mix及Ace Taq? Master Mix等购自南京诺唯赞生物科技股份有限公司。
1. 2 SST家族基因鉴定
卵形鲳鲹基因组数据(BioProject PRJNA574895)由广西水产遗传育种与健康养殖重点实验室测序组装获得。从Pfam数据库(http://pfam.xfam.org/)下载SST-HMM模型(PF03002),采用HMMER 3.1对卵形鲳鲹全基因组数据进行搜索,e取值小于-15;通过Pfam(http://pfam.xfam.org/)、SMART(http://smart.embl.de/)及NCBI CDD(https://www.ncbi.nlm.nih.gov/cdd/)等数据库确认搜索获得的基因是否属于SST家族基因。通过ProtParam(https://web.expasy.org/protparam/)对SST家族蛋白的分子量、理论等电点(pI)和疏水性均值(GRAVY)等理化性质进行预测,并以PSORT(http://psort1.hgc.jp/form.html)进行亚细胞定位分析。
1. 3 基因结构分析及保守基元(Motif)预测
卵形鲳鲹SST家族基因的外显子、内含子、侧翼区位置及长度等信息通过基因组注释文件提取获得;利用MEME 5.1.1(http://meme-suite.org/tools/meme)对SST家族蛋白的Motif进行預测分析,Motif长度设为10~100 aa;使用TBtools 0.66绘制卵形鲳鲹SST家族基因结构及其Motif位置示意图。
1. 4 基因染色体定位分析
从卵形鲳鲹全基因组注释文件中提取SST家族基因在染色体上的相应位置信息,利用Samtools 1.10获取卵形鲳鲹各染色体的长度,并以Mapchart 2.32绘制SST家族基因在染色体上的分布情况。
1. 5 多序列比对分析及系统发育进化树构建
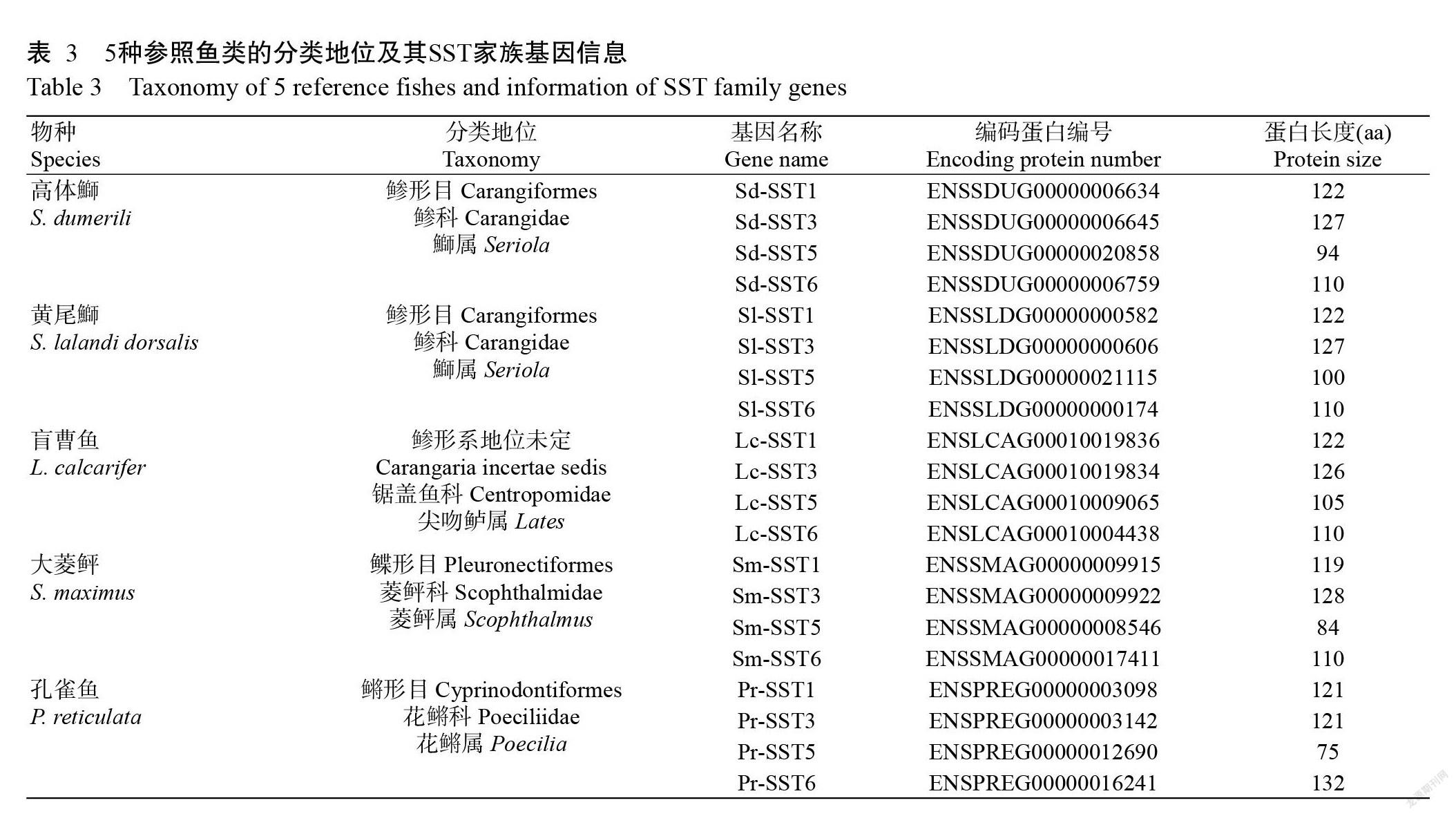
从Ensembl数据库(http://asia.ensembl.org/index.html)下载高体鰤鱼(Seriola dumerili)、黄尾鰤鱼(S. lalandi dorsalis)、大菱鲆(Scophthalmus maximus)、盲曹鱼(Lates calcarifer)及孔雀鱼(Poecilia reticulata)等5种鱼类的全基因组数据文件,采用相同的方法对SST家族基因进行提取鉴定。利用MEGA X进行SST氨基酸序列比对分析及构建系统发育进化树,并选择Poisson模型,对空位采用完全删除(Complete deletion),设Bootstrap为500次自举检测其置信度。
1. 6 卵形鲳鲹SST家族基因组织表达分析
利用RNAsimple提取试剂盒提取卵形鲳鲹不同组织总RNA,使用1.5%琼脂糖凝胶电泳检测RNA完整性,并以NanoDrop One超微量紫外分光光度计检测其浓度。根据HiScript? III RT SuperMix反转录试剂盒说明对提取的总RNA进行反转录,合成cDNA第一链。设计检测SST家族基因的实时荧光定量PCR扩增引物(表1),以18S rRNA为内参基因(Chen et al.,2017),采用2×ChamQ Universal SYBR qPCR Master Mix进行定量分析。实时荧光定量PCR反应体系15.0 μL:ChamQ Universal SYBR qPCR Master Mix 7.5 μL,cDNA模板1.0 μL,上、下游引物(10 μmol/L)各0.3 μL,ddH2O补足至15.0 μL。每个样品设3次生物学重复。使用2-ΔΔCt法换算卵形鲳鲹各组织中SST基因的相对表达量,通过SPSS 21.0进行单因素方差分析(One-way ANOVA),并以S-N-K法进行多重比较。
2 结果与分析
2. 1 卵形鲳鲹SST家族基因鉴定结果
根据SST-HMM模型对卵形鲳鲹全基因组进行搜索,共获得4个SST基因(SST1、SST3、SST5和SST6)。通过Pfam、SMART及NCBI CDD等数据库进行验证分析,4个SST基因均属于生长抑素/皮质抑素家族,其推导氨基酸序列长度介于106~127 aa,其中SST5氨基酸序列最短、SST3氨基酸序列最长;对应的编码蛋白分子量介于12249.3~14316.1 Da。蛋白理化性质预测结果(表2)表明,4个SST蛋白的pI介于6.51~7.43,SST1蛋白为酸性蛋白,其余均为碱性蛋白;SST蛋白不稳定性指数介于39.90~53.14,以SST5蛋白的稳定性最低、SST6蛋白的稳定性最高;GRAVY介于-0.060~0.053,SST5蛋白为疏水性蛋白外,其余均为亲水性蛋白(SST1蛋白亲水性最强)。亚细胞定位预测结果显示,卵形鲳鲹SST家族蛋白均定位于细胞外。
2. 2 卵形鲳鲹SST家庭基因结构及Motif分析结果
4个卵形鲳鲹SST基因的核苷酸序列均较短,基因结构(图1)较简单,其中,SST5和SST6基因缺少两端的非编码区(UTR)。4个卵形鲳鲹SST基因结构相似,均包含2个外显子和1个内含子。利用MEME 5.1.1分析4个卵形鲳鲹SST蛋白的保守结构域,共获得6个保守的Motif(Motif I~Motif VI),每个SST蛋白包含3~4个Motif(图2和图3)。其中,Motif I在4个卵形鲳鲹SST蛋白中均有存在,是卵形鲳鲹SST蛋白最保守的区域;Motif II主要存在于卵形鲳鲹SST3和SST5蛋白中;Motif III主要存在于卵形鲳鲹SST3和SST6蛋白中;Motif IV主要存在于卵形鲳鲹SST1和SST3蛋白中;Motif V主要存在于卵形鲳鲹SST5和SST6蛋白中;Motif VI主要存在于卵形鲳鲹SST1和SST6蛋白中。
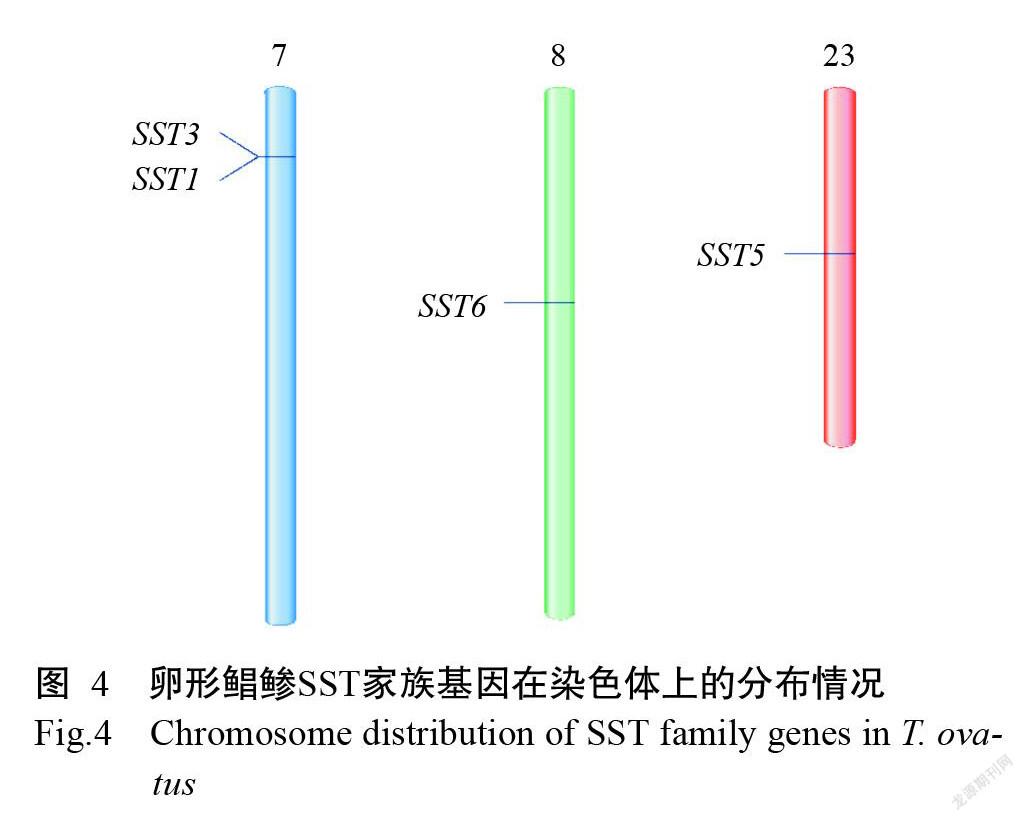
2. 3 卵形鲳鲹SST家族基因染色体定位情况
卵形鲳鲹SST家族基因染色体定位结果(图4)显示,4个卵形鲳鲹SST基因分布在3对染色体上。其中,SST1和SST3基因位于7号染色体上,具体位置分别是Chr7:3.464131-3.467259 Mb和Chr7:3.418956-3.421225 Mb,且2个基因间仅间隔1个编码326个氨基酸残基的未知基因;SST6基因位于8号染色体上,具体位置是Chr8:11.782339-11.782985 Mb;SST5基因位于23号染色体上,具体位置是Chr23:8.996148-8.996695 Mb。
2. 4 SST氨基酸序列比对分析及构建的系统发育进化树
对高体鰤、黄尾鰤、盲曹鱼、大菱鲆及孔雀鱼的全基因组进行鉴定,结果(表3)均鉴定获得4个SST家族基因(SST1、SST3、SST5和SST6)。4个卵形鲳鲹SST氨基酸序列相似性的平均值为33.42%,其中,SST5氨基酸序列与SST6氨基酸序列的相似性最高(39.78%),SST3氨基酸序列与SST5氨基酸序列的相似性最低(28.16%)。利用MEGA X进行SST氨基酸序列比对分析,结果显示,在SST1、SST3和SST6氨基酸序列中,大菱鲆与孔雀鱼的相似性最低,分别为83.05%、63.87%和90.00%,而高体鰤与黄尾鰤的相似性最高,分别为99.18%、100.00%和100.00%;在SST5氨基酸序列中,盲曹鱼与孔雀鱼的相似性最低(53.42%),同样以高体鰤与黄尾鰤的相似性最高(94.68%)。基于SST氨基酸序列相似性构建的系统发育进化树(图5)显示,6种鱼类的SST氨基酸序列聚为4个分支(SST1、SST3、SST5和SST6),其中,SST5氨基酸序列与SST6氨基酸序列的遗传距离较近,SST1氨基酸序列与SST3氨基酸序列的遗传距离较近。
2. 5 卵形鲳鲹SST家族基因组织表达分析结果
采用实时荧光定量PCR检测雌、雄性卵形鲳鲹9个组织中SST家族基因的相对表达量,并通过扩增产物测序确认SST基因,结果(图6)显示,4个SST基因在卵形鲳鲹9个组织中的相对表达量均存在明显差异。其中,SST1、SST3和SST6基因在脑组织中均显著高表达(P<0.05,下同),胃组织中的SST1和SST3基因也呈显著高表达状态;SST5基因在性腺和肌肉组织中高表达,其相对表达量显著高于在其他7种组织的相对表达量,在肝脏、肠道及胃等组织中的相对表达量则相对较低。
SST家族基因在卵形鲳鲹组织中的表达存在明显二态性。SST3、SST5和SST6基因在卵形鲳鲹卵巢中的相对表达量均显著高于在精巢中的相对表达量,雌鱼胃组织中的SST1基因及脑组织中的SST3基因相对表达量也显著高于雄鱼中的相对表达量,雄鱼肌肉中的SST6基因相对表达量则显著高于雌鱼中的相对表达量。
3 讨论
SST在动物的生长发育过程中发挥重要作用。目前,已在不同物种中发现不同数量的SST基因(Tostivint et al.,2019)。在人类(Homo sapiens)及食蟹猴(Macaca fascicularis)、家鼠(Mus musculus)、牛(Bos taurus)、猪(Sus scrofa)、爪蛙(Pelophylax ridibundus)和蜥蜴(Anolis carolinensis)等物种中发现2种SST基因(SST1和SST2);在金鱼(Carassius auratus)、鲤鱼(Cyprinus carpio)、草鱼(Ctenopharyngodon idella)、点带石斑鱼(Epinephelus coioides)、亚马逊帆鱼(Poecilia formosa)和黑头呆鱼(Pimephales promelas)中发现3种SST基因(Ye et al.,2005;Feng et al.,2015),其中金鱼、鲤鱼、草鱼及点带石斑鱼为SST1、SST3和SST6基因,亚马逊帆鱼和黑头呆鱼为SST1、SST5和SST6基因;在虹鳟(Oncorhynchus mykiss)、月光鱼(Xiphophorus maculatus)、大西洋鲱(Clupea harengus)、空棘鱼(Latimeria chalumnae)及红腹锯脂鲤(Pygocentrus nattereri)中发现4种SST基因;在红鳍东方鲀(Takifugu rubripes)、绿河鲀(Tetraodon nigroviridis)、刺鱼(Gasterosteus aculeatus)及青鳉(Oryzias latipes)中发现5种SST基因(SST1、SST3、SST4、SST5和SST6);在斑马鱼(Danio rerio)、斑点叉尾鮰(Ictalurus punctatus)及斑点雀鳝(Lepisosteus oculatus)中则发现6种SST基因(SST1~ SST6)。本研究在卵形鲳鲹、高体鰤鱼、黄尾鰤鱼、大菱鲆、盲曹鱼和孔雀鱼中均发现4种SST基因(SST1、SST3、SST5和SST6),与虹鳟和月光鱼的SST家族基因相同。可见,不同物种的SST家族基因种类及数量存在明显差异,且鱼类SST基因数量高于人类和哺乳动物,究其原因可能是人类和哺乳动物的部分基因在进化过程中发生丢失或被其他基因所替代,也可能与鱼类的基因组多倍化事件有关(Tostivint et al.,2004)。
卵形鲳鲹SST家族基因结构分析结果显示,4个SST基因(SST1、SST3、SST5和SST6)均包含2个外显子和1个内含子,其结构较简单。SST氨基酸序列比对分析发现,成熟肽SS-14在6种鱼类的SST1、SST5和SST6氨基酸序列中完全保守,仅在SST3氨基酸序列中存在1个氨基酸突变位点,说明SST蛋白的成熟肽高度保守(Feng et al.,2020)。不同SST氨基酸序列存在明显差异,4个卵形鲳鲹SST氨基酸序列相似性的平均值为33.42%,其中,SST5氨基酸序列与SST6氨基酸序列的相似性最高(39.78%),SST3氨基酸序列与SST5氨基酸序列的相似性最低(28.16%),说明SST家族基因功能虽然存在相似性,但也存在差异,且这种差异推动了SST家族的进化。不同SST基因可能参与不同生理调节或其他生物学功能,但具体功能有待进一步探究。
本研究利用MEGA X对6种鱼类的SST氨基酸序列进行比对分析,结果发现6种鱼类SST家族同源基因的结构较保守;基于SST氨基酸序列相似性构建的系统发育进化树显示,6种鱼类的SST氨基酸序列聚为4个分支,分别为SST1、SST3、SST5和平共处SST6。对于SST家族基因而言,高体鰤与黄尾鰤的遗传距离最近(除SST5基因外),二者均为鰤属(Seriola)鱼类,与卵形鲳鲹具有較近的遗传距离;而孔雀鱼SST家族基因与其他5种鱼类的遗传距离较远(除SST6基因外),与6种鱼类的系统分类学基本一致,说明这些物种SST家族基因的进化与物种本身的进化保持高度一致。染色体定位分析结果表明,SST1基因和SST3基因位于7号染色体上,具体位置分别是Chr7:3.464131-3.467259 Mb和Chr7:3.418956-3.421225 Mb,且这2个基因的间隔较近,形成一个基因簇,与在斑马鱼(Liu et al.,2010)和金钱鱼(Scatophagus argus)(Feng et al.,2020)上的研究结果类似。
SST是硬骨鱼类GH释放的主要抑制剂,在鱼类生长调节中发挥重要作用(Klein and Sheridan,2008;Sheridan and Hagemeister,2010),但需通过5种G蛋白偶联生长抑素受体(SSTR1~SSTR5)才能发挥作用(Gonkowski and Rytel,2019)。SST广泛存在于多种组织器官中,且其表达具有组织特异性(Feng et al.,2020)。本研究结果表明,SST家族基因在卵形鲳鲹脑、胃、性腺和肌肉等组织中均有不同程度的表达。其中,SST1、SST3和SST6基因在脑组织中均高表达,与在斑马鱼(Liu et al.,2010)和金钱鱼(Feng et al.,2020)上的研究结果一致,推测SST既是激素又是神经递质(Patel,1999),且具有神经调节功能;SST5基因在卵形鲳鲹性腺中也呈高表达,且在卵巢中的相对表达量显著高于在精巢中的相对表达量,推测该基因参与卵形鲳鲹的性腺发育及性二型性,与Feng等(2020)的研究结果一致。此外,SST3和SST6基因在卵巢中的相对表达也显著高于在精巢中的相对表达量,说明这2个基因可能发挥着与SST5基因相似的功能。SST1和SST3基因在卵形鲳鲹胃组织中高表达,说明其可能参与食物的消化吸收及营养代谢;SST6基因在卵形鲳鲹胃组织中的相对表达量较低,但在金钱鱼胃组织中的相对表达量极显著高于其他组织,说明这些基因的表达分布存在种属差异,因此在调节不同生理过程中也可能存在功能差异。
4 结论
从卵形鲳鲹基因组中鉴定出4个SST家族基因(SST1、SST3、SST5和SST6),其表达分布存在组织特异性和种属特异性,可能介导卵形鲳鲹的神经调节、性腺发育及性二型性等多种生理功能,且不同物种的SST基因功能可能存在差异。
参考文献:
方圆,苑立博. 2020. 生长抑素联合床旁持续血液净化治疗重症急性胰腺炎的效果[J]. 河南医学研究,29(15):2748-2749. [Fang Y,Yuan L B. 2020. Effect of somatostatin combined with continuous bedside blood purification therapy on severe acute pancreatitis[J]. Henan Medical Research,29(15):2748-2749.] doi:10.3969/j.issn.1004-437X.2020.15.020.
冯培哲. 2020. 金钱鱼生长抑素(Somatostatin)在生长调控中的功能研究[D]. 湛江:广东海洋大学. [Feng P Z. 2020. Function of somatostatin(SST) in growth regulation of Scatophagus argus[D]. Zhanjiang:Guangdong Ocean University.] doi:10.27788/d.cnki.ggdhy.2020.000145.
高世娇. 2020. 不同剂量生长抑素对中度重症急性胰腺炎的影响[J]. 临床医药文献电子杂志,7(35):89-90. [Gao S J. 2020. Effect of different doses of somatostatin on mo-derate severe acute pancreatitis[J]. Journal of Clinical Me-dical Literature(Electronic Edition),7(35):89-90.] doi:10.16281/j.cnki.jocml.2020.35.070.
黄小林,张殿昌,林黑着,黄忠,虞为,杨育凯,李涛. 2018. 池塘养殖卵形鲳鲹早期形态性状与体质量的灰色关联分析[J]. 南方农业学报,49(5):1016-1022. [Huang X L,Zhang D C,Lin H Z,Huang Z,Yu W,Yang Y K,Li T. 2018. Grey relational analysis between early morphological traits and body weight of Trachinotus ovatus bred in pond[J]. Journal of Southern Agriculture,49(5):1016-1022.] doi:10.3969/j.issn.2095-1191.2018.05.27.
刘世明,任文生. 2020. 生长抑素联合艾司奥美拉唑钠治疗急性上消化道出血的临床效果[J]. 血栓与止血学,26(2):193-194. [Liu S M,Ren W S. 2020. Clinical effects of somatostatin combined with esomeprazole sodium in the treatment of acute upper gastrointestinal bleeding[J]. Chinese Journal of Thrombosis and Hemostasis,26(2):193-194.] doi:10.3969/j.issn.1009-6213.2020.02.005.
张永德,冯鹏霏,余艳玲,潘传燕,宋漫玲,肖蕊,罗洪林. 2020a. 卵形鲳鲹MyoG基因克隆及其胚胎组织表达分析[J]. 南方农业学报,51(12):3090-3098. [Zhang Y D,Feng P F,Yu Y L,Pan C Y,Song M L,Xiao R,Luo H L. 2020a. Gene cloning of MyoG in Trachinotus ovatus and its embryonic tissues analysis[J]. Journal of Southern Agriculture,51(12):3090-3098.] doi:10.3969/j.issn.2095-1191.2020.12.027.
張永德,文露婷,罗洪林,林勇,杜雪松,余艳玲,韦孜娜,黄姻. 2020b. 卵形鲳鲹基因组调研及其SSR分子标记的开发应用[J]. 南方农业学报,51(5):983-994. [Zhang Y D,Wen L T,Luo H L,Lin Y,Du X S,Yu Y L,Wei Z N,Huang Y. 2020b. Genome survey and development of SSR molecular markers for Trachinotus ovatus[J]. Journal of Southern Agriculture,51(5):983-994.] doi:10. 3969/j.issn.2095-1191.2020.05.001.
Chen X J,Zhang X Q,Huang S,Cao Z J,Qin Q W,Hu W T,Sun Y,Zhou Y C. 2017. Selection of reference genes for quantitative real-time RT-PCR on gene expression in golden pompano(Trachinotus ovatus)[J]. Polish Journal of Veterinary Sciences,20(3):583-594. doi:10.1515/pjvs-2017-0071.
Dehal P,Boore J L. 2005. Two rounds of whole genome duplication in the ancestral vertebrate[J]. PLoS Biology,3(10):e314. doi:10.1371/journal.pbio.0030314.
Feng P Z,Tian C X,Lin X H,Jiang D N,Shi H J,Chen H P,Deng S P,Zhu C H,Li G L. 2020. Identification,expression,and functions of the somatostatin gene family in Spotted Scat(Scatophagus argus)[J]. Genes,11(2):194. doi:10.3390/genes11020194.
Feng X,Yu X M,Pang M X,Liu H Y,Tong J G. 2015. Molecular characterization and expression of three preprosomatostatin genes and their association with growth in common carp(Cyprinus carpio)[J]. Comparative Biochemistry and Physiology. Part B:Biochemistry and Molecular Biology,182:37-46. doi:10.1016/j.cbpb.2014.12. 001.
Gonkowski S,Rytel L. 2019. Somatostatin as an active substance in the mammalian enteric nervous system[J]. International Journal of Molecular Sciences,20(18):4461. doi:10.3390/ijms20184461.
Günther T,Tulipano G,Dournaud P,Bousquet C,Csaba Z,Kreienkamp H J,Lupp A,Korbonits M,Casta?o P J,Wester H J,Culler M,Melmed S,Schulz S. 2018. International union of basic and clinical pharmacology. cv. somatostatin receptors:Structure,function,ligands,and new nomenclature[J]. Pharmacological Reviews,70(4):763-835. doi:10.1124/pr.117.015388.
Klein S E,Sheridan M A. 2008. Somatostatin signaling and the regulation of growth and metabolism in fish[J]. Molecular and Cellular Endocrinology,286(1-2):148-154. doi:10.1016/j.mce.2007.08.010.
Liu Y,Lu D Q,Zhang Y,Li S S,Liu X C,Lin H R. 2010. The evolution of somatostatin in vertebrates[J]. Gene,463(1-2):21-28. doi:10.1016/j.gene.2010.04.016.
Moriyama S,Ayson F G,Kawauchi H. 2000. Growth regulation by insulin-like growth factor-I in fish[J]. Bioscience,Biotechnology,and Biochemistry,64(8):1553-1562. doi:10.1271/bbb.64.1553.
Patel Y C. 1999. Somatostatin and its receptor family[J]. Frontiers in Neuroendocrinology,20(3):157-198. doi:10.1006/frne.1999.0183.
Poppinga J,Kittilson J,McCormick S D,Sheridan M A. 2007. Effects of somatostatin on the growth hormone-insulin-like growth factor axis and seawater adaptation of rainbow trout(Oncorhynchus mykiss)[J]. Aquaculture,273(2-3):312-319. doi:10.1016/j.aquaculture.2007.10. 021.
Putnam N H,Butts T,Ferrier D E K,Furlong R F,Hellsten U,Kawashima T,Robinson-Rechavi M,Shoguchi E,Terry A,Yu J K,Benito-Gutiérrez E L,Dubchak I,Garcia-Fernàndez J,Gibson-Brown J J,Grigoriev I V,Horton A C,de Jong P J,Jurka J,Kapitonov V V,Kohara Y,Kuroki Y,Lindquist E,Lucas S,Osoegawa K,Pennacchio L A,Salamov A A,Satou Y,Sauka-Spengler T,Schmutz J,Shin-I T,Toyoda A,Bronner-Fraser M,Fujiyama A,Holland L Z,Holland P W H,Satoh N,Rokhsar D S. 2008. The amphioxus genome and the evolution of the chordate karyotype[J]. Nature,453:1064-1071. doi:10.1038/nature06967.
Sheridan M A,Hagemeister A L. 2010. Somatostatin and somatostatin receptors in fish growth[J]. General and Comparative Endocrinology,167(3):360-365. doi:10.1016/j.ygcen.2009.09.002.
Sheridan M A,Kittilson J D,Slagter B J. 2000. Structure-function relationships of the signaling system for the somatostatin peptide hormone family1[J]. American Zoologist,40(2):269-286. doi:10.1093/icb/40.2.269.
Tostivint H,Gaillard A L,Mazan S,Pézeron G. 2019. Revisi-ting the evolution of the somatostatin family:Already five genes in the gnathostome ancestor[J]. General and Comparative Endocrinology,279:139-147. doi:10.1016/j.ygcen.2019.02.022.
Tostivint H,Joly L,Lihrmann I,Ekker M,Vaudry H. 2004. Chromosomal localization of three somatostatin genes in zebrafish. Evidence that the[Pro2]-somatostatin-14 isoform and cortistatin are encoded by orthologous genes[J]. Journal of Molecular Endocrinology,33(3):R1-R8. doi:10.1677/jme.1.01602.
van de Peer Y,Maere S,Meyer A. 2010. 2R or not 2R is not the question anymore[J]. Nature Reviews Genetics,11:166. doi:10.1038/nrg2600-c2.
Wang B,Jia J R,Yang G K,Qin J K,Zhang C,Zhang Q P,Sun C Y,Li W S. 2016. In vitro effects of somatostatin on the growth hormone-insulin-like growth factor axis in orange-spotted grouper(Epinephelus coioides)[J]. Gene-ral and Comparative Endocrinology,237:1-9. doi:10.1016/ j.ygcen.2015.10.014.
Ye X,Li W S,Lin H R. 2005. Polygenic expression of somatostatin in orange-spotted grouper(Epinephelus coioides):Molecular cloning and distribution of the mRNAs enco-ding three somatostatin precursors[J]. Molecular and Cellular Endocrinology,241(1-2):62-72. doi:10.1016/j.mce. 2005.05.008.
(責任编辑 兰宗宝)
