石墨烯对4-硝基苯酚的吸附性能研究
2021-04-09杨金杯叶银钕赖衍斌
杨金杯,叶银钕,赖衍斌
(福建师范大学福清分校 近海流域环境测控治理福建省高校重点实验室,福建 福州 350300)
近年来,水污染已成为世界性的环境问题之一[1]。4-硝基苯酚是一种重要的有机中间体,广泛用于石化、染料、农药和医药的生产,因其分子含硝基和苯环而有较大毒性,已被国家列入水中优先控制污染物名列[2]。含酚废水的治理包含化学沉淀法、化学氧化、焚烧法、光催化法、生物法、萃取、膜分离和吸附等[3-5]。吸附法因过程简单、高效和可回收等优点,已被广泛用于废水废气治理[6]。
石墨烯是一种单层碳原子排列成六边形晶格的二维碳材料[7],因表面具有丰富的π键、较大的比表面积和多孔等优点,是一种优异的吸附材料[8],当前只有少量报道用于含酚废水的处理,而尚未见其对4-硝基苯酚的吸附研究报道。本文采用氧化-还原法制备了石墨烯并用于吸附4-硝基苯酚,探究了各种工艺条件对吸附的影响,考察了该过程的吸附热力学与动力学,确定热力学参数和活化能,为吸附法处理含4-硝基苯酚废水的应用提供依据。
1 实验部分
1.1 试剂与仪器
石墨粉,工业级;30%过氧化氢、高锰酸钾、硫酸、4-硝基苯酚、盐酸、水合肼85%、硝酸钠、氨水均为分析纯。
THZ-C型恒温振荡器;UV-1750型紫外-可见分光光度计;KQ-25DE型超声波清洗器;TDL-4型低速台式离心机;Quata FEG 200型扫描电镜;Autosorb-iQ比表面和孔径分布分析仪。
1.2 石墨烯的制备
通过氧化-还原法制备石墨烯。将1.0 g 硝酸钠、1.0 g石墨粉和45 mL浓硫酸置于500 mL烧杯里,在冰水浴的条件下缓慢加入6.0 g高锰酸钾,不断搅拌,防止温度过高导致意外。待混合均匀后,将烧杯移至恒温水浴锅中,恒温35 ℃磁力搅拌1 h。加入80 mL蒸馏水,温度升到90 ℃,反应0.5 h。加入200 mL水和10 mL双氧水,冷却,进行抽滤,固体采用5%盐酸和蒸馏水反复洗至中性,真空干燥,得到氧化石墨固体,研磨成粉末。
称取50 mg氧化石墨置于250 mL蒸馏水,超声0.5 h,使氧化石墨剥离成单层,即氧化石墨烯,使其很好地分散在水中。取150 mL超声过的浑浊液,加入0.15 mL氨水和0.15 mL水合肼,在95 ℃的恒温水浴锅中反应1 h。反应结束后,用5%盐酸中和,用蒸馏水洗至中性,抽滤,固体真空干燥,即为石墨烯。
1.3 吸附实验
将浓度100 mg/L的100 mL 4-硝基苯酚溶液置于250 mL锥形瓶里,置于恒温振荡器中,实验温度298.15 K,待锥形瓶中的溶液达到实验温度后,加入0.15 g石墨烯,以140 r/min速度振荡8 h。间隔一定时间取样,离心后取上层清液分析溶液的浓度,直至吸附达平衡。即时吸附量(qt,mg/g)、平衡吸附量(qe,mg/g)和平衡吸附率(Re)的计算式如下:
qt=V(c0-ct)/m
(1)
qe=V(c0-ce)/m
(2)
Re=(c0-ce)/c0
(3)
式中c0——溶液中4-硝基苯酚的初始浓度,mg/L;
ct——t时刻溶液中4-硝基苯酚的浓度,mg/L;
ce——溶液中4-硝基苯酚的平衡浓度,mg/L;
V——溶液体积,L;
m——吸附剂质量,g。
1.4 分析方法
溶液中4-硝基苯酚的浓度采用紫外-可见分光光度计进行测量,测定条件:波长317 nm,1 cm 石英比色皿。4-硝基苯酚的浓度(y,mg/L)与吸光度(x)的标准曲线为:y=15.734 0x+0.043 1,相关系数R2=0.999 9。
2 结果与讨论
2.1 石墨烯表征
图1为石墨烯粉末的表面SEM图。

图1 石墨烯的SEM谱图Fig.1 SEM image of graphene
由图1可知,所制备的石墨烯表面为片状结构,片层呈现弯曲状并且互相叠加,已失去了石墨原料的规则层状形态,转变为不规整的褶皱状形貌,片层之间存有空隙,层与层之间结构清晰可见[9]。上述结果显示,所制备的石墨烯粉末是片状石墨烯薄层通过无规则的紧密堆积形成的聚集体。
图2为石墨烯粉末的氮气吸附/脱附等温线。
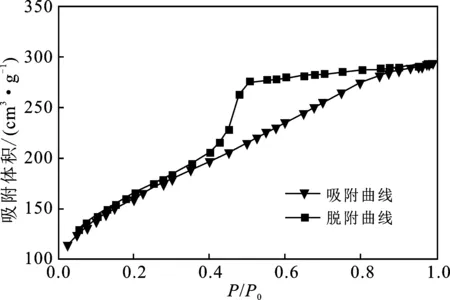
图2 石墨烯的氮气吸附/脱附等温线Fig.2 Nitrogen adsorption and desorption isotherm of graphene
由图2可知,该等温线是典型的Ⅳ型,表明所制备的石墨烯粉末具有介孔特征(2~50 nm),并且在较高的相对压力下具有迟滞回线,迟滞回线的形状为H3型,这与石墨烯的片状颗粒聚集有关。通过BET数据分析,所制备的石墨烯平均孔径为 3.26 nm,比表面积为555.8 m2/g,由于其较大的比表面积而显示出优异的吸附性能。
2.2 静态吸附条件研究
2.2.1 石墨烯用量对吸附的影响 其他条件同1.3节,石墨烯用量对4-硝基苯酚平衡吸附率的影响见图3。
由图3可知,石墨烯的平衡吸附率随着用量的增加而快速增大,100 mL浓度100 mg/L 4-硝基苯酚溶液被完全吸附的最小石墨烯用量为0.35 g,即静态石墨烯饱和吸附容量为28.4 mg/g。当石墨烯用量>0.35 g后,进一步增加石墨烯用量,平衡吸附率趋于稳定。当溶液中4-硝基苯酚初始浓度恒定时,吸附达到平衡时吸附质的浓度随着吸附剂用量的增加而显著降低,这是由于一定的初始浓度,增加吸附质的用量能提供更大的吸附表面积或更多的吸附位点[10]。

图3 石墨烯用量对吸附4-硝基苯酚的影响Fig.3 Effect of graphene dosage on the adsorption of 4-nitrophenol
2.2.2 溶液pH对吸附的影响 其他条件同1.3节,4-硝基苯酚溶液的pH对石墨烯平衡吸附量的影响见图4。

图4 溶液初始pH对吸附4-硝基苯酚的影响Fig.4 Effect of pH on the adsorption of 4-nitrophenol
由图4可知,石墨烯吸附4-硝基苯酚的平衡吸附量随着pH的增大而缓慢下降。石墨烯层状结构上含有大量的大π键,可与4-硝基苯酚上的羟基、羧基形成p-π共轭、与苯基形成π-π共轭而具有较强的吸附能力。4-硝基苯酚的电离程度与溶液pH有关,当pH较小时,4-硝基苯酚以分子形态存在为主,此时4-硝基苯酚与石墨烯的p-π、π-π共轭越强,因此溶液pH为1时石墨烯对4-硝基苯酚的吸附量最大,随着溶液pH 增大,4-硝基苯酚的离子化程度变强,石墨烯对它的吸附量也缓慢降低。当溶液pH高于4-硝基苯酚的酸度系数pKa=7.2后,4-硝基苯酚在溶液中以离子形态存在为主,此时石墨烯与它的静电作用能力最小,使吸附量达到极小值。由于不加酸碱时,4-硝基苯酚溶液的pH约为6.0,此时的平衡吸附量只比pH为1.0时的平衡吸附量略低(降低2.6%),因此,后续的实验过程固定溶液初始pH 为6.0。
2.2.3 溶液初始浓度对吸附的影响 其他要件同1.3节,4-硝基苯酚的不同初始浓度下石墨烯的平衡吸附率见图5。

图5 溶液初始浓度对吸附4-硝基苯酚的影响Fig.5 Effect of initial concentration on the adsorption of 4-nitrophenol
由图5可知,石墨烯对4-硝基苯酚的吸附率随4-硝基苯酚初始浓度的增大而逐渐减小。这是因为,一定量的石墨烯提供的活性吸附中心是有限的,即饱和吸附量为定值,当吸附达到平衡之后,石墨烯的吸附量已固定,此时继续增加4-硝基苯酚的浓度,石墨烯对4-硝基苯酚的吸附率呈现不断的降低。此外,同一初始浓度,石墨烯对4-硝基苯酚的吸附率随着温度的升高而增大,这表明温度的提高有利于石墨烯对4-硝基苯酚的吸附,即该吸附过程是一个吸热过程。
2.3 吸附等温线
用包括Langmuir(式4)、Freundlich(式5)、Temkin(式6)和Redlich-Peterson(式7)[11]等温吸附模型对吸附等温数据进行回归与关联,4个等温吸附模型的非线性形式如下:
(4)
(5)
(6)
(7)
式中,qm(mg/g)是吸附剂的单层饱和吸附容量,KL(L/mg)是与吸附自由能相关的Langmuir常数;KF和nF为Freundlich常数,分别代表吸附容量和吸附强度的常数;R是气体常数(8.314 J/(mol·K));T(K)是绝对温度;αT(L/mg)是Temkin等温常数,βT(J/mol)是与吸附能量相关的Temkin常数;KRP(L/mg)、αRP((L/mg)θ)和θ是Redlich-Peterson等温常数。
使用非线性方法通过决定系数(R2)和卡方值(χ2)确定最佳吸附等温线模型,其中卡方检验的数学表达式如下[12]:
(8)
式中,下标exp和cal分别表示实验数据和计算数据。对于非线性回归,仅通过决定系数(R2)确定最佳吸附等温模型是不合适的,而非线性卡方分析则是更好的方法[13]。如果模型计算值与实验数据相似,则χ2的值将很小,并且接近于零,而较高的χ2表示实验值与模型计算值之间的偏差较大。使用OriginPro 2015软件对于不同的吸附等温线模型拟合回归,其非线性拟合结果见图6、表1。

图6 吸附等温线的实验值与等温线模型的非线性拟合Fig.6 Experimental data of adsorption isotherm and non-linear fitting of the isotherm models

表1 等温吸附模型参数Table 1 Parameters of adsorption isotherm models
由表1可知,不同温度下的等温吸附数据采用Redlich-Peterson模型拟合的决定系数(R2)均大于其余三个模型,而且同一个温度下的卡方值χ2均小于其余三个模型,这表明Redlich-Peterson模型是描述石墨烯吸附4-硝基苯酚的最佳等温吸附模型,决定系数(R2)≥0.99,χ2≤0.28。Redlich-Peterson模型同时具有Langmuir和Freundlich等温线的特征,从而形成了一种混合吸附机制,可以进行多层和单层吸附[14]。该模型可以很好地描述各种吸附质浓度范围内的吸附平衡。模型中的指数θ在0~1之间,并且不同的θ值代表Redlich-Peterson模型表现为不同的模型:亨利定律(θ=0),Freundlich模型(0<θ<1,KRP≫1和αRP≫1),Langmuir模型(θ≈1)。由表1可知,拟合得到的参数θ,KRP和αRP值表明,三个不同温度下Redlich-Peterson模型表现为Langmuir模型(θ≈1)。因此,石墨烯吸附4-硝基苯酚的过程主要是单分子层吸附。
2.4 吸附热力学
石墨烯吸附4-硝基苯酚过程的热力学参数,包括吉布斯自由能(ΔG)、焓变(ΔH)和熵变(ΔS),可通过Van’t Hoff方程进行计算[15]。
(9)
ΔG=ΔH-TΔS
(10)

(11)
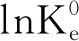
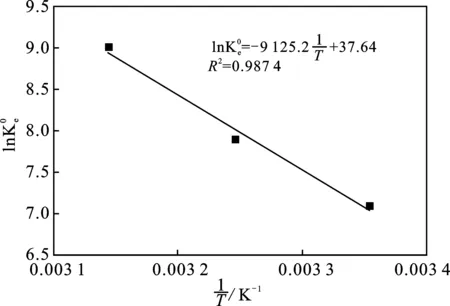
图与1/T拟合结果

表2 吸附过程热力学参数Table 2 Thermodynamic parameters for the adsorption
由表2可知,三个温度下ΔG均为负值证实了石墨烯吸附4-硝基苯酚的过程是自发进行。另外,ΔG的绝对值随温度的增大而逐渐升高,表明较高的温度有利于吸附的进行,这与ΔH>0的结果相一致,即该吸附是一个吸热过程。较高的焓变ΔH(75.88 kJ/mol)表明4-硝基苯酚在石墨烯上的吸附是化学吸附或者络合作用,这是因为化学吸附的焓变大于 29 kJ/mol,而络合作用的焓变介于8~60 kJ/mol[17]。ΔS>0表明该吸附是一个熵驱动过程而并非焓驱动。
2.5 吸附动力学
将0.15 g石墨烯和100 mL初始浓度为100 mg/L的4-硝基苯酚溶液放入250 mL锥形瓶中。在140 r/min振荡速度和298.15,308.15,318.15 K的温度下进行实验,定时取样分析,计算不同时间下石墨烯的吸附量,结果见图8。

图8 吸附动力学的实验值与动力学模型的非线性拟合Fig.8 Experimental data of adsorption kinetics and non-linear fitting of kinetics models
由图8可知,石墨烯对4-硝基苯酚的吸附速率和平衡吸附容量均随温度的升高而增大,表明4-硝基苯酚在石墨烯上的吸附是吸热过程,这与吸附热力学的结果一致。
采用拟一级(式12)、拟二级(式13)和Elovich(式14)反应动力学模型评估4-硝基苯酚在石墨烯上的吸附动力学[18]。
qt=qe[1-exp(-k1t)]
(12)
(13)
(14)
式中,k1(min-1)和k2(g/(mg·min))分别是拟一级和拟二级模型的速率常数;α和β是Elovich常数,分别代表初始吸附速率(g/(mg·min))和脱附系数(mg/(g·min))。
采用非线性回归方法,通过决定系数(R2)和卡方值(χ2)确定最合适的动力学模型,将方程(8)中的qe替换为qt即为此处的卡方值(χ2)表达式。通过OriginPro 2015软件对动力学实验数据进行拟合,结果见图8,回归得到的动力学参数列在表3中。

表3 吸附过程动力学参数Table 3 Parameters of adsorption kinetics models
由图8和表3可知,拟二级动力学三个不同温度下的R2最大(0.992 8~0.999 6)和χ2最小(0.019 5~0.422 7),4-硝基苯酚在石墨烯上的吸附动力学符合拟二级动力学。
将拟二级速率常数的对数lnk2与1/T作图,结果显示lnk2和1/T之间存在良好的线性关系,直线的斜率-6 238.6,截距12.97,决定系数(R2)为0.988 2。通过阿累尼乌斯公式k2=Aexp(-E/RT),根据上述拟合得到的斜率计算石墨烯吸附4-硝基苯酚的活化能(E)为51.87 kJ/mol。当吸附过程为物理吸附时,吸附质与吸附剂之间主要是作用力较弱的范德华力,其活化能不超过4.184 kJ/mol,而本文石墨烯吸附4-硝基苯酚的过程的活化能较大,这表明该吸附过程主要是化学吸附[19]。
3 结论
(1)以石墨为原料,通过氧化-还原法制备了石墨烯,用于吸附处理水中4-硝基苯酚,SEM和BET表明,石墨烯是一种多孔介孔材料,平均孔径为3.264 nm,比表面积为555.8 m2/g,是一种性能优异的吸附剂。
(2)pH为1.0时,石墨烯对4-硝基苯酚的吸附量最大,4-硝基苯酚的吸附率随石墨烯用量增大而上升,随4-硝基苯酚初始浓度的增大而逐渐减小,温度的提高有利于石墨烯对4-硝基苯酚的吸附,即该过程是一个吸热吸附。
(3)石墨烯吸附4-硝基苯酚的过程符合Redlich-Peterson等温吸附模型,为单分子层吸附。热力学参数ΔG<0,证实了4-硝基苯酚在石墨烯上的吸附过程可自发进行;ΔH=75.88 kJ/mol,表明该吸附是化学吸附或络合作用;ΔS>0,表明该吸附是一个熵驱动过程。
(4)4-硝基苯酚在石墨烯上的吸附符合拟二级动力学模型,吸附的活化能(E)=51.87 kJ/mol。
