Fe3O4/SiO2/P25的超声制备及对罗丹明B降解特性
2021-04-09刘峥何晓蔡辉东吴海霞冯庆革
刘峥,何晓,蔡辉东,2,吴海霞,冯庆革
(1.广西大学 资源环境与材料学院,广西 南宁 530004;2.华南理工大学 能源与环境学院,广东 广州 510006)
TiO2在降解甲醛、苯和VOCs等污染物的光触媒净化方面已有广泛应用[1-3],但TiO2仍存在难以回收等问题[4]。近年来,磁分离技术被广泛用于解决TiO2分离回收困难的难题,磁铁矿因其优异的化学稳定性和磁性被广泛应用于催化、分离等领域[2]。利用SiO2将磁铁矿包覆在其中,不仅可以防止Fe3O4氧化,还可提高复合材料的比表面积,抑制 TiO2电子空穴的复合[5-9]。
前人研究中多采用的有机硅源昂贵,且有毒,易造成环境污染。因此引入绿色的硅源,并利用超声波快速合成孔径分布均匀的纳米TiO2材料,成为超声化学的一个研究热点[10-12]。本文拟以农业副产物稻壳灰为硅源,商用P25为钛源,并引入磁性纳米Fe3O4微球,利用超声法制备Fe3O4@SiO2-P25光催化材料,并考察其对罗丹明B(RhB)染料的光降解性能。
1 实验部分
1.1 试剂与仪器
氯化铁、乙二醇、乙酸钠、氢氧化钠、聚乙二醇(PEG 200)、无水乙醇、罗丹明B(RhB)均为分析纯;二氧化钛(TiO2,P25),工业品;稻壳,农业回收废弃物;实验室用水为去离子水。
ZK-82A型真空干燥箱;DHG-9070A电热恒温鼓风干燥箱;SXZ-5-12NP箱式电阻炉;KQ2200DE数控超声波清洗器;722G可见分光光度计;BL-GX-V光化学反应仪;Nicolet is 50傅里叶红外光谱仪(FTIR);SU8020场发射扫描电子显微镜(FESEM);JDAW-2000B振动磁强计(VSM);DX-2700A X射线衍射仪(XRD);Axis Supra X射线光电子能谱(XPS);DTG-60H热分析仪(TGA-DTA)。
1.2 Fe3O4/SiO2/P25的制备
1.2.1 水玻璃的制备 稻壳经去离子水洗净后自然晾干,采用两段煅烧法进行煅烧[13],升温速率为5 ℃/min,至700 ℃后保持4 h,烧制成灰后自然冷却。将冷却后的稻壳灰和NaOH按照质量比10∶1.5混合,加入三口烧瓶,加入足量的水,直至完全浸没,搅拌充分后,升温至100 ℃,恒温反应2 h,立即抽滤,滤液即为水玻璃[14]。
1.2.2 Fe3O4的制备 称取5.4 g FeCl3·6H2O,用160 mL乙二醇溶解。加入14.4 g NaAc、聚乙二醇,将混合物转移至200 mL反应釜中,放入高温干燥箱中,200 ℃恒温8 h。冷却,用去离子水及无水乙醇多次洗涤后,再次放入高温干燥箱中,200 ℃恒温8 h,制得Fe3O4。
1.2.3 Fe3O4/SiO2(FS)的制备 0.1 g Fe3O4溶于80 mL无水乙醇中,超声分散3 min,加入2 mL水玻璃,20 mL去离子水,调节pH为7,搅拌30 min,利用磁铁分离,60 ℃真空干燥12 h,制得Fe3O4/SiO2(FS)。
1.2.4 Fe3O4/SiO2/P25的制备 FS溶于100 mL无水乙醇中,超声分散3 min,按照表1所示的不同配比,分别加入 0.5 g 的商用P25,超声20 min,利用磁铁分离,60 ℃干燥12 h,制得Fe3O4/SiO2/P25。

表1 不同配比制备Fe3O4/SiO2/P25复合材料Table 1 Preparation of Fe3O4/SiO2/P25 by different proportion
1.3 Fe3O4/SiO2/P25光催化降解RhB
配制浓度分别为5,10,15,20,25 μmol/L的RhB使用液。定量称取表1所制得的Fe3O4/SiO2/P25复合材料于石英管中,加入不同浓度的RhB溶液50 mL,暗反应30 min后开启光源,每间隔5 min取样,使用可见分光光度计在554 nm波长下检测RhB溶液的开始的吸光度(A0)和RhB溶液在每 5 min后的吸光度(At)后,换算浓度C0和Ct,采用公式(1)计算其降解率。测样结束后放回原石英管。
η=Ct/C0
(1)
2 结果与讨论
2.1 Fe3O4/SiO2/P25复合材料表征
选取③号Fe3O4/SiO2/P25复合材料进行物理化学性能表征。
2.1.1 形貌分析 图1为Fe3O4、Fe3O4/SiO2和Fe3O4/SiO2/P25的场发射扫描电镜图。

图1 不同材料的场发射扫描电镜图Fig.1 FESEM analysis of different materialsa.Fe3O4;b.Fe3O4/SiO2;c、d.Fe3O4/SiO2/P25
由图1a可知,Fe3O4微球颗粒均匀分布,直径为200~300 nm,而Fe3O4/SiO2表面较为光滑,样品发生团聚现象,但部分Fe3O4表面被SiO2包裹良好,没有发生团聚现象,见图1b。当包覆TiO2后,图1c和1d所示,周围附着TiO2粒子以及SiO2粒子,部分小颗粒样品聚集在一起。
表2为Fe3O4/SiO2/P25复合材料的EDS能谱分析结果。

表2 Fe3O4/SiO2/P25复合材料的EDS能谱分析结果Table 2 EDS analysis of Fe3O4/SiO2/P25 composites
由表2可知,Fe3O4/SiO2/P25复合材料存在Ti、Si、Fe元素,O、Si、Ti和Fe元素的占比分别为79.9%,4.35%,13.27%和2.49%,表明表面以Ti元素为主,TiO2粒子包裹在SiO2和Fe3O4表面。
2.1.2 XRD分析 图2 为Fe3O4、Fe3O4/SiO2、P25和Fe3O4/SiO2/P25的XRD图谱。

图2 不同材料的XRD图Fig.2 XRD patterns of different materials
由图2可知,Fe3O4微球颗粒在2θ=30.09,35.18,43.25,54.12,57.31,62.70°的衍射峰,分别属于Fe3O4的(220)、(311)、(400)、(422)、(511)、(440)晶面。Fe3O4微球颗粒和Fe3O4/SiO2出现衍射峰的位置基本一致,但Fe3O4/SiO2的衍射峰强度低于Fe3O4的衍射峰强度,推测为由于SiO2的加入,阻止了晶粒的长大和晶化,在23°位置有较低平的馒头峰,对应于无定型的SiO2。图2d为③号Fe3O4/SiO2/P25复合材料的XRD图谱,Fe3O4/SiO2/P25和P25都出现了典型的锐钛矿和金红石相两者混晶的衍射峰,以锐钛矿相为主,金红石相较少,归属于锐钛矿相的有A(101)、A(004)、A(200)、A(105)、A(211)、A(204)、A(215)和A(224)晶面(JCPDS No:21-1272),而归属于金红石相的有R(110)、R(101)、R(301)和R(112)晶面(JCPDS No:21-1276)。Fe3O4/SiO2/P25出现的衍射峰,与P25位置相一致,但明显弱于P25的衍射峰,这表明随着Fe3O4/SiO2的加入,P25的晶粒成长受到了抑制,同样晶化也受到了抑制。Fe3O4/SiO2/P25的颗粒表面仅在2θ=30.09°的位置出现了Fe3O4的衍射峰,其余位置并未出现和Fe有关的相,表明Fe3O4被SiO2和TiO2完好包覆。此外,还可能由于Fe和Ti两种离子半径大小相似,Fe3+可以进入到P25的晶体结构中,原本属于Ti4+的晶格位置被Fe3+占据,形成了铁钛固溶体[15]。
2.1.3 XPS分析 Fe3O4、Fe3O4/SiO2和Fe3O4/SiO2/P25的XPS分析结果见图3。


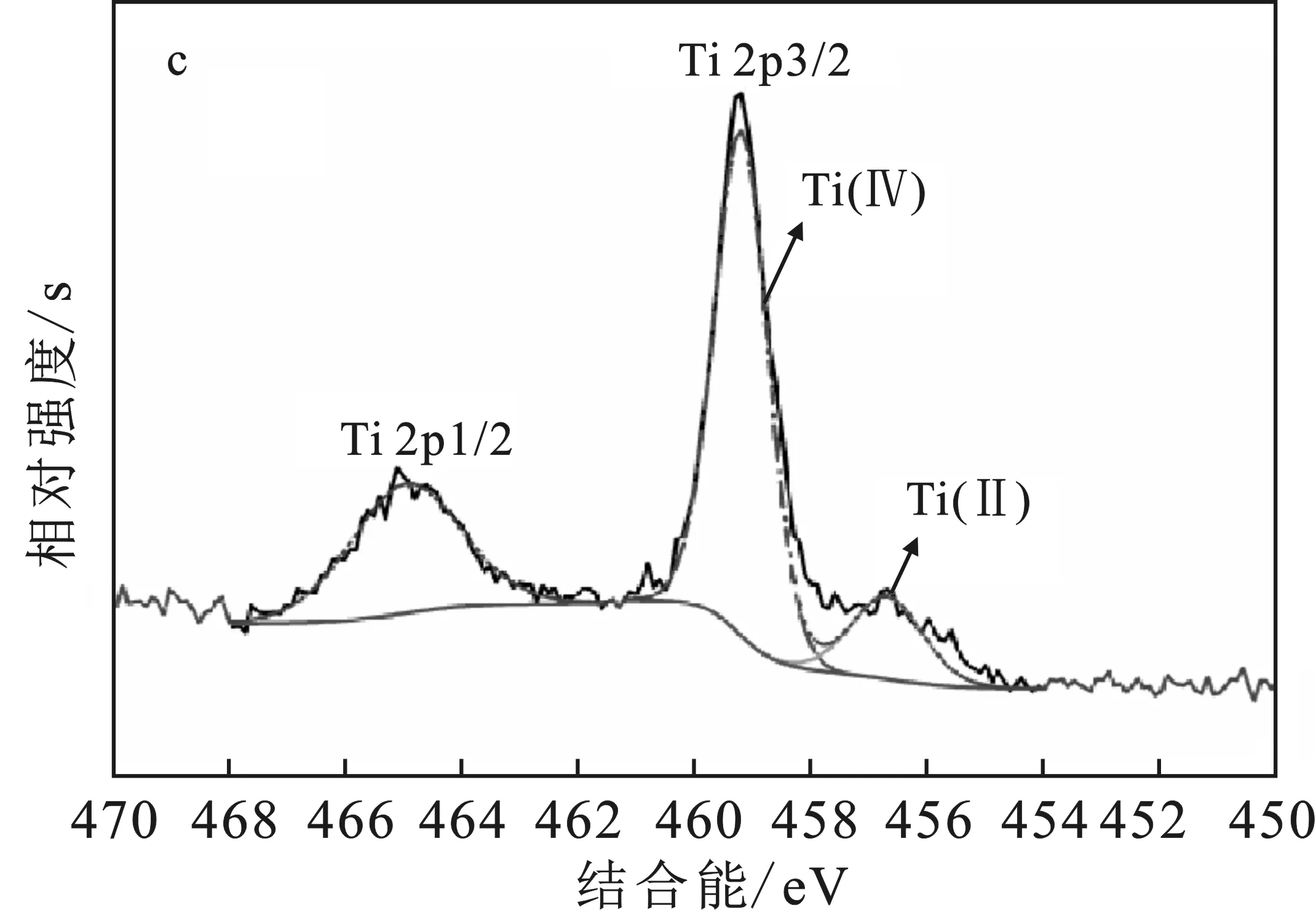
图3 三种材料的XPS图谱Fig.3 XPS analysis of three materialsa.Fe3O4、Fe3O4/SiO2和Fe3O4/SiO2/P25的XPS;b.Fe 2p的电子结合能;c.Ti 2p的电子结合能
图3a宽谱表明Fe3O4颗粒主要由Fe、O和C元素组成,出现了Fe 2p、Fe 3p、O 1s、O KLL和C 1s等特征峰,C元素源于合成Fe3O4过程引入的聚乙二醇等有机物的残余。Fe3O4/SiO2颗粒由Fe、O、Si、Na和C元素组成,Na 1s、Na KLL、Si 2s和 Si 2p 等峰表明水玻璃成功包覆在Fe3O4表面,但部分产物未完全水解,仍以Na2SiO3的形式存在。值得注意的是,Fe3O4/SiO2/P25颗粒表面没有发现Fe和Si的峰,仅由O、Ti和C元素组成,Ti 2p特征峰表明TiO2在颗粒表面被TiO2包覆完好。对Fe3O4/SiO2颗粒宽谱的Fe 2p进行分峰拟合,见图3b,在电子结合能707.4 eV和720.8 eV处对应于Fe3O4的 Fe 2p1/2 和Fe 2p3/2,这里在718.8,729.5 eV处没有发现明显的卫星峰或者肩峰说明不存在γ-Fe2O3[16],结合XRD的分析表明所制备的材料为纯的Fe3O4。在结合能为707.0 eV处的拟合峰代表Fe3O4中的三价铁Fe(Ⅲ),709.1 eV处的拟合峰代表Fe3O4中的二价铁Fe(Ⅱ)。图3c展示的结合能为459.3 eV和464.9 eV处的特征峰分别代表 Ti 2p3/2 和Ti 2p1/2。对Ti 2p3/2分峰拟合可知,459.2 eV 和456.7 eV结合能处分别代表了TiO2的Ti(Ⅳ)和Ti-O晶格的Ti(Ⅱ)。相比文献[17],Ti(Ⅳ)和Ti(Ⅱ)的电子结合能分别增大了0.90 eV和0.35 eV,这种偏移可能由于内层Fe元素和中间层Si元素对Ti、O原子周围电荷密度的影响。
2.1.4 FTIR分析 图4表示Fe3O4、Fe3O4/SiO2、P25和Fe3O4/SiO2/P25的FTIR吸收光谱。

图4 不同材料的FTIR光谱Fig.4 FTIR spectra of different materials
由图4可知,P25、Fe3O4/SiO2和Fe3O4/SiO2/P25的FTIR光谱上在3 400 cm-1附近处存在吸收峰,来自于复合材料表面液态水 —OH伸缩振动,1 635 cm-1归属于水峰。对纯的Fe3O4微球,1 200~2 500 cm-1出现很多小的杂峰,归属于Fe3O4制备过程中乙二醇等有机物的峰。对Fe3O4/SiO2样品,558 cm-1处吸收峰来自于Fe3O4的Fe—O峰,792 cm-1来自无定型Si—O—Si的对称收缩,而1 052 cm-1归属于Si—O—Si的反对称收缩振动峰。对于Fe3O4/SiO2/P25复合材料,Si—O—Si的反对称收缩振动峰向高波数偏移到1 098 cm-1处,且在933 cm-1处出现Si—O—Ti的特征峰,表明超声合成过程中Si—O—Si断裂后形成了Si—O—Ti键。
2.1.5 TGA-DTA分析 图5为③号Fe3O4/SiO2/P25复合材料的TGA/DTA曲线。

图5 Fe3O4/SiO2/P25复合材料TG/DTA曲线Fig.5 TGA/DTA curve of Fe3O4/SiO2/P25 composites
由图5的TGA曲线可知,在升温过程中,③号Fe3O4/SiO2/P25复合材料的质量下降约6.2%,可推测质量几乎没有损失。从TGA-DTA图来看,在25~1 000 ℃的稳定范围内有四个主要的吸热峰,25~258.5 ℃,峰值位置在49.2 ℃对应于无水乙醇挥发、水分去除产生的吸热峰;当温度>200 ℃ 时,Fe3O4会向Fe2O3转化,所以在258.5~744.1 ℃,峰值位置在564.5 ℃和678.5 ℃对应于γ-Fe2O3和ε-Fe2O3向α-Fe2O3转化的放热峰[18];744.1~1 000 ℃,峰值位置为908.9 ℃对应于TiO2锐钛矿相向金红石相转变。
2.1.6 磁分离分析 对Fe3O4、Fe3O4/SiO2和Fe3O4/SiO2/P25进行了磁滞回线的测定,并对③号Fe3O4/SiO2/P25进行了磁分离回收,结果见图6。


图6 不同材料的磁分离情况Fig.6 Magnetic separation of different materialsa.Fe3O4、Fe3O4/SiO2和Fe3O4/SiO2/P25的磁滞回线;b、c.Fe3O4/SiO2/P25的磁分离
由图6a可知,Fe3O4具有较高的饱和磁化强度(Ms),约为75 emu/g,矫顽力(Hc)和剩余磁化强度(Mr)都趋近于0,说明样品中的Fe3O4在室温下具有超顺磁性。Fe3O4/SiO2的Ms约为25 emu/g,Fe3O4/SiO2/P25的Ms约为8 emu/g。与Fe3O4、Fe3O4/SiO2相比,Fe3O4/SiO2/P25的Ms显著降低,其主要是TiO2、SiO2将Fe3O4包覆之后,样品中的磁性物质含量降低的原因。而Fe3O4/SiO2、Fe3O4/SiO2/P25的Hc和 Mr都趋近于0,说明复合材料在室温下也具有超顺磁性。尽管Fe3O4/SiO2/P25的饱和磁化强度远小于Fe3O4,但在磁分离应用中仍然具有足够的磁饱和强度,如图6b、6c中显示Fe3O4/SiO2/P25在没有磁铁吸引的情况下属于浑浊状态,而使用磁铁后吸引2 min后发生明显的聚集现象,完全被磁铁吸引。这说明该复合材料能够有效地进行磁分离,实现光催化材料的有效回收。
2.2 不同配比制备的Fe3O4/SiO2/P25复合材料光降解效果
在室温条件下,用15 W汞灯照射,使用Fe3O4/SiO2与P25不同配比制备(表1)得到的Fe3O4/SiO2/P25对20 μmol/L RhB溶液进行光催化降解30 min,结果见图7。
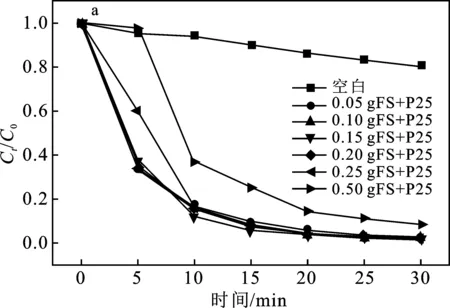

图7 不同配比制备Fe3O4/SiO2/P25复合材料对罗丹明溶液的降解效果Fig.7 Degradation effect of Fe3O4/SiO2/P25 samples at different ratio
由图7a可知,投加30 mg催化剂时,RhB溶液的降解率均达到了90%以上,其中以0.15 g Fe3O4/SiO2与0.5 g P25制备的③号复合材料的降解率最高,达到了98.54%。由图7b可知,在实验范围内,Fe3O4/SiO2/P25复合材料的ln(Ct/C0)与t呈线性关系,符合一级动力学规律。由表1可知,由0.15 g Fe3O4/SiO2与0.5 g P25制备而成的③号复合材料光催化降解RhB的k为0.121 8。
综合上述结果,可以认为Fe3O4/SiO2/P25复合材料制备的最佳配比为0.15 g Fe3O4/SiO2与 0.5 g P25。
2.3 Fe3O4/SiO2/P25复合材料光催化降解RhB性能
根据不同配比制备Fe3O4/SiO2/P25复合材料的光降解结果可知,由0.15 g Fe3O4/SiO2与0.5 g P25制备而成的③号Fe3O4/SiO2/P25复合材料光降解效果最佳,所以利用③号Fe3O4/SiO2/P25复合材料进行RhB光催化降解实验,分别从初始pH、初始浓度、催化剂投加量等方面考察该复合材料的光催化性能,以确定最佳光催化反应条件。
2.3.1 初始pH对RhB的降解影响 pH会影响光催化剂表面电荷、粒子聚集状态及底物的存在状态,从而影响光催化反应过程[19]。取初始浓度为 20 μmol/L的RhB溶液50 mL 7份,使用HCl和NaOH溶液分别调节RhB溶液pH,分别加入30 mg复合材料光催化剂,使用15 W汞灯进行光催化反应。考察不同初始pH对RhB的降解影响,结果见图8。


图8 ③号Fe3O4/SiO2/P25复合材料对不同初始pH值的RhB溶液的降解效果Fig.8 Degradation effect of ③ Fe3O4/SiO2/P25samples at different pH value
由图8可知,在溶液初始pH=7时降解率最高,为99.90%。pH=6和pH=7时k值分别为 0.218 9 min-1和0.215 5 min-1降解效果较好。RhB溶液的降解率先升高后降低,溶液pH=6或7时,降解效果最好。由于水溶液中,TiO2在pH=6.4时,阴阳离子正负电荷数值相等,达到等电点。RhB溶液在pH=6或7时降解效果最好,此时TiO2的表面正负电荷数值相等,促进光生电子与空穴的捕获过程,使其分离率提高,复合速率下降,从而提高材料降解RhB溶液的光催化效率。根据TiO2光催化机理,可以得出在光催化过程中会生成H+和OH-,所以溶液呈酸性或碱性时会影响溶液环境中的平衡,从而抑制光催化。故在降解过程中不需要调节pH。
2.3.2 催化剂投加量对RhB的降解影响[20]在15 W汞灯照射下,10 μmol/L RhB溶液加入催化剂,进行光催化反应。催化剂用量对RhB降解的影响见图9。


图9 ③号Fe3O4/SiO2/P25复合材料不同投加量下对罗丹明B溶液的降解效果Fig.9 Degradation effect of ③ Fe3O4/SiO2/P25samples at different dosage conditions
由图9可知,随着催化剂投加量的增加,RhB溶液的降解率逐渐升高。k值随着催化剂投加量的增加而增加。催化剂投加量越多,光催化效果越好。这可能因为是催化剂剂量增加,表面的活性位变多,量子效率得到提高,从而提高了光催化效率。当投加量为0.6 g/L时,RhB溶液的降解率可达到99.5%以上,但当投加量超过0.6 g/L时,其RhB降解率提升有限。考虑投加成本,采用0.6 g/L催化剂投加量为宜。
2.3.3 溶液初始浓度对RhB的降解影响[21]配制不同初始浓度的RhB溶液,催化剂投加量为 0.6 g/L 时,使用15 W汞灯进行光催化反应,考察RhB初始浓度对其降解率的影响,结果见图10。
由图10可知,当RhB溶液初始浓度为10 μmol/L 时,其降解率为99.2%。此后随着初始浓度的增加,RhB溶液的降解率有所下降。不同初始浓度的RhB溶液ln(Ct/C0)与t之间呈线性关系,符合一级反应动力学规律。根据线性回归方程求得各个浓度的k值。浓度为10 μmol/L时,k值最大为0.122 1 min-1,这说明③号Fe3O4/SiO2/P25复合材料对该浓度下RhB溶液光催化降解效果较好。原因可能是随着RhB溶液浓度的增加,其作为一种染料对光的吸收作用增加,RhB溶液透光率降低。同时,由于光催化反应的反应效率与自由基的形成以及自由基与RhB的反应有密切的联系。而催化剂表面的活性位点被大量RhB粒子覆盖,使得自由基产生减少,从而导致了光催化效率的降低。此外,RhB浓度的增大,使得中间产物的反应增多,并加大了各种降解物之间的竞争,也影响到了光催化效率。因此,选择溶液初始浓度以10 μmol/L最佳。

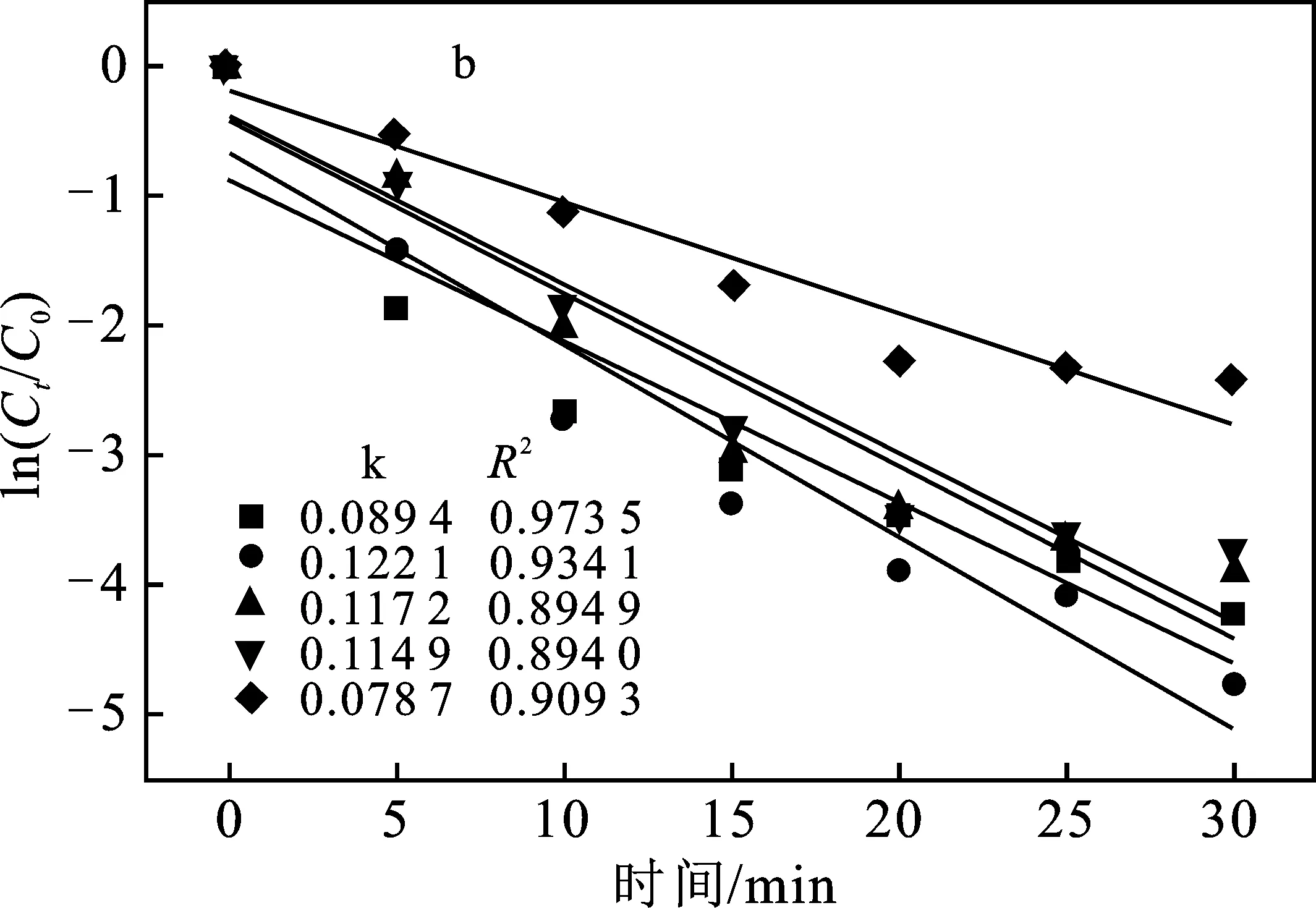
图10 ③号Fe3O4/SiO2/P25复合材料对不同初始浓度RhB溶液的降解效果Fig.10 Degradation effect of Fe3O4/SiO2/P25 samplesat different initial concentration
3 结论
(1)以农业副产物稻壳灰作为硅源,以商用P25为钛源,引入磁性纳米材料Fe3O4微球,经超声协助,制备Fe3O4/SiO2/P25复合材料,0.15 g Fe3O4/SiO2与0.5 g P25即m(Fe3O4/SiO2)∶m(P25)=0.3所制备的③号Fe3O4/SiO2/P25复合材料光催化效果最佳,且降解的溶液最佳pH为6或7。
(2)Fe3O4粒子周围附着TiO2粒子以及SiO2粒子,部分Fe3O4表面被SiO2包裹良好。TGA-DTA表明,Fe3O4/SiO2/P25的质量几乎没有损失,900 ℃以后,Fe3O4/SiO2/P25复合材料的TiO2晶型由锐钛矿相全部变为金红石相。Fe3O4/SiO2/P25在室温下具有超顺磁性,且能有效地进行磁分离。
(3)Fe3O4/SiO2/P25复合材料对RhB溶液的最佳降解条件为:pH=7,投加量为0.6 g/L,RhB初始浓度为10 μmol/L,此时最高降解率可达99.90%。
