自然光和UV辐照下二级出水DOM及毒性的变化
2021-03-30张世莹马晓妍郝丽伟张纬尧王晓昌周进宏西安建筑科技大学陕西省环境工程重点实验室西北水资源与环境生态教育部重点实验室陕西西安70055山东省城建设计院山东济南50000西安市第五污水处理厂陕西西安700宝鸡文理学院地理与环境学院陕西宝鸡70
张世莹,马晓妍*,董 珂,郝丽伟,张纬尧,李 莹,王晓昌,周进宏(.西安建筑科技大学,陕西省环境工程重点实验室,西北水资源与环境生态教育部重点实验室,陕西 西安 70055;.山东省城建设计院,山东 济南 50000;.西安市第五污水处理厂,陕西 西安 700;.宝鸡文理学院地理与环境学院,陕西 宝鸡 70)
目前污水处理技术正在向着低碳、绿色、安全的方向发展,近年来世界各地逐渐建立了基于拟自然处理过程的污水处理单元及系统[1],例如浅池处理系统[2]、生态储存单元[3]、人工湿地[4]等,对二级处理出水进一步净化从而降低常规污水处理系统难以去除的污染物.自然净化过程是物化作用、光解和生物降解等复杂过程共同作用的结果.并且,与缓慢的生物作用相比,自然光解作用速度更快[5].因此,自然光解过程更值得引起关注.
污水厂二级出水含有残留的溶解性微生物代谢产物、天然有机物和痕量有机物[6]等溶解性有机物(DOM),其中小分子痕量有机污染物和大分子溶解性物质是污水毒性效应的主要来源[7-8].痕量有机污染物较难被传统的污水处理工艺降解[9],因而污水厂二级出水中仍含有较多内分泌干扰物、杀虫剂、药品和个人护理产品等痕量有机污染化合物[10],可引起光合抑制效应、内分泌干扰效应、DNA 损伤和突变等多种生物毒性效应[11-13].前期研究结果表明,二级处理出水仍具有遗传毒性和植物毒性[14-15].二级出水中残留的DOM也可与消毒剂产生消毒副产物,从而增加出水的遗传毒性[16].由于二级出水中大分子溶解性有机物组分复杂、结构各异,因而常采用荧光特性表征其变化.
大量研究表明在自然净化过程中农药[17-18]、抗生素[19-23]、药物[24-26]等痕量有机污染物可通过自然光光解作用得以衰减.痕量有机物既可以通过自然光直接光解[27],也可以通过被自然光照下由污水中的有机物产生的水生活性氧(ROS)氧化从而间接光解[28].Niu等[29]指出自然光照对污水中的DOM有转化和降解效果.大量研究也表明 UV辐照可以降解DOM中的腐殖质组分[30-32].因而,自然光照和UV辐照均能转化和降解水体中DOM,但是在不同光源下哪些毒性效应可通过光照过程降低以及具体效率如何的研究较少.
因此,本研究对比了自然光照和 UV辐照对二级处理出水水质、DOM 荧光特性的改变以及对二级处理出水遗传毒性和植物毒性的削减特性,同时深入分析了毒性效应削减的成因.这对污水处理技术的改进和水环境生态安全具有重要意义.
1 材料与方法
1.1 自然光照及UV辐照实验
本研究中,污水取自西安市某污水处理厂二沉池出水.污水处理厂处理能力为2×105m3/d,收集的市政生活废水采用厌氧-缺氧-好氧生物处理及紫外线消毒处理工艺.二级出水水质指标如表1所示.为了避免吸附截留痕量有机污染物,水样首先经0.8μm Whatman GF/C玻璃纤维膜(预先450℃灼烧5h)过滤以去除水中大颗粒固体悬浮物.自然光照实验在夏季楼顶一处采光良好的区域进行,平均温度为(30±3)℃.在5L的圆柱形烧杯中倒入水样,进行自然光照处理.在自然光照的第 0,4,7,11h采集水样.在辐照时间内,利用照度计(中国北京师范大学广电仪器)测量自然光在297nm、365nm和400~1000nm波长处的光强,具体如表2所示.同时,将烧杯用锡箔纸裹住,与其他样品进行相同的处理,在自然光下辐照11h,作为黑暗对照.

表1 污水厂二级处理出水理化指标(mg/L)Table 1 Physicochemical indexes of secondary treatment effluent from wastewater treatment plant(mg/L)
UV辐照实验是在批处理反应器上进行,每个反应器上放有1个有效体积为5L的圆柱形烧杯、磁力搅拌器和位于反应堆中心的 16W 浸入式低压汞灯,具体如图1所示.低压汞灯的套管为石英玻璃,波长为254nm.采用UV-C型辐射计(中国北京师范大学广电仪器),在 254nm处测量辐照度为 31.7W/m2.为了使反应器温度保持在(25±1)℃,将反应器置于恒温设备中,在UV辐照处理的第0,0.5,1,2,4,8h分别采集水样.在实验过程中设置黑暗对照组.

图1 UV辐照实验装置示意Fig.1 Schematic diagram of UV irradiation experiment device
将采集的水样分别取 100mL水样进行理化指标测定,取2L水样进行固相萃取浓缩用于除草剂浓度的测定和生物毒性的测定.
1.2 理化指标的测定
将不同时间采集的水样用紫外-可见分光光度计(中国)测定 UV254,用总有机碳分析仪(日本岛津)测定TOC.三维荧光光谱采用F-7000荧光分光光度计进行测定.激发波长(Ex)范围为 220~400nm,波长间隔 5nm,发射波长(Em)范围为 280~500nm,波长间隔2nm.将三维荧光光谱图按照Chen等[33]的方法分成5个区域(表2),分别在相应波长范围内,对三维荧光光谱选i区域进行体积积分,积分公式下:

表2 各荧光区域积分范围Table 2 Integral range of each fluorescence region

式中:φi为区域的荧光强度积分值;λex为激发波长,nm;λem为发射波长,nm; I(λexλem)为相对应的荧光强度.二级出水中有色溶解性有机质(CDOM)即采用 φ定量表征.
1.3 毒性效应检测
1.3.1 样品预处理 固相萃取的操作步骤如下.首先依次用 10mL正己烷和二氯甲烷(1:1)混合物、10mL甲醇、10mL超纯水活化 Oasis HLB(waters,6mL,500mg),然后以 5~10mL/min速度上样.待上样完成后,用 10mL的超纯水清洗柱子,然后抽真空30min,以去除柱子里面的水分.分别用10mL甲醇、10mL正己烷和二氯甲烷(1:1)混合物洗脱柱子.在氮吹仪上 40℃水浴加热条件下缓缓吹至尽干,并用2mL甲醇溶解.将提取物等分成两部分,一部分用于除草剂的液相色谱-质谱的测量,另一部分在40℃水浴加热条件下缓缓吹至尽干,并用1% DMSO溶解,用于生物毒性测试.
1.3.2 umu遗传毒性检测 用鼠伤寒沙门氏菌Salmonella typhimurium TA1535/pSK1002菌株作为umu遗传毒性检测的试验菌种,遗传毒性检测参照ISO13829遗传毒性检测方法[34].umu实验阳性对照采用 4-硝基喹啉-1-氧化物(4-NQO),1%的 DMSO溶液作为空白.将样品用1% DMSO溶液以0.5倍系数梯度稀释,形成不同的浓度梯度样品用于检测.以阳性对照4-NQO的浓度(C)或者水样的浓缩倍数(N)为横坐标,以诱导比率 IR为纵坐标,进行线性拟合,作剂量-效应曲线,并计算诱导率IR=1.5时样品的浓度,记为IR1.5.
1.3.3 植物毒性检测 实验采用的小球藻是从中国科学院野生生物种质库—淡水藻种库购买的蛋白核小球藻(FACHB-1227).植物毒性的检测是采用郑凯等[35]建立的基于叶绿素荧光成像技术的光合抑制毒性的检测方法.样品检测在96孔平底黑色聚苯乙烯微板(美国 Corning公司)上进行,样品按照0.5倍系数稀释成7个浓度梯度,每个浓度设置三个平行,每个样品设置两个板间平行.阳性对照为农药敌草隆(Diuron),空白对照为 1% DMSO 溶液.将50μL样品或对照暴露于处于对数期的 300μL小球藻液中,待在恒温光照振荡培养箱中培养2h后采用大面积叶绿素荧光成像系统 Maxi-Imaging-PAM(德国 WALZ公司)测定荧光量子产率 Y(II)值,同时计算抑制率.以阳性对照敌草隆(Diuron)的浓度(C)或者水样的浓缩倍数(N)为横坐标,以量子产率Y(II)为纵坐标,作剂量-效应曲线获得样品或者阳性对照的 EC50(半数效应浓度)值.
1.3.4 毒性效应检测的定量表征 为了便于不同样品间进行比较,将样品的浓度转换为等效毒性效应的阳性对照的浓度.样品的 umu遗传毒性和植物毒性的当量浓度分别用TEQ4-NQO和TEQdiuron表示,计算方法如式(2)和式(3)所示.

1.4 除草剂浓度检测及潜力计算
利用 HPLC/MS进行全扫描识别出二级处理水含有西玛津、阿特拉津、莠灭净、特丁津、敌草隆和扑草净 6种除草剂,使用配备有 Acquity BEH C18柱(100m×2.1m×1.7m)的Acquity UPLC-XEVO TQ MS(UPLC/MS,Waters,USA)定量分析水样中除草剂浓度.以单一化合物浓度为5μg/L 和 50μg/L 考察回收率,分别为 120.0%~124.4%,110.0%~113.0%,104.0%~111.8%,102.0%~103.0%,104.0%~108.4%和104.0%~104.2%.流动相采用溶剂 A(98:2水/甲醇+0.1%甲酸)和溶剂 B(乙腈),在流速 0.4mL/min下,随着时间从 0min到0.25min,溶剂A和溶剂B分别保持90%和10%不变,从 0.25min到 4min时,溶剂 A 降到 2%,溶剂 B升到98%,从4min到5min时,溶剂A和溶剂B保持不变,从5min到5.01min时,溶剂A又升到90%,溶剂B又降到10%,从5.01min到6min时,溶剂A和溶剂B分别保持90%和10%不变.
植物毒性主要受光合抑制潜力的影响,分别配制不同浓度梯度的除草剂溶液并进行植物毒性检测以获得每种除草剂的EC50.值根据式(4),以敌草隆为单位换算,计算不同除草剂的抑制潜力.式(4)中RPx为除草剂的抑制潜力,EC50(diuron)为敌草隆的EC50值,EC50(i)为第i种除草剂的EC50值.

2 结果与讨论
2.1 理化指标的变化
2.1.1 TOC和 UV254对二级处理出水分别进行了11h的自然光照和8h的UV辐照(平均光强31.7W/m2),每组光照设置了黑暗对照.如表3所示,在UV辐照下,二级处理出水的 TOC和 UV254分别降低了 21%和55%.在自然光照下,TOC和UV254值并没有明显降低.这说明 UV辐照对二级处理出水中有机物的矿化比自然光照有更好的效果.UV254值和物质所含芳香环数量有关[36].UV辐照下二级处理水UV254值明显降低,说明 UV有助于削减 DOM 分子的芳香性.这也与Zhang等[37]的研究结论一致.
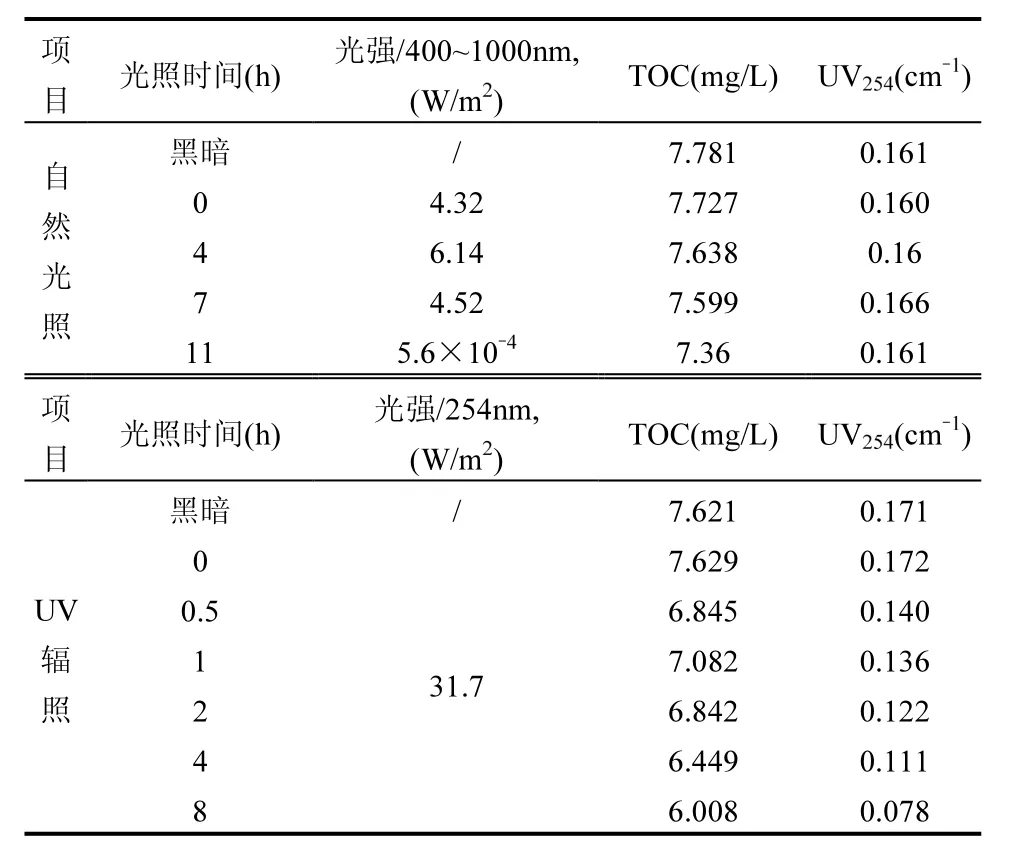
表3 自然光和UV辐照下二级处理水TOC和UV变化Table 3 TOC and UV changes under natural light and UV irradiation
2.1.2 有色溶解性有机质(CDOM)浓度变化 如图2所示.随着自然光照和UV辐照时间的延长,各组分荧光强度积分值(φi)逐渐下降.在自然光照超过7h之后,荧光强度基本保持不变,说明CDOM的去除效果已稳定.在自然光照下,Ⅰ区至Ⅴ区的去除率分别为7.53%、27.30%、42.97%、22.66%和44.64%,CDOM总去除率为 38.70%.富里酸类(42.97%)和腐殖酸类(44.64%)在 5种 CDOM 组分中去除效果较好,优于蛋白类物质和代谢产物类物质(图2a).这和薛爽等[38]对天然太阳光辐射下水体中DOM组分的光降解研究结果一致.自然光照中设置的黑暗对照组各组分荧光强度积分值在实验过程中基本保持不变.UV辐照下,Ⅰ区至Ⅴ区的CDOM去除率分别为49.34%、65.45%、44.48%、33.67%和43.87%,CDOM总去除率为41.47%(图2b).UV辐照设置的黑暗对照组水样各组分荧光强度积分值在实验过程中基本保持不变.由此可见,UV辐照相对于自然光照对二级处理出水中蛋白质类去除效果较好,对于代谢产物类、富里酸类和腐殖酸类物质的去除差异不大.UV辐照对二级处理出水CDOM的总去除率略高于自然光照.结合TOC的变化可知,两种光照对二级处理出水中CDOM 的矿化程度作用较低,可能主要是将 DOM转化为小分子有机物.Liu等[39]的研究表明,在UV辐照下 CDOM 组分中类腐殖质组分比类蛋白组分更加容易产生光降解.本文在 UV辐照下类蛋白组分降解效果优于类腐殖质组分.这可能和DOM电子基团和分子量差异有关[31]
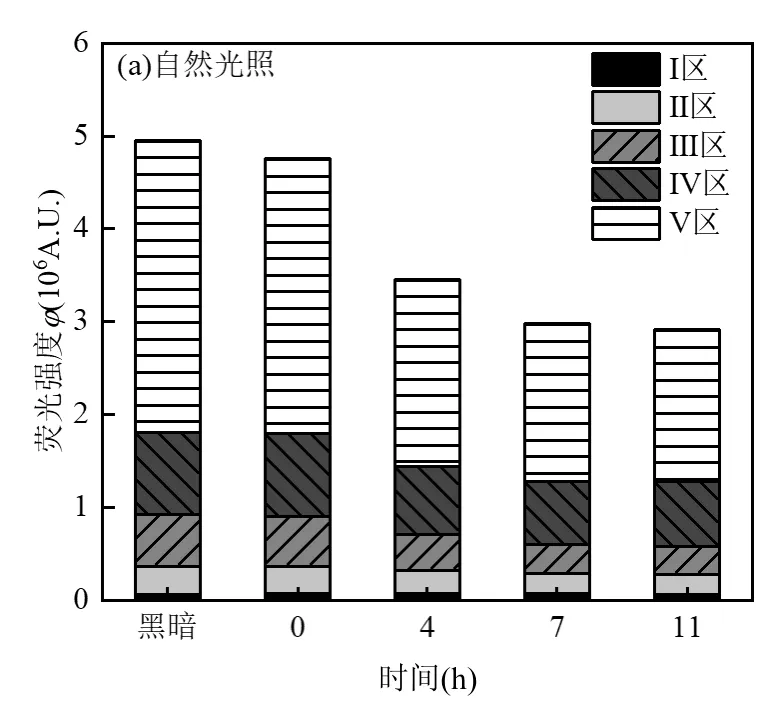

图2 自然光照和UV辐照下二级处理出水除草剂CDOM组分变化Fig.2 Changes of CDOM components in the secondary treated water herbicide under natural and UV light
2.2 毒性效应分析
由图 3可知,自然光照和 UV辐照下,遗传毒性和植物毒性均随着光照时间的增加而逐渐降低.自然光照11h后,遗传毒性被显著削弱,植物毒性从7h到 11h基本没有变化,说明遗传毒性和植物毒性的削减效果已趋于稳定.UV辐照4h之后,遗传毒性和植物毒性基本上也不再削减.在自然光照下,随着辐照时间的增加,二级处理出水的遗传毒性由5.41μg/L降至0.36μg/L,削减率为93.3%.植物毒性经过11h光照由314.68ng/L降至261.12ng/L,削减率为17.0%.对比 UV 辐照,经过 8h辐照,遗传毒性由3.20μg/L降至1.25μg/L,植物毒性由68.57ng/L降至13.23ng/L,遗传毒性和植物毒性削减率分别为60.9%和80.7%.Jia等[40]的研究发现,UV光解作用可使再生水中植物毒性降低 52%,遗传毒性增加 35%.植物毒性与本文研究结果一致,遗传毒性与本文研究结果相反,这可能与所施加的紫外灯类型,辐射强度,以及水体pH值等差异有关[41].自然光照与UV辐照设置的黑暗对照组中,其遗传毒性及植物毒性在两组光照时间内基本保持不变.
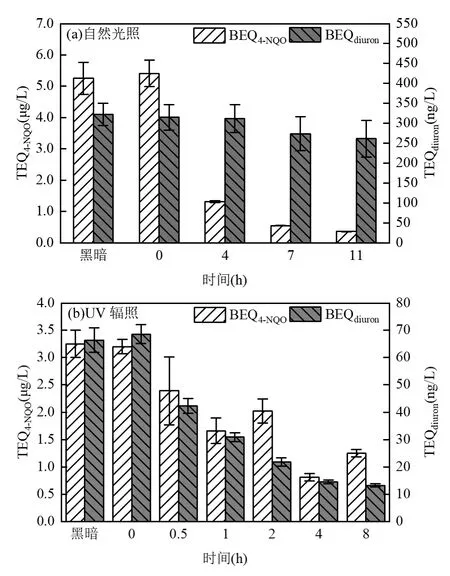
图3 自然光照和UV辐照下二级处理出水遗传毒性和植物毒性变化Fig.3 Changes in genotoxicity and plant toxicity of secondary treated water under natural and UV light
2.3 毒性效应变化成因分析
2.3.1 遗传毒性变化成因解析 对二级处理出水CDOM荧光强度和遗传毒性相关性分析结果如表4所示,自然光照下,二级处理出水总荧光强度和遗传毒性有显著的相关性(r=0.993,P<0.01).UV 辐照下,总荧光强度和遗传毒性(r=0.848,P<0.05)也有显著的相关性.自然光照下Ⅲ区(r=0.988,P<0.05)、Ⅳ区(r=0.992,P<0.01)和Ⅴ区(r=0.995,P<0.01)CDOM 组分和遗传毒性相关性显著,说明腐殖质和微生物代谢产物对遗传毒性贡献较大.UV辐照下,遗传毒性和I(r=0.886,P<0.05)、II(r=0.903,P<0.05)、 III(r=0.839,P<0.05)、IV(r=0.860,P<0.05)区物质均有显著相关性,这说明遗传毒性也有可能和类蛋白组分有关.DOM 分子结构复杂,可以与多种物质结合,DOM和遗传毒性的关系还需要进一步研究.

表4 自然光和UV辐照下5个CDOM组分和遗传毒性的相关系数Table 4 Correlation coefficient of 5CDOM components and genotoxicity under natural light and UV light
2.3.2 植物毒性变化成因解析 已有研究表明水体中的植物毒性主要来源于除草剂,非除草剂类化合物对植物毒性的贡献可以忽略不计[42-43].本研究在二级处理出水中共检测到6种除草剂,其EC50值及RPx值如表5所示.在自然光照和UV辐照下,二级处理出水中除草剂浓度的变化如图4所示.在11h自然光照下,6种除草剂总浓度由初始的15.2ng/L最终降至12.0ng/L,降解率为21.1%,在8h的UV辐照下,除草剂浓度由初始的 11.5ng/L最终降为 0,降解率为100%.显然UV辐照对除草剂的降解效果优于自然光照.自然光照与 UV辐照实验设置的黑暗对照组中,6种除草剂浓度基本保持不变.
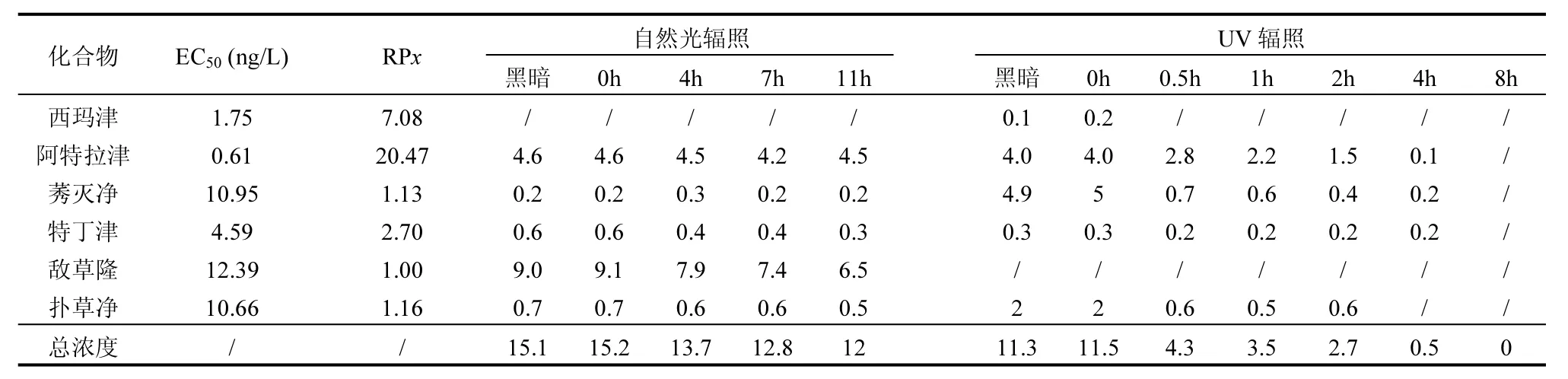
表5 除草剂光合抑制潜力及浓度(ng/L)的变化Table 5 Changes of photosynthetic inhibition potential and concentration(ng/L)of herbicides
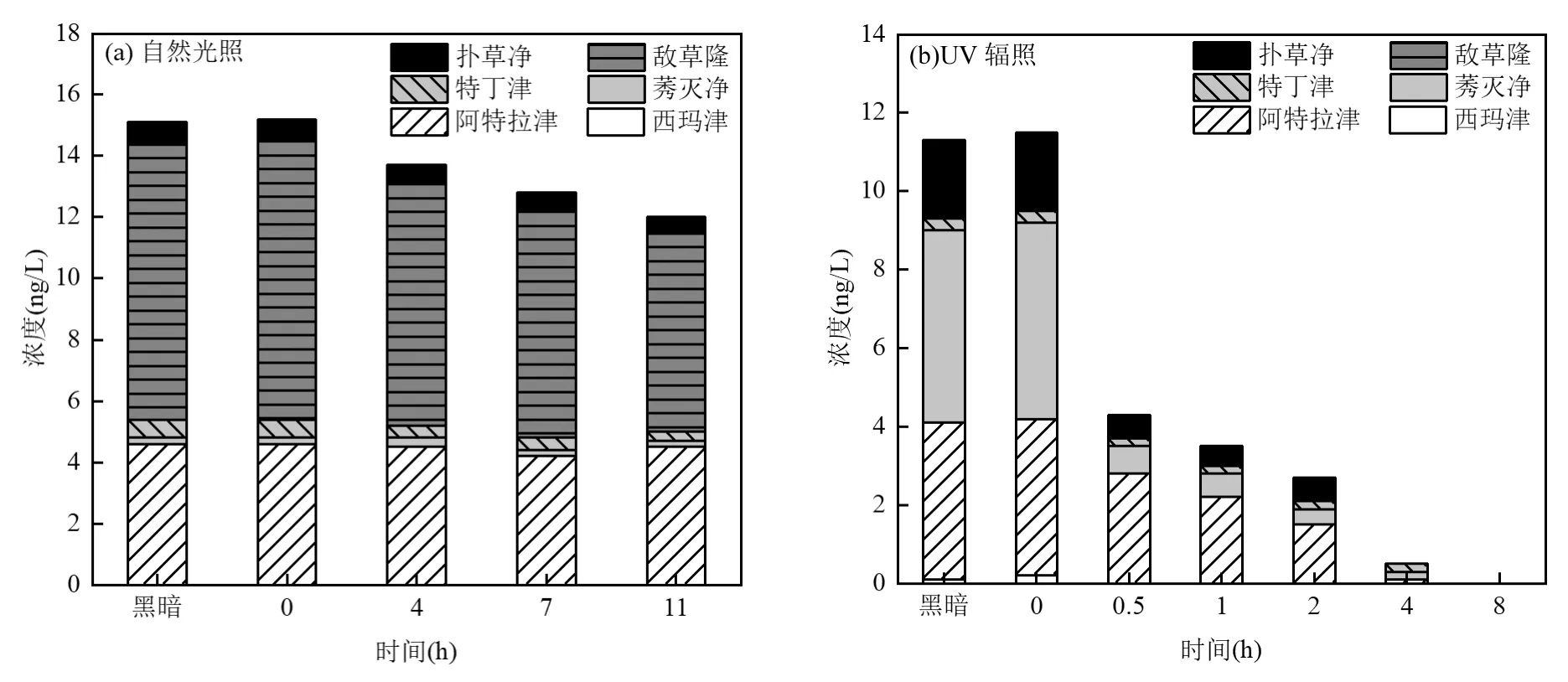
图4 自然光照和UV辐照下二级处理出水中各除草剂浓度变化Fig.4 Changes of herbicide concentrations in secondary treated water under natural light and UV light irradiation
阿特拉津的RPx为20.47(表5),为6种除草剂中的最大值,并且在二级处理出水中的浓度也较高.这说明三嗪类除草剂阿特拉津对二级处理出水的植物毒性贡献最大.如图 4所示,阿特拉津在 11h自然光照下几乎没有降解(由4.6ng/L降至4.5ng/L),而在8h的UV辐照下降解较完全(由4.0ng/L降至0ng/L).阿特拉津浓度在自然光照与UV辐照随时间变化如图5所示.从图5可以得出,阿特拉津在UV光照下的表观降解速率常数为 0.2225h-1,而在自然光照下,阿特拉津的表观降解速率常数为 0.0033h-1,在黑暗条件下,阿特拉津和敌草隆基本上不发生降解.Yang等[44]指出阿特拉津是一种难降解的污染物,但可以在254nm UV照射过程中被降解.由此可见,自然光中的紫外线强度较低是自然光对阿特拉津降解效果较差从而导致二级处理出水植物毒性削减较少的原因.另外,Fan等[45]的研究表明在UV辐照下腐殖酸的存在可以提高阿特拉津的光降解效果,本研究中 UV辐照组初始水样腐殖酸组分(Ⅴ区)荧光强度高于自然光照组,这可能也是阿特拉津降解差异的原因.
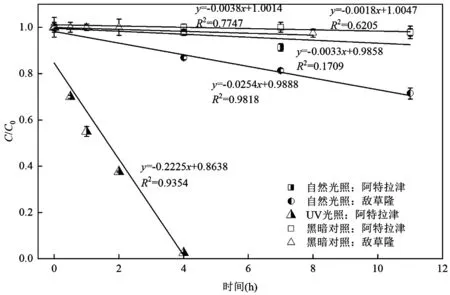
图5 阿特拉津在自然光照和UV辐照下的降解动力学曲线Fig.5 Degradation kinetics of Atrazine under natural and UV light irradiation
3 结论
3.1 UV辐照下,二级处理出水的TOC和UV254分别降低了 21%和 55%;但在自然光照下,TOC和UV254值并没有明显降低.UV辐照对二级处理出水的TOC和UV254的降低效果要高于自然光照.
3.2 UV辐照对蛋白质I类和II类的去除能力强于自然光,去除率分别为 49.34% vs.7.53%和 65.45% vs.27.30%.自然光和UV均对二级处理出水遗传毒性有较好的削减作用,其削减率分别为 93.3%和60.9%,并且遗传毒性和 CDOM 荧光强度有显著相关性.
3.3 UV辐照对植物毒性的削减效果优于自然光照,削减率分别为80.7% 和17.0%.阿特拉津对二级处理出水植物毒性贡献最大,并且 UV较自然光对阿特拉津的降解作用显著,表观降解速率常数分别为0.2225h-1和0.0033h-1;对阿特拉津极弱的降解能力是自然光对植物毒性削减效果较差的主要原因.
