贝氏柯克斯体IV型分泌系统效应蛋白研究进展
2021-03-28赵明亮付梦姣张家宁周冬生熊小路
张 珊, 赵明亮, 付梦姣, 张家宁, 周冬生, 熊小路
贝氏柯克斯体是一种专性细胞内寄生的嗜酸性革兰阴性小杆菌,为Q热病原。Q热是一种重要的人兽共患病,人Q热主要传染源是贝氏柯克斯体感染的家畜(如牛,羊),其排出贝氏柯克斯体污染环境[1],人吸入少量贝氏柯克斯体气溶胶而发病[2-3]。Q热分为急性和慢性2种类型。急性Q热为贝氏柯克斯体进入体内引起急性发病,主要有头痛、发热等类似流感临床表现。慢性Q热为贝氏柯克斯体持续存在体内建立慢性迁延感染,可引起心内膜炎、肝炎、骨髓炎等并发症[1],严重可导致死亡。Q热为一种全球广泛分布传染病,Q热暴发流行已经成为世界性公共卫生问题。
贝氏柯克斯体除具有脂多糖内毒素外,其还具有重要的致病因素——Dot/Icm IV型分泌系统(Dot/Icm IV secretion system,T4BSS)。其分泌至宿主细胞的效应蛋白(效应子),目前已鉴定了150多个。随着贝氏柯克斯体体外培养[4]和遗传操作技术[5]的建立,转座子插入和同源重组技术被广泛应用于研究T4BSS基因突变或缺失对贝氏柯克斯体胞内生存的影响。Weber等发现Cbu0041(cirA)、Cbu0388、Cbu0425(cirB)、Cbu0937(cirC)、Cbu2052(cirD)和Cbu2059(cirE)等T4BSS基因的插入失活会导致贝氏柯克斯体无法在小鼠巨噬细胞系中生存[6]。Newton等发现,Cbu1751(cig57)、CoxCC8和Cbu1754等T4BSS基因的插入失活影响贝氏柯克斯体在HeLa细胞中的繁殖[7]。Crabill等构建了贝氏柯克斯体突变体文库,发现贝氏柯克斯体Cbu0414、Cbu0513、Cbu0978、Cbu1387、Cbu1524和Cbu1752等T4BSS基因插入突变株在宿主细胞内生存能力下降[8]。
本文对近十多年来贝氏柯克斯体T4BSS效应蛋白的研究进行综述,以便从分子水平认识贝氏柯克斯体的致病机制。见图1。
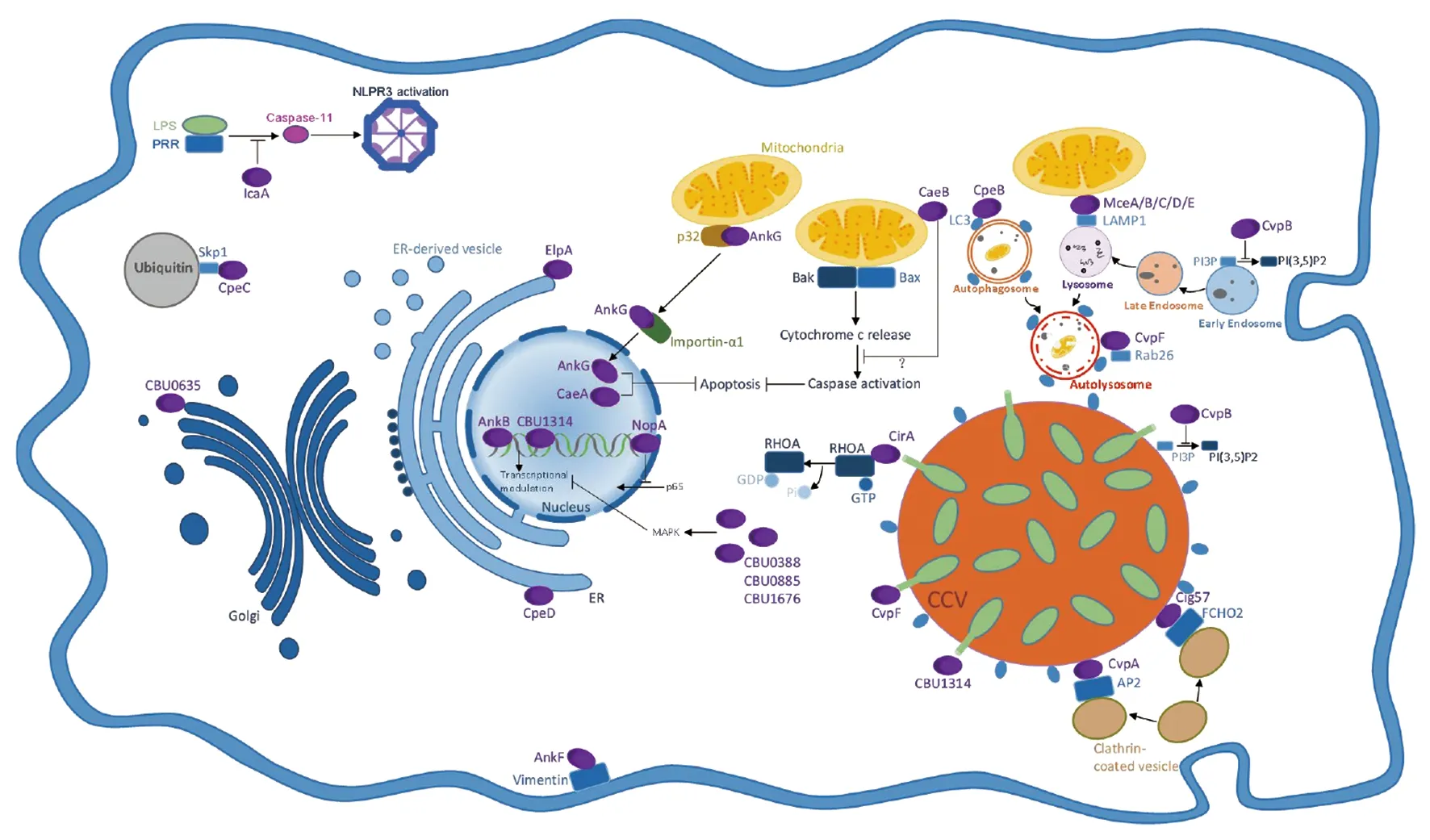
图1 贝氏柯克斯体Dot/Icm IV型分泌系统效应蛋白调控宿主细胞的信号通路Fig.1 Signaling pathways of host cells regulated by Dot/Icm type IV secretory system effector proteins in Coxiella burnetii
1 促进贝氏柯克斯体寄生泡发育成熟
贝氏柯克斯体为专性胞内寄生菌,其首先与宿主细胞的膜表面受体αvβ3整合素等作用,诱导宿主细胞胞吞将其摄入胞内,形成含贝氏柯克斯体的吞噬体。吞噬体循经典的内吞途径,依次与早期内体、晚期内体、溶酶体融合并不断酸化,形成贝氏柯克斯体寄生泡(Coxiella-containing vacuole,CCV)[9]。在此过程中,CCV还与宿主细胞自噬体和内体囊泡发生异型融合,最终在宿主细胞内发育成一个占据胞质大部分空间的成熟CCV[10]。成熟的CCV是贝氏柯克斯体在细胞内建立稳定感染的必要场地。
柯克斯体囊泡蛋白(Coxiella vacuolar protein,Cvp)为T4BSS效应蛋白,其定位于CCV内。Larson等研究发现效应蛋白基因cvpB、cvpC、cvpD和cvpE缺失突变株在细胞内的复制能力下降,形成的CCV有明显缺陷,而cvpD和cvpE基因回补株可以在一定程度上填补该缺陷[11]。
磷脂酰肌醇3-激酶(Phosphatidylinositol-3 kinases,PI3Ks)是一类可产生第二信使的脂类激酶,其中PI3Ks激活生成的磷脂酰肌醇3-磷酸(Phosphatidylinositol 3-phosphate,PI(3)P)是诱导细胞自噬的关键因子[12]。磷脂酰肌醇5-激酶(Phosphatidylinositol 5-kinase,PIKfyve)可将PI(3)P磷酸化为PI(3,5)P2;PI(3,5)P2的生成不利于宿主细胞的早期内体或晚期内体的同型融合[13-14]。Martinez等研究发现,贝氏柯克斯体cvpB::Tn突变株感染引起宿主细胞呈多囊泡表型,cvpB回补株感染则可使宿主细胞恢复呈现单一大CCV;抑制PIKfyve的活性则可形成单一大CCV(发育成熟CCV),且该CCV中含有LAMP1(Lysosome-associated membrane glycoprotein 1)和LC3(Microtubule-associated protein light chain 3)。这些结果表明效应蛋白CvpB通过与CCV和早期内体表面的PI(3)P和磷脂酰丝氨酸(Phosphatidylserine,PS)相互作用,干扰早期内体招募PIKfyve,并降低PIKfyve的活性,抑制PI(3)P向PI(3,5)P2转化,稳定CCV上的PI(3)P水平,从而促进其与其它囊泡融合,使CCV发育成熟[15]。
另外研究发现,CvpF能够特异地与宿主细胞自噬相关的GTPase RAB26相互作用,CCV招募自噬体标志物MAP1LC3B/LC3B(Microtubule associated protein 1 light chain 3 beta),调控内体转运和自噬,为CCV成熟提供条件[16]。共定位实验显示相较于野生型或回补株,cvpF::Tn突变株CCV招募的LC3B在数量上明显减少,说明CvpF可以促使CCV招募自噬体标志物。异位表达贝氏柯克斯体CvpF-HA后,与仅表达HA的细胞相比较,其SQSTM1(Sequestosome 1)水平更高;SQSTM1是一种与自噬有关的泛素结合蛋白,提示CvpF有调节宿主细胞自噬的功能[16]。另外,由于RAB26可以参与溶酶体定位、自噬体成熟和囊泡介导的肾上腺素能受体分泌等过程[17-19],因此推测CvpF可能作为鸟苷交换因子(GEF)或GDI置换因子(GDF),锚定RAB26并激活其在早期内体或前自噬体上的作用,促进贝氏柯克斯体CCV的发育成熟。
2 重塑宿主细胞骨架
细胞骨架是由蛋白纤维交织形成的立体网状结构,包括微管、微丝和中间丝,成束的肌动蛋白丝通过黏着斑与细胞外基质相连形成应力纤维[20]。Rho(Ras homologus oncogenes)蛋白在细胞的信号转导通路中作为信号转换器,调控细胞骨架运动和细胞形态等[21]。效应蛋白CirA(Coxiella effector for intracellular replication A)含有3个精氨酸指状基序,与Rho 蛋白家族RhoA(Rho1同源物)相互作用[22]。Weber等构建了2个RhoA突变体,分别是RhoA Q63L(持续GTP结合的激活态)和RhoA T19N(持续GDP结合的失活态)。与仅转染CirA或共转染CirA和RhoA T19N的细胞比较,共转染CirA和RhoA Q63L的细胞内应力纤维增多,圆形细胞数量减少。提示存在柯克斯体CCV上的CirA,可以使用CCV上RhoA激活GTP酶,引起宿主细胞骨架重塑[23]。
另外研究发现AnkF与宿主细胞骨架III型中间丝蛋白分子——波形蛋白相互作用,但AnkF并不在转录或翻译水平上影响波形蛋白;在CHO细胞中过表达的AnkF与波形蛋白共定位,且波形蛋白由原来的丝状排列变为点样分布,推测AnkF通过改变波形蛋白的装配和细胞内定位从而干扰其功能。免疫荧光分析法观察到贝氏柯克斯体感染的细胞中AnkF可以招募波形蛋白到CCV,且波形蛋白水平随CCV的发育成熟而有所上升。贝氏柯克斯体在内源性波形蛋白敲除的细胞中生长繁殖不受影响,推测有其他的细胞骨架蛋白弥补了波形蛋白缺失所带来的影响。在CHO细胞中过表达AnkF和波形蛋白,通过免疫荧光分析发现其他的细胞骨架蛋白如肌动蛋白和微管蛋白的定位未发生改变,即AnkF可特异地调节波形蛋白的定位[24]。
3 调控宿主细胞物质分泌和运送
网格蛋白介导的内吞可以调控细胞对转铁蛋白的摄取以及蛋白质在内体与高尔基体间的运输[25-26]。此外,网格蛋白介导的转运对贝氏柯克斯体的胞内生存也十分重要。效应蛋白Cig57含有3个胞内分选基序,其中的酪氨酸基序是与网格蛋白包被囊泡组分——FCHO2相互作用的基础,可促使柯克斯体CCV招募网格蛋白,逆转网格蛋白介导的囊泡转运[7,27]。用定量PCR分析贝氏柯克斯体感染宿主细胞的荷菌量,与正常细胞相比较,FCHO2基因敲除细胞在感染后第2、4、6 d,荷菌量呈下降趋势;通过免疫荧光分析发现FCHO2基因敲除细胞在感染第4 d后,柯克斯体CCV明显缩小[27],提示Cig57需要与FCHO2相互作用介导物质转运才能诱导CCV成熟。
效应蛋白CvpA包含多个双亮氨酸和酪氨酸的内吞分选基序,可被网格蛋白衔接蛋白(Adaptor protein,AP)复合物AP1、AP2和AP3识别。免疫共沉淀分析发现,含有CvpA分选基序的多肽和完整CvpA蛋白均能与AP2和网格蛋白重链(Clathrin heavy chain,CLTC)结合;cvpA突变或AP2和网格蛋白的任一成分缺失均可显著抑制贝氏柯克斯体生长繁殖[28]。此外,异位表达的CvpA定位于转铁蛋白受体(Transferrin receptor,TfR)阳性囊泡,同时该细胞摄取转铁蛋白(Transferrin,Tf)减少,提示CvpA可抑制胞内转铁蛋白的转运[28]。另外,AP2基因敲除细胞的转铁蛋白摄取也减少[29],提示CvpA可与AP2相互作用调控宿主细胞物质转运[28]。
效应蛋白ElpA具有2个跨膜螺旋和1个螺旋结构域的(ER-localizing protein A),其定位于内质网。研究显示表达完整ElpA的细胞比表达GFP和表达ElpA1-343/ElpA341-418的细胞分泌更少碱性磷酸酶;进一步研究发现ElpA能够引起宿主细胞内质网重排,导致内质网结构和分泌运送的严重破坏[30]。蛋白CBU0635是目前发现的唯一一个定位在高尔基体旁的效应蛋白,其也可破坏细胞的碱性磷酸酶分泌[31],另外效应蛋白CBUA0019、CBU1556、CBU1825也可能影响宿主细胞分泌。
4 调控宿主细胞转录和翻译
生物信息学分析显示贝氏柯克斯体6个效应蛋白(Cbu1314、Cbu0388、Cbu1524、Cbu0393、Cbu0794)带有核定位信号(Nuclear localization signals,NLS)。其中CBU1314含有2个进入核内的必须信号:第52~75位氨基酸序列(ELVKRIRVLEKVLKEQQKKIKKLE)和第181~186位氨基酸序列(KPPIRP)。Weber等研究发现,完整CBU1314蛋白主要定位在细胞核染色质,而删除核定位信号的CBU1314ΔNLS缺失蛋白在染色质上的数量明显减少;经染色质免疫共沉淀及DNA测序(Chromatin immunoprecipitation and DNA sequencing,ChIP-Seq)和MEME(Multiple EM for Motif Elicitation)测序分析发现,CBU1314蛋白可以识别宿主DNA的特定区域,该区域的大多数基因参与宿主细胞的转录、信号转导和免疫应答[32]。比较异源表达CBU1314和CBU1314ΔNLS细胞的转录组时,证明CBU1314在核内调控宿主细胞转录[32]。
宿主细胞的转录、翻译与丝裂原活化蛋白激酶(Mitogen-activated prote in kinase,MAPK)信号通路密切相关[33]。研究发现效应蛋白CBU0388(CetCb2)、CBU0885(CetCb4)和CBU1676(Cem9)分别通过对信号通路中一个或多个分子的磷酸化修饰,特异地调控酵母MAPK信号通路[34]。基因序列分析发现CBU0885和CBU1676蛋白均含有一个抑制MAPK活化的卤酸脱卤酶(Haloacid dehalogenase,HAD)保守结构域[34]。
5 抑制宿主细胞凋亡
宿主细胞是贝氏柯克斯体赖以生存之地,因此延长宿主细胞的寿命是其致病所必须具备的能力。AnkG(Ankyrin repeat family G)、CaeA(Coxiella anti-apoptotic effector A)和CaeB(Coxiella anti-apoptotic effector B)是目前已知的3个由T4BSS分泌的抗宿主细胞凋亡(Apoptosis)效应蛋白。三者均可抑制宿主细胞的内源性凋亡,CaeA还可作用于外源性凋亡通路[35]。
宿主细胞的p32是一种促凋亡蛋白,主要分布在线粒体,少量位于细胞核[36-37]。p32与Hrk(Bcl-2促凋亡家族成员之一)结合可促进细胞色素c的释放,p32与ARF(ADP-ribosylation factor)C-末端结合定位于线粒体发挥促凋亡作用[38-40]。免疫荧光和免疫印迹实验也显示效应蛋白AnkG与p32结合定位于线粒体,序列分析发现AnkG的N-末端含有与宿主蛋白p32结合的关键结构域。AnkG不含NLS,但经星形孢菌素诱导细胞凋亡后,细胞内的AnkG定位发生改变,主要位于细胞核。另外发现AnkG突变体AnkGR22/23S不能与p32结合,该突变体主要与微管蛋白共定位[41]。
星形孢菌素诱导细胞凋亡发现,与仅表达GFP的细胞比较,表达GFP-AnkG和GFP-NES-AnkG(GFP-AnkG fused to the nuclear export signal of the HIV-1 Rev protein)细胞的细胞核裂解水平降低[41],说明AnkG依赖与p32结合转运至细胞核才能发挥抗凋亡作用,但该抗凋亡作用与p32无关。另一方面,Lührmann等人利用嗜肺军团菌鞭毛蛋白缺失株来研究AnkG的抗凋亡作用,指出AnkG可以通过干扰p32的促凋亡活性,使细胞色素c释放减少来发挥抗凋亡作用[42]。Importin α1是输入蛋白家族中的重要成员之一,协助含有NLS的蛋白分子入核,通过识别和结合靶蛋白的核定位信号,与其他相关蛋白分子结合形成核转运复合体,将目的蛋白运输到核内发挥作用[43]。Schäfer等认为AnkG不含NLS,但其8到14个氨基酸具有与非经典NLS相似作用;他们通过免疫共沉淀实验又发现importin α1可与AnkG的11个氨基酸序列相结合而将AnkG转运至细胞核,其与p32无关;但他们最后认为AnkG的入核转运需要与p32和importin α1共同参与[44-45]。
CaeA定位于细胞核。CaeA含有的双螺旋结构域、NLS和谷氨酸/赖氨酸(Glutamic acid/lysine,EK)重复基序,这些结构是其抗凋亡的分子基础[31,46-47]。CaeA的表达可上调survivin(半胱氨酸天冬氨酸蛋白酶(caspase)抑制剂)表达水平,但与抗凋亡作用无直接关系[46]。星形孢菌素和紫外线诱导凋亡实验显示,CaeA仅能减少由紫外线诱导的多聚ADP核糖聚合酶(Poly ADP-ribose polymerase,PARP)裂解;而CaeB可抑制星形孢菌素和紫外线诱导的PARP裂解,说明CaeA抗凋亡能力弱于CaeB[47]。此外,CaeA可抑制Fas配体诱导的外源性凋亡,然而,CaeA抑制内源性和外源性凋亡的具体机制尚未完全阐明[46]。
CaeB定位于线粒体,免疫共沉淀实验发现CaeB不与p32结合[47],提示其发挥抗凋亡作用与结合p32的AnkG不同。细胞凋亡过程中Bax(Bcl-2-associated X protein)和Bak(Bcl-2 homologous antagonist/killer)形成寡聚物,线粒体外膜通透性增强,细胞色素c释放到细胞质,促使细胞色素c与caspase-9结合形成凋亡小体,激活caspase-3和caspase-7[48]。多西环素诱导Bax表达后,GFP-CaeB能抑制细胞内PARP的裂解[47],说明CaeB作用于Bax活化后的下游反应来发挥抗凋亡作用。经星形孢菌素处理后,仅表达GFP的细胞PARP、caspase-9和caspase-7均裂解,而表达GFP-CaeB的细胞caspase-9和caspase-7均未裂解[47],说明CaeB抑制caspase-9的活化。综上所述,CaeB可能作用于Bax和caspase-9间的级联反应从而发挥抗凋亡作用。
6 抑制宿主细胞炎性反应
细胞炎性反应为天然免疫反应,在抗胞内菌感染中起重要作用。炎性小体为调节天然免疫反应的是一类多蛋白复合物,其功能包括激活caspase-1(人和小鼠)、caspase-4/5(人)、caspase-11(小鼠),促炎性细胞因子IL-1β和IL-18的分泌,诱导细胞焦亡/炎性坏死(Pyroptosis/Inflammatory necrosis)等[49-50]。细胞焦亡途径可分为依赖caspase-1的经典途径和依赖caspase-4/5/11的非经典途径,其中非经典途径主要由革兰阴性细菌分泌的脂多糖所激活[50]。Cunha等[51]发现T4BSS效应蛋白IcaA(Inhibition of caspase activation A)可以抑制caspase-11介导的非典型性炎性小体激活,从而干扰细胞焦亡的发生。
Ras家族蛋白是一类小分子GTP酶,通过与GTP或GDP结合调节其活性,当与GTP结合时Ras蛋白呈活化状态,为含NLS的蛋白分子的核转运提供能量[52]。有研究证实真核细胞中的RCC1可以作为Ran(为Ras家族的核运输蛋白)的鸟苷交换因子与宿主细胞核染色质相互作用[53]。效应蛋白NopA(Nucleolar protein A)C-末端含有4个染色体聚缩调控(Regulation of chromosome condensation,RCC)重复序列,与Ran-GEF RCC1的7个重复序列同源[54]。含RCC的完整NopA分子主要定位于细胞核,而不含RCC的NopA肽则在宿主细胞质中弥散分布,说明RCC对NopA分子进入胞核至关重要[55]。免疫印迹法发现NopA与Ran-GDP相互作用,使细胞内Ran-GTP水平升高和Ran活性增强,通过干扰p65转录因子入核而抑制NF-κB信号通路,从而抑制宿主细胞炎性反应[55]。
7 其他亚细胞定位明确但功能尚未明确的效应蛋白
效应蛋白AnkB(Ankyrin repeat family B)富含锚蛋白重复序列。Rodríguez-Escudero等通过DAPI染色实验发现AnkB定位于酵母细胞核,且过表达AnkB的酵母细胞对氨基葡萄糖苷敏感,其可能是通过干扰核糖体基因的表达,影响蛋白质合成[56],但是它如何进入胞核和确切功能有待进一步研究阐明。
MceA/B/C/D/E(Mitochondrial Coxiella effector protein B to E)是5个靶向线粒体的效应蛋白,MceB和MceC沿线粒体小管均匀分布,MceD和MceE在线粒体呈点状分布[57]。免疫沉淀实验显示MceC可结合线粒体组分,如iAAA蛋白酶、YME1L和CLPB(Caseinolytic peptidase)。MceA的N-末端含有2个跨膜结构域,在线粒体外膜上组装成一个同源寡聚复合物[58]。MceA(CBU0077)可与LAMP1共定位[31],亦可存在内质网去改变内质网的形状与结构[56]。Fielden推测CBU0077定位于不同细胞器是因为真核细胞产生的MceA折叠状态与菌体自身表达的MceA结构不同有关[58]。
Cpe(Coxiella plasmid effector protein)B、CpeC和CpeD为贝氏柯克斯体质粒编码的T4BSS效应子。真核异位表达的CpeB与LC3B阳性的自噬体囊泡共定位,提示CpeB可能调节了宿主细胞的自噬进程[59]。CpeC含F-box结构域,与泛素连接酶复合物SCF蛋白(Skp1-Cul1-F-box蛋白,SKP1:S-phase kinase-associated protein 1)结合,定位于富含泛素的腔内[59]。F-box蛋白超家族介导的泛素化可以改变蛋白质功能或降解靶蛋白,进而调节宿主细胞的天然免疫、炎症反应和细胞凋亡等[60]。CpeD与钙连蛋白共定位,破坏内质网网络[59];CpeD含有一个与鞭毛虫驱动蛋白同源的结构域,其可能引导囊泡沿微管运输[61]。
8 结 论
随着贝氏柯克斯体体外培养技术和遗传操作方法的发展,贝氏柯克斯体T4BSS和效应蛋白的研究已经取得重要进展[4-5, 62-63]。研究证明T4BSS是贝氏柯克斯体重要的毒力因素,其分泌的效应蛋白能够调控宿主细胞的柯克斯体CCV发育成熟、宿主细胞的物质分泌运送、自噬与凋亡、炎性反应等一系列生理和病理过程,为贝氏柯克斯体生长繁殖提供场所和物质。这些研究成果为研究贝氏柯克斯体的分子致病机制提供新思路,并为更有效防治Q热提供理论依据。
