2个水稻叶片卷曲变窄突变体的遗传分析和基因定位
2021-03-22陈海元朱晓妹张所兵张云辉方先文
陈海元 朱晓妹 张所兵 张云辉 方先文

摘要:通过甲基磺酸乙酯(EMS)诱变水稻品种南粳46,发现2个可以稳定遗传的叶片卷曲变窄的突变体rnl1-1(rolling and narrow leaf1-1)和rnl1-2。与野生型相比,突变体从苗期开始表现出叶片卷曲变窄的表型,一直持续到成熟期。此外,突变体抽穗期延迟,株高、穗长、剑叶长、剑叶宽、一次枝梗数、二次枝梗数、粒厚、每穗粒数和粒宽均显著降低。遗传分析表明,突变体的突变表型受1对隐性基因控制。利用rnl1-1与籼稻品种Dular杂交建立F2群体,将该基因定位在水稻第12染色体长臂上的InDel标记HF36和HF43之间约277 kb 的区间内。该区间内NRL2基因突变引起的表型与rnl突变体相似,测序发现rnl1-1突变体中RNL2基因的第1708位核苷酸由C突变为T,使得编码的氨基酸由丝氨酸突变成脯氨酸;rnl1-2突变体中RNL2基因的第2011位核苷酸由G突变为A,使得编码的氨基酸由精氨酸突变成甘氨酸。
关键词:水稻;叶片卷曲变窄;突变体;基因定位;NRL2
中图分类号:S511.01 文献标志码: A文章编号:1002-1302(2021)02-0037-06
收稿日期:2020-04-10
基金项目:江苏省自然科学基金(编号:BK20180309)。
作者简介:陈海元(1988—),男,江苏徐州人,博士,助理研究员,主要从事水稻基因功能解析及分子设计育种研究。Tel:(025)84390321;E-mail:15150530179@163.com。
通信作者:方先文,博士,研究员,主要从事水稻品种资源研究。Tel:(025)84390321;E-mail:2431240491@qq.com。
细胞壁决定了植物的株型、生长、发育以及对生物和非生物胁迫的响应,纤维素、半纤维素和果胶是植物细胞壁的主要成分[1]。高等植物中,纤维素由β-1,4-葡聚糖链组成,在细胞膜上由纤维素酶复合体合成。复合体包括6个亚基,一般含有36个纤维素合成酶蛋白分子[2]。纤维素合酶(cellulose synthase,简称CESA)属于糖基转移酶家族2,具有8个跨膜结构域,其中2个跨膜域靠近N端,6个跨膜域靠近C端,中间为保守的“D,D,D,QXXRW”基序和糖基转移酶结构域[3]。纤维素合成酶类似蛋白(cellulose synthase-like,简称CSL)参与半纤维素骨架的合成,CSL蛋白与 CESA蛋白的序列高度同源,被分为9个亚族:CSLA~H 和 CSLJ[4]。一些CSL家族的功能已经被阐明,CSLA家族成员编码甘露聚糖合成酶[5],CSLC 与木葡聚糖合成相关[6],CSLF和CSLH家族参与多种葡聚糖的合成[7-8]。CSL亚家族中,CSLD与CESA亚族高度相似,因此认为CSLD可能与纤维素合成酶功能相似[9]。拟南芥KOJAK/AtCSLD3是第1个被克隆的CSLD亚族成员,参与早期根毛的发育[10-11]。AtCSLD2参与晚期根毛的发育[12]。AtCSLD1和AtCSLD4参与纤维素的沉积和花粉管的生长[13]。玉米ZmCSLD1对于细胞分裂至关重要,zmcsld1突变体中细胞变小且数目减少,导致器官变窄[14]。水稻CSLD亚族共有5个成员,其中OsCSLD1是KOJAK/AtCSLD3的同源基因,参与水稻根毛的发育[15]。OsCSLD4参与细胞壁的形成和植株生长[16-21]。
本研究通过甲基磺酸乙酯(EMS)诱变粳稻品种南粳46,获得2个稳定遗传的叶片卷曲变窄突变体,从表型、遗传等方面明确突变体的遗传特性,并对突变基因进行精细定位、基因测序与突变位点分析。通过对该突变体的研究,有利于进一步了解水稻株型的分子机制,为株型育种提供理论依据。
1材料与方法
1.1试验材料
通过EMS诱变粳稻品种南粳46,鉴定出2份水稻叶片卷曲变窄的突变体,依据表型分别将其命名为rnl1-1和rnl1-2。经过多代自交后,rnl1-1和rnl1-2突变体叶片卷曲变窄的性状被稳定遗传。
1.2農艺性状考察
2018年5月中旬,将野生型(WT)和rnl1-1和rnl1-2播种,1个月后移栽于大田,期间考察苗期性状。正常水肥条件下生长至黄熟期,随机选取野生型和rnl1-1突变体各10株,考察株高、分蘖数、剑叶长宽、一次枝梗数、二次枝梗数、每穗粒数、结实率、粒长、粒宽和粒厚等农艺性状。
1.3遗传分析与基因定位
2017年南京正季以rnl1-1突变体为母本,分别与野生型、粳稻品种中花11(ZH11)和籼稻品种Dular杂交获得F1代种子,随后在海南加代,获得用于遗传分析和基因定位的F2群体的种子,F2群体于2018年南京正季种植。rnl1-1与野生型、ZH11及Dular杂交构建F2群体,统计其叶片卷曲变窄的植株和叶片正常植株的比率,并用卡方测验分析统计结果。在rnl1-1与Dualr杂交构建的F2群体中,筛选隐性极端个体687个,用于连锁分析与基因定位。首先选取10个极端个体,用均匀分布在水稻12条染色体上的南粳46和Dular之间多态性好的简单重复序列(SSR)标记进行连锁分析,对突变基因进行初定位。在初定位区间内,寻找其他有多态的SSR标记或者InDel标记,分析其他极端个体,完成突变基因的精细定位。
1.4突变基因的鉴定与验证
通过水稻基因组注释计划(Rice Genome Annotation Project,https://rapdb.dna.affrc.go.jp)对精细定位区间内的基因进行预测,发现区间内存在1个已经报道的叶片发育相关基因NRL2(Os12g0555600),因此开发了8对引物对2个rnl1突变体中Os12g0555600基因的基因组(包含启动子和基因编码区)进行测序,并与野生型序列进行比对,并在定位群体中随机挑选10个隐性极端个体对突变位点进行验证。
2结果与分析
2.1突变体的表型分析
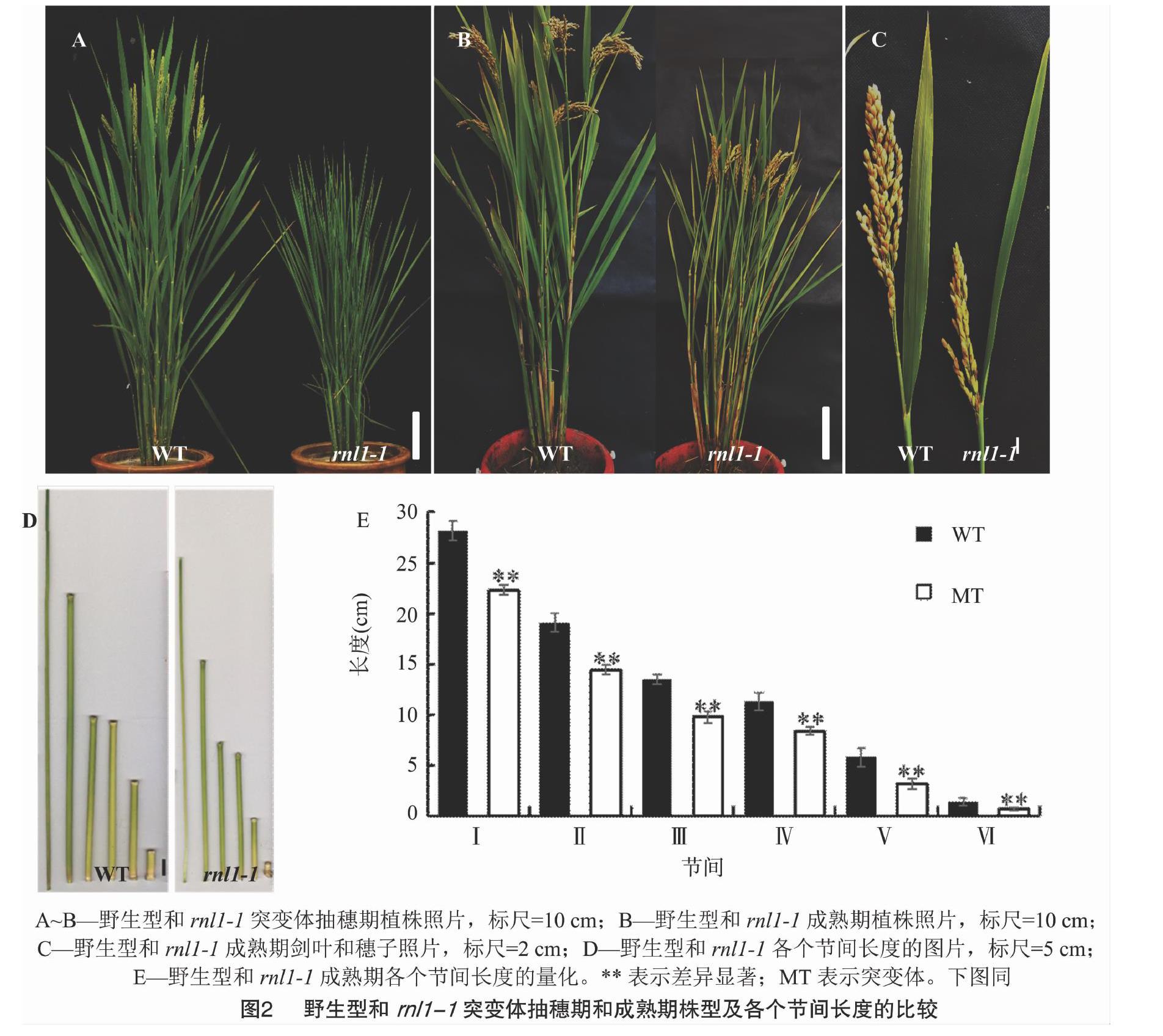
rnl1-1和rnl1-2突变体在苗期时叶片就表现出卷曲变窄的表型(图1-A、图1-E、图1-F),分蘖期时不同叶位的叶片也表现出类似的表型(图1-B、图1-C、图1-D、图1-G)。
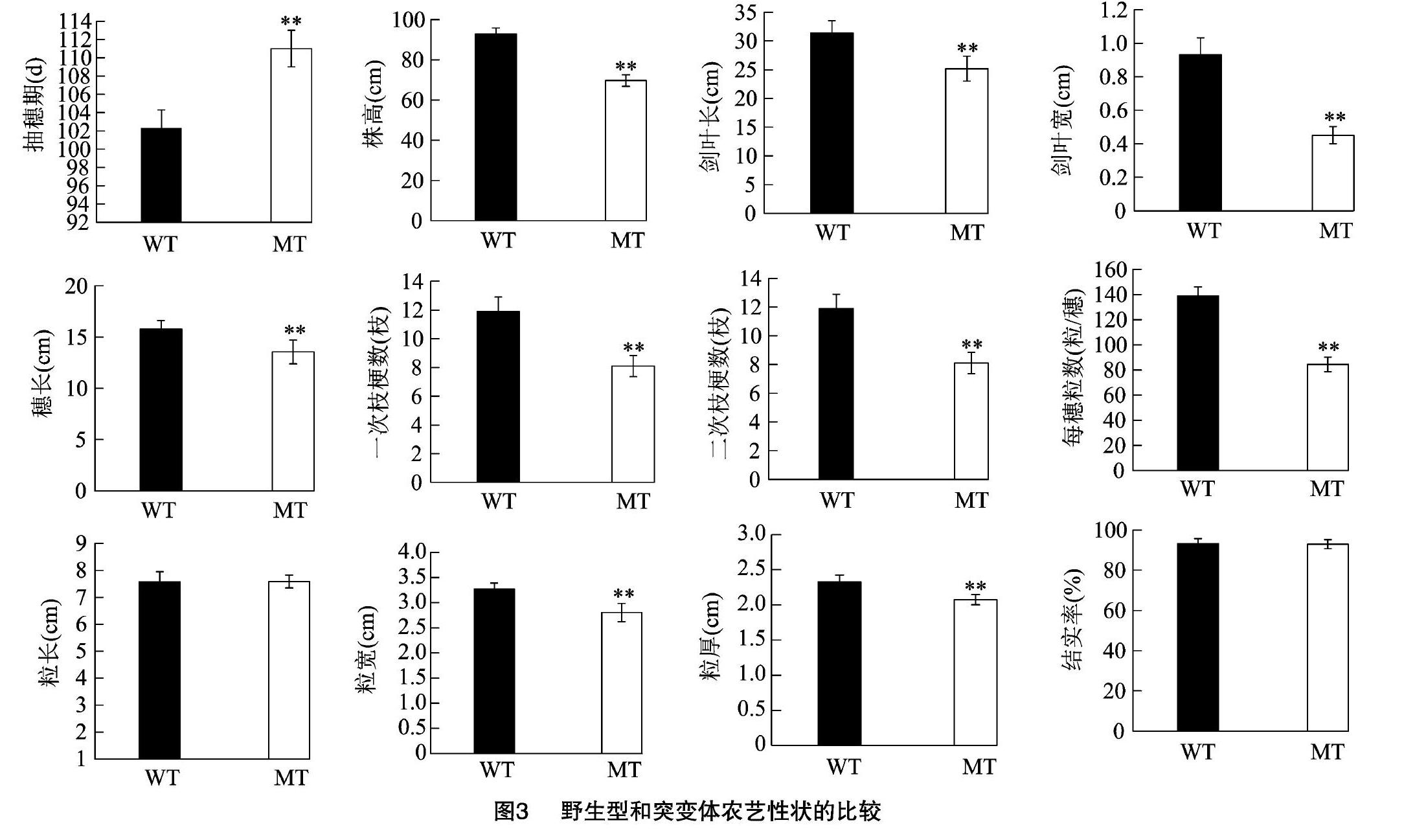
rnl1-1突变体的抽穗期比野生型延迟约9 d(图2-A,图3),成熟期时的株高较野生型也明显下降(约下降20 cm,图2-B)。对野生型和rnl1-1突变体主茎的穗子和各个节间长度进行比较,发现rnl1-1突变体的穗长和各个节间的长度较野生型都显著降低,第1节间和第2节间长度的减少是导致突变体株高下降的主要原因(图2-C、图2-D)。
对野生型和rnl1-1突变体的其他农艺性状进行分析,发现rnl1-1突变体的株高、穗长、剑叶长、剑叶宽、每穗粒数、一次枝梗数、二次枝梗数、粒宽和粒厚较野生型都显著下降,而粒长和结实率没有明显变化(图3)。
2.2遗传分析
将rnl1-1分别与野生型、粳稻品种ZH11和籼稻品种Dular杂交,其F1的叶片发育正常。rnl1-1/WT、rnl1-1/ZH11和rnl1-1/Dular的F2群体中,叶片卷曲变窄的植株与叶片正常发育的植株的比率符合3 ∶1的分离比(表1),表明叶片卷曲变窄的表型受1对隐性基因控制。
2.3连锁分析与精细定位
用rnl1-1和Dular作为DNA模板,用463对SSR引物进行多态性分析,得到155对多态性较好的引物,多态性频率为33.48%。用这些引物对rnl1-1/Dular F2群体中随机挑选的10个与突变体表型相似的极端个体进行连锁分析,发现突变基因与水稻第12染色体长臂上的2个分子标记RM519和RM6947紧密连锁。根据已经公布的日本晴和9311DNA序列,在此区间内又开发了3个多态性好的标记HF36、HF43和RM28466(表2)。
2.4候选基因分析
对定位区间内的基因进行分析,发现NRL2基因的突变表型与rnl1-1相似,因此对rnl1-1突变体中的NRL2基因进行测序,结果显示,rnl1-1突变体中RNL2基因的第1 708位核苷酸由C突变为T,使得编码的氨基酸由丝氨酸突变成脯氨酸;rnl1-1 突变体中RNL2基因的第2011位核苷酸由G突变为A,使得编码的氨基酸由精氨酸突变成甘氨酸。从rnl1-1/Dular F2群体中随机挑选的10个极端个体进行混池测序,结果表明10个极端个体的RNL2基因具有与rnl1-1相同的突变位点。
利用这些标记对rnl1-1/Dular F2群体中的576个极端个体进行分析,最终将突变基因限定在分子标记HF36和HF43之间,物理距离约为277 kb(图4-A)。
3讨论与结论
水稻OsCSLD4/NRL1基因是CSLD家族的一员,主要在快速生长的器官(如根、叶和穗)中高度表达[17-18]。进一步研究表明,OsCSLD4正在分裂细胞的M期特异表达[20],其蛋白定位于高尔基体中[16]。OsCSLD4/NRL1SLE1基因在细胞壁的生物合成及植株的生长发育中起关键作用。通过不同的方法已经鉴定出了一些该基因的突变体,这些突变体的共同特征是植株矮化,叶片卷曲变窄。此外,由于诱变材料背景或者基因突变位点的不同(表3),不同突变体的表型也有一定的差异。nd1突变体中,2 894位点核苷酸C-T的突变使编码的氨基酸发生 Ala-Val 的替换,导致茎和根的初生细胞壁结构均异常,株高降低,叶片卷曲变窄[16]。nrl1突变体中,2 431~2 489位点缺失59 bp核苷酸,使得编码的蛋白质部分氨基酸移码突变和提前终止,除了株高降低和叶片卷曲变窄外,突变体还表现出叶片夹角增大、根系发育异常和结实率显著下降[17]。nrl1-1变体中,592位点核苷酸T-C的突变使编码的氨基酸发生Leu-Ser的替换;nrl1-2变体中,1 314位点核苷酸G-A的突变使编码的氨基酸发生Ala-Thr的替换;nrl1-3突变体中,3 360位点核苷酸 G-A 的突变使翻译提前终止,3个突变体的叶片都卷曲变窄,株高有不同程度的下降[18]。cd1突变体中,396~397位点核苷酸之间插入了8 bp核苷酸,使部分氨基酸移码突变,翻译提前终止,由于灌浆不充分导致突变体种子细小、皱缩[19]。sle1-1突变体中,887~930位点缺失了 44 bp 核苷酸,961位点核苷酸发生G-A的突变,使翻译提前终止;sle1-2突变体中,2 960位点核苷酸C-A的突变引起编码氨基酸Ser-Tyr的替换,sle-2突变体还具有花粉发育异常和花药开裂障碍等表型[20]。这些突变体的表型特征提示,OsCSLD4在水稻生长发育的调解中具有多效性作用。
与野生型相比,本研究获得的rnl1-1突变体抽穗期延迟9 d,株高是野生型的77.58%,叶片卷曲变窄,株高、穗长、每穗粒数、剑叶长、剑叶宽、一次枝梗数和二次枝梗数、粒宽、粒厚显著减少,但是结实率正常(图3)。此外突变体的粒宽显著下降,粒长和粒厚没有顯著差异(图3)。已经报道的OsCSLD4基因的突变体中,rnl1-1的表型与nrl1-1、nrl1-2和nrl1-3突变体的表型相似,虽然突变体的各个器官变小或变窄,但是植株的结实率并未受到影响,而nrl和sle突变体的结实率显著下降,cd1突变体种子皱缩,表明OsCSLD4基因的完整结构对水稻正常生长发育是必需的,单个氨基酸的突变会导致株高下降,叶片卷曲变窄,氨基酸序列的截短会使植株生长受到严重影响,因此该基因不同结构域功能的研究对于株型育种具有重要意义。
参考文献:
[1]Reiter W D. Biosynthesis and properties of the plant cell wall[J]. Current Opinion in Plant Biology,2002,5(6):536-542.
[2]Mutwil M,Debolt S,Persson S. Cellulose synthesis:a complex complex[J]. Current Opinion in Plant Biology,2008,11(3):252-257.
[3]Sethaphong L,Haigler C H,Kubicki J D,et al. Tertiary model of a plant cellulose synthase[J]. Proceedings of the National Academy of Sciences of the United States of America,2013,110(18):7512-7517.
[4]Farrokhi N,Burton R A,Brownfield L,et al. Plant cell wall biosynthesis:genetic,biochemical and functional genomics approaches to the identification of key genes[J]. Plant Biotechnology Journal,2006,4(2):145-167.
[5]Liepman A H,Wilkerson C G,Keegstra K. Expression of cellulose synthase-like (Csl) genes in insect cells reveals that CslA family members encode mannan synthases[J]. Proceedings of the National Academy of Sciences of the United States of America,2005,102(6):2221-2226.
[6]Cocuron J C,Lerouxel O,Drakakaki G,et al. A gene from the cellulose synthase-like C family encodes a β-1,4 glucan synthase[J]. Proceedings of the National Academy of Sciences of the United States of America,2007,104(20):8550-8555.
[7]Burton R A,Wilson S M,Hrmova M,et al. Cellulose synthase-like CslF genes mediate the synthesis of cell wall (1,3;1,4)-β-D-glucans[J]. Science,2006,311(5769):1940-1942.
[8]Doblin M S,Pettolino F A,Wilson S M,et al. A barley cellulose synthase-like CSLH gene mediates (1,3;1,4)-β-D-glucan synthesis in transgenic Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America,2009,106(14):5996-6001.
[9]Carroll A,Specht C D. Understanding plant cellulose synthases through a comprehensive investigation of the cellulose synthase family sequences[J]. Frontiers in Plant Science,2011,2(5):5.
[10]Wang X,Cnops G,Vanderhaeghen R,et al. AtCSLD3,a cellulose synthase-like gene important for root hair growth in Arabidopsis[J]. Plant Physiology,2001,126(2):575-586.
[11]Favery B,Ryan E,Foreman J,et al. KOJAK encodes a cellulose synthase-like protein required for root hair cell morphogenesis in Arabidopsis[J]. Genes & Development,2001,15(1):79-89.
[12]Bernal A J,Yoo C M,Mutwil M,et al. Functional analysis of the cellulose synthase-like genes CSLD1,CSLD2,and CSLD4 in tip-growing Arabidopsis cells[J]. Plant Physiology,2008,148(3):1238-1253.
[13]Wang W,Wang L,Chen C,et al. Arabidopsis CSLD1 and CSLD4 are required for cellulose deposition and normal growth of pollen tubes[J]. Journal of Experimental Botany,2011,62(14):5161-5177.
[14]Hunter C T,Kirienko D H,Sylvester A W,et al. Cellulose synthase-like D1 is integral to normal cell division,expansion,and leaf development in maize[J]. Plant Physiology,2012,158(2):708-724.
[15]Kim C M,Park S H,Je B I,et al. OsCSLD1,a cellulose synthase-like D1 gene,is required for root hair morphogenesis in rice[J]. Plant Physiology,2007,143(3):1220-1230.
[16]Li M,Xiong G Y,Li R,et al. Rice cellulose synthase-like D4 is essential for normal cell-wall biosynthesis and plant growth[J]. Plant Journal,2009,60(6):1055-1069.
[17]Wu C,Fu Y,Hu G,et al. Isolation and characterization of a rice mutant with narrow and rolled leaves[J]. Planta,2010,232(2):313-324.
[18]Hu J,Zhu L,Zeng D,et al. Identification and characterization of NARROW AND ROLLED LEAF 1,a novel gene regulating leaf morphology and plant architecture in rice[J]. Plant Molecular Biology,2010,73(3):283-292.
[19]Luan W J,Liu Y Q,Zhang F X,et al. OsCD1 encodes a putative member of the cellulose synthase-like D sub-family and is essential for rice plant architecture and growth[J]. Plant Biotechnology Journal,2011,9(4):513-524.
[20]Yoshikawa T,Eiguchi M,Hibara K,et al. Rice slender leaf 1 gene encodes cellulose synthase-like D4 and is specifically expressed in M-phase cells to regulate cell proliferation[J]. Journal of Experimental Botany,2013,64(7):2049-2061.
[21]Ding Z,Lin Z F,Li Q,et al. DNL1,encodes cellulose synthase-like D4,is a major QTL for plant height and leaf width in rice (Oryza sativa L.)[J]. Biochemical and Biophysical Research Communications,2015,457(2):133-140.李長洲,袁国印,王一柳,等. 秸秆还田配施钾肥对水稻产量与钾素吸收的影响[J]. 江苏农业科学,2021,49(2):43-47.
