数字PCR 技术及其在动物生产中的应用
2021-03-15洪奇华陈学秋金妙仁胡彩虹
洪奇华,陈学秋,金妙仁,胡彩虹*
(1.浙江大学动物科学学院,浙江杭州 310058;2.杭州海尔希畜牧科技有限公司,浙江杭州 311261)
近20 年来,实时定量PCR(Real-time quantitative PCR,qPCR)技术已成为核酸分子定量的常规方法。qPCR 利用参照基因对起始样品进行相对定量,也可依赖于标准曲线实现对样品的绝对定量,但由于其计数分辨率有限,当靶核酸浓度较低、存在PCR 抑制剂干扰、扩增曲线的循环阈值(Ct 值)分辨不好时,qPCR 就不能满足严格的量化要求。而数字PCR(digital PCR,dPCR)技术采用“分而治之”的策略,不仅可以得到目标分子的浓度,还可以获得其绝对数目[1]。近年来,dPCR 技术凭借其高通量、高准确度、真正绝对定量等特点迅速发展起来,并在多个领域得到了极为广泛的应用。本文简要介绍了dPCR 技术的基本原理、主要优势和技术平台,并对其在动物生产中的应用进行了综述。
1 dPCR 的基本原理
dPCR 方法主要基于靶区的划分、单分子PCR 和泊松统计3 个要点,其检测原理与qPCR 基本相同,但在量化方式上有所不同。qPCR 反应在单一体系中进行,而dPCR 技术先将带荧光标记DNA 样品的反应体系进行稀释,分配到几百到几百万个不同的区室(如液滴和微孔)中,每个区室含有0、1 或多个DNA 模板分子,充当一个独立的PCR 微反应器;各反应室内DNA 分子独立进行常规PCR 反应,然后采集每个反应室的荧光信号,根据荧光信号的存在与否分别给出数字信号“1”或“0”的结果,代表目标DNA 的存在与否;最后通过泊松统计估计每个分区的平均分子数,然后除以分配体积换算成浓度,计算获得样本的原始拷贝数,从而实现对靶标分子的绝对计数(图1)[2-3]。dPCR 的关键是进行极限稀释,增加反应室的数量可以提高泊松精度[4]。
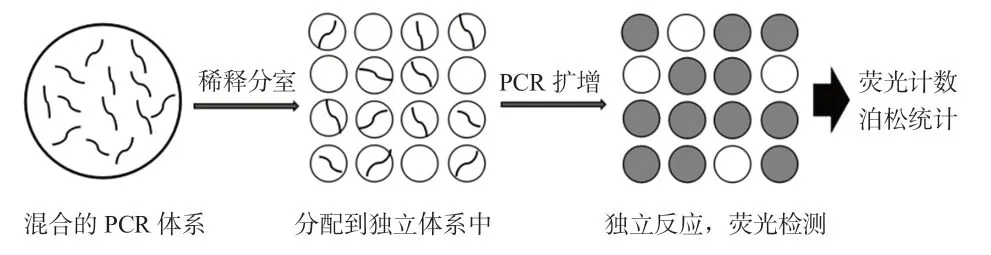
图1 数字PCR 基本原理示意图
2 dPCR 的主要优势
相对于传统PCR 和qPCR,dPCR 技术具有不依赖于标准曲线、灵敏度高、精确度高和对抑制剂更加耐受等独特优势。
2.1 不依赖于标准曲线的绝对定量 qPCR 方法中,通过在特定时间点(周期阈值Ct)测量PCR 扩增的荧光信号,与样品的标准曲线Ct 值比较并进行定量。dPCR则在大量的独立小室中分别进行PCR,利用信号存在与否来指示目标DNA,对样本进行直接“数字化”测量,因此是不需要标准曲线的绝对定量,在不同实验室和分析条件下结果更为一致,重现性好[5]。
2.2 灵敏度高 传统PCR 中,核酸样本和产物都在同一个混合体系中,目标样品的扩增效率和产物检测敏感度受体系复杂程度的限制。在dPCR 中,核酸样本被分为许多小室,在不同的反应室中同时扩增后分别进行评估,避免了引物与引物之间、不同产物之间的相互影响,因此结果不受扩增效率的影响,大大提高了检测的灵敏度,比传统PCR 提高10~100 倍[6-9]。
2.3 精确度高 在qPCR 中,由于荧光在每个周期加倍,通常一次分析只能获得2 倍拷贝数差异的结果。而不断发展的高度分区方法使dPCR 特别敏感,能区分样本中目标核酸之间的微小浓度差异,从而减少误差,提高实验精度。dPCR 通常可分辨1.25 倍差异的样品,甚至可达1.16 倍,能够实现稀有突变体的检测[2]。
2.4 对抑制剂耐受性高 qPCR 和dPCR 都能在“干净”的单重扩增中检测到单分子。但在qPCR 中,过量的背景DNA 或抑制剂可影响扩增效率并改变Ct 与目标数之间的关系。此现象在稀有突变检测中尤为突出,突变型和野生型等位基因都在热循环过程中被扩增,如果野生型分子比例超过100 倍以上,会因消耗过多聚合酶、核苷酸和荧光探针而影响到低浓度靶标。在dPCR 中,分区的反应量极低,相对丰富了每个隔间的低浓度靶标,扩展了动态范围,提高了扩增效率。近来有报道,dPCR 对不同类型抑制剂(如KCl 和NaCl 等盐类,去氧胆酸钠和SDS 等离子洗涤剂,乙醇、异丙醇和苯酚等),比qPCR 具有更高的耐受性[10]。
另外,dPCR 样本需求量低,不需要对极低浓度的模板进行预富集,从而显著提高检测灵敏度,而且可以在dPCR 系统中回收样品,更易于自动化操作。
3 dPCR 平台的发展
dPCR 的最初分区是通过在多个孔上手动分发样本来创建的[11],耗时费力。微流控技术的发展提供了许多有效的分区方法,一些公司开发的仪器已可以将样品分至数百到数百万个纳升或皮升级的反应室[12]。目前,FluidigmTM、Applied Biosystems/Life TechnologiesTM、Stilla Technologies、RainDropTMplus Technologies、Bio-Rad、Formulatrix 等多家公司已相继推出了各种商业化dPCR 平台[13]。根据反应单元形成方式的不同,可将dPCR 技术平台分为固体微腔和油包水乳液两大类。
3.1 固体微腔数字PCR 固体微腔平台建立在微流体、纳米制造和微电子等技术发展的基础上,可为dPCR 提供一个低成本、小体积和高通量的理想平台,如商用96、384 或1536 孔板,需要借助高通量的自动点样仪,仪器成本较高,操作相对复杂。通过使用光刻和微加工工艺可使微腔更小,如每孔容积1.4 fL,更多的孔可以提高动态范围和富集稀有样品的能力[2]。
第1 代dPCR 平台是通过包含微流控通道的芯片实现的[14]。然而,为了使芯片的尺寸最小化,各种系统中的隔室数量通常限制在几千个[15]。目前已有多个带微室的dPCR 系统,其中包括Bio-MarkTMDigital Array(Fluidigm,South San Francisco,CA,USA),每张芯片上集成有相互独立的10 000~40 000 个反应室,每个反应体系用量为6 nL;QuantStudio 3D(ThermoFisher Scientific,Waltham,MA,USA)芯片数字PCR 系统采用了高密度的纳升流控芯片技术,可以并行分析24 个芯片,每个芯片包含20 000 个隔室,内部体积为0.8 nL[14]。
3.2 液滴数字PCR 液滴数字PCR(Droplet digital PCR,ddPCR)反应室不是由孔壁隔开的,而是由微流控油包水乳液产生数千到百万计的液滴,PCR 反应在由连续油相分离的水滴中进行。ddPCR 的优点是可以根据需要生成任意多个分区,如可以提供多达1 000 万个纳升至皮升级的液滴,每个液滴都是一个独立的反应体系分区,远远高于由固体微腔在单个反应孔中分割的数量。该方法具有很高的灵敏度来区分DNA 突变等稀有样品,检测限可达0.001%[16]。液滴是连续生成的,需要几分钟到几小时才能生成足够的分区,但分步乳化系统通过大规模的并行化来解决这个问题,允许它们在几分钟内产生成千上万的液滴,同时保持相对均匀的液滴尺寸[17]。然而,ddPCR 技术也存在一定的局限性,如液滴生成过程中常会发生分区间的体积差异。
目前,Bio-Rad、Stilla、Life Technologies 和RainDance等公司都可提供ddPCR 技术[15,18]。其中QX200 system(BioRad,Hercules,CA,USA)可以平行分析96 孔,每孔含20 000个1 nL的液滴;RainDropsystem(Raindance Technologies,Lexington,MA,USA)可以平行分析8 孔,每孔含高达1 000 万个5 pL 的液滴;NaicaTMsystem(Stilla Technologies,Villejuif,France)中的样品首先流经一个由25 000~30 000 个液滴组成的大型微通道网络——液滴晶体,可以并行分析4 个液滴晶体[19]。
4 dPCR 技术在动物生产中的应用
dPCR 最初应用于基于极限稀释技术和等位基因特异性荧光探针的肿瘤相关突变研究[8]。随着技术的演变与优化,现已成功应用于许多领域,在动物生产中的病原体检测、生长繁殖相关基因检测、畜禽饲料成分检测、畜禽产品质量分析等方面也得到了成功应用。
4.1 动物病原体的检测
4.1.1 病毒的检测 病毒遗传物质形式多样,可以由DNA 组成,也可以由RNA 组成。组成病毒基因组的DNA 和RNA 有单链、有双链、有闭环、有线性的。动物病毒基因组主要包括双链DNA、单链DNA、双链RNA、单链RNA(+)、单链RNA(-)和环状双链DNA。病毒性疾病在养殖动物传染病中占很大的比例,由其引起的动物死亡率在所有病因中仅次于细菌,给畜禽养殖业带来了巨大的损失[20],因此开发快速、灵敏、准确的病毒检测方法显得尤为重要。近年来,国内外学者已将dPCR 技术应用于一些动物源性病毒的检测。
dPCR 较早应用于含单股环状DNA 的猪圆环病毒(Porcine Circovirus,PCV)检测。Zhao 等[21]最早利用ddPCR 平台建立了一种检测PCV-2 的灵敏方法,检测限为25拷贝/μL,比TaqMan-qPCR灵敏度高4倍。随后,原霖等[22]也建立了准确定量PCV-1基因的ddPCR 方法,检测限为7.8 拷贝/20 μL,灵敏度高且特异性强。近年来出现了一种新型圆环病毒PCV-3,Wu 等[7]针对PCV3-cap基因建立了一种高度特异性的ddPCR 检测方法,比qPCR 灵敏度约高出10 倍,检测结果重复性好。猪圆环病毒高灵敏度dPCR 检测方法的建立对猪皮炎肾病综合征、繁殖障碍和多系统炎症等疾病防控具有重要意义。除猪圆环病毒外,杨春华等[23]建立了人畜共患的单股环状DNA 病毒——猪细环病毒(Torque Teno Virus,TTV)的dPCR 检测方法,具有准确定量、重复性好、特异性强、灵敏度高、检测限低等优点,成为了一种强有力的检测诊断工具。
最近研究较多的非洲猪瘟由一种较大的双链DNA病毒——非洲猪瘟病毒(ASF Virus,ASFV)引起。邬旭龙等[24]建立了一种新型而高灵敏度的dPCR 检测方法,检测限为10 拷贝/20 μL,灵敏度是qPCR 的10倍,且具有很高的特异性和重复性,为实验室监测确诊提供了依据。伪狂犬病病毒(Pseudorabies Virus,PRV)也是一种双链DNA 病毒。陈亚娜等[25]建立了检测PRV 的ddPCR 方法,检测限为6.1 拷贝/20 μL,比qPCR 低,敏感度高且特异性强;Ren 等[8]发现,ddPCR 与TaqMan-qPCR 2 种方法均表现出良好的线性和重复性,但ddPCR 相较于qPCR 能在极低浓度下保持线性,ddPCR 的检测限为4.75 拷贝/μL,而qPCR的检测限为76 拷贝/μL,ddPCR 的灵敏度提高了16 倍。Pinheiro-de-Oliveira 等[26]则用ddPCR 方法研究了由双链DNA 病毒——犬丙型疱疹病毒2(Ovine herpesvirus type 2,OvHV-2)引起的巴西牛恶性卡他性热的爆发,发现在低浓度时能检测到qPCR 结果为阴性的3 个样品,表明dPCR 是一种敏感而特异性好的方法,可用作检测绵羊OvHV 的重要技术。
在含单链RNA(+)基因组的病毒检测研究中,多位学者利用了dPCR 方法。Yang 等[27]比较了ddPCR与qPCR 检测猪繁殖与呼吸综合征病毒(PRRSV)的定量线性、灵敏度和准确性,2 种方法均表现出高度的线性和定量相关性,但ddPCR 方法可以提高PRRSV检测的灵敏度和特异性。Wu 等[9]建立了一种检测人畜共患病毒——乙型脑炎病毒(Japanese Encephalitis Virus,JEV)的RT-ddPCR 方法,比较了其与TaqMan-RT-PCR 的敏感性,结果表明2 种方法均呈高度线性,RT-ddPCR 的检测限约为2 拷贝/ 20μL,比TaqMan-RT-PCR 灵敏度高100 倍,而且与其他猪病原菌无交叉反应,具较高的特异性。Zhang 等[28]新建了一种RTddPCR 检测A 型塞内卡病毒(Senecavirus A,SVA)的方法,具有良好的线性、重复性和重现性,并在极低浓度的SVA 核酸模板下保持线性关系。Pinheiro-de-Oliveira 等[29]也建立了一套用RT-ddPCR 方法检测口蹄疫病毒(Foot-and-Mouth Disease Virus,FMDV)RNA的标准化方法,显示出较好的稳健性、敏感性、特异性和准确性。
有时不同病毒引起的疾病症状十分相似,在临床上难以区分,敏感而特异的检测对疾病的及时控制至关重要。新型的dPCR 检测方法可作为诊断各种动物病毒的有效手段,有利于疾病的监测与控制,显示其潜在的应用前景。
4.1.2 细菌的检测与定量 随着畜禽养殖业向专业化、集约化和商品化的快速发展,以及饲料禁抗的实施,预防各种细菌性疾病的压力日趋严重,因此细菌的快速准确检测显得越发重要。
奶牛子宫炎是奶牛不孕的重要原因之一,由多种微生物感染引起。Jeon 等[30]利用ddPCR 方法分别测定发烧和不发烧2 组子宫炎奶牛的微生物菌群,发现2 组的化脓杆菌和细菌总数绝对丰度相似,但均高于健康组。随后Cunha 等[31]用ddPCR 方法测定了8 种潜在致病菌的绝对拷贝数,并评估了其与奶牛子宫炎和发热的关系,发现血液可作为母牛病原体从肠道到子宫的传播途径。因此ddPCR 方法的绝对定量成为子宫炎机理阐明的有利工具。
产志贺毒素大肠杆菌(STEC)与人类疾病关系密切。Verhaegen 等[32]用ddPCR 方法对志贺毒素基因Stx1、Stx2和内毒素基因Eae的定量进行了优化,ddPCR 和qPCR 的结果具有很好的一致性,但对PCR抑制剂耐受性比qPCR 好。此细菌中O157:H7 是主要血清类型,但近年来发现在阿根廷和德国存在O178 新型病原体。Paquette 等[33]比较了加拿大西部2 个屠宰场的牛粪大肠杆菌O178 和O157 数量,1 773 份样品经常规PCR 方法初筛后,再用ddPCR 对168 个样品进行绝对定量,发现O178 的比例高于O157,表明O178 可能是加拿大的一个新亚群。因此ddPCR 作为一种高灵敏度的方法可用于细菌新亚型的发掘。
dPCR 方法也已被用于微生物菌群评价。Looft 等[34]探讨了卡巴多克斯对猪肠道菌群的影响,发现饲料中添加该抗生素4 d 后,系统发育分析显示菌群结构发生了显著变化,尤其是普雷沃菌属丰度相对增加;但dPCR结果显示用药猪的普雷沃菌属绝对丰度没有变化,而是由于肠道中其他细菌数量减少,显示了dPCR 绝对定量在研究中的重要性。当利用抗生素进行抗感染治疗后,摄入益生菌的效果可通过粪便中益生菌的追踪来评价。Gobert 等[35]建立了一种dPCR 结合叠氮丙二钠(PMA)处理的新方法,对仔猪粪便中的鼠李糖乳杆菌和2 株副干酪乳杆菌进行定量分析,发现ddPCR 和qPCR 都可以对菌株进行特异性定量,但ddPCR 无需建立标准曲线,且能定量更低数量的活细胞,因此PMA-ddPCR 方法为临床前和临床粪便中细菌存活率的定量检测提供了一种新手段。
此外,dPCR 方法也已被用于鸡和其他动物中细菌疾病的检测与诊断。如Wattrang 等[36]发现在一些感染鸡的未稀释DNA 样本中,血液中丹毒DNA 的检测受到抑制,而ddPCR 对这种抑制不太敏感,为该细菌的检测提供了有效的方法。
4.1.3 寄生虫的检测与定量 目前,dPCR 技术已用于动物肠道寄生虫的研究。Yang 等[37]对绵羊和牛粪便中的隐孢子虫进行了ddPCR 和qPCR 研究,2 种方法均显示出高度的线性,但ddPCR 的精确度比qPCR 更高,所需模板拷贝数低,且受抑制剂的影响较小。Elmahalawy 等[38]用ddPCR 方法对瑞典放牧绵羊中的3种胃肠道线虫(血矛线虫、锥虫和毛线虫)进行绝对定量,结果表明该方法适用于不同属和各种样品的绝对定量。Baltrušis 等[39]也建立了一种ddPCR 新方法,用于精确鉴定和量化牛混合性胃肠道感染中的古柏线虫和奥思特线虫,利用2 种寄生虫序列的单核苷酸差异,开发了标记FAM 或HEX 荧光的2 种特异性水解探针,不仅可以区分这2 种寄生虫的DNA 序列,还可以在混合DNA样本中进行定量分析,新开发的通用探针可为属特异性提供稳健准确的参考。除肠道寄生虫外,dPCR 技术也已被应用于其他寄生虫的检测与定量,如猪疥螨不同生活阶段SMIPP-C基因的转录水平研究[40]。
4.2 动物生长繁殖相关基因检测与定量 生长繁殖相关基因的检测与筛选涉及到经济产量和生产力,已成为畜禽养殖和动物育种中经济性状选择的重要因素。Quach等[41]采用ddPCR 方法确定了皮特兰、长白、杜洛克和约克夏4 个家猪品种20 头猪的睾丸特异性蛋白Y 编码(TSPY)基因为三拷贝,且只在公猪中检测到;在低繁殖率组和特别高繁殖率组中,猪的TSPY 基因拷贝数没有显著差异,但其数值比正常组稍偏低。Reliszko 等[42]用dPCR 检测了妊娠猪MiR-23b、MiR-26a、MiR-92a、MiR-125b和MiR-203a的表达水平,发现怀孕16 d 时,MiR-23b水平显著上升,而用RT-qPCR 方法未能检测到显著性差异,说明dPCR 是最可靠的方法,能检测到低丰度循环miRNA 的微小倍数变化。Favia 等[43]将ddPCR 技术应用于单峰骆驼8 种骨骼肌中肌肉抑制素的转录表达水平的绝对定量。Szczerbal 等[44]研究发现用ddPCR 方法可有效检测和定量白细胞嵌合,准确估计X 与Y 性染色体的拷贝数之比,用细胞遗传学分析检测到的XX/XY 嵌合体均能被ddPCR 证实,表明该方法简单、灵敏、快速、准确。
4.3 畜禽饲料成分检测中的应用 转基因产品具有诸多优势,但尚未完全被人类接受。许多国家和政府对饲料产品中存在的转基因生物成分进行管制,规定了每种转基因成分的标识阈值,因此需要准确的定量方法来确定产品中的转基因成分。目前通常用qPCR 方法对产品中转基因成分进行定量分析,由于该方法对抑制剂敏感,并依赖于标准曲线进行定量,在极低数量的DNA 靶点检测方面存在局限性。
近年来,dPCR 技术在饲料相关转基因成分检测中的应用越来越受到关注。Corbisier 等[45]和Morisset 等[46]分别用dPCR 方法检测了转基因玉米MON810和内参基因Hmg的绝对拷贝数,结果与qPCR 检测结果一致,但dPCR 技术在低靶标浓度时重现性更好,对抑制剂的耐受性更强。Cottenet 等[47]评估了dPCR 技术对15 个转基因玉米和9 个转基因大豆事件的定量性能,根据转基因生物验证指南,从高、中、低3 个不同的转基因含量水平上对转基因生物的真实性和精确性进行了测定,结果表明精确度较高,每个转基因事件的定量限值在12~31 个目标拷贝。Bogožalec 等[48]针对“抗草甘膦”大豆和大豆参考基因,用QX100/QX200 ddPCR 方法对4 个样本进行适用性研究,开发了一种用于复杂样品中转基因生物定量分析的方法。吴潇等[49]基于QX200 平台建立了特异的ddPCR 检测方法,对转基因大豆中结构特异性基因进行准确定量,结果检出限为2 拷贝/20 μL,检测灵敏度高于国标中qPCR 方法。上述研究结果均显示,dPCR 技术有着qPCR 无可比拟的优越性,是饲料转基因绝对定量检测的一种有效方法。
对于复杂基质或饲料,单重检测方法难以执行高通量分析所需的最佳转基因成分检测。为满足复杂转基因成分的绝对定量,已开发了系列双重或多重dPCR 检测方法。潘广等[50]建立的双重ddPCR 定量方法能特异性检出转基因玉米T25,在相对标准偏差≤25%时可以检测到4.6 个特异性分子,而在不考虑各重复间相对标准偏差的情况下可以检测到1 个拷贝。刘津等[51]建立了一种特异、稳定、灵敏、通用的转基因大豆MON89788品系双重dPCR 定量检测方法,ddPCR 平台对大豆MON89788 品系和内源Lectin的绝对定量限分别为8.0、8.2 拷贝/μL,cdPCR 平台分别为7.443、7.646 拷贝/μL,2 个平台的相对定量限均为0.1%。蔡教英等[52]建立了油菜样品的双重ddPCR 定量分析方法,定量限(LOQ)和检测限(LOD)分别为18、3.7 拷贝。Niu 等[53]提出了一种单一通用引物-多重ddPCR(SUP-M-ddPCR)的策略,发现“五重法”LOD 和LOQ 分别为0.1% 和0.01%,可以作为检测转基因玉米产品的重要工具。因此,双重和多重ddPCR 定量方法比单重dPCR 定量方法更简便、系统、高效、经济,适用于饲料样品中复杂转基因成分的定量检测。
为使转基因成分检测更真实可靠,用于dPCR 检测的样品多需进行前处理,往往会导致实验结果偏差。Fu等[54]探索了一种无预处理的dPCR 检测方法,该方法对9 种转基因玉米(MON810、MON863、TC1507、MIR604、MIR162、GA21、T25、NK603 和Bt176)的检出限为0.1%(低于欧盟法规规定的标识阈值),9个样品间的特异性和稳定性一致,实验室内和实验室间的重复性均较好,可以更灵敏、特定而稳定地检测国际贸易产品中的转基因成分。
由于克服了PCR 抑制和依赖于外部标准曲线等问题,近年来dPCR 被认为是一种新的qPCR 替代技术,对目标DNA/RNA 进行绝对定量,在转基因生物的定量检测、外源基因拷贝数分析以及标准物质定值方面具有重要作用,可为饲料生产和牧场生物技术可追溯性提供指导。
4.4 畜禽产品质量分析
4.4.1 畜禽产品中病原菌污染检测 动物病原体可能会对人类安全和健康带来影响,甚至引发社会卫生安全事件,因此有必要快速准确地对畜禽产品中的病原体进行监测,为食品安全评价和潜在风险控制提供参考。
戊型肝炎病毒(HEV)的食源性传播已成为人们关注的问题,采用RT-qPCR 技术可以进行灵敏地检测与定量。Martin-Latil 等[55]比较了微流控RT-dPCR 与RT-qPCR 检测猪肝制品中HEV 的性能,发现RT-dPCR的灵敏度与RT-qPCR 相似,但RT-dPCR 所需体积仅为RT-qPCR 的1/13,所需成本约为1/2,且不受抑制剂显著影响。
目前食品中肠出血性大肠杆菌(EHEC)的常用鉴定方法是基于PCR 技术筛选富集培养物中特征性基因标记,当食品基质复杂时可能会出现假阳性。McMahon 等[56]建立了一种能同时检测单个细菌中Stx和Eae基因的多重单细胞ddPCR 方法,在绞碎牛肉/猪肉中可以准确地鉴定出EHEC,既减少了假阳性,又降低了检测成本,并提高了检测速度和准确性。
鼠伤寒沙门氏菌是一种零容忍的食源性致病菌。Wang 等[57]比较了qPCR 和ddPCR 2 种方法检测该病原菌的效果,发现ddPCR 拥有更高的灵敏度(10-4ng/μL或102CFU/mL)、更少的预培养时间(节省2 h)和更强的抑制剂耐受性,为食源性鼠伤寒沙门菌的检测提供了一种新方法。
人畜共患病原菌对食品质量和公众健康构成极大威胁,qPCR 是目前检测食源性致病菌的常用有效手段。以上研究结果显示,dPCR 技术更加灵敏可靠,为畜禽产品中病原菌检测提供了一种新的方法。
4.4.2 畜禽产品成分分析 近年来,经常出现食品产品与标签不符、以次充好等商业欺诈问题,其中肉类产品掺假是食品行业的重大问题,需要可靠的技术来监控。相对于qPCR 具有明显优势的dPCR 技术在畜禽产品成分分析中的研究与应用日益受到关注。Cai 等[58]以dPCR 技术为基础,建立了一种高精度的针对肉制品中猪肉和鸡肉的定量方法,发现生肉重与DNA 含量、DNA 含量与DNA 拷贝数的关系均接近线性,能够根据DNA 拷贝数建立计算生肉重量的公式,并用已知比例的猪肉和鸡粉样品验证了该方法的准确性和适用性。王珊等[59]和陈晨等[60]建立了定量检测羊肉制品中羊源和猪源性成分的ddPCR 方法,能够更好地鉴别掺假。杨华等[61]建立了针对牛、猪、鸡和鸭肉的多重ddPCR检测技术,能够快速并准确判断样品中是否存在牛肉及其在牛肉制品中掺入的鸡肉、鸭肉和猪肉。苗丽等[62]利用ddPCR 定量检测系统准确检测肉及肉制品中羊源性成分的含量,且具有较强的抗干扰能力。Ren 等[63]采用ddPCR 方法检测了羊肉制品中鸡肉含量,并引入一个常数将拷贝数与肉重的比例进行转换,该方法比qPCR 更精确、更灵敏,且在不同的热处理和超高压条件下具有良好的重复性和稳定性,同时还证实了肉的不同部位对ddPCR 方法的定量准确度没有影响。Shehata等[64]用ddPCR 方法检测了食品和饲料中牛肉、猪肉、鸡肉和火鸡肉成分,证实了该方法的特异性、重复性和再现性,牛肉和火鸡肉检测灵敏度为0.05%~3.0%,猪肉和鸡肉为0.01%~1.0%。Cai 等[65]开发了一个双液滴数字PCR(dddPCR)检测和量化系统,在单一反应管中同时鉴定和量化含牛肉和猪肉混合物的肉制品,认为该检测和定量系统适用于肉制品的质量控制和常规分析。李伟琦等[66]也建立了特异、灵敏和通用的火鸡源性成分dPCR(ddPCR 和芯片式dPCR)定量检测方法,对混合鲜肉中火鸡源性成分的质量百分比定量检测限为5%。
通常用于确定肉品种类的基因主要来自线粒体,但由于每个细胞的线粒体DNA 含量有5 倍的组织间差异,导致物种DNA 含量低估(-70%)或高估(+160%),因此不适合将线粒体DNA 作为物种定量的靶标。Floren 等[67]开发了一种以核F2 基因为靶标,对加工肉制品中的牛肉、马肉和猪肉成分进行精确定量的两步ddPCR 方法,认为该方法优于qPCR 法,且在14 个不同的物种中证实了其特异性,定量限(LOQ)和检测限(LOD)分别为0.01% 和0.001%,可作为生产系统质量保证和控制的参考。
5 小结与展望
众多研究结果显示,dPCR 具有快速、简便、准确、灵敏等优点,与qPCR 相比,对低丰度DNA 更为敏感和特异,大大提高了抑制剂存在情况下计算单个分子和解析少量拷贝的精度,可用来检测复杂样品中微量甚至痕量靶核酸。dPCR 的灵敏度取决于检测器的灵敏度、PCR 扩增效率以及反应单元的数目,随着更低丰度DNA 检测以及提高动态范围的需求,需要提供更多数字分区的平台。目前,dPCR 技术在动物生产中的应用正得到广泛认可,并在提高检测限和实验室间重现性方面具有相当大的前景。
考虑到机器和样本试剂成本,dPCR 目前比qPCR更贵,拥有dPCR 仪器的实验室比较有限,然而随着商业化dPCR 仪器的发展,预期成本将逐步下降。另外,该技术通量不高,操作比较复杂,存在一定的假阳性,而且还没建立dPCR 相关技术标准,因此,dPCR 作为一项新的技术,还存在许多问题需要解决。相信随着技术的进步与革新,如低成本芯片的制作、液滴生成和PCR 扩增的集成、自动化程度的提高等,该方法定将会得到更加广泛的应用。
