AhBG1转基因拟南芥的ABA敏感性和抗旱性研究
2021-03-11黄莹琳张洪亮龙海涛
黄莹琳,张 志,2,张洪亮,2,胡 博,2,龙海涛*
(1. 华南师范大学生命科学学院∥广东省植物发育生物工程重点实验室, 广州 510631;2. 华南师大(清远)科技创新研究院有限公司,清远 511517)
植物激素脱落酸(ABA)在植物生命周期的各种生理过程中起着至关重要的作用,包括种子休眠、发芽和对环境胁迫条件的适应性反应[1-2]. 当植物面临干旱、盐、渗透等胁迫时,植物体内的ABA快速增加,调节植物体内的稳态. 植物中ABA水平取决于其生物合成、分解、运输、转化、贮存和利用,其中无生理活性的结合型ABA葡萄糖酸酯(ABA-GE)水解成具有生理活性的游离型ABA也至关重要,关系到ABA对植物生长发育的调节. 这个步骤由植物的ABA特异性β-葡萄糖苷酶(简称BG或BGLU)将无活性的ABA-GE水解后形成活性的ABA[3]. 目前,在拟南芥中发现4个β-葡萄糖苷酶(AtBG1、AtBG2、BGLU10、BGLU18)都能催化ABA-GE转变成ABA[4-5]. 玉米基因组中具有26个编码β-葡萄糖苷酶的基因,信号肽的分析显示它们分别定位于质体、线粒体、胞质和液泡[6].
β-葡萄糖苷酶参与植物对胁迫的快速响应,通过提高ABA质量分数可提高植物对非生物胁迫的耐受性. 有报道指出:bglu18拟南芥突变体延迟了脱水诱导的ABA积累[5]. 水稻Os3BGlu6可以在体外将ABA-GE水解为ABA,水稻缺失Os3BGlu6的突变体植株矮小,叶片ABA质量分数和光合作用速率降低导致水稻抗旱性下降[7]. 过表达BG1匍匐翦股颖ABA水平积累高,导致植株矮生并提高了干旱存活率[8]. AtBG1通过其对气孔发育的负调控来确保正常的气孔密度,还可以快速形成活性ABA以适应水分亏缺[9].
课题组的前期工作发现:在花生响应干旱胁迫时,有6个β-葡萄糖苷酶家族基因的表达水平显著提高,对维持ABA稳态发挥作用[10],但具体机制尚不清楚. 本文根据花生响应干旱的转录组结果,从花生中克隆了BG基因(命名为AhBG1),将其在拟南芥异源表达,研究其对ABA敏感性和抗旱性的影响,为认识AhBG1的功能提供依据.
1 材料与方法
1.1 拟南芥培养
在超净工作台中用75%乙醇处理拟南芥种子40 s,再用无水乙醇处理2次,每次40 s,转移到含有1/2 MS固体培养基上. 在4 ℃避光层积处理2 d后,置于光下培养7 d. 待幼苗长出后移栽到高温灭菌的泥炭土生长.
1.2 序列分析及预测
基于NCBI的Blast和GenBank(http://www.ncbi.nlm.nih.gov/BLAST)对cDNA和其编码氨基酸序列进行了分析. 使用TMHMM 2.0对二级结构进行预测(http://www.cbs.dtu.dk/services/),用SignalP 4.1 server分析信号肽.
1.3 AhBG1蛋白的亚细胞定位观察
取约10片未抽薹的拟南芥嫩叶片,酶解法提取原生质体,将重组质粒瞬时转入原生质体,在拟南芥室温23 ℃避光孵育13~24 h,然后用激光共聚焦显微镜Leica LSM Image Browser 3.2 program(Leica Corporation, Germany)进行拍照观察.
1.4 ABA质量分数的测定
用HPLC仪(日本岛津Shimadzu LC-6A)测定,以Sigma公司ABA样品为标准品,用10 μL ABA样品注入Kromasil C18柱,设置柱温为35 ℃,流动相为V(甲醇)∶V(1%乙酸)=45∶55,流速1 mL/min. 检测器Waters 486 detector,检测波长为252 nm. 绘制ABA标准曲线. 取同一叶位的叶片0.3 g,采用同样的参数根据峰面积计算出样品每克干质量的内源ABA的质量分数.
1.5 ABA敏感性分析
参照GE等[11]方法. 将Col-0野生型和AhBG1过表达拟南芥株系种子分别铺板于含有不同 ABA浓度的1/2 MS培养基,层积处理2 d 后置于光下培养,统计萌发率. 光下培养8 d后观察不同浓度ABA的平板上子叶生长状况,统计子叶变绿率.
1.6 拟南芥幼苗干旱存活率统计
将Col-0野生型和过表达AhBG1拟南芥植株正常培养至3周龄后停止供水21 d,再复水培养7 d,观察并分析拟南芥幼苗的生长状态并统计存活率.
1.7 叶片失水率分析
取正常生长条件下培养3周龄的拟南芥莲座叶放于培养皿,置于光照培养箱(28 ℃,60%相对湿度)中, 每隔30 min称量叶片质量(m),计算叶片失水率. 计算公式如下:
叶片失水率(%)=(m0-mt)/m0×100%,
其中,m0为叶片放进培养箱时的质量,mt为tmin后叶片的质量.
1.8 数据分析
所有实验重复3次,用均数±标准差表示,使用SPSS18.0 统计软件进行方差分析(ANOVA),P<0.05表示差异有统计学意义. 使用Microcal Origin 7.5软件作图.
1.9 基因表达检测
提取拟南芥RNA,用PrimeScriptTM one step RT-PCR kit试剂盒反转得到cDNA. 根据已知的基因序列,设计RealTime PCR引物(表1),按照TaKaRa公司的SYBR Premix Ex TaqTMII说明书进行Real Time PCR. PCR反应条件为:95 ℃ 30 s,1个循环;95 ℃ 5 s,60 ℃ 34 s (退火温度取决于不同引物的最适反应温度),共50个循环. 利用2-ΔΔCT方法分析基因的相对表达量.

表1 相关基因表达所用的引物Table 1 The primers for related gene expression
2 结果与分析
2.1 AhBG1的氨基酸序列分析
氨基酸序列的多重比对分析表明:AhBG1与拟南芥AtBG1、AtBG2、水稻Os3BG6的同源性分别是8.88%、8.63%和9.77%. TMHMM 2.0分析预测表明:AhBG1的二级结构中含有1个跨膜结构,跨膜螺旋氨基酸结构位于7~24氨基酸位点(图1A). 使用SignalP 4.1 server在线分析发现其第1~第28氨基酸位点具有信号肽(图1B).
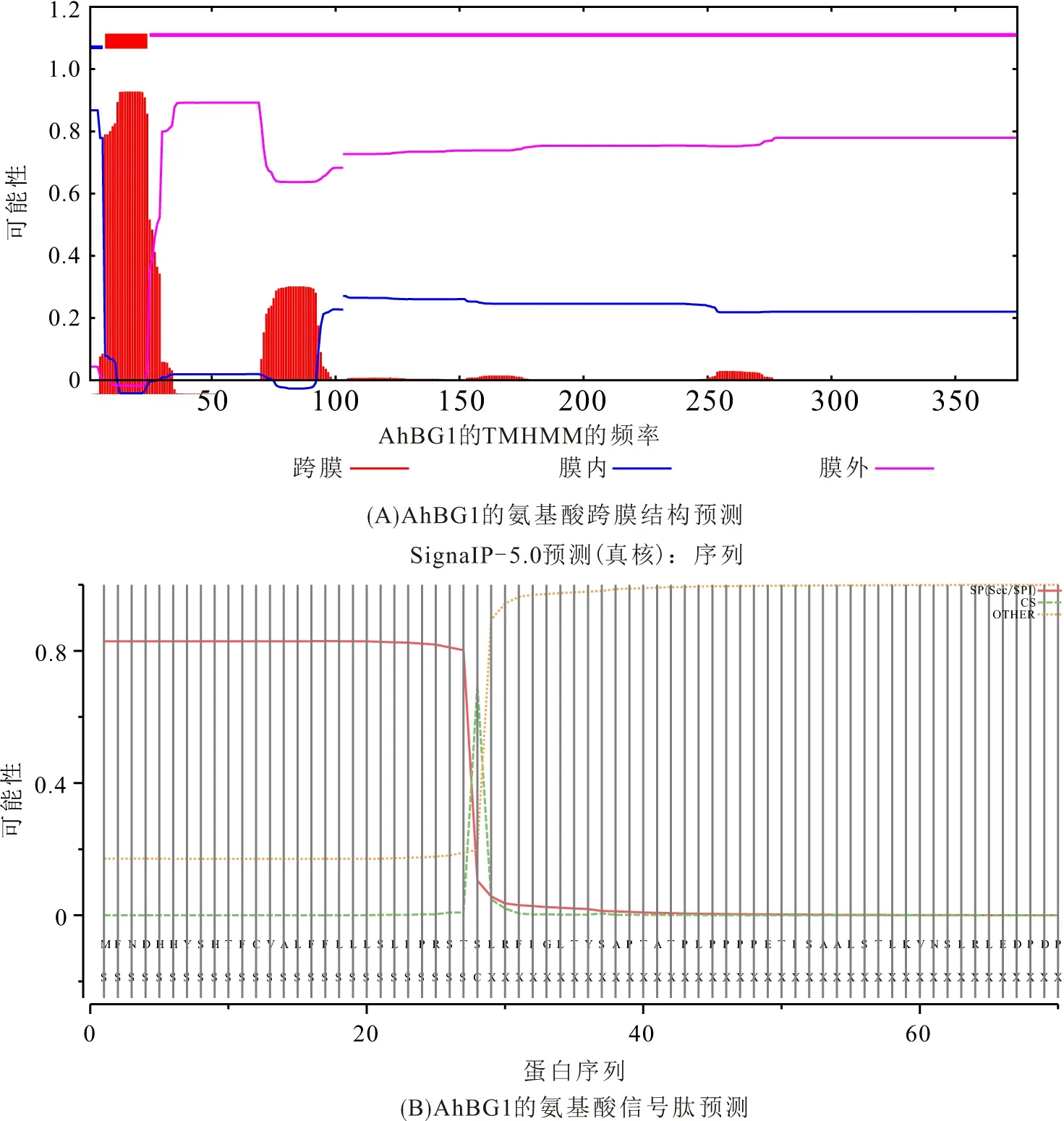
图1 花生AhBG1的生物信息学分析
2.2 AhBG1转基因拟南芥筛选和AhBG1蛋白定位
利用花椰菜花叶病毒(CaMV)35S启动子与AhBG1基因及绿色荧光蛋白基因eGFP融合,将P35S∶∶AhBG1-eGFP在拟南芥原生质体细胞中瞬时表达,使用激光共聚焦荧光显微镜观察,发现AhBG1基因编码的蛋白定位于细胞质(图2A). 通过农杆菌EHA105将AhBG1基因的过表达载体p35S∶∶AhBG1-eGFP异源转化到拟南芥中,筛选获得3个AhBG1超表达拟南芥株系(图2B),根据AhBG1基因表达从高到低命名为AhBG1-OX-1、AhBG1-OX-2和AhBG1-OX-3. 激光共聚焦显微镜观察AhBG1过表达阳性拟南芥株系根尖有绿色荧光,AhBG1-eGFP融合蛋白在细胞质中出现绿色荧光,确定AhBG1蛋白确实定位于细胞质(图2C).
2.3 过表达AhBG1对拟南芥植株体内ABA质量分数和ABA敏感性的影响
ABA是响应干旱胁迫的重要应激激素. 对AhBG1-OX-1、AhBG1-OX-2、AhBG1-OX-3和Col-0野生型拟南芥植株脱水处理2 h,检测叶片中ABA质量分数的变化. 在正常生长条件下,AhBG1-OX-1株系拟南芥体内的ABA质量分数高于野生型,脱水处理2 h后,各株系拟南芥的ABA质量分数都显著增加,其中过表达拟南芥中ABA质量分数的升高显著高于野生型,特别是AhBG1-OX-1株系拟南芥的ABA质量分数最高(图3). 说明AhBG1的过表达可能促进了转基因植株叶片内ABA-GE生成ABA,有利于适应干旱胁迫.
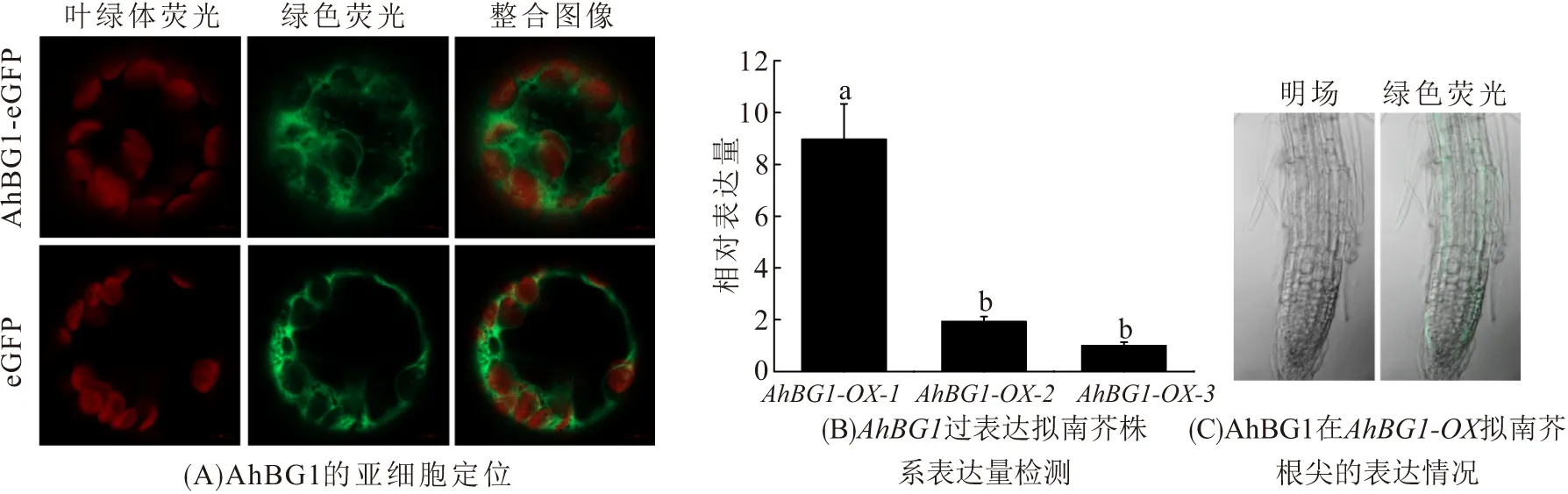
图2 AhBG1转基因拟南芥的筛选和AhBG1蛋白定位
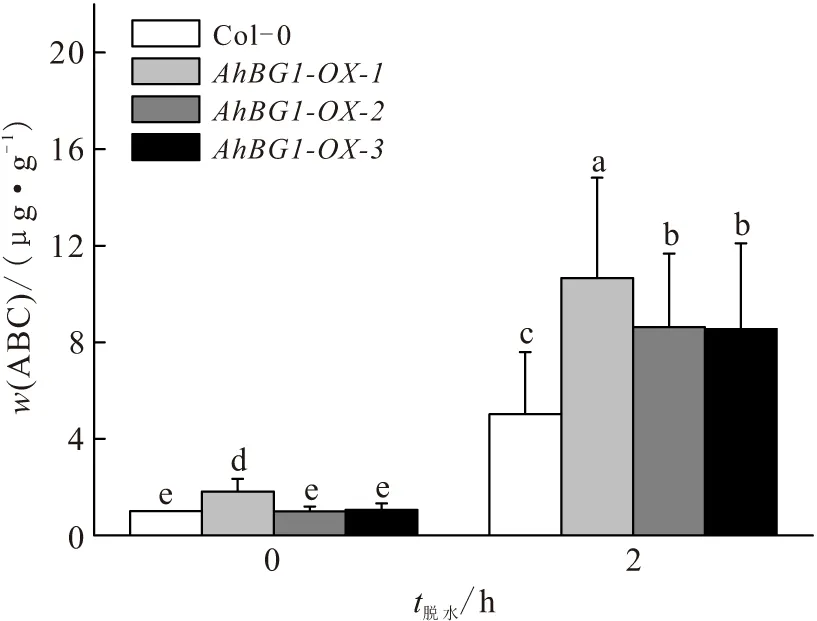
图3 脱水处理下AhBG1转基因拟南芥和野生型叶片ABA质量分数的变化
将Col-0野生型和AhBG1-OX-1株系拟南芥种子分别铺板于含有0.1 、0.5 、2.0 μmol/L ABA的1/2 MS培养基,层积处理后统计萌发率. 在0.1、0.5、2.0 μmol/L ABA处理下AhBG1-OX-1株系拟南芥种子萌发率均低于Col-0野生型(图4A). 种子正常萌发后,将AhBG1-OX-1株系和Col-0野生型拟南芥植株移入含有不同浓度ABA的平板上生长8 d,观察子叶生长状况. 结果表明:在0.5 μmol/L ABA的生长条件下,AhBG1-OX-1株系拟南芥的子叶变绿率低于Col-0野生型(图4B、C). 以上ABA处理后的实验结果说明,在拟南芥中异源过表达AhBG1基因提高转基因植株内源ABA质量分数和对外源ABA的敏感性.
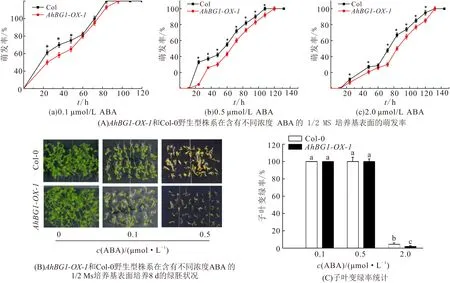
图4 AhBG1-OX-1株系拟南芥对外源ABA 的敏感性分析
2.4 过表达AhBG1对拟南芥耐旱性的影响
ABA是植物响应干旱的关键激素之一,因此本研究对3周龄的AhBG1-OX-1、AhBG1-OX-2、AhBG1-OX-3株系和Col-0野生型拟南芥植株停止供水21 d,再继续复水7 d. 结果发现:AhBG1-OX-1、AhBG1-OX-2和AhBG1-OX-3株系拟南芥的存活率均高于Col-0野生型,其中AhBG1-OX-1株系拟南芥存活率最高(图5A、B). 在脱水处理30~300 min期间,AhBG1-OX-1株系拟南芥叶片失水率持续显著低于Col-0野生型(图5C),表明AhBG1转基因拟南芥植株的耐旱性增强.
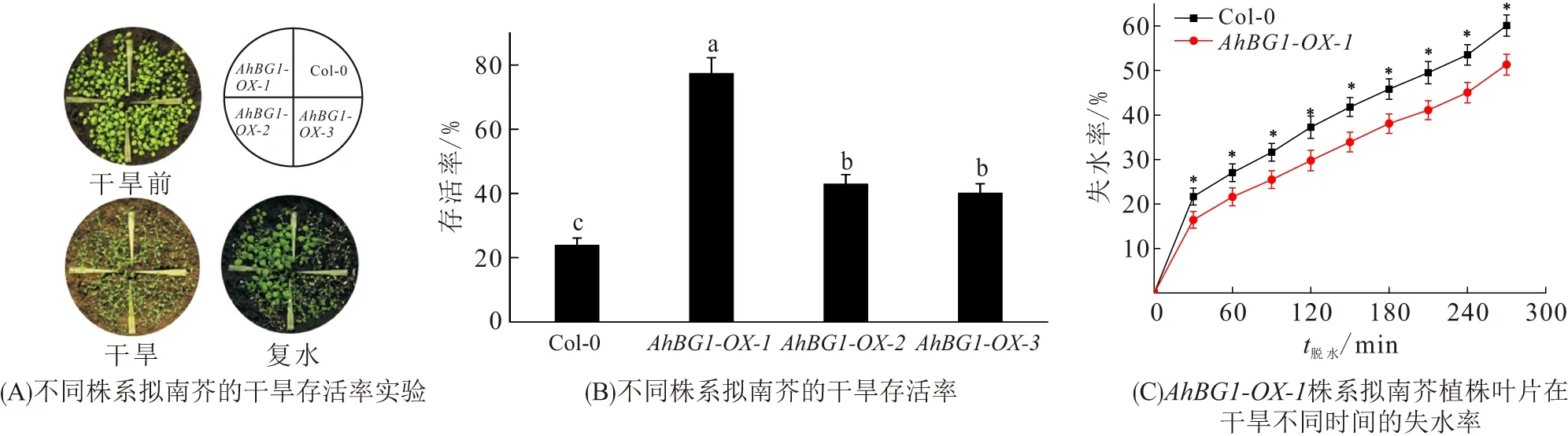
图5 AhBG1转基因拟南芥的抗旱性分析
2.5 脱水处理对过表达AhBG1拟南芥体内ABA稳态相关基因表达的影响
检测干旱情况下过表达AhBG1拟南芥中ABA稳态相关基因表达变化. 正常情况下,在AhBG1-OX-1株系拟南芥中,AtRD29A表达高于Col-0野生型(表达量增加5.2倍,图6C),而AtAREB1、AtNCED3、AtCYP707A1、AtUGT71C5基因的表达与野生型拟南芥无显著变化. 脱水2 h后,在AhBG1-OX-1株系和Col-0野生型中AtNCED3、AtCYP707A1、AtAREB1和AtRD29A等基因的表达皆上调,AtUGT71C5基因的表达下调(图6). 其中,在AhBG1-OX-1株系中AtNCED3、AtAREB1和AtRD29A基因表达增幅显著高于Col-0野生型,而AtCYP707A1表达增幅显著低于Col-0野生型. 结果也与脱水处理下AhBG1-OX株系和Col-0野生型叶片ABA质量分数的变化结果相吻合.
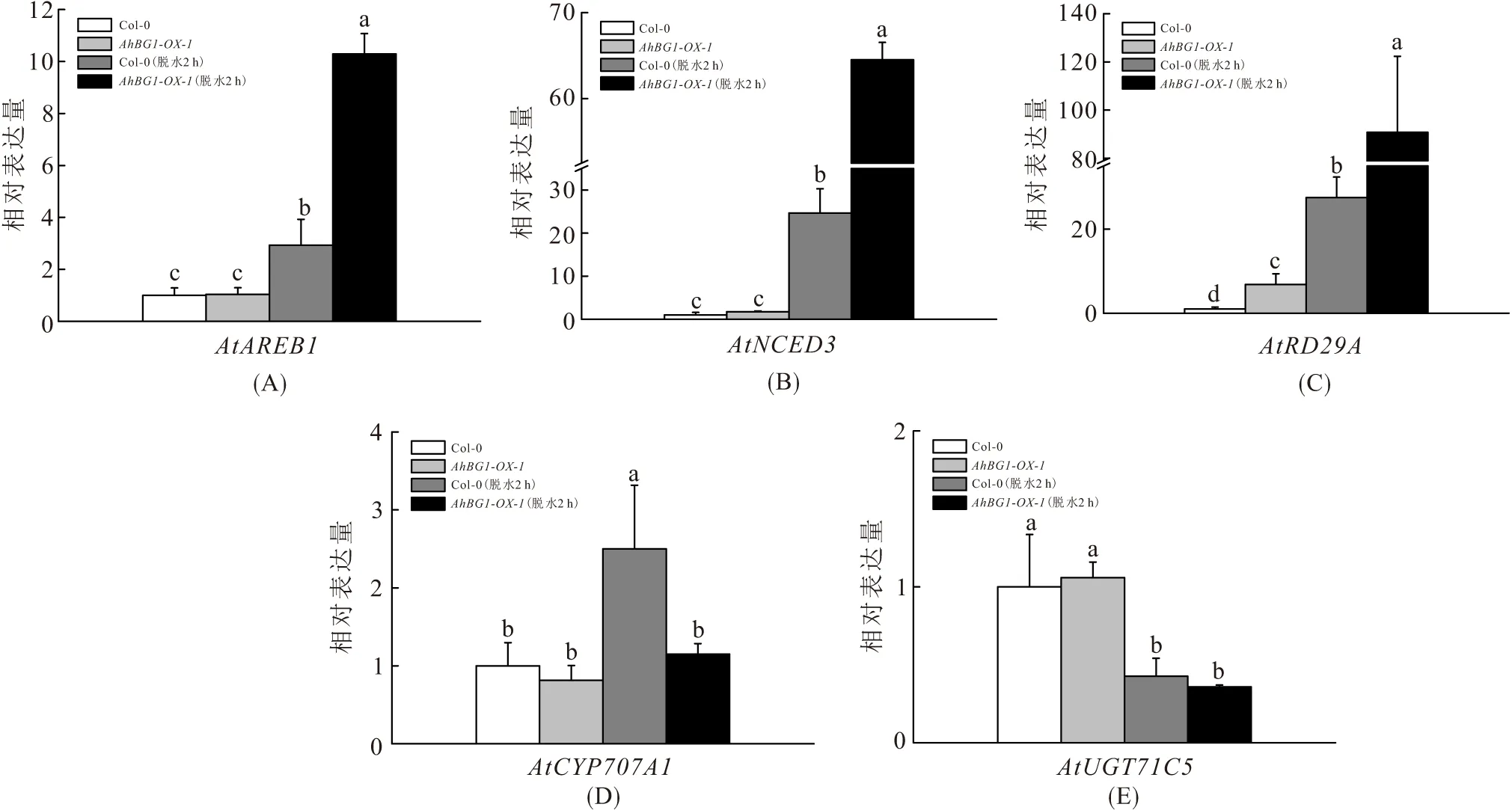
图6 脱水处理下AhBG1-OX-1株系和Col-0野生型叶片ABA稳态相关基因的表达变化
3 讨论
ABA稳态是指植物自我调节并保持其内部游离型ABA含量相对稳定的一种状态,受到植物体内ABA生物合成、氧化代谢、可逆糖基化、转运等调控[12]. 外界环境胁迫下,植物通过调节ABA水平的动态变化,以调控植物水分平衡、影响体内渗透调节、提高细胞耐受性来提高植物的抗旱能力. HAN等[5]指出,植物在干旱胁迫下,体内ABA含量的增加首先来自于ABA-GE的水解. 这引起研究人员对植物体内ABA特异性β-葡萄糖苷酶功能的研究.
我们从花生的数据库中筛选并克隆的AhBG1,与拟南芥的AtBG1与AtBG2氨基酸序列同源性较低,具有信号肽和跨膜区域. AtBG1和AtBG2分别定位于内质网[4]和液泡[13]. 本研究发现AhBG1定位在细胞质(图2),推测其作用可能不同于AtBG1和AtBG2,有待进一步研究. 另外,组织特异性检测表明花生根、茎和叶片中AhBG1均有表达,其中在叶片中表达水平最高,与拟南芥BGLU18在叶中高水平表达一致[14],经干旱处理时,花生中AhBG1表达增加(未发表),表明AhBG1在花生叶片响应干旱过程可能发挥重要作用.
β-葡萄糖苷酶提高植株体内ABA水平从而促进植株的抗旱性[4-5,7-8]. 过表达AtBG1拟南芥在正常条件下的叶片和根部ABA水平略增加,在脱水条件下ABA含量增加了20倍,从而表现出对干旱的耐受性[4],水稻Os3BGlu6的过表达提高了水稻的耐旱性[7]. 而T-DNA插入突变体Atbg1表现为对干旱敏感.bglu10突变体拟南芥在干旱处理下叶片失水率较高,ABA含量和β-葡萄糖苷酶活性较低,最终导致耐旱性降低[19]. 过表达AhBG1拟南芥在干旱条件下体内的ABA水平显著高于野生型(图3),使其提高了ABA的敏感性和抗旱性.
9-顺式-环氧类胡萝卜素双加氧酶(NCED)是ABA生物合成的关键酶[15-16],除ABA生物合成外,分解代谢是控制细胞ABA水平的主要过程. 细胞色素P450家族的4个成员CYP707A1至CYP707A4进行羟化反应,生成不稳定的8′-羟基ABA[17]. ABA通过ABA UDP-葡萄糖基转移酶(UGT)与葡萄糖结合,生成无生理活性的ABA-GE[2]. AtABRE1是ABRE依赖性的ABA信号激活因子,是ABA信号通路过程的关键正调控因子,可增强拟南芥干旱耐受性[18]. 脱水2 h后,在AhBG1-OX株系中AtNCED3、AtAREB1和AtRD29A基因表达增幅显著高于Col-0野生型,而AtUGT71C5、AtCYP707A1表达增幅显著低于Col-0野生型(图6). 表明同等条件的脱水处理,更能诱导AhBG1-OX-1株系ABA生物合成途径和信号转导途径相关基因的表达上调,促进ABA糖基化途径基因和分解代谢途径基因下调,同时控制氧化代谢途径基因上调程度,从而有利于促进植物体内ABA积累,提升过表达植株的抗干旱能力. 因此,AhBG1蛋白定位于细胞质,可能通过催化ABA-GE形成ABA,从而提高植物体内的ABA含量,并影响ABA生物合成、分解代谢及信号通路等相关稳态基因的表达提高植物体的耐旱性.
