布鲁菌介导细胞自噬的研究进展
2021-03-10顾国婧李博文李文杰周志雄罗艺晨帅学宏陈吉轩黄庆洲焦寒伟
顾国婧,李博文,李文杰,周志雄,罗艺晨,帅学宏,赵 宇,陈吉轩,黄庆洲,伍 莉,焦寒伟
(西南大学 动物科学学院 医学研究院免疫学研究中心/兽医科学工程研究中心,重庆 402460 )
布鲁菌为球杆形革兰阴性胞内寄生菌,可侵入宿主细胞引起布鲁菌病(简称布病,又称马尔他热)。布病对关节、神经、生殖和免疫系统都会造成损害[1],给人类健康和畜牧业的发展带来严重威胁。自噬是真核生物细胞在自噬相关基因的调控下维持机体生态平衡的一种生理机制,在大多数情况下自噬处于未激活状态,病原菌入侵或外界环境发生改变会激活自噬。据报道,布鲁菌可以抑制宿主细胞的凋亡通路,从而介导自噬,为其在宿主细胞内的生存繁殖创造有利条件。随着自噬相关研究的深入,布鲁菌介导细胞自噬成为探究其致病机制的新热点。
1 布鲁杆菌引发自噬
巨噬细胞是布鲁菌的主要宿主,布鲁菌侵染巨噬细胞可激活自噬的发生。而在成骨细胞中,牛种布鲁菌(Brucellaabortus,B.abortus)对于自噬途径的激活还参与了成骨细胞功能和骨形成的调节[2]。布鲁菌感染会诱导TGF-β1分泌、诱导胶原沉积、抑制mmp-9分泌,从而诱导自噬途径的激活[3]。有研究表明,羊种布鲁菌(Brucellamelitensis,B.melitensis) 16M侵染巨噬细胞后,LC3-Ⅰ向LC3-Ⅱ的转化率将会提升,自噬途径随即被激活;Beclin1是抑制、干扰细胞自噬的关键基因,添加该基因后可以抑制细胞自噬的发生,降低B.melitensis16M在宿主细胞中存活和繁殖的能力。因此推测B.melitensis16M可以激活自噬途径并促进B.melitensis16M在宿主细胞中的存活[4]。B.melitensis16M激活的自噬途径可以降低布鲁菌与溶酶体的融合率,从而减少了B.melitensis16M被溶酶体内水解酶的降解,是自噬有利于B.melitensis16M在宿主细胞内生存繁殖的机制之一。
综合多个不同的研究结果来看,B.abortus和B.melitensis在复制前可能遵循不同的胞内通路,有的表明B.abortus的转运和复制与经典的大自噬途径无关,但有的却显示大自噬有利于B.melitensis的存活和复制。还有试验结果表明,B.abortusS2308和B.melitensis16M菌株都能够侵袭缺乏ATG5的成纤维细胞并在其中进行复制,而ATG5是典型的大自噬途径的核心成分,这表明布鲁菌的复制并不依赖于经典的大自噬途径[5]。这种不依赖于ATG5的自噬反应被称为非典型的自噬。最近的研究表明,非典型自噬途径在宿主-病原相互作用中起着关键作用,并且具有与典型自噬途径相同的上游调节因子。
吞噬过程中,布鲁菌在含有布鲁菌的液泡(BCV)内存活,与早期核内体(EE)、晚期核内体(LE)相互作用,并与溶酶体(lysosomes,Lys)部分融合形成eBCV。eBCV促进Ⅳ型病毒分泌系统(type Ⅳ secretion system,T4SS)的诱导,T4SS又传递效应蛋白,控制eBCV与ER出口位点(ERES)的相互作用[6]。STARR等[7]研究发现,胞内布鲁菌通过形成eBCV从内泡室向ER(endoplasmic reticulum,ER)运输,并产生一个ER衍生的复制液泡(rBCV)。布鲁菌控制eBCV向rBCV的转化的机制在很大程度上仍不清楚,但rBCV的产生并没有通过ER和高尔基体之间的依赖于ARF1的囊泡转运[8]。目前已明确证实,T4SS可以通过病毒基因的突变将eBCVs中相应的细菌突变体隔离,使其无法与ERES相互作用并将eBCV转化为rBCV[8-11]。相反,在rBCV成熟期间,eBCVs定位于ER出口位点ERES,如果灭活小GTPase Sar1则会抑制rBCV的产生,表明布鲁菌阻断ER的早期分泌途径,促进eBCV向rBCV转化[8]。Rab2和GAPDH是形成rBCV和细菌复制所必需的,这也能表明布鲁菌改变早期分泌途径的特定成分以获得ER结构。细菌的分裂和复制都发生在rBCVs内[10],这表明细菌会在eBCV中为增殖做好准备。布鲁菌在ER中增殖后,rBCV转换为具有自噬特征的间隔(aBCV),侵染流程如图1所示。aBCV具有与成熟的自噬体一致的晚期内质体特征,而不显示ER标记,所以它们在功能上与rBCVs不同。aBCVs与细菌释放和细胞间传播相关,并有助于布鲁菌在ER中增殖后完成细胞内周期[7]。
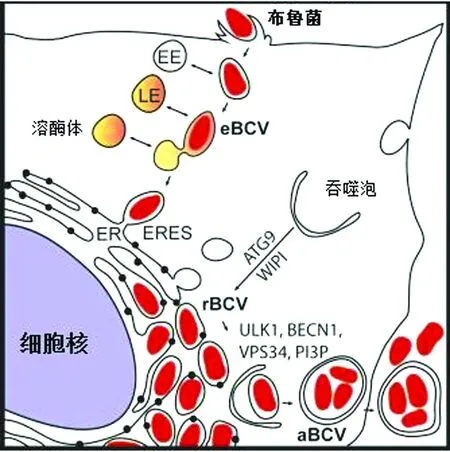
图1 布鲁菌胞内侵染流程[12]
aBCV的形成需要自噬起始蛋白ULK1、Beclin1和ATG14L以及PI3K的活化,而与ATG5、ATG16L1、ATG4B、ATG7无关。另外,还与规范的自噬不同的是,这个过程需要ATG9和WIPI1,但不需要DFCP1。有研究表明eBCV向rBCV的成熟则并不需要自噬起始蛋白ULK1和Beclin1以及自噬延长蛋白ATG5、ATG7、ATG16L1和LC3B[13]。还有研究指出非典型通路依赖于ULK1和Beclin1,但与LC3和ATG7以及ATG5无关[14-15]。在布鲁菌感染巨噬细胞的晚期,自噬基因AMPK、ULK3和VPS34的miRNA表达谱发生改变[16],表明该细菌可能为了形成aBCV而改变了相关自噬基因的表达。袁莎[17]研究发现,16M感染巨噬细胞可促进细胞因子IL-6分泌,IL-6能抑制IFN-γ的产生,达到抑制IFN-γ诱导的典型自噬的目的。综上所述,细菌可能根据它们在胞内生存复制的不同阶段选择性利用了宿主细胞的自噬相关机制。
2 布鲁菌介导细胞自噬相关的重要毒力因子和信号通路
布鲁菌主要借助LPS、外膜蛋白、VirB编码的T4SS、双组分调控系统等毒力因子的作用得以在宿主细胞中生存、繁殖[18-19]。这些因子是布鲁菌能够侵入宿主细胞并在胞内生存复制的必需因素。
2.1 布鲁菌LPS介导细胞自噬研究表明,LPS是布鲁菌的主要毒力因子之一[20]。LPS在结构和功能整合中起着关键作用,同时也是先天免疫系统的主要靶点[21]。它不仅在引导细菌改变胞内运输途径方面发挥着重要作用,还保护细菌免受恶劣的细胞内环境的影响,抑制促炎症和抗菌宿主反应,并干扰巨噬细胞中的抗原提呈[20]。有研究表明,与大肠杆菌相比,布鲁菌LPS的活性及毒力要弱几百倍[22],这说明布鲁菌LPS属于非典型的LPS。LPS的O抗原能够阻碍机体细胞诱发凋亡,避免激活细胞先天性免疫系统。但是,目前研究中发现,布鲁菌的LPS只与其在宿主细胞内的生存有关。
2.2 T4SS介导细胞自噬T4SS对布鲁菌在宿主细胞内免疫逃避、存活、增殖有着密切的作用。通常情况下,宿主细胞吞噬布鲁菌后,随即形成含有BCV的吞噬小体,与Lys融合后,通过水解酶的作用,就能将布鲁菌溶解。但是在T4SS的作用下,布鲁菌可以阻止Lys与吞噬小体的结合,从而逃脱降解过程。布鲁菌凭借T4SS系统的帮助在胞内转移,最终到达ER,在T4SS编码的VirB操纵子表达诱导下产生酸性的BCV,BCV的酸性环境利于布鲁菌的生存[23]。
T4SS不仅阻碍了BCV与Lys的融合,同时促进细菌转运到了ER并衍生出适合布鲁菌复制的位点,复制过程中需要ER跨膜蛋白Irela的参与[31]。Irela是一个应激ER的未折叠蛋白反应的传感器,它也有助于诱导自噬。
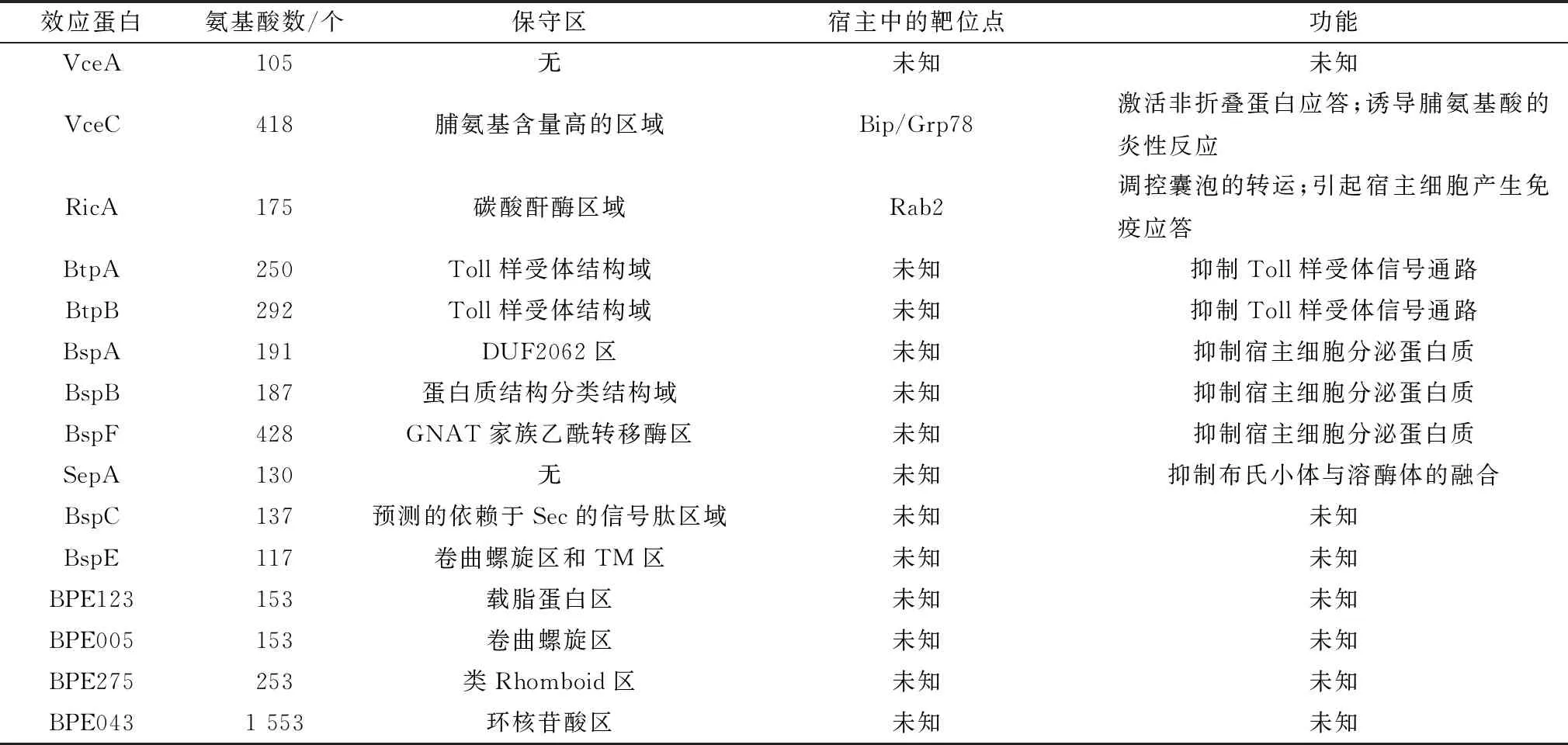
表1 布鲁菌T4SS效应分子功能
2.3 UPR介导细胞自噬有研究通过非折叠蛋白反应(UPR)的激活,提供了自噬和布鲁菌感染之间的潜在联系[13,28,31-32]。UPR是一种ER应激反应,通过严格控制促进ER功能基因的转录,来恢复ER应激时的稳态,包括脂质合成、ER相关降解(ERAD)和蛋白质的合成[33]。UPR途径由3个感受ER应激的ER相关受体控制,即IRE-1α、PERK和ATF6[34]。在一些报道中均表明了UPR过程中自噬的激活是由IRE1-TRAF2-JNK途径介导的[13,28,35]。自噬在ER应激时也被激活,以恢复内环境平衡和促进细胞存活[35]。
UPR是布鲁菌复制所必需的,但目前还不清楚布鲁菌感染是否会引发完全的UPR反应。有研究表明B.abortus和猪布鲁菌(Brucellasuis,B.suis)只激活IRE1α,后者与宿主细胞对T4SS分泌的感知有关[32],而B.melitensis通过分泌效应子TcpB触发UPR的所有3个途径(IRE1α、PERK和ATF6依赖性通路)来诱导ER应激[28]。包括BspC、BspG、BspH和BspK在内的许多附加效应器在上皮细胞中的表达也会触发ER应激,这表明布鲁菌诱导UPR的机制是复杂的,涉及到很多宿主蛋白[27]。并不是所有的UPR调节蛋白都对细菌的复制很重要,但所有研究都支持IRE1α可以被布鲁菌感染激活[28,32,36]。
2.4 IRE1α介导细胞自噬有试验表明布鲁菌感染4 h后在细胞内检测到IRE1α被激活,表明IRE1α在布鲁菌胞内循环的早期发挥作用,其激活需要自噬蛋白ATG9和WIPI。宿主蛋白Yip1A在IRE1α的激活下产生,并与IRE1α结合后磷酸化,触发XBP-1依赖性转录[13]。IRE1α对Yip1A的激活与GTPase-Sar1和COPⅡ-coat复合物亚单位的上调有关,后者是ERES和早期分泌转运的重要组成部分,是产生rBCV所必需的[8]。COPⅡ成分和GTPase Sar1的上调可能会增强ERES的功能并促进ER囊泡出芽,以促进ER膜的获得。IRE1α活化可以诱导膜磷脂的合成,从而增加粗糙ER的表面积和体积,而ER膜可被病原体利用以扩大其复制生态位的大小和提高其质量[37-38]。IRE1α可以独立于其他ER相关信号分子来参与调节自噬。
还有研究结果表明,IRE1-ULK1信号轴被细菌颠覆后会促进其在细胞内的寄生。沿该轴的关键信号成分,包括IRE1α、BAK/BAX、ASK1和JNK,以及宿主自噬系统ULK1、ATG9a和Beclin1的缺失或失活会显著干扰布鲁菌的细胞内运输和复制。IRE1α-ULK1轴上的宿主激酶,包括IRE1α、ASK1、JNK1和/或AMPKα以及ULK1,在病原体感染时也以依赖于IRE1α的方式协同磷酸化[39]。
2.5 Yip1A介导细胞自噬Yip1A被认为在膜转运中具有多种功能,包括参与ERES处COPⅠ囊泡出芽[40]、囊泡与高尔基膜的连接[41]和不依赖于COPⅠ的逆行囊泡转运[42]。通过TAGUCHI等[12]的研究可以知道,在布鲁菌感染的细胞中,ER衍生液泡在复制的细菌附近形成,Yip1A是一种IRE1活化和ER衍生空泡形成所必需的宿主因子,同时,功能性ERES和COPⅡ囊泡也均参与了布鲁菌的细胞内复制。
在感染过程中,布鲁菌可能通过分泌系统向宿主细胞的细胞质分泌效应分子来参与触发IRE1的激活。IRE1分子借助Yip1A在ERES上形成高阶配合物,再通过自磷酸化激活,然后触发ER衍生的自噬空泡的形成。同时,COPⅡ组分Sar1、Sec23和Sec24的上调也促进了液泡的形成。这些液泡会与溶酶体小泡融合。布鲁菌可以阻断UPR诱导的液泡形成过程,并获得ER衍生膜。
2.6 GTPase Rab 2介导细胞自噬GAPDH和小GTPase Rab 2是布鲁菌复制的关键酶,定位于囊泡管状簇(vesicle tubules cluster,VTC)上。GAPDH在宿主细胞内具有多种功能,如参与糖酵解和凋亡[43-44]。小GTPase Rab 2在BCV发生的早期阻止BCV与ER的融合。而Rab 2在布鲁菌建立了2次复制生态位后,对其生存也是必要的。当GAPDH和Rab 2的表达被抑制时,布鲁菌的复制也会被强烈地抑制。此外,以GDP锁定的形式来阻断小GTPase Rab 2也抑制了布鲁菌的复制。这些结果表明了GAPDH和小GTPase Rab 2在宿主细胞内布鲁菌毒力中的重要作用。GAPDH与小GTPase Rab 2的相互作用还控制了ER和高尔基体之间的囊泡逆行运输[45]。
最初的研究表明,Rab 2的非活性形式对囊泡从ER到高尔基体的顺行运输有负面影响[46]。最近,Tisdale小组已经证明Rab 2通过向VTCs招募GAPDH来调节蛋白质从高尔基向ER的逆行转运,从而允许逆行性囊泡的释放[47-48]。这种逆行运输需要一个功能性的GAPDH/COPⅠ/Rab 2/PKCi/l复合物。
2.7 miRNA介导细胞自噬Fas-l、Bcl-2、IL-1、IL-3R、Cn和AMPK都参与自噬途径[49-51],这些基因都受miRNAs调控。病原菌可以诱导miRNA在细胞中的差异表达,反过来miRNA也可以调节宿主对病原菌的反应。由于NF-κB信号通路调控基因转录,LPS可以诱导miRNA的表达,比如miR-146b-5p。miR-146b-5p靶向于Tbc1d14,Tbc1d14与自噬激酶ULK1共定位并相互作用。Tbc1d14的过度表达上调了介导RAW264.7细胞自噬激活的miR-146b-5p,同时还诱导了4个自噬相关基因Iigp1、Irgm1、Trp53inp1和Nrbp2的差异表达[52]。除此以外。在布鲁菌感染后,miR-1981在RAW264.7细胞中的表达也会上调。但总的来说miRNAs在布鲁菌感染过程中介导自噬的具体作用在很大程度上仍是未知的。
2.8 p38 MAPK通路介导细胞自噬p38 MAPK通路和自噬机制的交叉是布鲁菌细胞内生命周期的关键组成部分。吞噬小体成熟和细胞内复制都需要p38 MAPK刺激,反过来,p38 MAPK又受细胞内感染的诱导和调控。在BCV沿着内吞途径成熟后,毒力因子转位到宿主细胞,刺激p38磷酸化和自噬。在沙林鼠种布鲁菌(Brucellaneotomae,B.neotomae)通过内小体运输的过程中,B.neotomae可能会诱导依赖于VirB4的BCV转化,这就与p38磷酸化和自噬小体形成相关。MAP激酶的诱导和自噬溶酶体的成熟与rBCV的形成有关,也是在巨噬细胞中形成高效的细胞内复制生态位所必需的。
B.neotomae在整个感染过程中都刺激了p38的磷酸化,并且依赖于p38的激活来实现细胞内的生长。此外,B.neotomae对p38磷酸化的诱导依赖于完整的T4SS,这表明T4SS、p38和细菌胞内生长之间存在联系。而一些B.abortus、B.melitensis、B.suis也可刺激小鼠巨噬细胞中的p38磷酸化,但并没有研究它们对于T4SS的依赖性[53]。
2.9 ROS通路介导细胞自噬布鲁菌可以通过ROS途径改变自噬相关基因表达,提高自噬活性。AIR结构域也可以通过ROS信号途径参与布鲁菌促进的NLRP3的炎症反应和活化[54]。由此可见,ROS与细胞自噬存在着密切的联系。那么布鲁菌是否也会通过ROS这一通路介导吞噬细胞的自噬?有研究人员探索了B.melitensis16M侵染过程中AIR结构域和ROS对小鼠巨噬细胞自噬及炎症的影响,指出AIR结构域能够通过ROS通路影响16M侵染,同时也提出干扰AIR结构域能够促进吞噬小体的成熟,促进自噬的发生;16M侵染细胞引起的自噬对炎症小体的激活有反向调节作用,达到抑制炎症反应的作用[55]。布鲁菌诱导细胞自噬分泌IL-1β与NLRP3炎性小体的活化有关,而ROS在此过程中也发挥重要的作用。
2.10 PI3K/Akt信号通路介导细胞自噬PI3K/Akt信号通路是重要的细胞信号通路之一,与很多疾病有关。其中,PI3K在细胞中对S型和R型的布鲁菌感染有不同的调节作用,而Akt在促进细胞生存、生长、增殖、转移等方面都起到关键作用,PI3K/Akt信号通路与肿瘤的发生发展有着密切的关系[56],也与一些病毒的生存繁殖密切相关。有试验指出,布鲁菌感染能激活PI3K/Akt信号通路,当该通路被抑制剂和RNA阻断时,可有效降低布鲁菌的存活率,诱导B.melitensis16M介导的细胞凋亡和抑制B.melitensis16M介导的细胞自噬[57]。
