北极高纬度苔原CO2净通量的空间变异规律及影响因素
2021-03-05陈清清包韬朱仁斌徐华
陈清清包韬朱仁斌 徐华
研究论文
北极高纬度苔原CO2净通量的空间变异规律及影响因素
陈清清1,2包韬3朱仁斌2徐华4
(1宜春学院生命科学与资源环境学院, 江西 宜春 336000;2中国科学技术大学地球和空间科学学院极地环境与全球变化安徽省重点实验室, 安徽 合肥 230026;3中国科学院东亚区域气候-环境重点实验室, 中国科学院大气物理研究所, 北京 100029;4中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室, 江苏 南京 210091)
北极夏季无冰区苔原CO2的释放对全球碳循环起着重要的作用。在第4次北极科学考察(2008年7月26日—8月5日)期间, 采用密闭箱法在北极新奥尔松(Ny-Ålesund)黄河站区附近的鸟类保护区苔原(Tundra in Seabird Sanctuary, TSB)、普通海滩苔原(Tundra in Non-seabird Colony, TNS)和两者间的过渡苔原(Tundra in Transition Zone, TTR)监测CO2净通量(Net CO2Fluxes, NEE)空间变异规律及其影响因素。结果表明: 鸟类保护区苔原TSB的平均 NEE为(–39.0±6.0)mg·m–2·h–1, 为CO2吸收汇, 且对CO2的吸收随着植被覆盖度和海鸟活动强度的增强而显著增强; 普通海滩苔原TNS和过渡苔原TTR的平均NEE分别为 (12.0± 6.3)mg·m–2·h–1和(40.5±29.3)mg·m–2·h–1, 均为CO2净排放源。普通海滩苔原TNS的CO2排放强度随土壤水分的减少和地势增高而增强; 过渡苔原TTR中高地苔原区的平均NEE为(106.4±23.1)mg·m–2·h–1, 为CO2强排放源; 而泥炭苔原区的平均NEE为(–58.3±9.5)mg·m–2·h–1, 为CO2强吸收汇。苔原土壤的理化性质对苔原NEE有重要影响, 鸟类保护区苔原TSB和普通海滩苔原TNS的NEE与土壤含水率呈显著负相关关系(= –0.44,=0.003)。鸟类保护区苔原TSB的NEE与土壤温度弱正相关(=0.32,=0.06), 与NH4+-N(<0.05)和NO3–-N(<0.05)含量均显著负相关。在全球变暖的驱使下, 不同地形地貌和海鸟活动特征的北极苔原区域CO2排放的复杂性将显著增强, 对全球碳循环产生较大的影响, 本研究也将为此提供科研资料。
CO2净通量北极新奥尔松高纬度苔原
0 引言
北极和亚北极生态系统的有机碳主要储存在上层冻土中, 且储量巨大, 约占全球土壤有机碳的50%[1-3]。气候变暖导致冻土融化, 表层土壤微生物活动增强, 北极和亚北极苔原生态系统具有强大的CO2排放潜力[4], 但从已有研究来看, 北极和亚北极是CO2的排放源还是吸收汇尚不明确。亚北极的俄罗斯湿润苔原区域的CO2净通量(NEE)波动范围为–79~–41g·m–2·a–1, 为CO2吸收汇[5]。北极泥炭地和沼泽的年平均CO2净通量(NEE)波动范围为–170~–458 mg·m–2·h–1, 平均值为–218 kg·ha–1·a–1, 为CO2强吸收汇[6]。而干旱苔原区域的NEE监测结果为275 kg·ha–1·a–1, 为CO2净排放源[7]。除南极外, 北极高纬度苔原是海鸟主要栖息地, 格陵兰和斯瓦尔巴群岛聚居大量的海鸟[8-9]。海鸟活动是极地苔原外源碳(C)、氮(N)、磷(P)、硫(S)等营养物质输入的主要途径, 并能够在长时间尺度下改变影响苔原土壤和植被的发育[10], 促进海鸟聚居区及附属区域生态系统的发育[11-12], 最终影响温室气体的排放。海洋动物聚居区的温室气体通量比普通苔原区的显著增高, 尤其是南极企鹅聚居区和海豹聚居区[13-16], 对北极高纬度苔原区域的CO2排放及其影响的研究较少。Wüthrich等[17]和Lloyd[18]研究发现艾登布克塔(Eidembukta)和新奥尔松(Ny-Ålesund)苔原在1995年为CO2净吸收汇, 而在1996年转变为净排放源。
苔原CO2的排放取决于光合作用和呼吸作用强度的差异, 是由苔原植被变化特征和土壤理化性质等决定的[19-20], 受到土壤温度、土壤水分、植被群落和动物干扰的影响[19-21]。海洋动物活动强度的区域差异性也会造成极地苔原系统土壤和植被的发育的差异; 对于大部分不受海洋动物粪便影响的区域, 地形地貌造成的土壤和植被发育也是CO2排放的重要因素。全球变暖的趋势下, 海鸟活动增强、夏季无冰区的扩张和生长季延长都能增加苔原汇的强度[22-24], 而鸟粪营养增加, 土壤呼吸作用增强等则会增加苔原CO2的排放[25-26], 因此, 影响北极高纬度苔原生态系统CO2排放的因素更多也更复杂, 但尚未开展系统科学的研究。
本文在第4次北极科学考察(2008年7月26日—8月5日)期间, 选取了北极高纬度的斯瓦尔巴德群岛新奥尔松(Ny-Ålesund)的鸟类保护区苔原(TSB)、普通海滩苔原(TNS)和两者之间的过渡苔原(TTR)为研究区域, 观测北极高纬度苔原不同空间尺度CO2净通量(NEE)变化规律并分析其影响因素。本文的研究目标是: (1)鸟类保护区苔原TSB、普通海滩苔原TNS和过渡苔原TTR的CO2净通量(NEE)的空间变化规律; (2)苔原土壤理化性质的差异; (3)苔原土壤CO2净通量(NEE)的影响因素。
1 研究区域与研究方法
1.1 研究区域概况
本文的研究区域为北极挪威群岛西部的斯瓦尔巴德半岛的新奥尔松(Ny-Ålesund)的苔原区域, (图1a)。北大西洋的高尔夫暖流流向斯瓦尔巴德群岛西部, 其支流西斯匹次卑尔根环流流向北极最北部的开阔海域[24,27], 与气旋共同作用下, 斯瓦尔巴德半岛西部呈海洋性气候, 夏天较凉爽, 冬天较温和, 年平均气温–5.8 ℃, 比同纬度的格陵兰高6~7 ℃[28]。全年以东南风为主导风向, 1~2 m·s–1风速的出现频率最高[29]。年平均降水量约400 mm, 且往内陆逐渐减少, 新奥尔松降水量为每年200~300 mm。植物种类较少, 以北部极地苔原植物区系和极地沙漠植物区系为主, 包括、、、和等[30]。野生动物主要包括北极狐、北极驯鹿、北极鹅及30余种海鸟[31-32]。新奥尔松典型的无冰期是从6月持续到9月[33]。6月初冻土开始融化, 9月初最大融化深度为1.6~2.0 m, 活跃层厚度也达到最大, 并持续到9月中旬[34]。夏季有80%的时间为多云天气, 导致太阳辐照强度较低(http://www.yr.no/place/ Norway/Svalbard/)。新奥尔松区域整体为淤泥黏性土壤和沙质发育土壤覆盖, 有机质含量较低。采样期间平均温度为(2.1±0.9) ℃, 平均降水量大约是400 mm。
本文在第4次北极科学考察期间, 在3个苔原区域监测CO2净通量(NEE)的空间变异规律(图1b)。
区域Ⅰ为鸟类保护区苔原(TSB), 位于新奥尔松(Ny-Ålesund)的西北部。海鸟活动的重点区域面积为0.5 km2, 海拔为5~20 m。鸟类保护区苔原的海鸟种类较多, 主要品种有: razor-billed auk ()Arctic duck ()kittiwake()Arctic Tern()fulmar()和 albatross()。苔原植被覆盖区域面积>98%, 裸露的土壤和石头区域面积约占2 %。主要植被类型是苔藓(和)、地衣()和莎草(和)。土壤有机层厚度约为15~20 cm。
区域Ⅱ为普通海滩苔原(TNS), 位于新奥尔松(Ny-Ålesund)的东南。此苔原基本没有海鸟活动, 但有北极兔和驯鹿活动踪迹。普通海滩苔原的 48%为苔藓或者地衣覆盖, 20 %生长着维管植物, 28 %是裸露的土壤, 4 %是石头。土壤有机层厚约为10~20 cm。
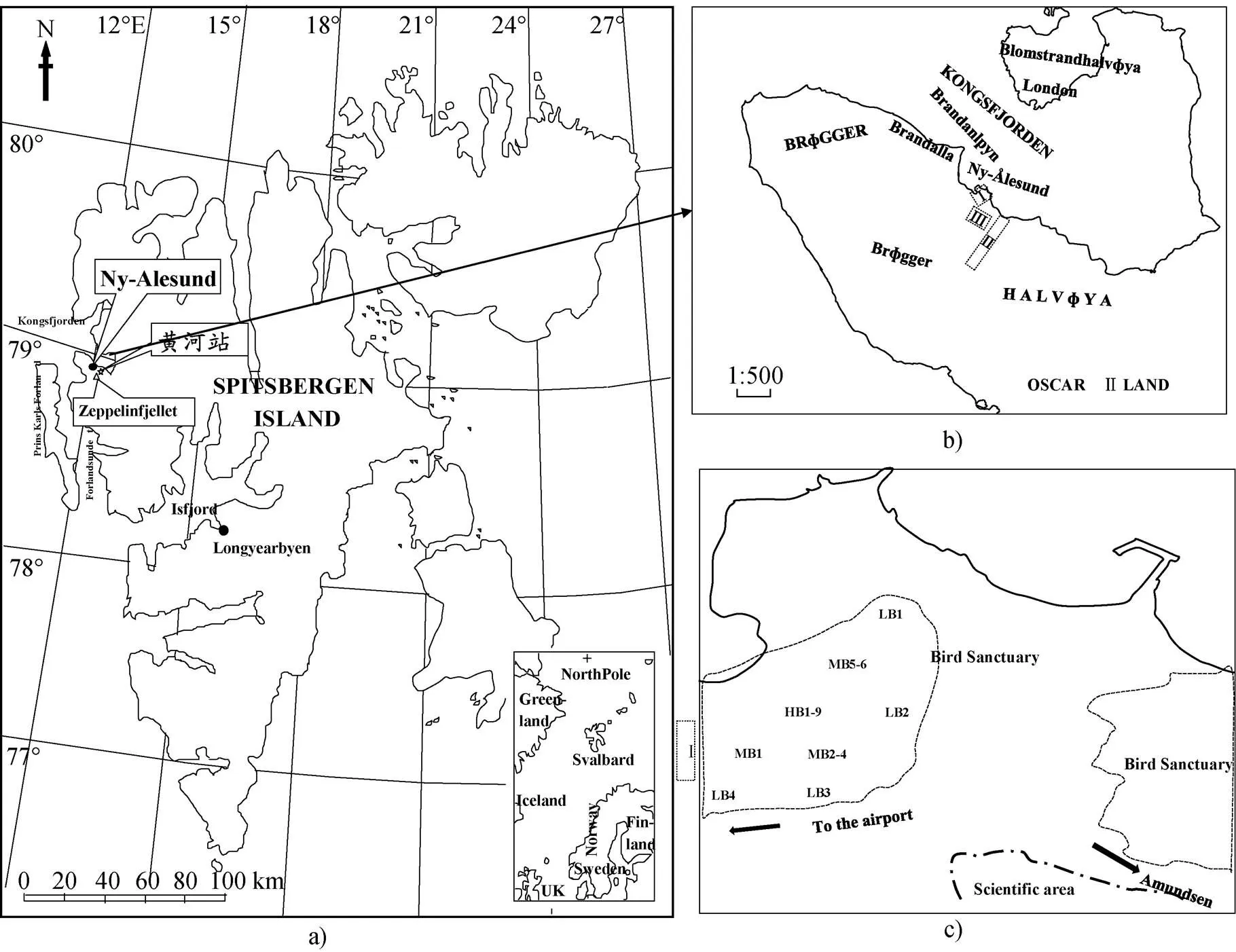
图1 北极斯瓦尔巴(Svalbard)群岛、新奥尔松(Ny-Ålesund)地区的地理位置、研究区域分布图和鸟类保护区采样点分布图.a)北极斯瓦尔巴(Svalbard)群岛和新奥尔松(Ny-Ålesund)地区的地理位置; b)研究区域分布图(Ⅰ为鸟类保护区苔原TSB, Ⅱ为站区附近的普通海滩苔原TNS, Ⅲ为过渡苔原TTR); c)鸟类保护区采样点分布图
Fig.1.The location of Ny-Ålesund, Svalbard in Arctic and the distribution map for the study during the net CO2fluxes observation period.a) the location of Ny-Ålesund, Svalbard; b) the study area (Ⅰ-TSB, Ⅱ-TNS, Ⅲ-TTR); c) observation sites in the bird sanctuary
区域Ⅲ为过渡苔原区域(TTR), 位于黄河站区鸟类保护区苔原(TSB)和普通海滩苔原(TNS)之间的过渡区域, 离黄河站很近, 土壤情况较复杂, 地表植被稀疏。
1.2 野外CO2净通量(NEE)的观测点实验设计
1.2.1 鸟类保护区苔原(TSB)
在鸟类保护区苔原(TSB)采用静态箱法监测CO2净通量(NEE)的空间规律。根据植被覆盖度、水文条件以及海鸟活动等的差异将鸟类保护区苔原TSB分成3类观测区: 植被覆盖度最高、强烈的海鸟活动区HB(High Seabird-activity Area)观测点HB1~HB9, 植被覆盖度较高、中等强度的海鸟活动区MB (Medium Seabird-activity Area)观测点MB1~MB6, 以及植被覆盖度低、海鸟活动边缘区LB (Low Seabird-activity Area)测点LB1~LB4。共随机设置19组采样点, 探讨苔原TSB的CO2净通量(NEE)的空间变化。这19组采样点覆盖了苔原TSB的典型海鸟活动和植被变化区, 且每组内设置两个采样点互为对照。
为使鸟类保护区苔原的CO2净通量(NEE)具有可对比性, 综合考虑植被情况、水文条件和海鸟活动情况等, 本研究也选取了普通海滩苔原(TNS)和过渡苔原(TTR)为研究区域并进行NEE空间变化规律观测。
1.2.2 非海鸟聚居地的普通海滩苔原(TNS)
依据地形地貌特征, 在普通海滩苔原(TNS)区域从地势低的湿润苔原区到地势高的干旱苔原区随机设置5大类43组观测点, 采用静态箱法, 观测苔原TNS的CO2净通量(NEE)的空间变化规律。5大类观测点的设置为: 地势低的湿地苔原观测区Wet Sites(SW)的8组观测点(SW1~SW8)、地势略高的半干旱苔原观测区Mesic Sites(SM)的8组观测点(SM1~SM8)、地势更高的干旱斜坡苔原观测区Dry Slope Sites(SD)的8组观测点(SD1~ SD8)、地势高的高地苔原观测区Upland Sites(UD)的9组观测点(UD1~UD9)和地势最高的顶部苔原观测区Higher Upland Sites(UL)的10组观测点(UL1~UL10), 囊括了普通海滩苔原TNS的代表性区域, 每组观测点设置两个重复。
1.2.3 过渡苔原(TTR)
过渡苔原(TTR)在黄河站附近, 充分考虑了苔原地势等表观特征, 设置高地苔原HT观测区3组采样点(HT1~HT3)和泥炭地苔原NM观测区2组采样点(NM1和NM2), 采用静态箱法, 观测苔原TTR的CO2净通量(NEE)的空间变化规律。
1.3 CO2净通量(NEE)的测定
本文采用静态箱法监测北极高纬度苔原生态系统的CO2净通量(NEE)[35]。CO2采样系统即静态箱系统由一个一端开口的丙烯酸树脂的透明箱体和一个底座构成。本次采样共用两组规格的采样箱, 一组箱体外径的长×宽×高是50cm×50cm× 50 cm, 另一组箱体外径的长×宽×高为50cm× 50cm×30 cm。为取样后不改变箱内气压, 不影响气体扩散, 箱子露出土壤的高度至少为25 cm[36]。将PVC底座插入土壤约5 cm, 放置透明箱子后, 向底座注水密封, 密封面积0.25 m2。采集CO2气体, 将两通针的一端插入透明箱上方, 另一端连接带橡胶塞的真空瓶, 每隔15 min采一次气体样品, 共三次。测定顺序不会影响采样结果, 同步记录箱内温度和采样时的气象条件。真空瓶体积为17.5 mL, 采样前抽成高真空。在第4次北极科学考察期间, 采用静态箱法, 两组不同尺寸采样箱进行流动采样[37], 观测鸟类保护区苔原(TSB)、普通海滩苔原(TNS)和过渡苔原(TTR)的CO2净通量(NEE)的空间变化规律。
1.4 CO2浓度测定和净通量计算
气体样品CO2浓度在中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室用气相色谱分析仪(Shimadzu GC-14B)检测。检测条件: 检测器为热导检测器(TCD), 色谱柱为80/100目Chromosorb 102填充柱, 进样器、检测器和填充柱的温度分别为100 ℃、60 ℃和60 ℃, 高纯H2作载气, 载气流速为80 mL·min–1[38]。标准气体的浓度为641 ppm, 由南京特种气体厂生产, 并经日本国立农业食品产业技术综合研究机构农业环境技术研究所(原国立农业环境技术研究所)校正, 平均值为(640.9±1.43) ppm (=15)。
CO2净通量(NEE)的计算公式为=ρ×× (d/ d)×273/(273+)。式中:为CO2净通量(NEE), 单位时间单位面积交换CO2的质量, 单位为mg·m–2·h–1; ρ为标准状态下CO2的密度1.964 kg·m–3;为箱子有效高度(高出地表的高度), 单位为m; d/d为浓度随时间的变化率, 单位为ppm·h–1; t为箱内气温, 单位为℃。文中CO2净通量(NEE)的正值表示排放CO2即为CO2的排放源, 负值表示苔原吸收CO2即为CO2的吸收汇。
1.5 气象资料、土壤采样及其理化性质检测
采样气体样品时, 同时记录新奥尔松地区的气象数据。在CO2净通量观测点插入温度计到地表以及地表以下5、10和15 cm, 检测0 cm、–5 cm、–10 cm和–15 cm的土壤温度。在对应气体样品点旁边采集表层0~20 cm处的土壤作为土壤样品, 冷冻保存至实验室进行检测。土壤含水率(Wc)是将新鲜土壤样品在105 ℃条件下烘至恒重, 根据公式Wc=(水分重量/干土重) ×100%计算。pH测定方法: 用天平称取4 g室温下风干的土壤样品, 放入小烧杯中, 按照质量体积比 1∶2.5, 量取10 mL超纯水倒入小烧杯, 加磁力振子在磁力搅拌器上高速旋转2 min后, 静置至上层液澄清, 测量上清液pH。总有机碳(TOC)用重铬酸钾体积法测定, 测量方法的分析误差为2.5%。土壤NH4+-N 和 NO3–-N含量分别用靛酚蓝比色法和格里斯分光光度法测定[39]。土壤总磷(TP)含量采用钼酸铵分光光度法检测。土壤C、N、S、H含量是将土壤在室温下晾干, 然后用德国Vario·EL元素分析仪(Elementar Vario EL, Hanau, Germany)测定, 相对误差小于1 %[30]。
1.6 统计分析
实验室内主要是利用微软Excel 2016、 SPSS以及OriginPro7.5计算、分析数据, 绘制图和表。微软Excel 2016计算CO2净通量(NEE), 使用标准误差()来衡量NEE的不确定性。使用OriginPro7.5绘制NEE空间变化图。用OriginPro7.5和SPSS分析不同观测点和不同苔原NEE的显著性差异, 并分析NEE与土壤化学性质(土壤温度、土壤含水率、土壤碳氮比(C/N), 及土壤中的TC、TN、NH4+-N、NO3–-N和TP含量)的相关性及绘图。
2 结果与讨论
2.1 苔原土壤理化性质
苔原TSB和苔原TNS的土壤理化性质如表1所示。植被覆盖度高、海鸟活动强烈区HB的平均TC和TN含量(9.1 %和1.1 %)最高。P和S是海鸟粪便的典型的基本元素[40], 海鸟会增加苔原土壤C、N、P和S等营养物质的输入, 会显著地增加苔原土壤TN、NH4+-N和NO3–-N含量[14,41]。因此, 在鸟类保护区苔原(TSB)和普通海滩苔原(TNS)的所有观测区中, 植被覆盖度高、海鸟活动强烈的观测区HB土壤的TP和TS含量极高, 比植被覆盖和海鸟活动中等强度观测区MB及植被覆盖度低和海鸟活动边缘区观测区LB以及苔原TNS土壤高一个数量级; NH4+-N和NO3–-N的平均含量比观测区MB、LB和苔原TNS土壤高1到2个数量级; 而C/N值则低于这些区域。观测区HB和MB土壤的pH值略微高于观测区LB。苔原TSB的pH值与苔原TNS的相近, 苔原TNS土壤的pH从地势低的湿润苔原到地势高的高地干旱苔原呈减小趋势。由于海鸟粪便增加了苔原土壤有机物的输入以及海鸟踩踏等海鸟活动的干扰, 所以苔原TSB土壤的TN、NH4+-N、NO3–-N、TC、TP、TS和土壤含水率(Wc)高于苔原TNS土壤, 其中NH4+-N含量约为苔原TNS土壤的3倍, NO3–-N含量比苔原TNS土壤高约2个数量级, TS含量比苔原TNS土壤高约1个数量级。
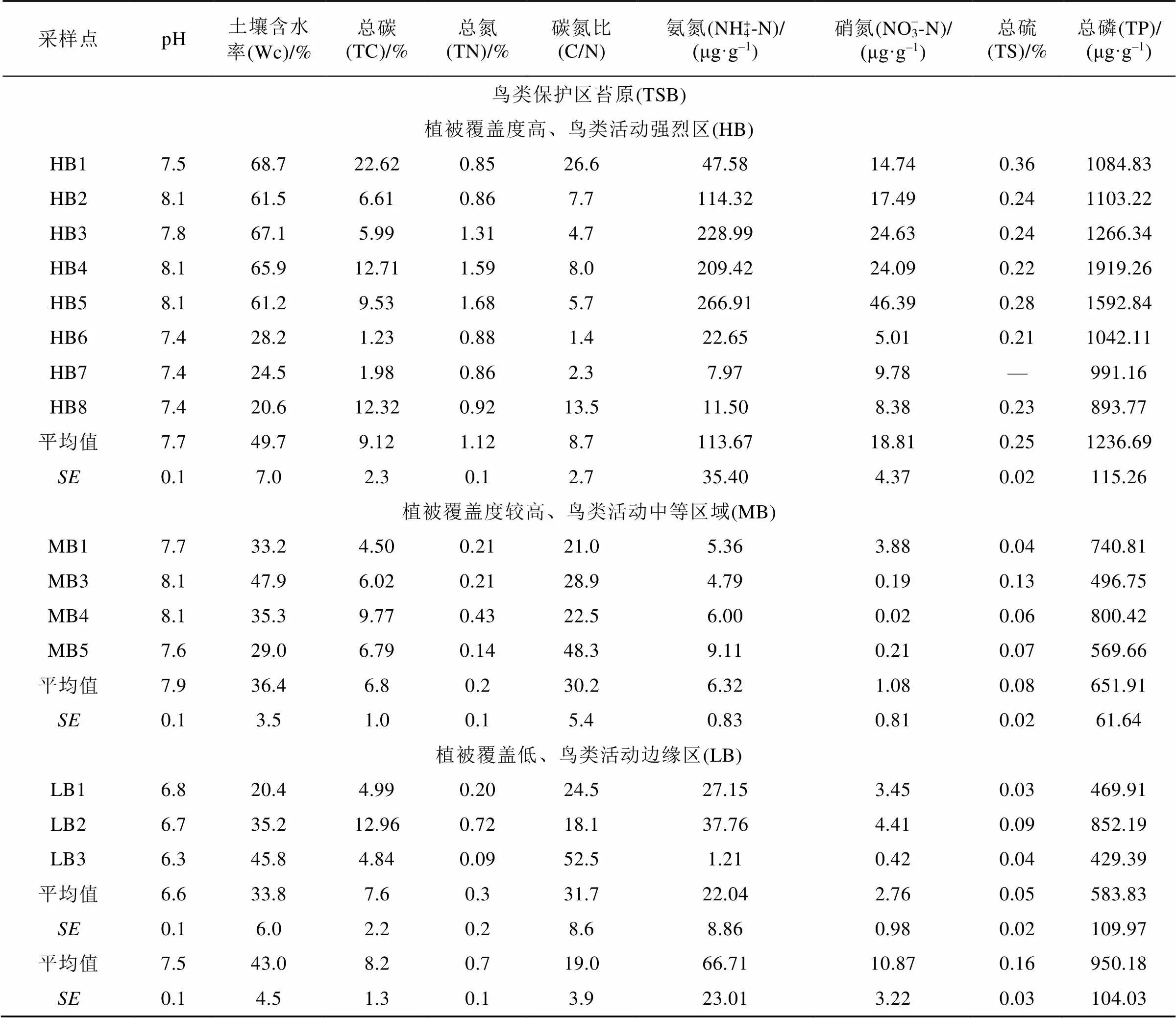
表1 新奥尔松苔原土壤的理化性质
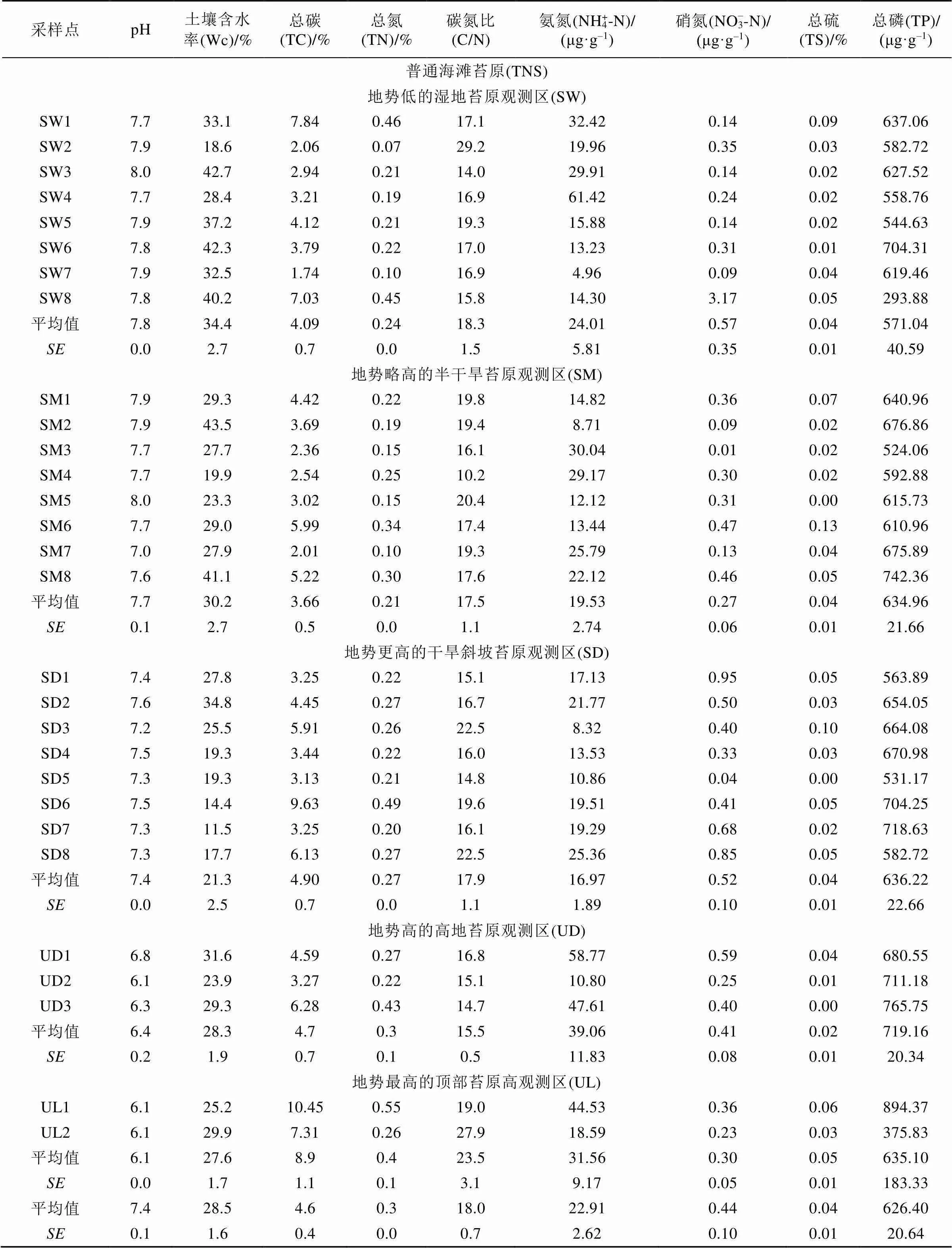
续表
2.2 鸟类保护区苔原(TSB)CO2净通量(NEE)的空间变化
鸟类保护区苔原(TSB)的CO2净通量(NEE)的空间结果如表2和图2a所示。在植被覆盖度最高、海鸟活动最强烈观测区HB(HB1~HB9), 采样点的所有NEE数据中约有35 %均小于零, 变化范围为–188.0~84.5 mg·m–2·h–1, 平均值为(–76.4±10.6)mg·m–2·h–1, 强烈吸收CO2。在植被覆盖度较高、海鸟活动强度中等的观测区MB(MB1~ MB6), 超过65 %的NEE数据为负值, 变化范围为–145.3~86.9 mg·m–2·h–1, 均值为(–29.9±8.3) mg·m–2·h–1, 为CO2吸收汇, 但吸收强度显著(≤0.05)低于观测区HB。在植被覆盖度低、海鸟活动边缘观测区LB(LB1~LB4), 超过80 %的NEE数据为负值, 变化范围–98.7~175.9 mg·m–2·h–1, 平均NEE为(–1.7±7.4)mg·m–2·h–1, 弱吸收CO2, 吸收强度显著(≤0.05)低于观测区HB和MB。
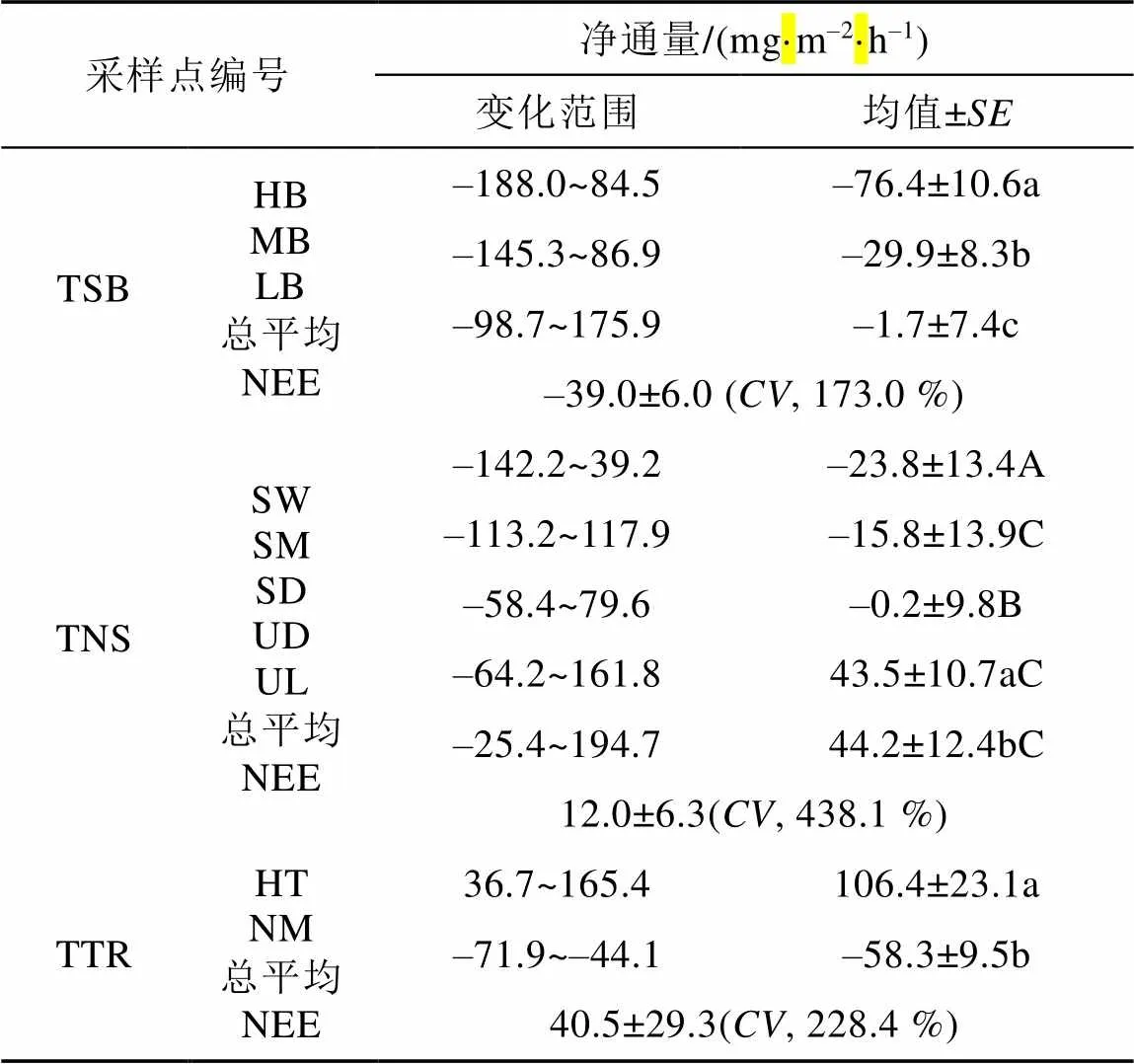
表2 鸟类保护区苔原(TSB)、普通海滩苔原(TNS)和过渡苔原(TTR)CO2净通量(NEE)在夏季(2008年7月26—8月5日)的空间变化
注: 不同字母a, b, c表示具有显著性差异(≤0.05); 不同字母A, B,C表示在≤0.1水平上存在差异。
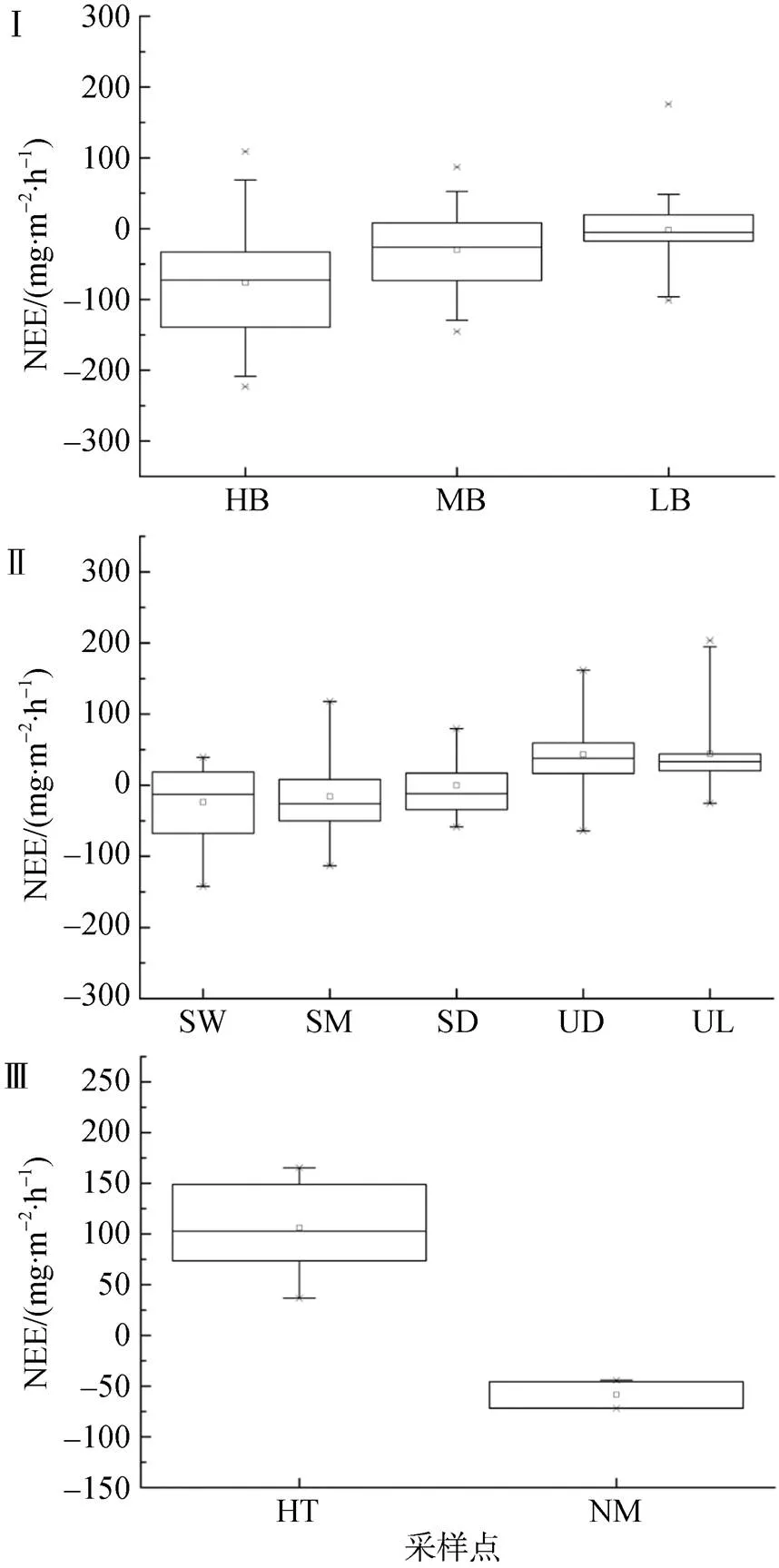
图2 新奥尔松地区研究区域CO2净通量(NEE)的空间变化.Ⅰ为鸟类保护区苔原(TSB), Ⅱ为站区附近的普通海滩苔原(TNS), Ⅲ为过渡苔原(TTR)
Fig.2.Spatial variation of net CO2fluxes (NEE) in the study area of Ny-Ålesund.Ⅰ-TSB, Ⅱ-TNS, Ⅲ-TTR
就苔原TSB整体而言, NEE的波动范围为–188.0~175.9 mg·m–2·h–1, 均值为(–39.0±6.0) mg·m–2·h–1, 为CO2强吸收汇。海鸟活动也增加了苔原TSB的外源营养物质(C、N、P等)的输入, 土壤营养丰富, 促进了苔藓的发育, 植被覆盖度大, CO2吸收强烈。同时由于土壤营养物质和海鸟活动的差异, 苔原TSB的植被分布也呈现明显的差异, 导致NEE的空间变异显著(为173.0%)[35]。
2.3 普通海滩苔原(TNS)CO2净通量(NEE)的空间变化
本研究设置了观测点地势低的湿地苔原观测区SW对应点位SW1~SW8、地势略高的半干旱苔原观测区SM对应点位SM1~SM8地势更高的干旱斜坡苔原观测区SD对应点位SD1~SD8、地势高的高地苔原观测区UD对应点位UD1~UD9和地势最高的顶部苔原观测区UL对应点位UL1~UL10, 观测苔原TNS的CO2净通量(NEE)空间变化情况, 结果如表2和图2b所示。地势低的湿地苔原观测区SW的所有NEE数据中约有60 %小于零, 整体波动范围为–142.2~39.2 mg·m–2·h–1, 均值为(–23.8±13.4) mg·m–2·h–1, 为CO2吸收汇。地势略高的半干旱苔原观测区SM的所有NEE数据中小于零的超过75 %, 变化范围在–113.2~ 117.9 mg·m–2·h–1, 平均值为(–15.8±13.9) mg·m–2·h–1,为CO2吸收汇, 但其吸收强度在0.1水平上弱于观测区SW。地势更高的干旱斜坡苔原观测区SD的所有NEE数据中约有70 %小于零, 整体波动范围为–58.4~79.6 mg·m–2·h–1, 平均NEE为(–0.2±9.8) mg·m–2·h–1, 为CO2弱吸收汇, 吸收强度在0.1水平上弱于观测区SW。地势高的高地苔原观测区UD的所有NEE数据中约有25 %小于零, 整体变化范围为–64.2~161.8 mg·m–2·h–1, 平均NEE为(43.5±10.7) mg·m–2·h–1, 为CO2强排放源, 在0.1水平上与观测区SW和SD具有差异性。地势最高的顶部苔原观测区UL所有NEE数据中小于零的少于25%, 变化范围在–25.4~194.7 mgCO2·m–2·h–1之间, 平均NEE为44.2±12.4 mg·m–2·h–1, 为CO2强排放源, 在0.1水平上与观测区SW和SD具有差异性, 在0.05水平上与观测区UD具有显著差异性。
综合来说, 苔原TNS的NEE为(12.0± 5.7) mg·m–2·h–1, 整体表现为CO2排放源;为438.1 %, 苔原TNS的CO2排放具有很大的空间变异性。苔原TNS的NEEs的空间监测结果表明, 地势低的湿地苔原观测区SW和地势略高半干旱苔原观测区SM均为CO2强吸收汇, 地势更高的干旱斜坡苔原观测区SD为CO2弱吸收汇, 地势高的高地苔原观测区UD和地势最高的顶部苔原观测区UL为CO2强排放源(图2b); 不同苔原观测区CO2的排放随土壤水量的增加而降低, 随地势的升高而升高。苔原TNS受海鸟活动影响极为微小, 以砂石和早期土壤发育特征为主, 地形和地貌的差别导致了植被分布的差异, 最终导致了不同苔原观测区NEE的空间差异[42]。
2.4 过渡苔原(TTR)CO2净通量(NEE)的空间变化
在过渡苔原(TTR)设置的高地苔原观测区HT(HT1~HT3)和泥炭地观测区NM(NM1~ NM2), 其CO2净通量(NEE)结果如表2和图2c所示。高地苔原观测区HT的所有NEE数据均高于30 mg·m–2·h–1, 变化范围为36.7~165.4 mg·m–2·h–1之间, 平均值为(106.4±23.1) mg·m–2·h–1, 是苔原TSB、苔原TNS和苔原TTR所有观测区中的最强CO2排放源。而泥炭地观测区NM的所有NEE数据均低于–40 mg·m–2·h–1, 波动范围为–71.9~ –44.1 mg·m–2·h–1, 平均NEE为(–58.3±9.5) mg·m–2·h–1, 是苔原TSB、苔原TNS和苔原TTR所有观测区中的强吸收汇。
苔原TTR的NEE为(40.5±29.3) mg·m–2·h–1, 为CO2强排放源;为228.4 %, 苔原TTR的CO2排放具有很大的空间变异性。苔原TTR受海鸟活动影响微弱, 地形、地貌特征和植被分布情况是影响苔原CO2排放的主要因素[42]。
2.5 新奥尔松(Ny–Ålesund)苔原CO2净通量(NEE)的分析与讨论
总体而言, 苔原TSB的整体NEE为(–19.1±9.6) mg·m–2·h–1, 为CO2吸收汇; 苔原TNS的平均NEE为(12.0±5.7) mg·m–2·h–1, 为CO2排放源; 苔原TTR中高地苔原的平均NEE为(106.4±23.1) mg·m–2·h–1, 为CO2强排放源, 而泥炭地的平均NEE为 (–58.3± 9.5) mg·m–2·h–1, 为CO2强吸收汇。苔原TSB、苔原TNS和苔原TTR这3类不同苔原NEE的空间差异原因为海鸟活动强度、植被覆盖程度和地势的差异[42-43]。苔原TSB的海鸟活动密集, 为此区域输入了C、N、P和S等营养物质, 促进了苔原植被的发育, 强烈吸收CO2[35, 43]。苔原TNS和苔原TTR的海鸟活动较少, 影响微弱。其中, 地势较低的苔原区域, 水量丰沛, 植被发育较好, 为CO2吸收汇; 地势较高的区域, 土壤含水率较低, 植被稀疏, 对CO2的排放大于吸收, 为CO2排放源[42]。
此后, 不同学者在新奥尔松(Ny-Ålesund)不同苔原区域也开展了温室气体的相关研究。2009年, 陈清清等[44]再次在新奥尔松苔原的鸟类保护区苔原(TSB)开展了CO2净通量的相关研究。发现海鸟活动强烈区的CO2净通量(NEE)为(–88.2±8.8) mg·m–2·h–1, 海鸟活动中等的苔原区NEE为(14.6±9.1) mg·m–2·h–1, 海鸟活动边缘区的NEE为(42.2±13.3) mg·m–2·h–1, 苔原TSB的整体平均值(–5.1±8.3) mg·m–2·h–1, 为CO2吸收汇, 与本文研究结果一致。同时, 陈清清等[44]也在与本研究的普通海滩苔原类似的苔原区域开展了CO2净通量(NEE)研究, 其平均NEE为(12.1±6.2) mg·m–2·h–1, 为CO2排放源, 与本文研究中结果极为相近。2014年和2015年, 李芳芳[45]也在普通海滩苔原TNS开展了监测CO2净通量(NEE)的变化规律相关研究, 2014年NEE的波动范围为–131.5~ 73.2 mg·m–2·h–1, 平均值为(7.92±7.3) mg·m–2·h–1,为CO2排放源; 2015年NEE 的波动范围为–90.9~ 30.4 mg·m–2·h–1, 平均值为(8.9±5.1) mg·m–2·h–1, 为CO2排放源。误差范围内与本文研究结果基本相同。
将本研究结果与其他极地区域苔原研究结果进行相比。鸟类保护区苔原TSB的观测区中, 植被覆盖度最高、强烈的海鸟活动区HB和植被覆盖度较高、中等强度的海鸟活动区MB的CO2净通量(NEE)处于低纬度北极的阿拉斯加和西伯利亚苔原区域已报告的数据范围–63.8~–38.5 mg·m–2·h–1内[22,46-47]。观测区HB的NEE与南极海洋动物聚集区苔原如企鹅和海豹聚居区(NEE为–37.2~ 5.2 mg·m–2·h–1)的结果相近, 且均为CO2强吸收汇[48]。鸟类保护区苔原TSB的整体NEE均处于格陵兰不同植被区域的平均NEE通量范围(–200~30 mg·m–2·h–1)[23, 49]。
2.6 土壤理化性质对新奥尔松(Ny-Ålesund)苔原CO2净通量(NEE)的影响
CO2净通量受气温、土壤温度、光照强度、降水、植被覆盖程度、植被类型等因素的综合影响[40, 50-52]。土壤基质含量决定了土壤CO2产生和同化的速率, 控制了CO2净通量[53-57]。海鸟粪便能增加苔原土壤C、N、P等营养物质输入, 增强植被的发育, 加强了苔原碳汇作用。同时, 海鸟活动增加了苔原植被N输入, 能够促进该区域对CO2的吸收, 增强其碳汇功能[56-57]。鸟类保护区苔原TSB的CO2净通量(NEE)与TN、TP、TC含量和C/N值有一定的相关性, 但比较微弱; 而与土壤NH4+-N(<0.05)和NO3–-N(<0.05)含量显著负相关(图3)。苔原TNS的NEE与土壤TC、TN、TP、NH4+-N、NO3–-N含量及C/N没有明显的相关关系。土壤的水分条件会影响土壤物质的形态和转化率及微生物活性等[50, 57]。土壤水分孔隙率(WFPS)≥60 %, 高于厌氧呼吸作用范围, 降水和土壤水分会增加CO2同化作用增强, CO2排放减弱或吸收增强[50, 57]。土壤水分含量较低, 呼吸作用可能超过光合作用, CO2同化作用增强, 增加CO2的排放[50, 57], 因此水分含量的高低对土壤CO2的排放起着重要作用。鸟类保护区苔原(TSB)和普通海滩苔原(TNS)的CO2净通量(NEE)与土壤含水率呈显著负相关关系(<0.01) (图3)。
土壤温度是影响生态系统CO2排放的重要因素[35]。植被覆盖度高、海鸟活动强烈的观测区HB的CO2净通量(NEE) 与0~15 cm平均土壤温度显著正相关(=0.32,=0.06)(图4)。在普通海滩苔原(TNS)区域, 地势低的湿地苔原观测区SW的CO2净通量(NEE)与0~15 cm土壤平均温度呈显著极负相关关系(≤0.01), 地势略高的半干旱苔原观测区SM的CO2净通量(NEE)与0~15 cm土壤平均温度呈极显著正相关(≤0.01), 地势更高的干旱苔原观测区SD的CO2净通量(NEE)与0~15 cm土壤平均温度呈显著正相关(≤0.05), 而与地势高的高地苔原观测区UD的NEE与0~15 cm土壤平均温度也具有弱的负相关关系(=–0.41,= 0.09)。
3 本研究的不确定性分析
极地生长季温室气体的排放, 尤其高密度海鸟活动的7—8月份, 对全年温室气体排放及碳循环起着重要的作用。本研究选取了新奥尔松夏季无冰区的鸟类保护区苔原(TSB)、普通海滩苔原(TNS)和过渡苔原(TTR), 监测CO2净通量(NEE)的空间变化规律, 整个观测期持续10天左右, 本研究的不确定性分析也聚焦于此。本研究仅关注北极高纬度新奥尔松苔原的生长期短暂的夏季CO2净通量的空间规律, 采用密闭箱法监测体系, 观测时间均在9:00—11:00(当地时间), 与Oechel 等[58]以及Lafleur 和Humphreys[24]的监测方法体系一致。本研究结果与其他在北极苔原7月和8月的研究结果具有可比较性, 如前述的格陵兰、阿拉斯加、西伯利亚和南极苔原区域[22-23, 46-48, 59-61]。
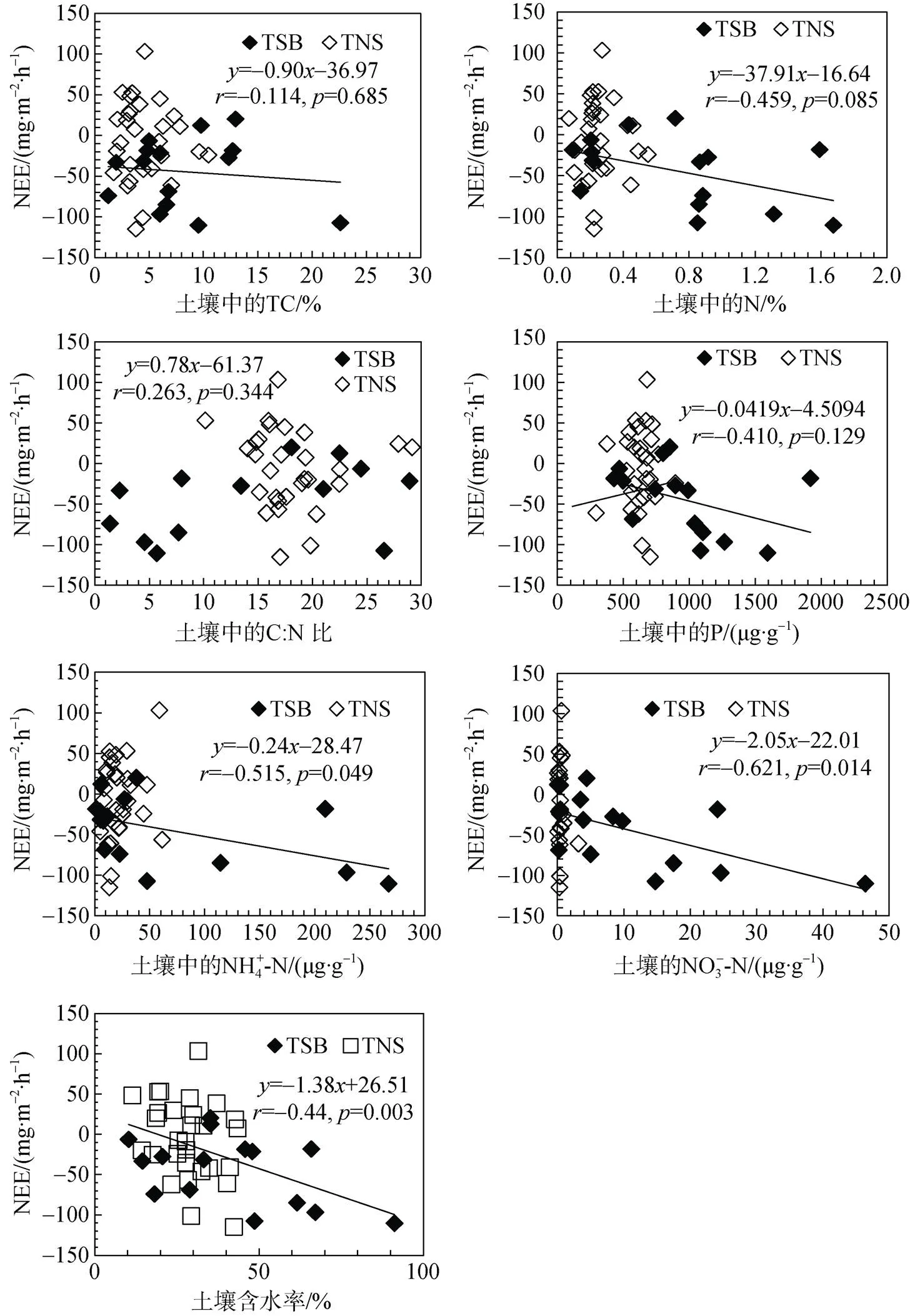
图3 鸟类保护区苔原(TSB, n=16)和普通海滩苔原(TNS, n=29)NEE与土壤理化学性质(土壤中NH4+-N、NO3–-N、TN、TC、TP、C∶N及土壤含水率)的相关性
Fig.3.The correlation between NEE and soil chemical properties (NH4+-N, NO3–-N, TN, TC, TP, C∶N ratio and soil moisture) at the different observation sites in seabird sanctuary tundra TSB (=16) and beach tundra TNS (=29)
4 结论
1.鸟类保护区苔原TSB整体为CO2吸收汇, 植被覆盖度高、海鸟活动强烈的观测区HB对CO2的吸收显著高于植被覆盖度和海鸟活动中等观测区MB, 观测区HB和MB的NEE均显著低于植被覆盖度低、海鸟活动边缘观测区LB。苔原植被发育越好, 海鸟活动越密集, 对CO2吸收越强烈。
2.非海鸟聚居区的普通海滩苔原TNS和过渡苔原TTR均为CO2排放源。苔原TNS中, 地势越低越湿润的苔原区域对CO2吸收越强, 如从地势略高的半干旱苔原观测区SM到地势低的湿地苔原观测区SW; 地势越高越干旱的苔原观测区的CO2排放越强烈, 如从地势高的高地苔原观测区UD到地势最高的顶部苔原观测区UL。苔原TTR中泥炭区为强吸收汇, 而高地苔原区域为强排放源。
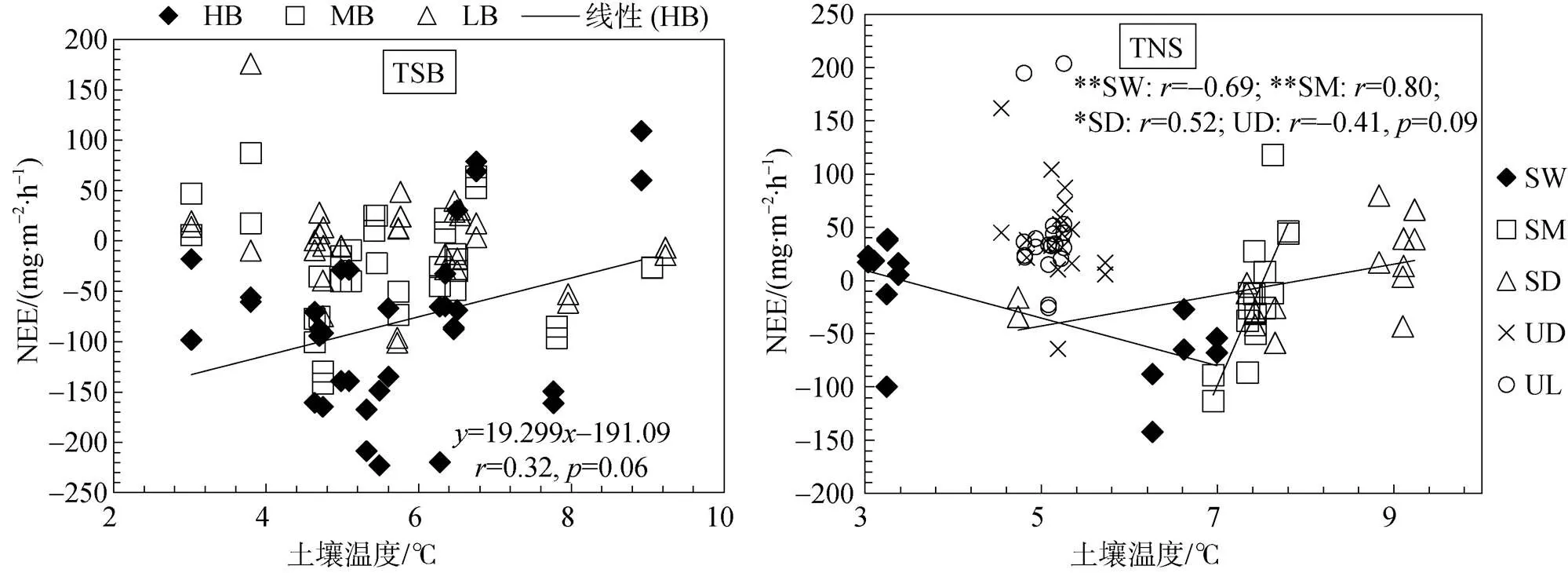
图4 鸟类保护区苔原(TSB)和普通海滩苔原(TNS)的NEE与土壤温度的相关性.*表示P≤0.05, **表示P≤0.01显著相关
Fig.4.The correlation between NEE and soil temperature at the different observation sites in tundra TSB and tundra TNS.Significant correlations were indicated by *(≤0.05) and ** (≤0.01)
3.土壤理化性质会对新奥尔松(Ny-Ålesund)苔原CO2净通量(NEE)产生重要影响。鸟类保护区苔原TSB和普通海滩苔原TNS的NEE与土壤水分显著负相关(<0.01); 鸟类保护区苔原TSB的NEE与土壤温度显著正相关, 与NH4+- N(<0.05)、NO3–-N(<0.05)含量显著负相关。
致谢感谢贾楠博士在第4次北极科学考察中采集温室气体和土壤样品, 感谢梁有庆高级工程师在实验上的指导。
1 VIRKKALA A M, VIRTANEN T, LEHTONEN A, et al.The current state of CO2flux chamber studies in the Arctic tundra[J].Progress in Physical Geography: Earth and Environment, 2018, 42(2): 162-184.
2 HUGELIUS G, STRAUSS J, ZUBRZYCKI S, et al.Estimated stocks of circumpolar permafrost carbon with quantified uncertainty ranges and identified data gaps[J].Biogeosciences, 2014, 11(23): 6573-6593.
3 TARNOCAI C, CANADELL J G, SCHUUR E A G, et al.Soil organic carbon pools in the northern circumpolar permafrost region[J].Global Biogeochemical Cycles, 2009, 23(2): GB2023.DOI: 10.1029/2008GB003327.
4 WATSON R T, NOBLE I R, BOLIN B, et al.Land use, land-use change and forestry.A special report of the international panel on climate change (IPCC)[EB/OL].(2000).https://www.ipcc.ch/report/land-use-land-use-change-and-forestry/.
5 MARUSHCHAK M E, KIEPE I, BIASI C, et al.Carbon dioxide balance of subarctic tundra from plot to regional scales[J].Biogeosciences, 2013, 10(1): 437-452.
6 BLAIS A M, LORRAIN S, TREMBLAY A.Greenhouse gas fluxes (CO2, CH4and N2O) in forests and wetlands of boreal, temperate and tropical regions[M]//TREMBLAY A, VARFALVY L, ROEHM C.et al.Greenhouse gas emissions–Fluxes and processes.Berlin, Heidelberg: Springer, 2005: 87-127.
7 HEIKKINEN J E P, ELSAKOV V, MARTIKAINEN P J.Carbon dioxide and methane dynamics and annual carbon balance in tundra wetland in NE Europe, Russia[J].Global Biogeochemical Cycles, 2002, 16(4): 62-1-62-9.DOI:10.1029/2002GB001930.
8 BLACKALL T D, WILSON L J, THEOBALD M R, et al.Ammonia emissions from seabird colonies[J].Geophysical Research Letters, 2007, 34(10): L10801.
9 RIDDICK S N, DRAGOSITS U, BLACKALL T D, et al.The global distribution of ammonia emissions from seabird colonies[J].Atmospheric Environment, 2012, 55: 319-327.
10 KRUPA S V.Effects of atmospheric ammonia (NH3) on terrestrial vegetation: A review[J].Environmental Pollution, 2003, 124(2): 179-221.
11 LINDEBOOM H J.The nitrogen pathway in a penguin rookery[J].Ecology, 1984, 65(1): 269-277.
12 MIZUTANI H, KABAYA Y, WADA E.Ammonia volatilization and high15N/14N ratio in a penguin rookery in Antarctica[J].Geochemical Journal, 1985, 19(6): 323-327.
13 SUN L G, ZHU R B, XIE Z Q, et al.Emissions of nitrous oxide and methane from Antarctic Tundra: Role of penguin dropping deposition[J].Atmospheric Environment, 2002, 36(31): 4977-4982.DOI: 10.1016/S1352-2310(02)00340-0.
14 PARK J H, DAY T A, STRAUSS S, et al.Biogeochemical pools and fluxes of carbon and nitrogen in a maritime tundra near penguin colonies along the Antarctic Peninsula[J].Polar Biology, 2007, 30(2): 199-207.
15 ZHU R B, LIU Y S, XU H, et al.Methane emissions from three sea animal colonies in the maritime Antarctic[J].Atmospheric Environment, 2008, 42(6): 1197-1205.
16 ZHU R B, LIU Y S, XU H, et al.Nitrous oxide emissions from sea animal colonies in the maritime Antarctic[J].Geophysical Research Letters, 2008, 35(9): L09807.DOI:10.1029/2007GL032541.
17 WÜTHRICH C, MÖLLER I, THANNHEISER D.CO2-fluxes in different plant communities of a high-Arctic tundra watershed (Western Spitsbergen)[J].Journal of Vegetation Science, 1999, 10(3): 413-420.
18 LLOYD C R.The measurement and modelling of the carbon dioxide exchange at a high Arctic site in Svalbard[J].Global Change Biology, 2001, 7(4): 405-426.
19 CANNONE N, BINELLI G, WORLAND M R, et al.CO2fluxes among different vegetation types during the growing season in Marguerite Bay (Antarctic Peninsula)[J].Geoderma, 2012, 189-190: 595-605.DOI:10.1016/j.geoderma.2012.06.026.
20 ZHU R B, BAO T, WANG Q, et al.Summertime CO2fluxes and ecosystem respiration from marine animal colony tundra in maritime Antarctica[J].Atmospheric Environment, 2014, 98: 190-201.
21 LIU Y S, ZHANG W Y, ZHU R B, et al.Potential methane and nitrous oxide production and respiration rates from penguin and seal colony tundra soils during freezing–thawing cycles under different water contents in coastal Antarctica[J].Advances in Polar Science, 2017, 28(1): 61-74.DOI: 10.13679/j.advps.2017.1.00061.
22 HARAZONO Y, MANO M, MIYATA A, et al.Inter-annual carbon dioxide uptake of a wet sedge tundra ecosystem in the Arctic[J].Tellus B: Chemical and Physical Meteorology, 2003, 55(2): 215-231.
23 GROENDAHL L, FRIBORG T, SOEGAARD H.Temperature and snow-melt controls on interannual variability in carbon exchange in the high Arctic[J].Theoretical and Applied Climatology, 2007, 88(1/2): 111-125.
24 LAFLEUR P M, HUMPHREYS E R.Spring warming and carbon dioxide exchange over low Arctic tundra in central Canada[J].Global Change Biology, 2008, 14(4): 740-756.
25 OECHEL W C, HASTINGS S J, VOURLRTIS G, et al.Recent change of Arctic tundra ecosystems from a net carbon dioxide sink to a source[J].Nature, 1993, 361(6412): 520-523.
26 OECHEL W C, VOURLITIS G L, HASTINGS S J, et al.Acclimation of ecosystem CO2exchange in the Alaskan Arctic in response to decadal climate warming[J].Nature, 2000, 406(6799): 978-981.
27 BIRKS H J B, JONES V J, ROSE N L.Recent environmental change and atmospheric contamination on Svalbard as recorded in lake sediments–An introduction[J].Journal of Paleolimnology, 2004, 31(4): 403-410.
28 SCHWERDTFEGER W.Weather and climate of the Antarctic[M].Amsterdam: Elsevier, 1984.
29 邓海滨, 陆龙骅, 卞林根.北极苔原新奥尔松地区的地表辐射特征[J].极地研究, 2006, 18(4): 254-264.
30 刘雅淑.南极苔原温室气体通量时空变化规律与产生机理研究[D].合肥: 中国科学技术大学,2011.
31 袁林喜, 龙楠烨, 谢周清, 等.北极新奥尔松地区现代污染源及其指示植物研究[J].极地研究, 2006, 18(1): 9-20.
32 邓海滨, 陆龙骅, 卞林根.北极苔原Ny-Ålesund地区短期气候特征[J].极地研究, 2005, 17(1): 32-44.
33 WINTHER J G, GODTLIEBSEN F, GERLAND S, et al.Surface albedo in Ny-Ålesund, Svalbard: Variability and trends during 1981-1997[J].Global and Planetary Change, 2002, 32(2/3): 127-139.
34 WESTERMANN S, WOLLSCHLÄGER U, BOIKE J.Monitoring of active layer dynamics at a permafrost site on Svalbard using multi-channel ground-penetrating radar[J].The Cryosphere, 2010, 4(4): 475-487.
35 朱仁斌, 孙立广, 谢周清, 等.南极菲尔德斯半岛植被微区CO2浓度的监测[J].环境科学, 2001, 22(4): 6-10.
36 HUTCHINSON G L, MOSIER A R.Improved soil cover method for field measurement of nitrous oxide fluxes[J].Soil Science Society of America Journal, 1981, 45(2): 311-316.
37 VAN HUISSTEDEN J, MAXIMOV T C, DOLMAN A J.High methane flux from an Arctic floodplain (Indigirka Lowlands, eastern Siberia)[J].Journal of Geophysical Research: Biogeosciences, 2005, 110(G2): G02002.DOI:10.1029/2005JG000010.
38 郎漫, 蔡祖聪.百菌清对土壤氧化亚氮和二氧化碳排放的影响[J].应用生态学报, 2008, 19(12): 2745-2750.
39 KEENEY D R, NELSON D W.Nitrogen-inorganic forms[M]//PAGE A L.Methods of soil analysis: Part 2 Chemical and microbiological properties.2nd ed.New Jersey: Wiley,1983: 643–698.
40 SUN L, XIE Z, ZHAO J.A 3, 000-year record of penguin populations[J].Nature, 2000, 407(6806): 858.
41 ZHU R B, SUN J J, LIU Y S, et al.Potential ammonia emissions from penguin guano, ornithogenic soils and seal colony soils in coastal Antarctica: Effects of freezing-thawing cycles and selected environmental variables[J].Antarctic Science, 2011, 23(1): 78-92.
42 MOURA P A, FRANCELINO M R, SCHAEFER C E G R, et al.Distribution and characterization of soils and landform relationships in Byers Peninsula, Livingston Island, Maritime Antarctica[J].Geomorphology, 2012, 155-156: 45-54.
43 RAICH J W, TUFEKCIOGUL A.Vegetation and soil respiration: Correlations and controls[J].Biogeochemistry, 2000, 48(1): 71-90.
44 陈清清, 朱仁斌, 丁玮, 等.海鸟活动对北极新奥尔松苔原-大气CO2交换的影响[J].极地研究, 2012, 24(3): 254-265.
45 李芳芳.高纬度北极苔原断面温室气体通量变异规律研究[D].合肥: 中国科学技术大学, 2017.
46 VOURLITIS G L, OECHEL W C.Eddy covariance measurements of CO2and energy fluxes of an Alaskan tussock tundra ecosystem[J].Ecology, 1999, 80(2): 686-701.
47 VAN DER MOLEN M K, VAN HUISSTEDEN J, PARMENTIER F J W, et al.The growing season greenhouse gas balance of a continental tundra site in the Indigirka Lowlands, NE Siberia[J].Biogeosciences, 2007, 4(6): 985-1003.
48 ZHU R B, MA D W, XU H.Summertime N2O, CH4and CO2exchanges from a tundra marsh and an upland tundra in maritime Antarctica[J].Atmospheric Environment, 2014, 83: 269-281.
49 CHRISTENSEN T R, FRIBORG T, SOMMERKORN M, et al.Trace gas exchange in a high-Arctic valley: 1.Variationsin CO2and CH4flux between tundra vegetation types[J].Global Biogeochemical Cycles, 2000, 14(3): 701-713.
50 贾志军, 宋长春.湿地生态系统CO2净交换、水汽通量及二者关系浅析[J].生态与农村环境学报, 2006, 22(2): 75-79.
51 宋长春, 阎百兴, 王跃思, 等.三江平原沼泽湿地CO2和CH4通量及影响因子[J].科学通报, 2003, 48(23): 2473-2477.
52 李海防, 夏汉平, 熊燕梅, 等.土壤温室气体产生与排放影响因素研究进展[J].生态环境, 2007, 16(6): 1781-1788.
53 SUBKE J A, REICHSTEIN M, TENHUNEN J D.Explaining temporal variation in soil CO2efflux in a mature spruce forest in Southern Germany[J].Soil Biology and Biochemistry, 2003, 35(11): 1467-1483.
54 MICHAELIS L, MENTEN M L, GOODY R S, et al.The kinetics of invertase action[J].Biochemistry, 1913, 49(2): 333–369.
55 STITT M, KRAPP A.The interaction between elevated carbon dioxide and nitrogen nutrition: The physiological and molecular background[J].Plant, Cell & Environment, 1999, 22(6): 583-621.DOI: 10.1046/j.1365-3040.1999.00386.x.
56 MAGNANI F, MENCUCCINI M, BORGHETTI M, et al.The human footprint in the carbon cycle of temperate and boreal forests[J].Nature, 2007, 447(7146): 849-851.
57 陈全胜, 李凌浩, 韩兴国, 等.典型温带草原群落土壤呼吸温度敏感性与土壤水分的关系[J].生态学报, 2004, 24(4): 831-836.
58 OECHEL W C, VOURLITIS G, HASTINGS S J.Cold season CO2emission from Arctic soils[J].Global Biogeochemical Cycles, 1997, 11(2): 163-172.
59 RHEW R C, TEH Y A, ABEL T.Methyl halide and methane fluxes in the northern Alaskan coastal tundra[J].Journal of Geophysical Research: Biogeosciences, 2007, 112(G2): G02009.DOI:10.1029/2006JG000314.
60 VON FISCHER J C, RHEW R C, AMES G M, et al.Vegetation height and other controls of spatial variability in methane emissions from the Arctic coastal tundra at Barrow, Alaska[J].Journal of Geophysical Research: Biogeosciences, 2010, 115(G4): G00I03.DOI:10.1029/2009JG001283.
61 SOEGAARD H, NORDSTROEM C, FRIBORG T, et al.Trace gas exchange in a high-Arctic valley: 3.Integrating and scaling CO2fluxes from canopy to landscape using flux data, footprint modeling, and remote sensing[J].Global Biogeochemical Cycles, 2000, 14(3): 725-744.
The spatial variation of net CO2fluxes (NEE) and their influence factors in tundra in high Arctic
Chen Qingqing1,2, Bao Tao3, Zhu Renbin2, Xu Hua4
(1College of Life Science, Resources and Environment, Yichun University, Yichun 336000, China;2Anhui Province Key Laboratory of Polar Environment and Global Change, School of Earth and Space Science, University of Science and Technology of China, Hefei 230026, China;3Key Laboratory of Regional Climate-Environment for Temperate East Asia, Institute of Atmospheric Physics, Chinese Academy of Sciences, Beijing 100029, China;4State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210091, China)
The release of CO2from summer ice-free tundra of the high Arctic plays an important role in the global carbon cycle.These net ecosystem exchanges (NEEs) and their influence factors from Seabird Sanctuary Tundra (TSB), Tundra in Non-Seabird Colony (TNS) and Tundra in Transition Zone (TTR) were measured using the closed chamber method during the Fourth Arctic Scientific Exploration (26 July–5 August 2008) in the High Arctic.The spatial variations of NEE show that TSB was a sink for CO2, with an average NEE of (−39.0±6.0) mg·m−2·h−1.Typically, absorption of CO2in areas with high vegetation cover and strong seabird usage was greater than in areas with lower vegetation cover and seabird usage.In contrast, TNS and TTR were emission sources for CO2, with average NEEs of (12.0±6.3) mg·m−2·h−1and (40.5±29.3) mg·m−2·h−1, respectively.Highland TTR ((106.4±23.1) mg·m−2·h−1) was the strongest emission source, while peatland TTR [(−58.3±9.5) mg·m−2·h−1] was a strong sink.Spatial variation of NEEs was linked to differences in vegetation cover and hydrological conditions related to seabird activity in all tundra types.Physical and chemical properties of tundra soils also affected NEE values, showing negative correlations with soil moisture (=−0.44,=0.003) in TSB and TNS, but a positive correlation with soil temperature (=0.32,=0.06) and negative correlations with NH4+-N (<0.05) and NO3–-N (<0.05) concentrations in TSB.
CO2,net CO2fluxes, Arctic, Ny-Ålesund, high Arctic tundra
2020年11月收到来稿, 2021年1月收到修改稿
国家重点研发计划重点专项(2020YFA0608500)、国家自然科学基金(41776190,41976220)资助
陈清清, 女, 1984年生。博士, 主要从事元素生物地球化学循环研究。E-mail: chenqq@nju.edu.cn
朱仁斌, E-mail: zhurb@ustc.edu.cn
10.13679/j.jdyj.20200073
