不同恢复阶段热带森林土壤nirS型反硝化微生物群落结构及多样性特征
2021-02-06曹乾斌王邵军陈闽昆左倩倩
曹乾斌,王邵军,2,*,陈闽昆,曹 润,王 平,左倩倩,赵 爽,杨 波
1 西南林业大学生态与环境学院,昆明 650224 2 南京林业大学南方现代林业协同创新中心,南京 210037

土壤反硝化微生物群落结构及多样性受生态系统类型及土壤环境因子的影响显著[2,4]。研究表明,在温带农田生态系统中,土壤质地、含水量、硝态氮含量是调控反硝化过程的主控因子[8]。而在森林生态系统中,土壤有机碳、易容性有机碳、全氮、铵态氮及pH则成为调控反硝化微生物群落的重要因子[9-11]。热带森林生态系统每年N2O的排放量高达3.0 Tg,占全球总排放量的40%,是地球上最大的天然N2O排放源[12],因此,热带森林土壤反硝化微生物具有更高的多样性和丰富度。另外,由于热带森林具有相对较高的降雨量,年均温度变化小,植物群落多样性及异质性较高,土壤理化性质具有较大的变异性[2],可能导致热带森林区域土壤反硝化微生物群落结构及多样性的巨大差异。目前,nirS型反硝化标记基因已被广泛用于草地、河口沉积物、农田土壤、湿地、北方森林等区域土壤反硝化微生物多样性研究[2,13],而有关热带森林中土壤nirS型反硝化细菌的群落结构及多样性的研究,却十分缺乏。因此,探明热带森林中土壤nirS型反硝化细菌群落多样性及其与土壤理化因子间相互关系,具有十分重要的科学意义。
云南西双版纳位于北回归线以南的热带湿润区,地貌复杂,小气候多样,水热条件优越,物种丰富,是我国原始热带雨林保存最为完整的地区之一。由于农业生产方式改变及人口增加等因素的影响,热带雨林遭受了刀耕火种等农业活动的严重人为破坏,形成了一系列处于不同恢复阶段的次生恢复类型[14]。不同恢复阶段形成的森林群落结构会对土壤微生物区系组成产生重要影响,可能影响反硝化微生物群落的结构及多样性[15-16]。因此,本研究以中国科学院西双版纳热带植物园区为研究区,选择3种处于不同恢复阶段的热带森林群落为研究对象,以nirS型基因标记物,采用Illumina MiSeq高通量测序技术,对比分析不同森林群落土壤nirS型反硝化微生物群落结构及多样性特征,深入探讨nirS型反硝化微生物与土壤理化因子的关系,进而揭示影响热带森林土壤反硝化功能微生物的主要因子,为评估热带森林恢复过程中土壤N2O排放动态及土壤N循环过程提供数据支撑。
1 材料与方法
1.1 研究区概况
研究样地位于云南省西双版纳州的中国科学院西双版纳热带植物园(21°55′N,101°16′E)区内,属东南亚北热带季风气候区,自然植被类型为热带雨林和季雨林,自然恢复的次生植被主要包括白背桐群落、崖豆藤群落、高檐蒲桃群落等,人工林主要为橡胶林[17]。全年平均气温21.5℃。干湿季节分明,年均降水量1557 mm,其中,全年降雨量的87%集中在5—10月的雨季,为1335 mm;而13%则集中于11月至次年4月的干季,为202 mm。研究区土壤类型为白垩纪砂岩发育而成的砖红壤。
1.2 样地设置
根据中国科学院西双版纳热带森林植物园建园以来的相关森林维护记录,在植物园区内选取起源于热带雨林经刀耕火种后自然恢复形成的次生热带森林(白背桐群落、崖豆藤群落及高檐蒲桃热带森林群落)为研究对象,3个群落处于连续演替的不同恢复阶段且起源(植被与土壤类型)和立地条件(包括坡度、坡向与坡位等)基本类似[18]。样地详情如下:
白背桐群落(Mallotuspaniculatuscommunity,简称MP),恢复年限约12 a,海拔600 m。植被盖度约60%,枯枝落叶层厚1—2 cm,平均树高8.85 m,平均胸径7.13 cm。样地内乔木树种为白背桐(M.paniculatus);下木为小乔木粉被金合欢(Acaciapruinescens);灌木植物包括椴叶山麻秆(Alchorneatiliifolia);草本层盖度约为40%,包括野生风轮草(Clinopodiumchinensis)、丰花草(Borreriastricta)等。
崖豆藤群落(Millettialeptobotryacommunity,简称ML),恢复年限约42 a,海拔 568 m。植被盖度90%左右,枯枝落叶层厚4—5 cm,平均树高12.25 m,平均胸径9.93 cm。样地内乔木树种为思茅崖豆(M.leptobotrya);下木为小乔木钝叶金合欢(A.megaladena);灌木植物包括锈毛鱼藤(Derrisferruginea)、椴叶山麻秆(A.tiliifolia)、猪肚木(Canthiumhorridum)和滇南九节(Psychotriahenryi),灌木层优势种为锈毛鱼藤;草本层盖度约为25%,包括刚莠竹(Microstegiumciliatum)、银叶砂仁(Amomumsericeum)等。
高檐蒲桃群落(Syzygiumoblatumcommunity,简称SO),恢复年限约53 a,海拔619 m。植被盖度95%左右,凋落物层厚 6—7 cm,平均树高23.56 m,平均胸径23.45 cm。样地内乔木树种为高檐蒲桃(S.oblatum);下层乔木为思茅崖豆(M.leptobotrya)、鸡嗉子榕(Ficussemicordata)、印度栲(Castanopsisindica)和云南黄杞(Engelhardiaspicata);灌木植物包括黑风藤(Fissistigmapolyanthum)、南山花(Prismatomerisconnata);草本层盖度约为15%,包括多型叉蕨(Tectariapolymorpha)、红豆蔻(Alpiniagalanga)、子分叉露兜(Pandanusfurcatus)等,草本层优势种为多型叉蕨。
1.3 样品采集和理化因子测定
于2019年3月、9月中旬在3个处于不同恢复阶段样地内,各设置3个50m×50m样地,样地与样地间距至少200m。每个样地内在对角线取3个取样点,扒开取样点上方枯枝落叶,按0—10cm取土,混合均匀后装入无菌自封袋,分2份带回实验室。其中一份用于土壤基本理化指标测定,另一份用于土壤反硝化微生物测定。
土壤温度采用便携式土壤水分温度测量仪(SIN-TN8,昆仑中大)测定;土壤含水率(%)采用烘干称量法(105℃,24h)测定;土壤容重采用环刀法测定;土壤pH采用电位法(土水比1∶2.5)测定;土壤有机碳采用油浴加热-重铬酸钾氧化法测定;土壤易氧化有机碳采用高锰酸钾氧化法测定;土壤全氮、铵态氮、硝态氮采用全自动流动分析仪测定;土壤水解性氮采用碱解扩散法测定;土壤微生物量碳采用氯仿水浴法测定[19]。
1.4 土壤微生物DNA提取及反硝化基因测定和测序
准确称取0.5g鲜土,根据E.Z.N.A. ® soil试剂盒(Omega Bio-tek,Norcross,GA,U.S.)说明书进行总DNA抽提,DNA浓度和纯度利用NanoDrop2000进行检测,利用1%琼脂糖凝胶电泳检测DNA提取质量;对每份土壤样品,采用nirS型反硝化细菌引物对:Cd3aF (5′-GTSAACGTSAAGGARACSGG- 3′)和R3cd (5′-GASTTCGGRTGSGTCTTGA- 3′),对V3-V4 可变区进行PCR扩增。扩增程序为:95℃预变性3 min,27个循环(95℃变性 30 s,55℃退火30 s,72℃延伸30 s),最后72℃延伸10 min(PCR仪:ABI GeneAmp® 9700型)。扩增体系为20μL,4μL 5*FastPfu缓冲液,2μL 2.5mmol/L dNTPs,0.8μL引物(5μmol/L),0.4μL FastPfu聚合酶;10ng DNA模板,剩余体积用双蒸水补足。每个样本均进行3个重复,将同一样本的PCR产物混合后用2%琼脂糖凝胶电泳检测,使用AxyPrepDNA凝胶回收试剂盒(AXYGEN公司)切胶回收PCR产物,Tris_HCl洗脱;2%琼脂糖电泳检测。将PCR产物用QuantiFluorTM-ST蓝色荧光定量系统(Promega公司)进行检测定量,采用Illumina PE250平台构建系统文库并测序。对Illumina PE250测序得到的PE reads,首先根据overlap关系进行拼接,同时对序列质量进行质控和过滤,区分样本后进行OTU聚类分析和物种分类学分析。使用QIIME软件,对OUT丰度矩阵中每个样本的系列数在不同深度下随机抽样,以每个深度下抽取到的系列数和对应的OUT数绘制稀释曲线。根据上述OUT划分和分类水平鉴定结果,使用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析,并分别在各个分类水平:domain(域),kingdom(界),phylum(门),class(纲),order(目),family(科),genus(属),species(种)统计各样本的群落组成。之后在各分类水平进行Alpha多样性指数及物种组成分析。
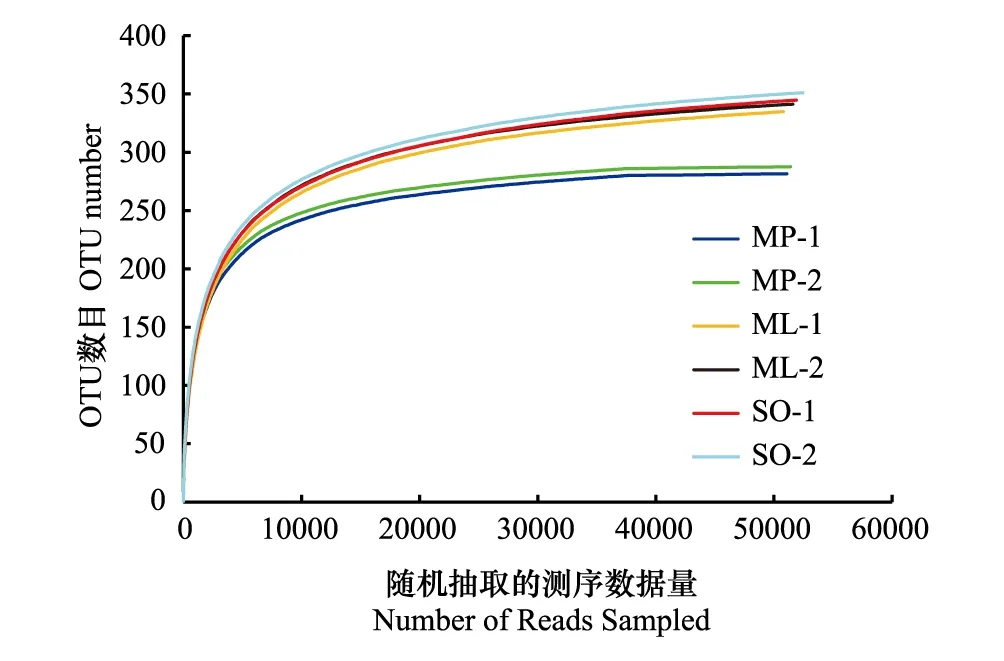
图1 各样地不同月份土壤样品稀释曲线 Fig.1 The rarefaction curves of soil samples in different monthsMP- 1与MP- 2分别代表白背桐群落(M. paniculatus)3月和9月的测量数据;ML- 1与ML- 2分别代表崖豆藤群落(M. leptobotrya)3月和9月的测量数据;SO- 1与SO- 2分别代表高檐蒲桃群落(S. oblatum)3月和9月的测量数据
1.5 数据处理
土壤数据用Excel进行整理,数据分析前进行正态性及方差齐性检验,采用单因素方差分析(one-way ANOVA)比较不同恢复阶段、不同月份数据之间的差异;采用双因素方差分析比较不同月份(3月、9月)及不同样地对土壤nirS型反硝化微生物Shannon指数的影响;使用R语言绘图包(ggplot2)进行数据处理及图形绘制。
2 研究结果
2.1 土壤nirS基因测序结果
在97%的相似性水平下,对测序结果进行OTU划分,一共获得1640个OTUs,经比对鉴定后获得5门7纲17目22科27属70种土壤nirS型反硝化菌群信息。采用随机抽样方法构建的样品稀释曲线(Rarefaction curve),结果如图1。3个样地2个月份的样品稀释曲线均趋于平坦,表明测序数据量合理,且OUT数目随恢复年限增加而增多。从各样地的稀释曲线在水平方向上跨度范围来看,SO样地的nirS型反硝化菌群丰富度最高,而MP样地最低。此外,ML和SO样地的稀释曲线平缓程度以及OUT数目相似,表明处于恢复后期的热带森林群落内nirS型反硝化细菌群落丰富度以及物种均匀度相似。
2.2 土壤反硝化微生物群落组成的变化
从门分类水平来看(图2),不同恢复阶段土壤nirS型未分类反硝化细菌门变化极大(1.37% — 94.04%),在已经被注释的nirS型反硝化细菌门中,主要集中于变形菌门(Proteobacteria)、绿弯菌门(Chloroflexi)、酸杆菌门(Acidobacteria)和放线菌门(Actinobacteria)。变形菌门成为热带森林不同恢复阶段中的优势门(32.71% — 98.63%),其相对丰度3月表现为MP(98.63%)>ML(68.66%)>SO(32.71%),9月份则表现为ML(79.62%)>MP(72.35%)>SO(60.90%)。此外,绿弯菌门(0.12%—28.3%)和放线菌门(0.54% — 2.31%)均沿恢复年限增加而增加,但酸杆菌门相对丰度表现为恢复初期的ML群落最高(1.09%—11.64%)。
3种不同恢复阶段热带森林群落中,土壤nirS型反硝化细菌门相对丰度在不同月份间差异显著(图2)。与3月份相比,9月份变形菌门在ML、SO群落中出现不同程度增幅(3.56% — 86.18%),表现为SO(52.19倍)>ML(4.82倍)>MP(0.59倍),但MP群落降低了26.64%。此外,各样地的新检测出的反硝化细菌门差异较大,如9月份ML群落新检测出2门(放线菌门和绿弯菌门),其余样地均新检测出1门(拟杆菌门)。放线菌门(Actinobacteria)是3个样地内9月份的共有新增反硝化细菌门,相对丰度表现为MP(2.31%)>SO(1.91%)>ML(0.54%)。变形菌门的最高和最低相对丰度均出现在3月份,分别为MP(98.63%)和SO(32.71%)群落。
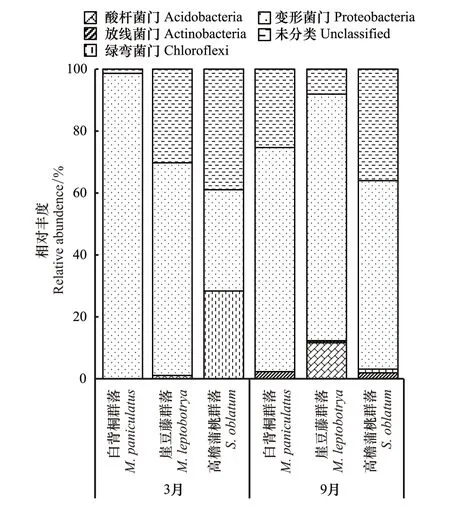
图2 不同恢复阶段、不同月份间门水平反硝化微生物相对丰度Fig.2 Relative abundance of phylum-level denitrification microorganisms in different months across three recovery stages
从属分类水平来看(图3),3种不同群落类型的nirS型反硝化细菌属相对丰度在不同恢复阶段表现差异较大。除未分类细菌属(0.37% — 94.04%)之外,3个样地在3月和9月共有的nirS型反硝化细菌属为:贪铜菌属(Cupriavidus,2.20% — 60.27%)、脱氯单胞菌属(Dechloromonas,0.04%—40.67%)、嗜盐单胞菌属(Halomonas,0.04%—5.17%)、假单胞菌属(Pseudomonas,0.76%—21.09%)以及罗思河小杆菌属(Rhodanobacter,0.02%—34.19%)。除贪铜菌属的相对丰度表现为沿恢复年限增加而降低外,其余共有反硝化细菌属在相同月份内的相对丰度变化趋势差异巨大。脱氯单胞菌属、嗜盐单胞菌属和罗思河小杆菌属在3月份表现为MP>SO>ML,假单胞菌属表现为ML>SO>MP;而在9月,脱氯单胞菌属和罗思河小杆菌属的相对丰度则表现为沿恢复年限增加而增加,嗜盐单胞菌属表现为MP>ML>SO,假单胞菌属则表现为MP>SO>ML。
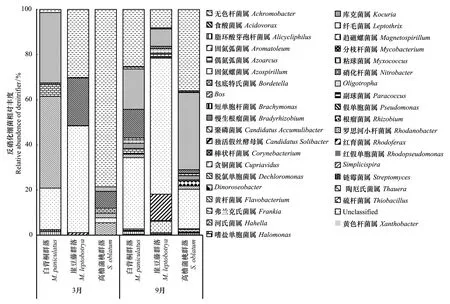
图3 不同恢复阶段、不同月份间属水平反硝化微生物相对丰度Fig.3 Relative abundance of genus-level denitrification microorganisms in different months across three recovery stages
与3月相比,9月份各样地的nirS型反硝化细菌属种类数差异较大。其新检测出的种类数表现为:SO(19种,0.01% — 2.17%)>MP(13种,0.02%—2.31%)>ML(7种,0.01% — 0.59%)。在各样地共有的nirS型反硝化细菌属中,9月ML群落的罗思河小杆菌属、嗜盐单胞菌属、脱氯单胞菌属和贪铜菌属的相对丰度分别是3月的473.7、31.1、10.8和1.3倍,SO群落的罗思河小杆菌属和贪铜菌属则为16.9和7.9倍,而MP群落的假单胞菌属则为16.7倍;同一样地内的共有反硝化菌属相对丰度在9月表现出不同程度的降低,如MP群落的脱氯单胞菌属、ML群落的假单胞菌属的相对丰度仅为3月的0.04和0.27。
2.3 土壤nirS型反硝化微生物α多样性的样地差异
如表1所示,在相似性水平为97%下,3种不同恢复阶段热带森林中土壤反硝化微生物多样性表现为9月(湿季)高于3月(干季)。Shannon多样性指数随恢复年限增加而增加(1.65—3.93),且各样地间差异性显著(P<0.05),9月份MP、ML、SO样地的Shannon指数分别是3月份的2.28、2.20和1.48倍;Simpson多样性指数随恢复年限增加而降低(0.04—0.28),除3月的SO样地和9月的MP样地与其它样地差异性显著外(P<0.05),其余相同月份间差异不显著;Chao指数则表现为:3月份SO群落最低,ML群落最高,而9月份则随恢复年限增加而增加,其变化范围在25—365之间。
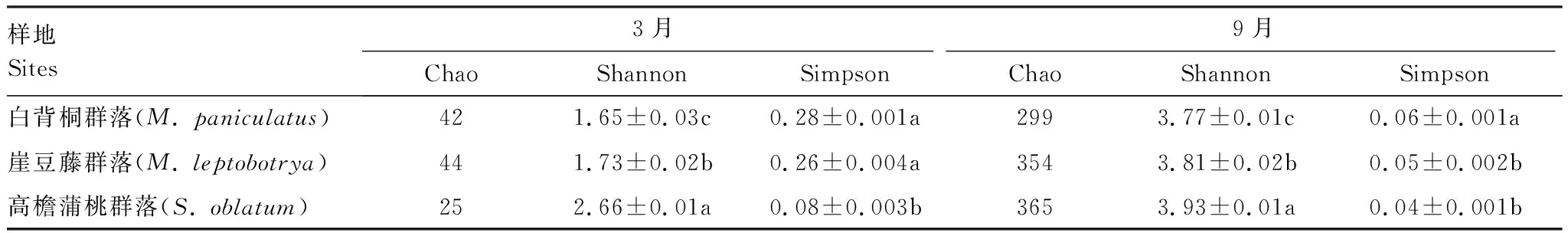
表1 不同恢复阶段热带森林土壤nirS型反硝化微生物α多样性指数
热带森林不同恢复阶段和月份对土壤nirS型反硝化微生物的影响均达极显著水平(表2)。由表2可知,恢复年限和月份变化(3月到9月)均对土壤nirS型反硝化细菌的群落结构及多样性特征产生显著影响(P<0.01),且恢复年限与月份变化也会对土壤nirS型反硝化细菌共同产生影响(P<0.01)。

表2 恢复阶段和取样时间对土壤nirS型反硝化微生物Shannon指数影响的双因素方差分析
2.4 土壤理化性质与反硝化微生物的关系
3种不同恢复阶段热带森林土壤理化指标的测定结果见表3。由表可知,土壤含水率、全氮、水解氮、铵态氮、硝态氮、微生物量碳及土壤有机碳随恢复年限增加而增加,且不同样地差异性显著(P<0.05),尽管SO群落的pH值最高,但与ML群落差异不显著,而土壤温度表现为随恢复年限增加而降低,土壤容重表现为ML群落最高,MP群落最低。

表3 不同恢复阶段热带森林土壤理化性质特征
热带森林不同恢复阶段土壤nirS型反硝化微生物群落α多样性指数与土壤环境因子的相关分析结果见表4。其中,Shannon指数与土壤含水率、温度、微生物量碳、土壤全氮、水解氮、铵态氮、硝态氮呈极显著正相关(P<0.01),而Simpson指数与土壤易氧化碳、全氮、水解氮、铵态氮及硝态氮呈极显著负相关(P<0.01)。Chao指数与土壤微生物量碳、全氮及硝态氮呈极显著正相关(P<0.01),与土壤pH、有机碳、水解氮及铵态氮呈显著正相关(P<0.05)。

表4 土壤nirS型反硝化微生物群落α多样性指数与土壤理化性质间的关系
采用主成分分析(PCA)对影响热带森林不同恢复阶段土壤nirS型反硝化细菌α多样性指数的理化因子进行分析,其结果如图4。PC1和PC2的主成分累积解释量为67.32%,Shannon指数与各土壤理化指标的夹角排序为:土壤硝态氮<土壤微生物量碳<全氮<易氧化碳<含水率<水解氮 图4 土壤反硝化微生物α多样性指数与土壤理化因子的主成分分析(PCA)Fig.4 PCA of alpha diversity index of soil denitrification microbial community with soil physicochemical propertiesShannon:Shannon指数;Simpson:Simpson指数;Chao:Chao指数;SOC:土壤有机碳 Soil organic carbon;MBC:微生物生物量碳 Microbial biomass carbon;TN:全氮 Total nitrogen;ROC:易氧化碳 Readily oxidizable organic carbon;HN:水解氮 Hydrolyzable 铵态氮 Ammonium 硝态氮 Nitrate nitrogen;SW:土壤水分 Soil water;ST:土壤温度 Soil temperature;BD:容重 Bulk density;1—9:样方数据平均值Average of sample plots 3种不同恢复阶段的热带森林土壤nirS型反硝化细菌群落结构差异显著。变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、拟杆菌门(Bacteroidetes)和放线菌门(Actinobacteria)成为该热带森林区域的优势门,且变形菌门的相对丰度变化范围较宽(32.71% — 98.63%),这一结果与Gu[20]及Zhao[4]等人的研究结果相似。变形菌门在土壤生态系统中广泛存在,其拷贝数在总克隆文库中占比高达25- 40%[21],且一些厌氧异养变形菌相对丰度会随土壤氧气浓度的周期波动出现显著变化[2]。本研究中,变形菌门、酸杆菌门的相对丰度表现为恢复初期高于恢复后期。这可能与变形菌门和酸杆菌门属于寡营养型反硝化微生物有关,它们在养分有效性较低的环境中反而具有较高的相对丰度[22];而绿弯菌门和放线菌门可能属于富营养型反硝化细菌门,处于恢复后期的高檐蒲桃群落具有充足的有效养分,因此其在恢复后期具有较高的相对丰度。此外,本研究区在3月期间会出现周期性的浓雾(从夜晚持续至第二天早上),这使得研究区内的土壤相对湿度保持在一个相对稳定水平[23],加之处于恢复初期的群落植被结构和盖度比处于恢复后期更单一,无法维持一个相对稳定的土壤含水率及养分有效性水平,使得反硝化细菌相对丰度出现激烈波动(如变形菌门)。9月份新检测出的放线菌门表现为恢复中后期高于恢复初期,可能是因为放线菌门对水分和温度更为敏感,在水分充足的月份具有更高的丰度[24],且处于恢复后期的土壤养分有效性更高,最终导致高温湿润的9月比低温干燥的3月检测出更多的放线菌门。 与3月份相比,9月份各样地的nirS型反硝化细菌属种类数出现不同程度的增幅。贪铜菌属、脱氯单胞菌属、嗜盐单胞菌属、假单胞菌属及罗思河小杆菌属成为3个样地内的优势属(图3)。这一结果与陈秀波[15]等人的研究结果相同,但其采用的是nosZ型引物,这说明上述几种反硝化细菌属不但具有亚硝酸还原酶,同时也具有氧化亚氮还原酶(Nos酶,一种能将N2O气体还原成N2的酶)。此外,除贪铜菌属的相对丰度在3月、9月表现为沿恢复年限增加而降低外,其余反硝化细菌属的相对丰度变化趋势各不相同,如9月的脱氯单胞菌属和罗思河小杆菌属在沿恢复年限增加而增加,3月则表现为MP>SO>ML;9月新检测出的反硝化细菌种数表现为SO(19种)>MP(13种)>ML(7种),说明这些反硝化细菌属的相对丰度对样地及季节变化(干湿季)较为敏感。处于恢复初期的ML群落内土壤nirS型反硝化细菌相对丰度变化最大,而处于恢复后期的SO群落变化相对较小,说明恢复年限对nirS型反硝化细菌的群落结构造成显著影响。洪璇[25]、Winter[26]等人认为,nirS型反硝化细菌群落结构会随着季节及所处的生境出现显著变化,且与生境中的含氮化合物的浓度密切相关。3个样地内均发现的罗思河小杆菌属、假单胞菌属、脱氯单胞菌属和贪铜菌属等nirS型反硝化细菌属,也在河口区[25]、水稻土[27]、湖泊底泥及森林土壤[13]中被发现,说明这些nirS型反硝化细菌属的生态幅较广。因此,热带森林区域季节的变换,会使得土壤nirS型反硝化细菌群落的丰富度随生态类型出现显著差异。 热带森林的恢复过程对nirS型反硝化细菌群落多样性产生重要影响。随着热带森林恢复年限的增加,土壤nirS型反硝化微生物群落多样性也逐渐增加,9月份MP、ML、SO样地的Shannon指数分别是3月份的2.28、2.20和1.48倍,说明恢复年限越高,其Shannon指数变化越小,nirS型反硝化微生物群落结构就越趋于稳定。随着恢复年限增加,植被盖度及郁闭度会逐渐增加,凋落物数量及质量也逐年累积,同时土壤温度及湿度等环境因子趋于稳定,在累积大量养分的同时刺激了微生物活性[14,28],使得高檐蒲桃群落的nirS型反硝化细菌的群落多样性最高,而白背桐群落最低。此外,处于恢复后期的崖豆藤群落和高檐蒲桃群落的稀释曲线位置及宽度接近,说明随着恢复年限的增加,热带森林群落土壤反硝化细菌的群落结构及多样性趋于相似。处于恢复后期的2个样地的土壤pH值及土壤有机碳、全氮及硝态氮含量相近,这为nirS型反硝化微生物提供了较为相似土壤理化环境,从而使得恢复后期的崖豆藤群落和高檐蒲桃群落的nirS型反硝化微生物群落结构及多样性趋于相似。但土壤有机碳、全氮及硝态氮等养分浓度仍存在差异,最终使得恢复后期的两个群落内的反硝化微生物具有一定的差异性。土壤pH、有机碳、全氮及硝态氮含量会刺激土壤养分有效性,显著影响热带森林土壤nirS型反硝化细菌的群落多样性[29- 31]。因此,热带森林恢复过程中形成不同的植物群落,会改变群落土壤理化环境,最终影响土壤nirS型反硝化细菌的群落多样性。 取样月份不同对不同恢复阶段的土壤nirS型反硝化细菌多样性影响显著。本研究表明,随恢复年限增加,9月份各样地Shannon指数比3月份平均增加将近2倍,且不同样地增加倍数差异显著,说明月份变化也会对不同恢复阶段的土壤nirS型反硝化细菌多样性造成显著影响。研究表明,西双版纳热带森林中干季(3月)的温度及降雨量显著低于湿季(9月),使得湿季微生物分解底物的有效性显著高于干季[23,32]。此外,热带森林中土壤温度年均变化不大,但土壤含水率会随季节出现显著变化,这导致土壤氧分压随含水率出现周期性波动,刺激土壤反硝化作用,促进土壤nirS型反硝化细菌的活性[33]。另一方面,随着恢复年限的增加,各种土壤碳(如微生物量碳、易氧化碳)、氮(如铵氮、硝氮)含量会在湿季(9月)大量积累,水分过多导致根系分泌物浸出也会使得土壤积累更多的含碳、氮类物质,使得即使在干季也能保持较高的反硝化细菌多样性[34];而在湿季,适宜的温度和水分使得微生物繁殖速率加快,最终使得9月的nirS型反硝化细菌多样性高于3月。因此,热带森林季节变化改变了不同恢复阶段的土壤含水率的时间分配,进而影响微生物栖息的土壤微环境,最终对土壤nirS型反硝化细菌产生重要影响。 本研究表明,土壤含水率、全氮、水解氮、铵态氮、硝态氮、微生物量碳及土壤有机碳随恢复年限增加而增加,且不同样地差异性显著(P<0.05),这与nirS型反硝化微生物的Shannon指数变化趋势一致,且与Shannon指数呈显著正相关,说明热带森林不同恢复阶段土壤理化性质变化对土壤nirS型反硝化细菌群落结构及多样性产生重要影响。随着热带森林恢复年限增加,植物枯枝落叶的输入量和积累量增加,处于恢复后期的热带森林土壤积累了更多的活性C、N养分,为反硝化细菌的生长和繁殖提供了更适宜的环境[16,20]。不同林型的枯落物的输入数量及质量,会改变土壤理化性质特征,且反硝化功能微生物与土壤理化环境因子间也存在着复杂的交互作用[13],最终使得处于不同恢复时长的群落土壤反硝化细菌的丰度和结构[20,23,32]出现显著差异。而处于恢复前期的热带森林群落,植被覆盖度低,群落内土壤温度、水分及土壤C、N养分波动剧烈,最终使得土壤反硝化微生物的活性低于恢复后期的热带森林群落。
3 讨论
3.1 热带森林恢复对nirS型反硝化细菌群落结构的影响
3.2 热带森林恢复对nirS型反硝化细菌群落多样性的影响
3.3 热带森林恢复过程中土壤理化环境变化对nirS型反硝化细菌的影响

4 结论

