罗非鱼寄生嗜丽鱼虫的形态描述及系统发育研究
2021-01-28容梦婕喀迪尔丁艾尔肯张文润郝翠兰
容梦婕,喀迪尔丁·艾尔肯,张文润,岳 城,郝翠兰
(新疆农业大学 动物医学学院,新疆 乌鲁木齐 830052 )
罗非鱼(Oreochromis)属鲈形目、慈鲷科,又称“非洲鲫鱼”,自然分布遍及非洲内陆及中东大西洋沿岸咸淡水地区,向北分布至以色列及约旦等地,因其适应性强、生长快、繁殖力高和食性广等特点,现已成为世界上养殖最广、推广最快的温水性鱼类。目前作为全球最大的罗非鱼养殖和出口国家[1-2],中国最初于1957年从越南引进了莫桑比克罗非鱼(O.mossambicus),随后引入其他罗非鱼进行养殖以及品种改良[3]。罗非鱼耐低氧、抗病力强,又多数属粗放养殖,因此与其他养殖鱼类相比发病较少。但随着密养与精养的出现,鱼病问题逐渐显露,而寄生虫性疾病是影响罗非鱼养殖发展的主要限制因素之一,尤其是单殖吸虫。
嗜丽鱼虫属(Cichlidogyrus)属锚首虫亚科,是寄生在慈鲷科鱼类中的主要单殖吸虫。据报道,世界上目前已知的嗜丽鱼虫有87种[4-9],其中75种寄生于慈鲷科鱼类[10]。在中国,对该属种的记录相对较晚。2006年吴相云等[11]在广东养殖的罗非鱼鳃上发现了2种单殖吸虫,分别为嗜丽鱼虫属的几丁嗜丽鱼虫(C.sclerosus)及盾形片虫属(Scutogyrus)的长角盾形片虫(S.longicornis),该记录在我国是新纪录属种。随后,在珠江[12]、澜沧江[13-15]及南方的天然水系[16]等地均有罗非鱼感染嗜丽鱼虫属的报道。这些报道均以鉴定单殖吸虫的后吸器和交接器等几丁质结构的形态鉴定为主,然而由于虫体个体较小,种类多,且常受到各种客观或主观因素的影响,如生长的生态环境和宿主不同,试验方法及观察角度不同等[17],仅依据形态学的特征难以对虫体进行正确的鉴别。随着分子生物学的日臻成熟,将DNA分子作为遗传标记的系统学弥补了传统分类学的不足,对虫种鉴定予以辅助,并且能为种间亲缘关系提供证据[18]。笔者旨在通过形态学和分子生物学相结合的方法,对在乌鲁木齐市市售罗非鱼鳃中采集到的2种锚首虫进行物种鉴定,以期明确该虫体的种类,并为该虫在分子系统进化方面积累资料。
1 材料与方法
1.1 样品的来源与处理
2018年11月—2019年5月,对新疆乌鲁木齐北园春市场市售鱼做寄生虫学调查期间,先后采集到罗非鱼82尾。将新鲜的鱼标本及时运送到实验室,经拍照、测量和称量质量等记录后,用常规的解剖法处死鱼类。而后取出完整的鱼鳃,置于培养皿中,将鱼鳃分离成单片,并用解剖针轻轻刮取黏液。在解剖镜下逐一检查,挑取虫体。发现寄生虫后将其吸取到盛有清水的小皿中,冲洗干净后,将其吸取到1.5 mL的EP管中,滴加体积分数75%和95%的乙醇溶液保存,分别用于标本制作和DNA提取。
1.2 形态学鉴定
在解剖镜下挑取形态完整的35只虫体逐一放置在载玻片上,制成水封片或用4%聚乙烯乳酸酚固定封片。在光学显微镜(Nikon E2000)下观察其几丁质结构,参照文献[19]的测量方法,通过EZ-MET软件测定后吸器及交接器中的几丁质结构,度量单位以微米计(括号前的数值为所测量标本的平均值,括号中为量度变化范围)。利用t检验比较测量结果平均数的差异是否显著。最后绘制特征图。所制虫体标本保存在新疆农业大学动物医学学院寄生虫教研室。
1.3 DNA提取
取95%乙醇固定的虫体样本若干只,再次冲洗后置于TE缓冲液(pH 8.0)中浸泡过夜后,吸去TE缓冲液,分别装入1.5 mL的EP管中,用TransGen动物组织基因组DNA提取试剂盒提取虫体DNA,在冰箱中-20 ℃保存,用于后续试验。
1.4 目的基因的PCR扩增及测序
3个基因的PCR反应体系相同,总体积为25 μL,2×Easy Taq PCR SuperMix 12.5 μL,1 pmol/μL上下游引物各1 μL,10 ng/μL的模板2 μL,ddH2O 8.5 μL。同时,以双蒸水代替模板DNA作为阴性对照。相关引物信息及PCR反应条件见表1。

表1 PCR引物及反应条件
PCR反应结束后,将扩增的产物经1%的琼脂糖电泳分析,切取目的条带,并用TransGen Biotech(全氏金)胶回收试剂盒进行纯化。纯化产物连接到pMD18-T载体上,再转入大肠杆菌(Escherichiacoli)DH5α感受态细胞中,LB平板培养,经PCR检测后每个样品选取2个阳性克隆送至生工生物工程(上海)股份有限公司进行测序。
1.5 序列比对及系统发育分析
测序结果,用DNASTAR软件包中的 SeqMan 软件对获得的基因序列进行校对和编辑,在DNAMAN 6.0软件中进行序列比对,计算序列间的差异百分比。在美国国立生物技术信息中心数据库中选取相似度较高的嗜丽鱼虫属28S rDNA及18S-ITS1-5.8S序列,并分别以Euryhaliotremafastig-atum和相似指环虫(Dactylogyrussimilis)为外类群,运用MEGA 7.0软件筛选出28S rRNA和18S-ITS1-5.8S rDNA的最大似然树最佳替换模型分别为K2+I+G和K2+G,根据其模型构建系统发育树并计算遗传距离进行分析。嗜丽鱼虫的COⅠ序列信息较少,因此未进行系统发育分析,所得的测序结果直接上传至GenBank数据库。
2 结 果
罗非鱼共采集82尾,除了在鳃丝上检出嗜丽鱼虫外,在其他内部的脏器组织和体表皮肤上,均未发现其他的病原体存在。嗜丽鱼虫的感染率为86.5%,每尾鱼感染1~35枚虫体,每片鳃感染1~10枚,平均感染强度为12.5。
2.1 形态学结果
2.1.1 几丁嗜丽鱼虫
形态描述:基于 12 个封片标本进行描述及测量。虫体体型较大(图1a),大小862.2(616.9~1185.9) μm×186.6(141.4~228.2) μm,头腺发达,具有1对眼点,后吸器与体前部区分不明显。后吸器含2对中央大钩、2根联结片及7对边缘小钩(图1b)。背中央大钩与腹中央大钩的形状、大小相近,内外突分化不明显,钩体深度弯曲且附有键带。背中央大钩(DG):全长a=31.8(29.2~33.3) μm,钩基部长b=32.2(34.2~29.8) μm,外突长c=4.5(3.5~5.0) μm,内突长d=2.3 μm,钩尖长e=12.1(9.6~15.7) μm。腹中央大钩(VG):全长a=31.6(29.8~34.3) μm,钩基部长b=32.7(30.4~34.3) μm,外突长c=5.4 μm,内突长d=3 μm,钩尖长e=12.8(10.3~15.7) μm。背联结片(DB)具2个“梨形”的耳状突起,中空:x=43.4(35.5~60.0) μm,y=15.6(10.1~18.6) μm,h=23.5(20.7~28.0) μm,w=13.7(11.7~14.9) μm。腹联结片(VB)呈“V”形,两端钝圆:x=45.3(37.2~54.2) μm,w=10.7(7.8~15.0) μm。边缘小钩(U)7对,大小基本一致,U=16.5(14.9~17.5) μm。
交接器(MA)较大,由交接管与支持器组成(图1c)。交接管长而圆拱,末端逐渐变得尖细,基部呈锯齿板状结构,近“扇形”。支持器膨大,有明显的肩部,末端“指状”弯曲。交接管(Pe)长63.9(51.9~73.4) μm,交接管基部(He)长13.8(11.3~16.0) μm,支持器(Ap)长67.9(55.8~92.1) μm。阴道不易见,轻微几丁质化。
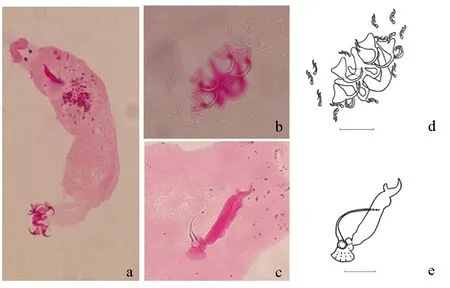
图1 几丁嗜丽鱼虫整虫(a)、后吸器(b、d)、交接器(c、e)Fig.1 Whole view of parasite C. sclerosusa (a), haptor (b and d), and copulatory organ(c and e) a、b、c.镜下图;d、e.手绘图;d.比例尺=50 μm; e.比例尺=25 μm. a, b and c.image under a microscope; d and e.hand drawing; d.scale bar=50 μm; e.scale bar=25 μm.
2.1.2 彼丽嗜丽鱼虫(C.mbirizei)
形态描述:基于23个封片标本进行描述及测量。虫体呈“纺锤形”(图2a),大小660.5(305.8~855.5) μm×96.3(49.8~152.8) μm,头腺有3~4对,眼点一对。咽部球形,后吸器为圆形,有2对中央大钩、2根联结片和7对边缘小钩(图2b)。背、腹中央大钩大小相近,内外突分化明显,钩尖弯曲。背中央大钩(DG):全长a=48.7(45.1~54.3) μm,钩基部长b=45.4(37.7~55.4) μm,外突长c=6.3(3.7~13.7) μm,内突长d=10.1(3.7~18.4) μm,钩尖长e=15.9(13.2~18.2) μm。腹中央大钩(VG):全长a=46.2(40.5~51.1) μm,钩基部长b=40.2(34.8~47.4) μm,外突长c=4.8(2.1~10.0) μm,内突长d=10.5(2.4~18.2) μm,钩尖长e=14.7(11.3~17.5) μm。背联结片(DB)拱形,具2个耳状突起,中空:x=48.8(38.4~62.7) μm,y=21.5(17.1~27.2) μm,h=24.9(19.9~31.6) μm,w=13.9(10.1~17.3) μm。腹联结片(VB)呈“V”形,弯曲程度大,近锐角,两侧末端钝圆且在前缘有凹陷:x=32.2(24.8~63.2) μm,w=8.6(5.6~11.1) μm。边缘小钩(U)7对,其中第4、5对边缘小钩相对较大U(Ⅳ~Ⅴ)=24.6(16.5~31.2) μm,其他的大小基本一致,U(Ⅰ~Ⅲ、Ⅵ~Ⅶ)=18.3(12.6~26.2) μm。
交接器(MA)由交接管与支持器组成(图2c),交接管非常长且细,基部球形并有椭圆形的膜状腺体。管状支持器,远端分裂出两个明显的钝圆凸起,基部结构宽而扁,形同“麻叶”。交接管(Pe)长177.7(80.2~255.0) μm,交接管基部(He)长17.2(9.1~19.4) μm,支持器(Ap)长48.4(35.5~68.5) μm。阴道(Vg)可见,细且呈螺旋状卷曲。
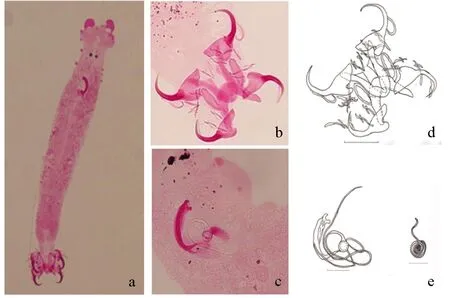
图2 彼丽嗜丽鱼虫整虫(a)、后吸器(b、d)、交接器(c、e)Fig.2 Whole view of parasite C. mbirizei (a), haptor (b and d), and copulatory organ(c and e) a、b、c.镜下图; d、e.手绘图; d.比例尺=50 μm; e.比例尺=25 μm. a, b and c.image under a microscope; d and e.hand drawing; d.scale bar=50 μm; e.scale bar=25 μm.
2.2 分子生物学结果
2.2.1 PCR扩增结果
几丁嗜丽鱼虫(MJ 12)和彼丽嗜丽鱼虫(MJ 23、MJ 33)样品的3个基因区段全部扩增成功。其中,28S基因片段长度均为863 bp,18S-ITS1-5.8S扩增片段长度分别为1019 bp和1005 bp,COⅠ基因扩增的片段长度分别为592 bp和572 bp。2种嗜丽鱼虫的基因序列均已上传至GenBank(MN078042、MN078060、MN905938、MN905939、MN905506)。
2.2.2 数据库比对结果
对样品几丁嗜丽鱼虫(MJ 12)和彼丽嗜丽鱼虫(MJ 23、MJ 33)的28S rDNA序列进行BLAST分析比对,结果几丁嗜丽鱼虫(MJ 12)与GenBank上发表的来自中国(DQ157660.1)、捷克(MH767401.1)的几丁嗜丽鱼虫序列的相似性分别为99.8%和100%,GC含量为49.6%;彼丽嗜丽鱼虫(MJ 23、MJ 33)与来自巴西(MG030378.1)的彼丽嗜丽鱼虫序列的相似性达99.6%,与刀茎嗜丽鱼虫(C.cirratus)相似性为99.3%,GC含量为50.6%。18S-ITS1-5.8S基因序列经BLAST比对分析,发现几丁嗜丽鱼虫(MJ 12)与来自巴西(KX869722.1)、捷克(MH767390.1)及中国(DQ537359.1)的几丁嗜丽鱼虫的相似性均在99.5%以上,彼丽嗜丽鱼虫(MJ 23)与巴西(MG030376.1)、芬兰(MG973076.1)的彼丽嗜丽鱼虫序列相似性分别为100%和94%,与捷克(HE792784.1)采集的刀茎嗜丽鱼虫相似性为99.6%。
2.2.3 系统发育分析
在基于28S rDNA序列的最大似然树(图3)中,所有种类的嗜丽鱼虫都独立形成一个分支,几丁嗜丽鱼虫(MJ 12)与其他几丁嗜丽鱼虫聚为一支,自举值为99%;彼丽嗜丽鱼虫(MJ 23、MJ 33)与彼丽嗜丽鱼虫及刀茎嗜丽鱼虫聚为一支,且拓扑结构稳定。遗传距离矩阵显示,分析所用的嗜丽鱼虫种间的遗传距离在0.005~0.079,种与种之间较为相近,与盾形片虫属的属间距离为0.044~0.084。本试验所得的几丁嗜丽鱼虫(MJ 12)的28S rDNA序列与来自两个地区的几丁嗜丽鱼虫之间的距离均为0.000。彼丽嗜丽鱼虫(MJ 23、MJ 33)与彼丽嗜丽鱼虫、刀茎嗜丽鱼虫两两之间的遗传距离也均为0.000,而与其他种的遗传距离为0.021~0.064。
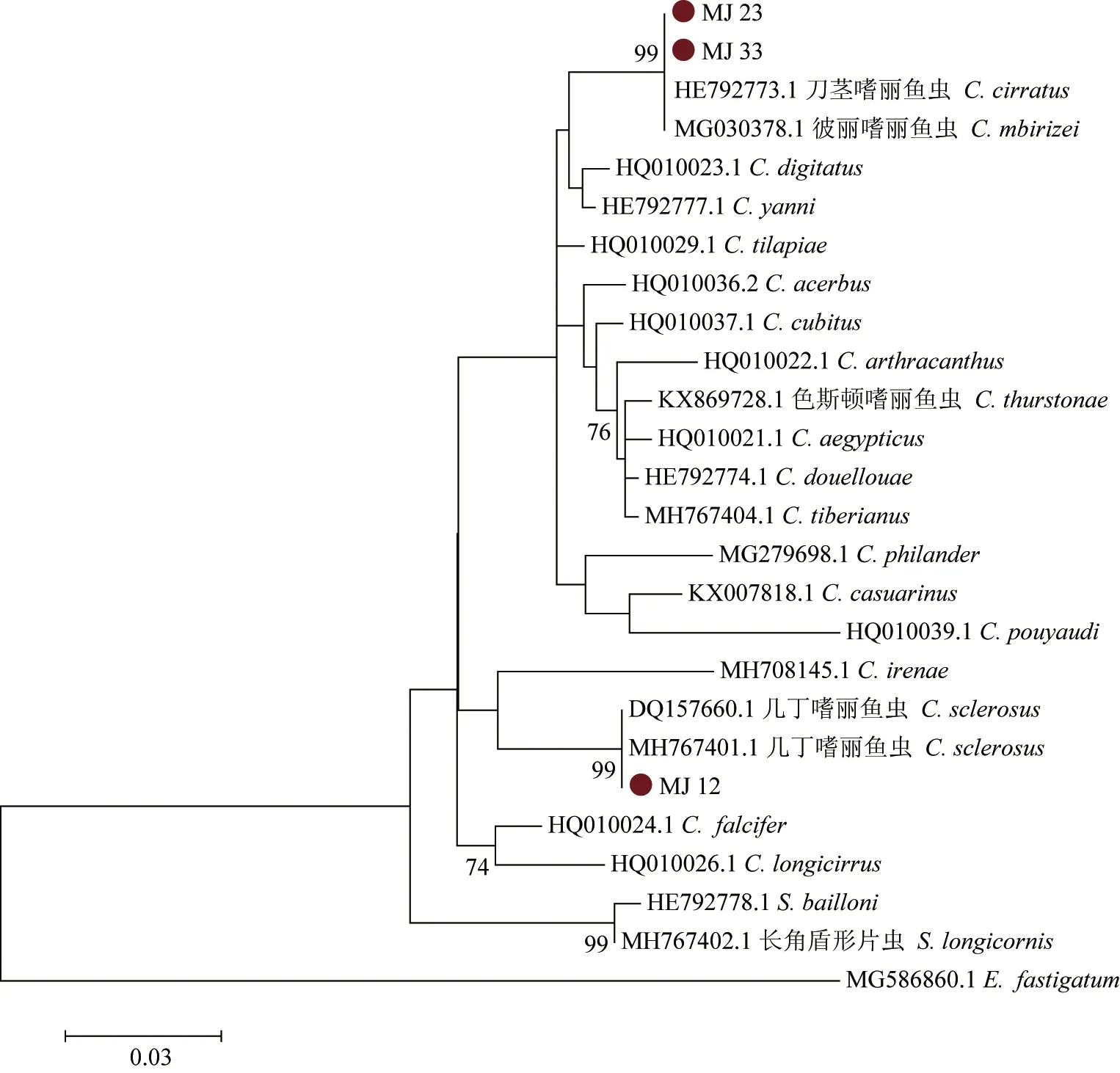
图3 基于28S rDNA序列构建的罗非鱼寄生嗜丽鱼虫最大似然法系统发育树Fig.3 Phylogenetic tree of parasitic Cichlidogyrus in tilapia based on 28S rDNA sequences by the ML method
基于18S-ITS1-5.8S rDNA序列所构建的最大似然树(图4),其结果与28S 序列的结果相一致。同时,从遗传距离矩阵可以看出,嗜丽鱼虫的种间距离为0.010~0.152,几丁嗜丽鱼虫(MJ 12)与几丁嗜丽鱼虫间的距离为0.000,彼丽嗜丽鱼虫(MJ 23)与彼丽嗜丽鱼虫和刀茎嗜丽鱼虫之间的遗传距离分别为0.000和0.003。这与形态学结果相同,并且彼丽嗜丽鱼虫和刀茎嗜丽鱼虫可能是同一种。
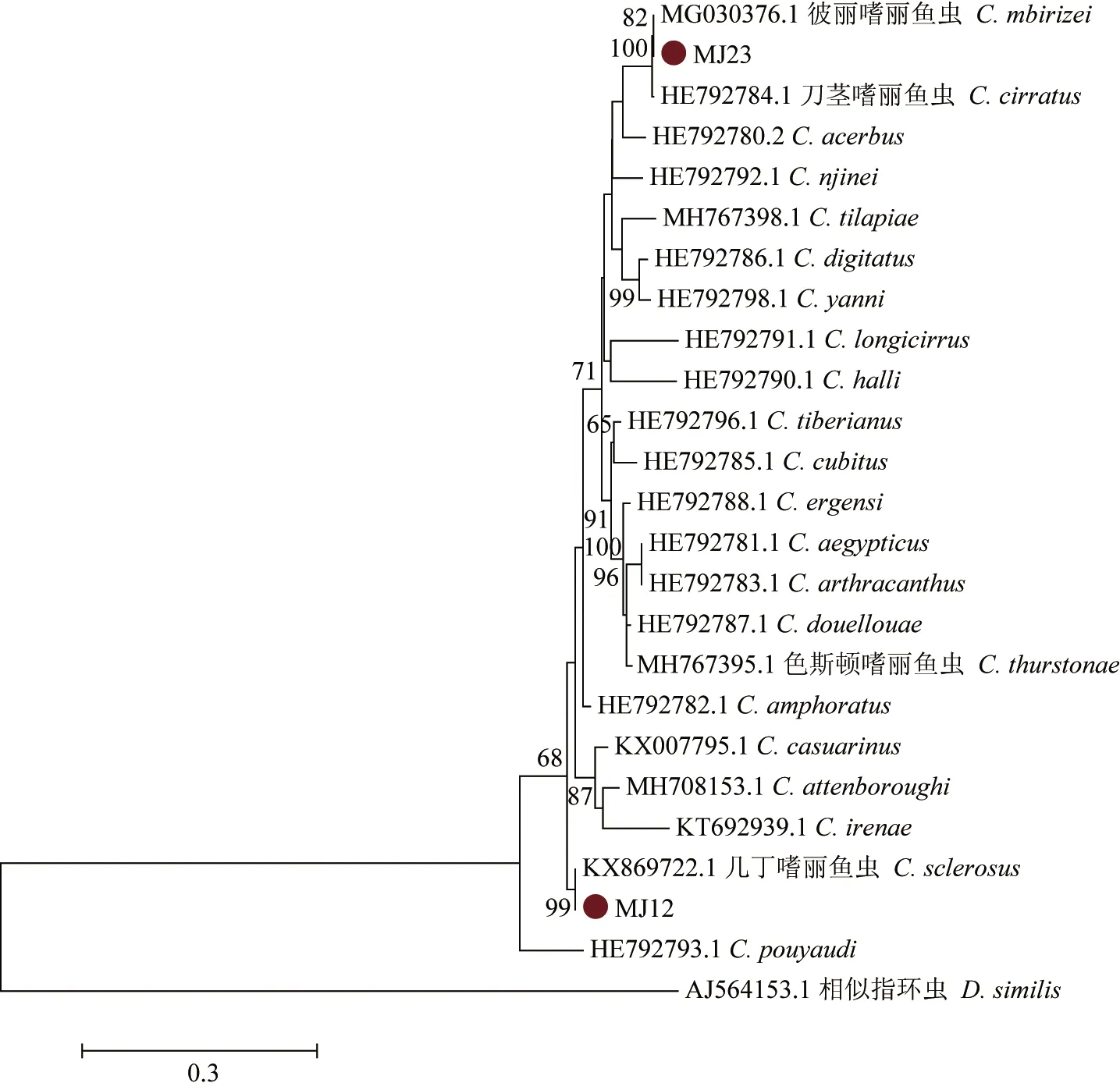
图4 基于18S-ITS1-5.8S rDNA序列构建的罗非鱼寄生嗜丽鱼虫最大似然法系统发育树Fig.4 Phylogenetic tree of parasitic Cichlidogyrus in tilapia based on 18S-ITS1-5.8S rDNA sequences and the ML method
3 讨 论
3.1 罗非鱼上寄生两种嗜丽鱼虫的形态鉴定
嗜丽鱼虫属是寄生在慈鲷科鱼类中物种最丰富的单殖吸虫。一般来说,单殖吸虫具有较强的宿主特异性,但该属对寄生宿主的专一性不强,在大多数情况下,属于广泛性寄生(寄生在多种宿主上),也存在在单一宿主上寄生多种嗜丽鱼虫的现象。其中罗非鱼是其广泛寄生的宿主,约有1~20种虫子寄生于同一种宿主上[10]。因此,宿主的分类地位不能作为嗜丽鱼虫分类鉴定的依据。与一般的单殖吸虫一样,嗜丽鱼虫属的种间分类依据主要是几丁质结构(包括后吸器和交接器)的形态学特征。
几丁嗜丽鱼虫分布广泛,在很多国家或地区均有罗非鱼感染该虫的报道,如南非[23]、肯尼亚[24]、乌干达[25]、日本[26]、墨西哥[27]等。本试验所发现的几丁嗜丽鱼虫在形态和测量值上与Paperna等[28]的原始记录一致,并且基于28S和18S-ITS1-5.8S序列的进化树及遗传矩阵均表明,本试验发现的虫体之一为几丁嗜丽鱼虫。
彼丽嗜丽鱼虫最早由Bukinga等[7]在非洲坦噶尼喀湖的罗非鱼鳃部采集并记录,而后在泰国[29]进行了重新描述。本试验通过直观的形态图比较,发现在新疆采集的彼丽嗜丽鱼虫(图5a)与原始记录中(图5b)的部分结构略有不同,主要表现在:前者腹连接片的弯曲程度大,呈现出弧度约75°的锐角,而后者腹连接片较平,呈钝角的“V形”;新疆采集的彼丽嗜丽鱼虫支持器基部扁而宽,而在原始记录里,该虫的支持器基部较窄,并附着在交接管“球状”的基部上。这些结构的差异可能是因为发育和寄生虫对宿主或局部环境的适应而发生的变化[30],也可能是由于虫子处在不同的伸缩状态,造成连接片的弯曲差异。
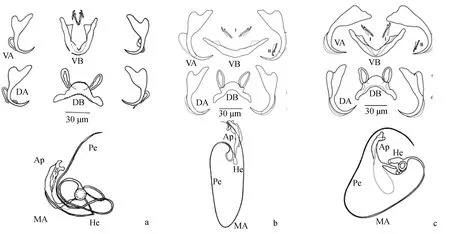
图5 彼丽嗜丽鱼虫(a、b)和刀茎嗜丽鱼虫(c)的几丁质结构比较Fig.5 The comparison of chitinous structure between C. mbirizei (a and b) and C. cirratus (c) DB.背联结片;DA.背中央大钩;VB.腹联结片;VA.腹中央大钩;MA.交接器;Ap.支持器;He.基部;Pe.交接管. DB.dorsal transverse bar; DA.dorsal anchor; VB.ventral transverse bar; VA.ventral anchor; MA.male apparatus; Ap.accessory piece; He.heel; Pe.penis.
在彼丽嗜丽鱼虫的原始描述中,提出了该虫形态与刀茎嗜丽鱼虫(图5c)形态相似,但通过交接器的形态易区分二者,主要体现在支持器和阴道的部分结构不同。而Zhang等[16]通过电镜下扫描观察,提出刀茎嗜丽鱼虫和彼丽嗜丽鱼虫之间,支持器的形态差异可能是由于观察的角度不同所造成的,刀茎嗜丽鱼虫与彼丽嗜丽鱼虫可能为同物异名。笔者对两者的结构图及其形态测量值做了对比(表2),结果形态相近,测量值除交接管及支持器有略微差异外(P<0.05),其余结构的测量值基本一致(P>0.05),这与Zhang等[16]的结果一致。
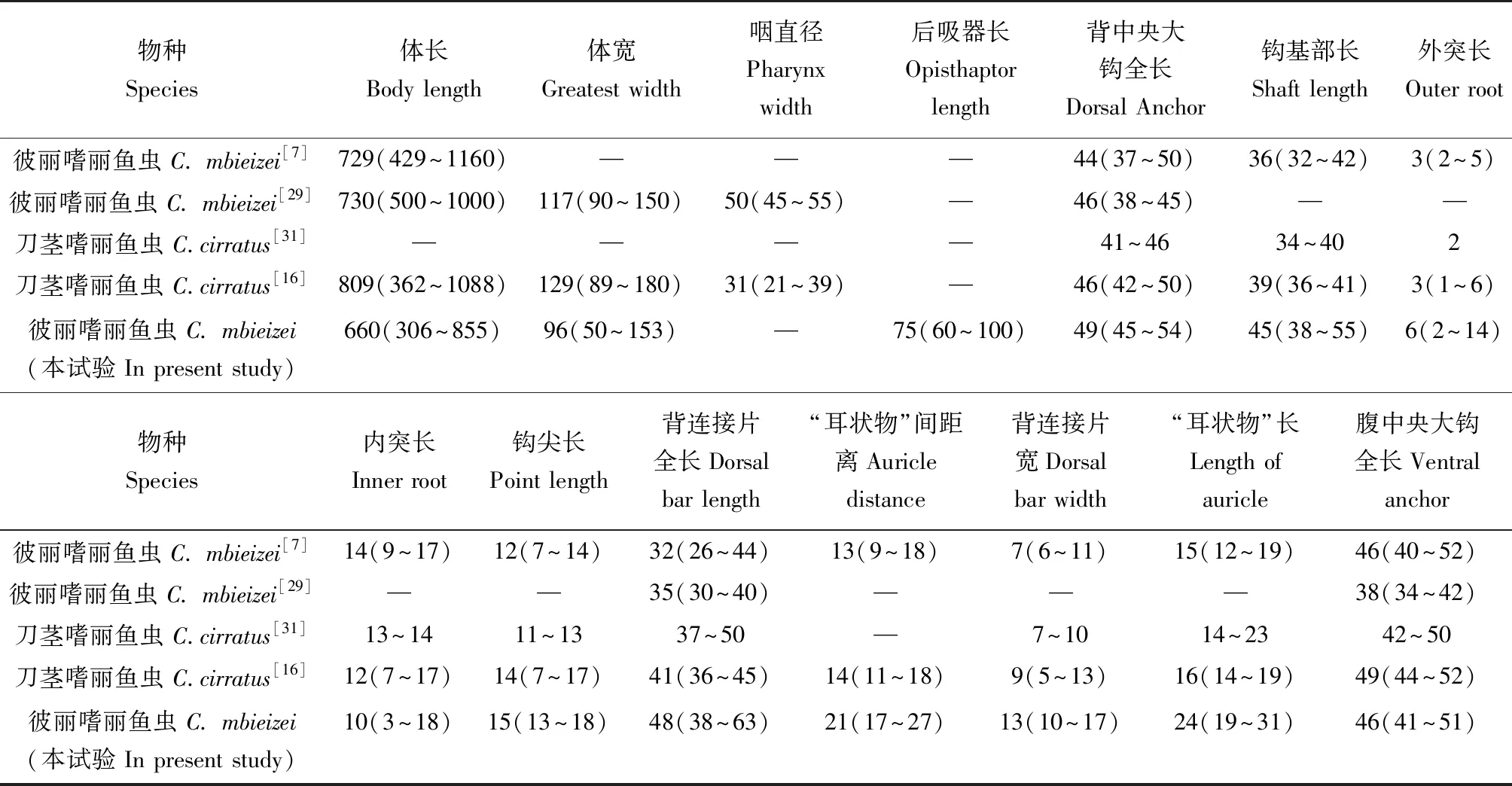
表2 已报道罗非鱼寄生彼丽嗜丽鱼虫及刀茎嗜丽鱼虫的形态测量结果比较 μm
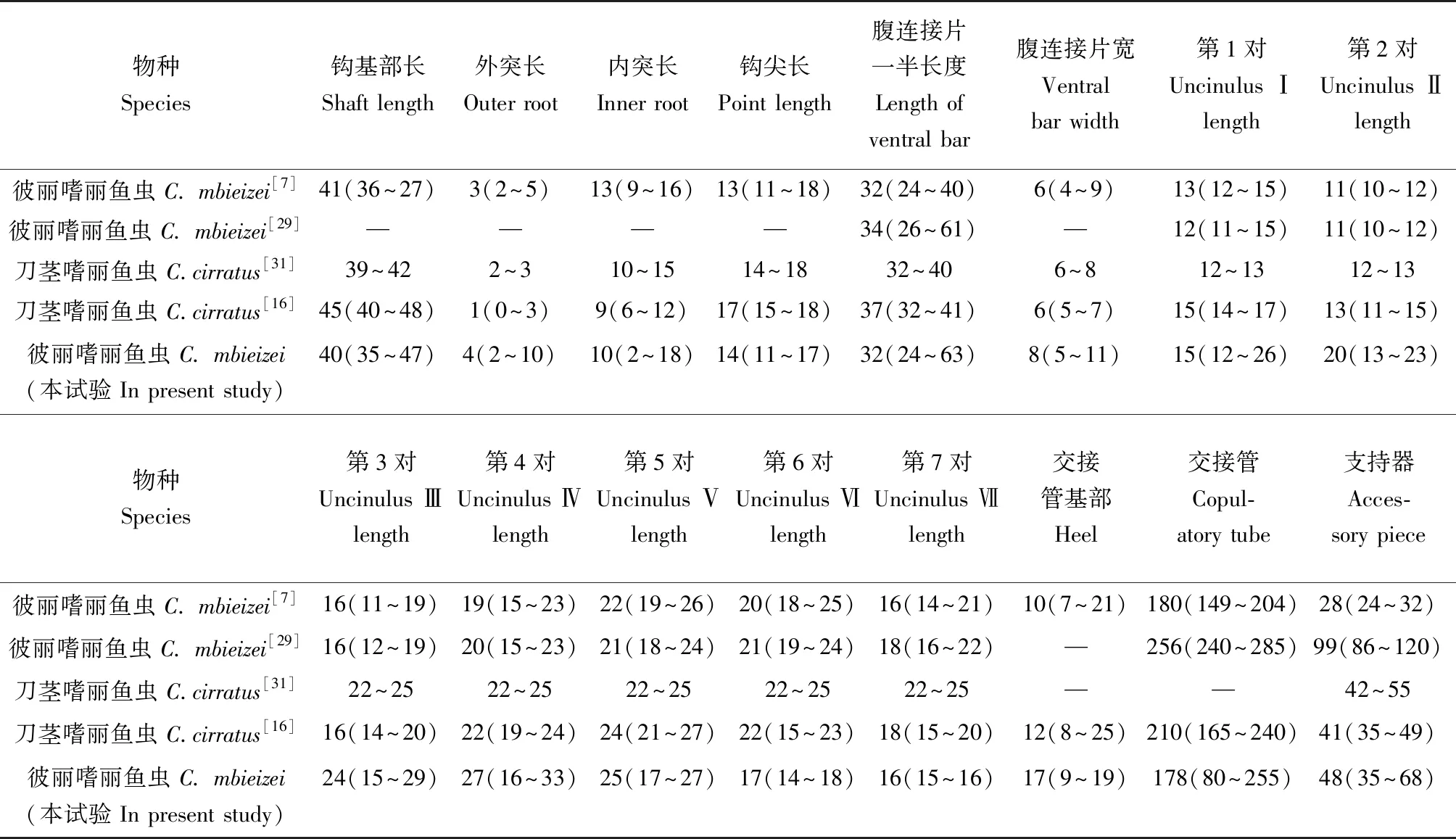
(续表2)
3.2 罗非鱼上寄生两种嗜丽鱼虫的分子生物学鉴定
本试验选取了常用来解决属内种间系统发育关系[18]的28S及用于种间鉴定的18S-ITS1-5.8S核糖体RNA,进一步进行虫种鉴定。美国国立生物技术信息中心数据比对及系统发育树的结果表明,所采集的两种嗜丽鱼虫样品分别为几丁嗜丽鱼虫和彼丽嗜丽鱼虫,其结果与形态学结果相一致。与此同时,根据系统发育树结果进一步探究了彼丽嗜丽鱼虫与刀茎嗜丽鱼虫之间的关系。两个分子遗传标记均显示,本试验采集的彼丽嗜丽鱼虫与巴西的彼丽嗜丽鱼虫的同源性在99.5%以上,与捷克的刀茎嗜丽鱼虫的同源性达99%,且遗传距离非常近,而与其他的嗜丽鱼虫遗传距离较远,这与形态学特点相符。因此,笔者支持彼丽嗜丽鱼虫与刀茎嗜丽鱼虫为同物异名的说法。
4 结论与展望
本试验结合形态学和分子生物学方法,鉴定出采自乌鲁木齐市周边市场及养殖场的罗非鱼上寄生的两种嗜丽鱼虫分别为几丁嗜丽鱼虫和彼丽嗜丽鱼虫。同时,经证明彼丽嗜丽鱼虫与刀茎嗜丽鱼虫为同物异名。
近年来,随着罗非鱼产量逐年增长以及国际市场需求量不断扩大,我国罗非鱼进、出口量飞速增加[32]。罗非鱼因其味美价廉,深受消费者和养殖者的喜爱。然而,单殖吸虫病是淡水鱼类水产养殖中引起鱼类死亡的原因之一。嗜丽鱼虫主要利用其后吸器附着在鱼类的鳃部,吮吸鱼鳃部血液、黏液,导致鱼类鳃组织局部或全面损伤,从而引入其他病原生物的入侵而形成炎症,宿主食欲下降,生长迟缓,严重时可致鱼类大批死亡。据报道,原产地罗非鱼鳃上寄生的单殖吸虫种类较多[12]。我国自2006年在广东养殖的罗非鱼鳃上发现了两种嗜丽鱼虫之后,陆续在珠江、澜沧江等不同水系均有不同嗜丽鱼虫感染罗非鱼的报道,并且有些优势虫种的感染率高达100%。此外,当引进的鱼中携带有寄生虫,在养殖过程中罗非鱼误入或投放到天然水域中,其所携带的寄生虫也随着宿主进入到相应的水域环境里,这有可能影响和感染本地的其他鱼类,造成一定的经济损失,并且极有可能影响和改变当地鱼类的寄生虫区系,这一问题是非常值得关注的。
