对高中化学增加“反应历程”内容特殊意义的思考
2021-01-22唐隆健
唐隆健


摘要: 新版高中化学课程标准首次将“化学反应历程”纳入教学。认为增加反应历程内容具有多重特殊意义,为相关教学和命题提供参考: 一是进一步丰富和深化认识化学反应的视角,纠正教学中对化学反应某些想当然的错误认知;二是蕴含大量生动的学科核心素养;三是本内容紧扣现代化学研究前沿,有利于激发学生的学术研究志趣;四是本内容在化工生产等领域具有广泛的应用价值。强调在教、学、评时应对本内容把握好深广度,建议在符合新课标要求的前提下因材施教,使其教学价值最大化。
关键词: 反应历程; 基元反应; 教学价值; 教学建议
文章编号: 1005-6629(2021)10-0087-05
中图分类号: G633.8
文献标识码: B
1 问题提出
《普通高中化学课程标准(2017年版2020年修订)》最大的特点除明确提出学科核心素养、增加选择性必修模块外,还以学科大概念为统领对学科内容进行了优化重组、删减增补。在学科内容增补方面,具有代表性且值得关注的是在选择性必修1《化学反应原理》的内容要求中明确提出:“知道化学反应是有历程的,认识基元反应活化能对化学反应速率的影响,知道催化剂可以改变反应历程”[1]。即“化学反应历程”的部分内容首次由大学下移至高中阶段,目的是更好地丰富学生认识化学反应的动力学视角。这一内容的增加,充分体现了化学新课标设计者与时俱进的眼光,也体现了一种更加科学的课程观——在化学基础教育阶段,增加看待化学问题的视角和维度远比抠细节挖深度要紧。目前,关于这一新增内容的教学研究尚少,笔者仅在吴星教授主编的书中见到一篇相关文章,谈到在高中化学引入“反应历程”的意义主要是: 建构化学学科结构化知识的内在需要,帮助学生建立“化学反应是有历程的”认识角度,帮助学生更加准确地认识“基元反应活化能”概念[2]。笔者在此基础上,进一步细化和挖掘这一新增内容的特殊意义,以期对相关教、学、评有所助益。
2 化学反应历程教学内容的特殊意义
2.1 拓展认识化学反应的视角和维度
从学生长远发展看,培养其独特的学科视角比掌握具体知识更具迁移价值。看待化学反应通常有热力学和动力学两大视角。热力学视角主要包括反应的能量变化、方向和限度,动力学视角主要包括反应速率和反应历程。化学反应在微观上往往是按一定路径分多步完成,其中的每一步反应称基元反应,由基元反应构成的反应序列(路径)称反应历程或反应机理(注: 后面统一用“反应历程”一词)。由多个基元反应构成的总反应称复杂反应或总包反应,典型的复杂反应有链反应(如燃烧)、可逆反应(对峙反应)、平行反应(竞争反应)、连续反应(连串反应)等[3,4]。实际反应多为复杂反应,基元反应很少。
遗憾的是,新课标之前高中阶段在化学动力学方面只强调反应快慢而缺失了“反应历程”这一重要视角,导致学生往往只能从静态的总反应方程式看到反应的始末态,而无法深刻理解反应的全貌和细节,甚至带来诸多误解。因为化学方程式只告诉我们反应物和产物及其计量关系,并不能告诉我们从反应物到产物的微观路径(如CH4与Cl2的取代反应,若不知其自由基取代反应机理,便难以理解会有乙烷生成)。中学阶段因缺失反应历程视角而常犯的错误有:
(1) 误以为催化剂不参加反应。尽管催化现象发现很早,但其机理本质在历史上相当长时间一直认识模糊。中学阶段,有些师生也因催化剂不改变反应的热力学状态且最终不被消耗而误以为它不参加反应。虽然现在人们对很多反应的催化机理仍不很清楚,但有一点早已形成共识,即催化剂参与反应并改变了反应历程,它可与反应物生成某种不稳定的中间化合物而降低反应活化能。催化剂参与反应有很多直接证據,如固体催化剂在反应前后尽管化学性质和质量都不变,但其形貌往往有明显改变(催化NH3氧化的铂丝网用几个星期表面会变粗糙)[5]。在溶液或气相等均相催化反应中,往往可通过超短脉冲激光等飞秒级手段使人们像观看“慢动作”那样捕捉到催化剂参与形成的瞬息万变的反应中间体。又如,在Fe3+催化H2O2分解时,细心的实验者可觉察到,因含铁过渡态物质形成而使溶液颜色发生的细微异常变化(反应初始颜色比氯化铁溶液本身还深,反应快结束时颜色又逐渐变浅,反应终止时变为与加等体积水稀释等量Fe3+一样浅)。事实上,以“过渡态理论”为基础的现代催化理论正是在人们认识到反应历程后才建立的。
(2) 误以为反应物中的某微粒或基团不参与反应。如活泼金属与盐酸反应,单从反应的方程式(尤其是离子方程式,比如Mg+2H+Mg2++H2↑)通常看不见Cl-的作用,然而实验事实表明Cl-也参与并加快了反应,关于Cl-的作用机理已有“活化金属、破坏氧化膜、配位作用”等说法[6]。又如酯化反应,若无反应历程视角而仅从总反应的方程式看,会误以为羧酸中的羰基不参与反应,而事实是: 一般酯化反应历程的第一步就是羧酸中的羰基氧质子化并形成碳正离子,继而醇亲核进攻正碳再依次脱去H2O和H+形成酯,因此很多酸都能作为该反应的催化剂(为第一步反应提供H+)[7]。值得注意的一个现象是,常有教师为帮助学生直观理解反应过程而想当然地根据总反应的方程式制作出微观动画模型或演示球棍模型,并未查阅其实际反应历程,这将会给学生一个误导: 以为仅通过总反应式就能看出反应的微观历程,这一点当引起警惕。
(3) 误以为反应物浓度增大一定加快反应。如CO+NO2CO2+NO,若认为增大CO浓度一定加快反应完全是异想天开,因为它并非基元反应,在温度不太高时是一级反应,速率与NO2浓度呈正比但与CO浓度无关。又如,NH3在钨催化剂表面的分解(2NH3N2+3H2)也非基元反应,当催化剂表面被NH3饱和以后,该分解为零级反应,继续增大NH3浓度对速率亦无影响[8]。因此,通常教材在表述浓度对反应速率的影响规律时,都严谨地加有“对多数反应”“一般情况”等限定语。
(4) 误解“反应进程—能量”示意图和活化能。一些教师常随意画出任意反应的“反应进程—能量”示意图(往往只画一个能量峰),并在此基础上解说活化能与焓变。殊不知,反应过程的能量变化图仅对基元反应才有明确意义,只有基元反应的反应物和产物间才只有一个能量峰,也只有基元反应的活化能才有明确物理意义——反应物分子的平均能量与处于过渡态的活化络合物分子平均能量的差值,总反应的活化能是各基元反应活化能经数学处理得到的(也称表观活化能),其物理意义目前科学家还在探索中[9]。比如,高中常见的非基元反应2NO+O22NO2,就因其表观活化能为负值,故升温反应速率反而下降[10]。
综上可见,在高中阶段适当增加“反应历程”内容非常必要,可极大地拓展认识反应的视角和维度,纠正对化学反应诸多想当然的误解,还为学有余力的学生进一步理解某些化学反应疑难问题开了一个窗口。
2.2 蕴涵丰富生动的学科核心素养
“化学反应历程”内容除了具有拓展认识反应视角和完善化学动力学知识结构外,还蕴含了丰富的学科核心素养。
(1) 彰显宏观辨识与微观探析。总反应的方程式仅能表示一个反应宏观的热力学结果和物质间的计量关系,而“反应历程”则进一步从微观上揭示了反应是如何分步进行的,以基元反应为对象的碰撞理论、过渡态理论都是从微观上认识反应过程的。而且,反应历程往往还能反映出物质微观结构和反应性能间的关系,从而强化结构决定性能和反应的学科素养。从学科发展角度看,“反应历程”的研究和相关实验技术的飞速发展已使化学动力学从过去只关注反应速率的宏观层面转向了越来越重视反应微观细节的微观反应动力学(又称分子反应动力学),即真正从单个分子的微观结构和特定量子态出发,在分子水平上深刻认识反应的过程机理[11]。这些内容的了解,能使学习者更好地从宏微结合的完整视角认识反应。
(2) 突出证据推理与模型认知。“化学反应历程”内容蕴含丰富的证据推理与模型认知素养,比如,碰撞理论和过渡态理论等经典速率理论都是针对基元反应而建立起的描述反应历程的理论模型,其中过渡态理论针对基元反应建立了如下具体认知模型: A+B—C[A…B…C]→A—B+C,其中[A…B…C]表示旧键欲断未断、新键欲成未成且能量较高的活化络合物(即反应的过渡状态)。又如,在猜测和提出一个反应可能的机理时,不但要发挥想象力,更要充分结合事实证据,且最终机理是否正确还要继续接受实验审判(一个反应机理是否正确的必要条件就是由这个反应机理推导出的速率方程要符合实验事实)。
(3) 强调科学探究与创新意识。如上所述,反应历程的确定往往需要利用各种仪器设备进行大量实验(如测定活化能和速率常数等关键动力学参数、捕捉反应的瞬时中间物种等),同时要结合实验证据进行大胆推理假设,且最终不一定正确,可谓“科学知识只是暂时性真理”的典型代表。所以,至今已完全弄清的反应历程并不多,而且有些过去认为是对的反应历程,随着更多事实的获取又被推翻。如H2与I2的反应,曾在长達半个多世纪由于其表观速率方程的迷惑而误以为是基元反应,后来结合量子力学和新的实验事实使人们认识到这可能是一个由单分子反应、双分子反应和三分子反应连串的复杂反应,但近年又有化学家根据新的事实提出了新的反应历程[12]。可见,真正揭秘一个反应的微观历程往往需要不懈的努力探究,要在尊重事实的前提下敢于不断破旧立新,这其中所蕴含的科学精神令人起敬。
总之,“化学反应历程”内容蕴含大量的学科核心素养方面的题材,对这一教学维度和教学价值的关注与挖掘,有利于更好地实现学科育人。
2.3 紧扣现代化学研究前沿
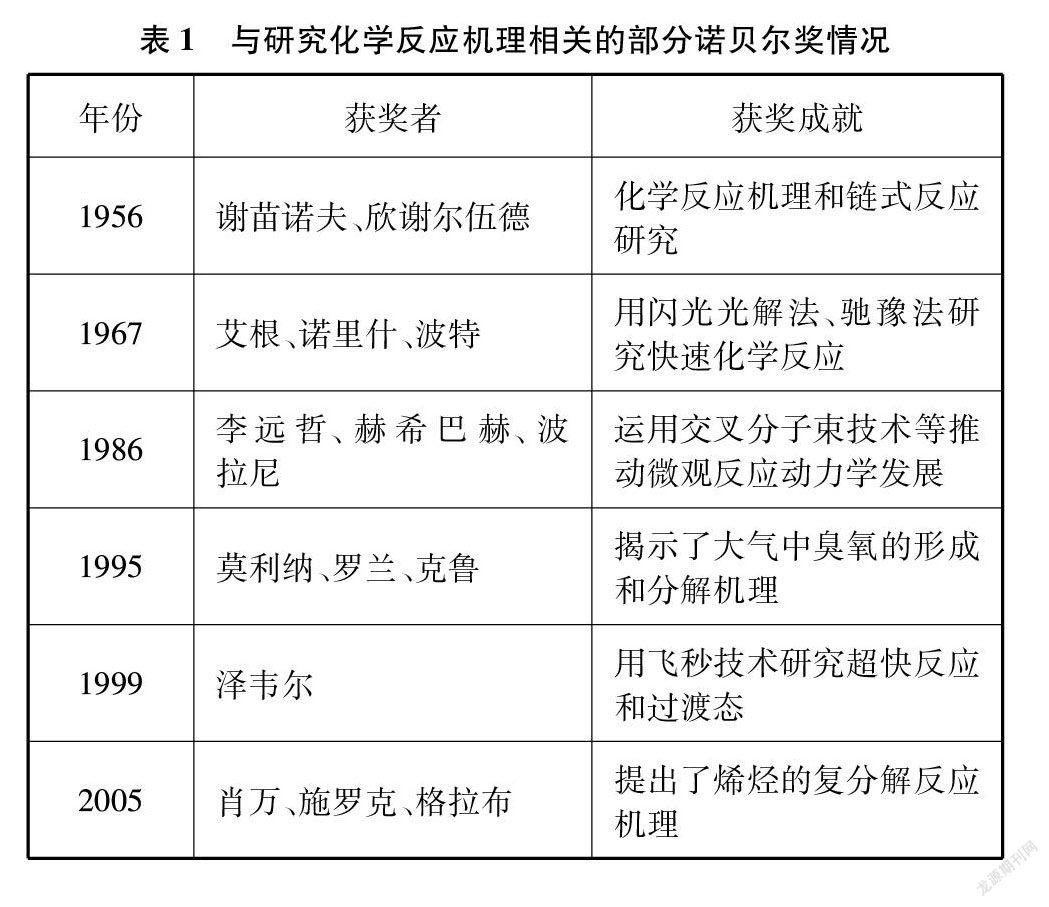
化学动力学发展整体晚于热力学,目前仍方兴未艾。有关反应历程研究的艰难缓慢境况,直到近代将闪光光解法(测定自由基等瞬时存在物种)、交叉分子束(侦测反应中的分子碰撞现象)、激光技术(如用飞秒超快“摄像机”对反应动态过程拍照)、量子化学(如计算反应物过渡态和中间物结构能谱)及先进谱学技术等应用于化学动力学研究后才得到好转[13]。可见,反应历程研究往往涉及大量跨学科前沿技术。事实上,反应历程研究一直是化学发展的前沿,徐光宪等化学家曾提出现代物理化学的三大前沿领域是: 分子反应动力学、分子工程学、表界面物理化学[14]。到目前为止,在反应历程领域诞生的诺贝尔化学奖得主已达10余人(见表1)[15],其中特别值得一提的是1956年获奖的欣谢尔伍德和谢苗诺夫,他们首次系统地研究了链式反应并指出化学反应历程具有普遍重要意义,从而促进了人们对复杂化学过程的认识。展望未来,无论是实验技术的革新还是应用领域的拓展,化学反应历程研究都显示了蓬勃的生命力,比如国家自然科学基金委在“十三五”期间遴选出的化学科学部优先发展的13个领域中,至少有“化学精准合成、高效催化过程及其动态表征、化学反应与功能的表界面基础研究、分子选态与动力学控制”等4个领域与化学反应历程密切相关。当然,这也为未来化学家提出了更多挑战(毕竟当前化学动力学的成熟度仍远不及化学热力学),这些都可作为激发有志学生将来投身相关领域研究的育人素材。
2.4 在化工生产等领域实用价值巨大
一些新的化学反应历程的揭示往往会极大地促进化学化工、生命医药、材料能源和环境保护等重要领域的发展。比如表1中,科学家通过对平流层O3分解机理的揭示(氯氟烃光解产生的氯自由基通过改变O3分解反应历程而加快其分解),有效阻止了臭氧层的继续破坏(如对氟利昂的限用及其替代品的开发等);烯烃复分解反应机理的提出催生了更高效、绿色的有机合成新路径,促进了新药物和先进聚合物材料的研发。又如在实际化工生产中,由于热力学不考虑时间因素,达到平衡可能需很长时间,因此很多化工反应并未达到平衡(往往通过反应物循环利用提高转化率),通常更关注速率、成本和安全等,而弄清其反应历程和速率方程就可找到调控反应速率的关键,从而在生产中实现“多快好省”。如工业制H2SO4的关键反应SO2+1/2O2SO3并非基元反应,其实际速率方程为v=kp(O2) p-1(SO2),因此增大SO2分压反而会降低正反应速率[16],这对实际化工生产显然具有重要指导意义。再如反应历程研究对链式反应机理的揭示,能使人们更好地认识燃烧、爆炸的机制,从而在工业实际中更科学、安全地控制燃烧和爆炸过程。此外,科学家们通过研发新型催化剂而改变反应历程、提高反应选择性、降低能耗的例子更是不胜枚举。
可见,化学反应历程与化工、材料、医药、环境等重大领域密切相关,实用性极强,对这些内容的了解能更好地让学生感受化学“学以致用”的魅力,进一步激发学科兴趣。
3 关于本内容的教学建议
3.1 遵循新课标要求,把握好深广度
虽然“化学反应历程”内容具有上述多重教学价值,但绝非将大学相关内容完全下移到高中。新课程标准中相关的内容要求属于简单的“输入性学习要求”(即属于“知道”层次,不作更高学业要求),其教学目的主要是帮助学生建立“化学反应是有历程的”认识视角,从而对化学反应及催化剂、活化能等理解更准确,并不要求掌握某个反应的具体历程和速率方程等深层细节[17],本文的有关拓展介绍也主要是为教师教学提供参考。目前,不同高中教材对该内容介绍的程度差异也较大,人教版相对简单,而鲁科版则较为详细[18,19]。两版教材虽都明确指出了反应历程和基元反应的概念,以及催化剂通过改变反应历程和降低活化能而加快反应,但鲁科版还进一步明确指出活化能概念只对基元反应才有明确意义,并在介绍浓度对反应速率的影响时介绍了速率常数,且指出: 反应速率与反应物浓度间的定量关系(即速率方程)是实验测定的结果,不能随意根据反应的方程式直接写出(除非基元反应)。教材介绍尚有如此大差异,教师在相关教学和命题中就更要把握好分寸,尤其在等级选拔性考试中要发挥好教学导向作用,不能随意拔高难度,从而真正在发挥好本内容特殊教学价值的同时不过多增加教学负担。比如,检测命题时建议可用如下较简单的命题判断形式考查学生是否具备“化学反应有历程”的相关常识。
例: 下列关于化学反应的认识正确的是()。
A. 通过化学反应的方程式可以看出其反应历程
B. 速率快的反应一步完成,慢的反应分多步完成
C. 催化剂因其反应前后质量和化学性质均不变,故不参与反应
D. 反应机理研究有利于对化学反应的精准调控并提高物质的合成效率
3.2 因材施教,使教学价值再升级
本内容为教师的因材施教留足了空间。一般学生达到课标基本要求即可,但对学有余力的学生,本内容无疑为其进一步系统认识化学动力学开好了头,学生可在课外进一步阅读相关大学教材,有条件的教师则可为学生开设相關选修课或指导学生到实验室进行一些与反应历程相关的探究性实验(如酸与金属反应时Cl-的影响等)。此外,在作业和选拔性考试中,除了可像上述例题那样直接考查相关知识外,还可运用大量真实的反应历程问题作为情境载体,进一步培养和考查学生的各种高阶思维能力,如灵活的信息整合能力(2020年高考全国Ⅰ卷10题、Ⅱ卷11题及2021年全国乙卷28题最后一问)、数据分析与证据推理能力(2020年全国Ⅰ卷28题最后一问用已知速率方程作载体考查学生必备知识和辩证思维)、实验探究与创新能力(2016年高考北京卷27题第2问,以离子方程式书写和实验方案补充等问题巧妙考查了学生对催化剂的认识、实验设计和分析)等。
参考文献:
[1]中华人民共和国教育部制定. 普通高中化学课程标准(2017年版2020年修订)[S]. 北京: 人民教育出版社, 2020: 31~33.
[2][6]吴星. 中学化学学科理解——疑难问题解析[M]. 上海: 上海教育出版社, 2020: 185~189, 183~184.
[3][4][5][8][11][13]傅献彩等. 物理化学(第5版, 下)[M]. 北京: 高等教育出版社, 2006: 160~161, 182, 286, 173, 249~253, 156.
[7]邢其毅等. 基础有机化学(第3版, 上)[M]. 北京: 高等教育出版社, 2005: 576~577.
[9][18]王磊等主编. 普通高中教科书·化学反应原理(选择性必修1)[M]. 济南: 山东科学技术出版社, 2020: 65~71.
[10]严宣申. 化学原理选讲[M]. 北京: 北京大学出版社, 2012: 45.
[12]北京师范大学等. 无机化学(第4版, 上)[M]. 北京: 高等教育出版社, 2002: 284~285.
[14]张礼和. 化学学科进展[M]. 北京: 化学工业出版社, 2005: 212.
[15]王存宽. 大学科学素养读本——引领现代化学进展的诺贝尔奖[M]. 杭州: 浙江大学出版社, 2006: 291~298.
[16][17]普通高中化学课程标准修订组. 普通高中化学课程标准(2017年版2020年修订)解读[M]. 北京: 高等教育出版社, 2020: 129~130.
[19]王晶等主编. 普通高中教科书·化学反应原理(选择性必修1)[M]. 北京: 人民教育出版社, 2020: 25~27.
