纳豆激酶液体混菌发酵工艺研究
2021-01-20李珊珊周伏忠刁文涛王雪妍陈晓飞
李珊珊, 周伏忠, 刁文涛, 王雪妍, 冯 菲, 陈晓飞
(河南省科学院生物研究所有限责任公司,郑州 450008)
溶栓是预防和治疗血栓疾病的主要方法,但目前治疗该类疾病的药物均存在很多缺点,通过细菌发酵生产的纳豆激酶(NK),能很好地弥补传统溶栓药物的不足,有望成为临床上的第三代溶栓药物[1-4]. 以NK作为辅助溶栓的保健食品,已在欧美和日本盛行20多年,且在抗菌、抗线虫、防止骨质疏松、阿尔茨海默病治疗和临床手术中,同样具有不可估量的潜在应用价值[5-8].
目前国内关于NK的报道,大多集中在固体发酵制备纳豆、纳豆胶囊、纳豆粉等保健食品方面,但固体发酵培养基成分复杂,不利于提纯等操作;而液体发酵工艺简单,易控制,规模易扩大,更适合工业化生产,且最重要的是有利于后期的纯化处理[9-10]. 目前关于我国NK的相关报道中,NK液体发酵酶活相对较低(大多在900~1300 IU/mL)[11-13],不能满足工业生产的要求,因此获得高产NK的生产菌株和液体发酵工艺是其产业化的必经之路.
本研究用实验室复合诱变选育的5株NK高产突变菌株,通过随机组合的方法,筛选混菌发酵的菌株组合,随后通过单因素试验和正交试验确定最佳发酵工艺. 这种方法是通过两种或多种微生物的协同作用,共同完成发酵过程的混菌发酵技术,不需要进行复杂的DNA体外重组,却可以取得纯种培养无法达到的效果,如提高产品产量、改善产品品质及获得特殊代谢产物等[14].
1 材料与方法
1.1 材料
1.1.1 菌种 本实验所用NK生产菌株CBL-2-7-10-6、PXDBJ-13-9-7-18、DNS-17-3-15-7、LJJ-1-13-12-4和L-5-8-15,分别为本院实验室保藏的CBL-2、PCDBJ-13、DNS-17、LJJ-1和L经复合诱变后选育的NK正向突变株,CBL-2为解淀粉芽孢杆菌,LJJ-1为多黏芽孢杆菌,其余3株均为枯草芽孢杆菌[15].
1.1.2 主要试剂 牛纤维蛋白原、凝血酶和标准尿激酶购自中国药品生物制品检定所,其他试剂均为国产分析纯.
1.1.3 培养基 种子培养基为LB培养基:蛋白胨10 g,酵母粉5 g,NaCl 10 g,加水定容至1000 mL,121 ℃灭菌20 min.
液体发酵培养基[16]:大豆蛋白胨25 g,葡萄糖20 g,MgSO40.5 g,CaCl20.2 g,K2HPO42 g,KH2PO41 g,加水800 mL溶解后调pH7.0,定容至1000 mL,121 ℃灭菌20 min.
1.2 研究方法
1.2.1 不同发酵时间对NK 活性的影响 采用液体发酵培养基,35 ℃、180 r/min 摇床培养,分别在培养15、20、25、30、35、40、45、50、55、60、65、70 h取样测定NK活性,绘制实验用的5个菌株不同发酵时间产NK活性曲线,在此基础上,确定液体发酵时间.
1.2.2 混菌发酵最佳组合的筛选 对5个菌株随机组合,进行混菌发酵(混菌发酵不超过3个菌株,发酵时间依据NK活性的试验结果而定). 然后测定发酵液的NK活性,确定混菌发酵的最佳组合.
1.2.3 混菌发酵工艺研究 参考张琳等[12]和王艳艳等[17]的方法略加修改,通过单因素试验和正交试验,确定混菌发酵工艺(培养基、pH、发酵温度及各菌株接种量等).
2 结果
2.1 不同发酵时间对NK活性的影响
实验用的5个菌株(CBL-2-7-10-6、PXDBJ-13-9-7-18、DNS-17-3-15-7、LJJ-1-13-12-4和L-5-8-15)液体发酵产NK活性随发酵时间的变化曲线见图1.

图1 NK活性随发酵时间的变化曲线Fig.1 The variation curve of NK activity with fermentation time
由图1可以看出,这5个菌株随发酵时间的变化曲线基本相似,在接种15 h时发酵液均基本无法检测到NK活性;20 h后,各菌株开始逐渐进入NK生产阶段;接种20~35 h时,发酵液NK活性随发酵时间的延长呈指数级增长;至接种35~45 h时间段内,随发酵时间的延长,NK活性增长速度逐渐放缓;发酵45~50 h时相对稳定;50 h时达到最大,此后NK活性开始逐渐下降. 因此,确定NK液体发酵时间为50 h.
2.2 混菌发酵最佳组合的筛选
将5个突变菌株通过随机组合的方法,在液体发酵培养基中,35 ℃,摇床转速180 r/min,发酵50 h后,通过血纤维平板法测定发酵液的NK活性,确定最佳组合. 随机组合方案及发酵液产NK活性结果见表1.

表1 5突变株随机组合及其发酵液NK活性Tab.1 Random combination of 5 mutants and NK activity of their fermentation broths
从表1可以看出,25个组合中,只有5个组合(3、5、8、12、17组合)发酵产NK活性,显著高于组合中任何菌株单独发酵的NK活性,说明这5个组合在发酵过程中,不同菌株之间可能具有相互协同作用,而其余组合液体发酵产NK活性均不比组合中产NK活性高的菌株单独发酵效果好;其中组合5液体发酵产NK 活性最高,达3 092.35 IU/mL,较单菌株发酵最高酶活(第23组合发酵的NK活性2 096.57 IU/mL)提高了47.5%. 因此,确定混菌发酵的最佳组合为组合5的3个突变菌株.
2.3 发酵工艺研究
2.3.1 发酵培养基中碳氮源及其添加量对发酵液NK活性的影响 通过正交试验,对发酵培养基中碳源、氮源、碳氮源添加量进行了正交试验研究,正交试验因素水平设计见表2.
按照330 μL/100 mL 的量接种CBL-2-7-10-6、DNS-17-3-15-7 和L-5-8-15(第5组合)种子液,在pH7.0、35 ℃及摇床转速为180 r/min 的条件下,发酵50 h后测定发酵液NK活性,结果见表3.

表2 发酵培养基碳氮源配方正交试验因素水平Tab.2 Factors and levels of the orthogonal test for the optimization of carbon and nitrogen formula in the medium

表3 发酵培养基碳氮源配方正交试验结果Tab.3 The orthogonal test results of the carbon and nitrogen source formula of fermentation medium
由发酵培养基碳氮源配方正交试验结果(表3)可知,影响以上3个菌株液体混合发酵产NK活性的主次因素依次为氮源>碳源>碳氮源添加量,最佳碳氮源配方为表2中培养基的碳氮源分别为葡萄糖和大豆蛋白胨,且二者的添加量在培养基中的质量分数均为4%.
2.3.2 发酵培养基中无机离子添加量对NK活性的影响 在前面研究结果的基础上,通过正交试验,对液体培养基中MgSO4、CaCl2、K2HPO4和KH2PO4等无机盐的添加量进行了正交试验研究,即在培养基中葡萄糖和大豆蛋白胨质量分数均为4%的基础上,将上述无机盐分别加入不同培养基中(表4). 按照前面接种和发酵条件发酵后,测定发酵液NK活性,结果见表5.

表4 发酵培养基中无机盐添加量正交试验因素水平Tab.4 Factors and levels of the orthogonal test for the optimization of inorganic salt addition formula in the medium
由表5可以看出,表1中组合5的菌株混合发酵液体培养基中,无机离子的含量对发酵液NK活性影响的主次因素依次为MgSO4>CaCl2>(K2HPO4+KH2PO4). 经正交试验分析,最佳组合为A2B3C1,即发酵液中无机盐MgSO4、CaCl2和K2HPO4+KH2PO4的添加量分别为0.04%、0.06%和0.2%+0.1%.
因此,结合两个正交实验的结果,确定表1中组合5(CBL-2-7-10-6、DNS-17-3-15-7、L-5-8-15)的3个突变菌株液体混合发酵的最佳培养基配方为:葡萄糖4%、大豆蛋白胨4%、MgSO40.04%、CaCl20.06%、K2HPO40.2%、KH2PO40.1%.

表5 发酵培养基中无机盐添加量正交试验结果Tab.5 Orthogonal test results of the amount of inorganic salt added in fermentation medium
2.3.3 初始pH 和发酵温度的影响 本试验研究了初始pH 和发酵温度对CBL-2-7-10-6、DNS-17-3-15-7和L-5-8-15(表1中组合5的3个突变菌株)混菌发酵的影响. 即在最佳培养基的基础上,设置不同初始pH(pH 4、5、6、7、8、9、10)进行发酵,确定最适pH;随后,在最适pH 下,设置不同发酵温度(25、28、31、34、37、40 ℃),确定最适发酵温度,结果见图2和图3.

图2 pH对产NK活性的影响Fig.2 Effects of fermentation pH on NK activity
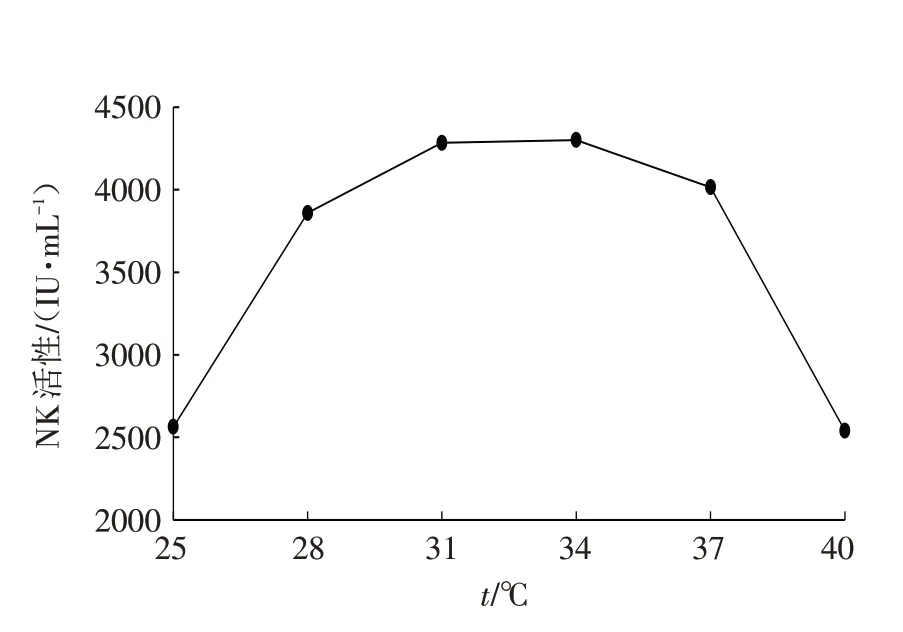
图3 发酵温度对发酵产NK活性的影响Fig.3 Effects of fermentation temperature on NK activity
由图2可以看出,初始发酵pH对上面3个菌株混菌产NK活性的影响显著. 当初始发酵pH为7时,混合发酵产NK活性最强,可达到4200 IU/mL以上,且在初始pH为6~8时,发酵液产NK活性相对稳定,但当初始pH<6或>8时,随着pH偏离7越远,发酵液产NK活性下降越快,这与大多数报道的结果一致,因此,确定这3个菌株混合发酵的最适初始pH为7.
从图3可以发现,CBL-2-7-10-6、DNS-17-3-15-7和L-5-8-15这3个突变株混菌发酵产NK活性受发酵温度影响的曲线与受pH影响的曲线有些相似,均为两边低中间高的半圆形弧线. 根据图3可知,当发酵温度为28~34 ℃时,其变化对NK活性的影响较小,尤其温度在31~34 ℃之间变化时,对NK活性几乎没有影响. 但当发酵温度低于28 ℃时,随发酵温度的降低,NK活性显著下降. 同样,当发酵温度高于37 ℃时,NK活性随着的升高急剧下降. 从节约成本的角度考虑,确定发酵温度为31 ℃.
2.3.4 各菌株接种量对混菌发酵产NK 活性的影响 在上述试验结果的基础上,通过正交试验,测定了CBL-2-7-10-6、DNS-17-3-15-7和L-5-8-15突变菌株接种量对混菌发酵产NK活性的影响,正交试验设计及结果见表6和表7.

表6 混菌发酵不同菌株接种量正交试验因素水平Tab.6 Factors and levels of the orthogonal test for the inoculation amounts of different strains in mixed fermentation单位:μL·100 mL-1
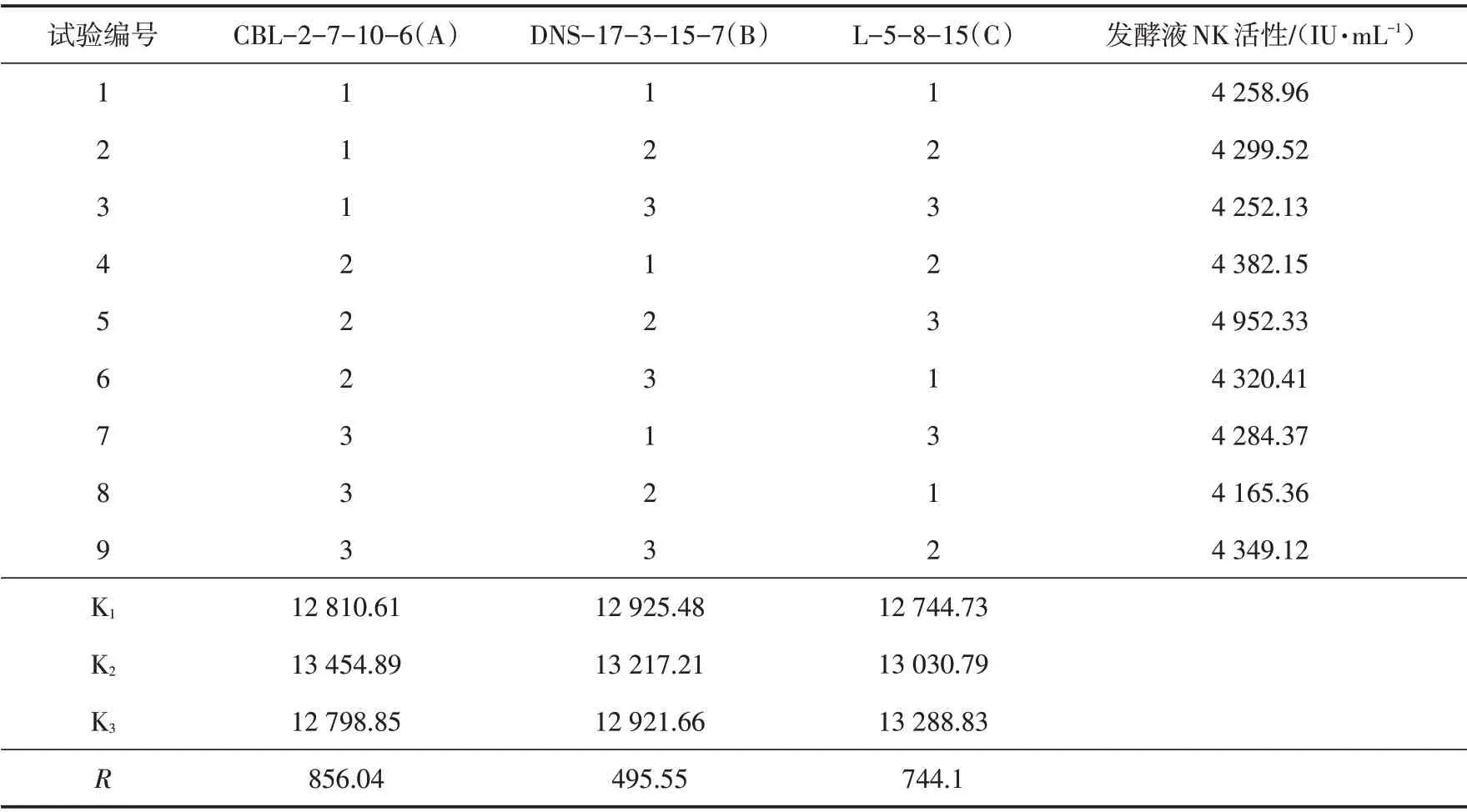
表7 混菌发酵不同菌株接种量正交试验结果Tab.7 Orthogonal test results of the inoculation amounts of different strains in mixed fermentation
由表7 可以看出,混菌发酵中,突变菌株的接种量对NK 活性影响的主次因素依次为:CBL-2-7-10-6>L-5-8-15>DNS-17-3-15-7. 经正交试验分析,最佳接种量组合为A2B2C3,即CBL-2-7-10-6、L-5-8-15 和DNS-17-3-15-7 的接种量分别为670、670 和1000 μL/100 mL,在此条件下,混菌发酵的NK 活性可以达到4 952.33 IU/mL.
3 讨论
在多菌株混合发酵中,不同菌株之间可以通过相同功能、但不同特性的酶之间的联合作用,而提高其活力[14,18-19]. 本研究用实验室诱变选育的5 个突变株,通过随机组合的方法,筛选混菌发酵的最佳组合,最终确定了CBL-2-7-10-6、DNS-17-3-15-7、L-5-8-15 组合. 按照接种量均为330 μL/100 mL 的混合发酵组合,这3 个突变菌株混合发酵后NK 活性可以达到3 092.35 IU/mL,较这3 个菌株单独发酵的最大酶活(2 096.57 IU/mL)提高了47.5%,说明不同菌株之间协同作用效果显著,这与刘军[14]等在淀粉酶研究中报道的结果相似. 随后,通过一系列正交试验和单因素试验,确定了这3个突变菌株混菌发酵的培养基和最佳发酵工艺:①发酵培养基中葡萄糖质量分数为4%、大豆蛋白胨4%、MgSO40.04%、CaCl20.06%、K2HPO40.2%、KH2PO40.1%,初始pH7.0. ②突变菌株CBL-2-7-10-6、DNS-17-3-15-7和L-5-8-15的接种量分别为670、670、1000 μL/100 mL,发酵温度31 ℃,摇床转速160 r/min,发酵时间50 h. 在此条件下,发酵液酶活可以达到4 952.33 IU/mL,是本研究单菌株发酵最高酶活(DNS-17-3-15-7发酵的NK活性2 096.57 IU/mL)的2.36倍,与现有报道[12,20-21]相比,本研究确定的这3个突变菌株混合发酵工艺,产NK能力的优势非常突出,从而为液体发酵产NK的工业化奠定了坚实的基础.
