PUMA对高脂饮食小鼠LPS诱导的急性肾损伤和凋亡的影响
2021-01-19廖豪峰庞梦雅张政葛缅
廖豪峰?庞梦雅?张政?葛缅
【摘要】 目的 探討p53上调凋亡调控因子(PUMA)是否参与调节高脂饮食(HFD)所致糖尿病小鼠脂多糖(LPS)诱导的急性肾损伤。方法 将24只小鼠随机均分为普食(Chow)组与HFD组,分别以普通饲料或者高脂饮食喂养12周,饮食干预结束后分别再分为LPS组与Con组,LPS组小鼠腹腔注射LPS 10 mg/kg制备脓毒症急性肾损伤模型,Con组给予等体积磷酸盐缓冲液腹腔注射,24 h后检测小鼠肾病理损伤、血清肌酐、血尿素氮、PUMA蛋白和Caspase-3蛋白表达水平以及肾脏凋亡情况。结果 与Chow组相比,HFD组小鼠体质量增加、随机血糖升高(P均< 0.05),产生胰岛素抵抗。与Con组相比,LPS组血清肌酐和血尿素氮升高(P均< 0.05),出现肾上皮细胞形态异常、上皮细胞坏死和炎症浸润等病理损伤,原位末端转移酶标记技术染色显示肾组织出现大量凋亡细胞,PUMA蛋白水平及Caspase-3蛋白表达增高(P均< 0.05)。与Chow+LPS组相比,HFD+LPS组上述表现更为明显(P均< 0.05)。结论 HFD通过上调PUMA表达,促进了LPS诱导的小鼠急性肾损伤以及凋亡。
【关键词】 p53上调凋亡调控因子;高脂饮食;糖尿病;脂多糖;急性肾损伤
Effect of PUMA on LPS-induced acute kidney injury and apoptosis in high-fat diet-fed mice Liao Haofeng, Pang Mengya, Zhang Zheng, Ge Mian. Department of Anesthesiology, the Third Affiliated Hospital of Sun Yat-sen University, Guangzhou 510630, China
Corresponding author, Ge Mian, E-mail: gemiansums@ 163. com
【Abstract】 Objective To investigate whether p53 upregulated modulator of apoptosis (PUMA) participates in regulating the acute kidney injury induced by lipopolysaccharide (LPS) in high-fat diet (HFD)-fed mice. Methods Twenty-four mice were randomly divided into the Chow and HFD groups, and fed with regular chow or HFD for 12 weeks, respectively. Subsequently, the animals were further divided into the control and LPS groups. Mice in the LPS group were injected with LPS 10 mg/kg intraperitoneally to establish the mouse models of acute kidney injury, whereas an equivalent amount of PBS was administered in the control group. The expression levels of serum creatinine, urea nitrogen, PUMA protein and Caspase-3 protein were detected and the pathological kidney injury and apoptosis were observed 24 h later. Results Compared with the Chow group, mice in the HFD group had significantly higher body weight (P < 0.05), elevated random blood glucose (P < 0.05) and insulin resistance. Compared with the control group, the serum levels of creatinine and urea nitrogen of mice in the LPS group were significantly increased (both P < 0.05), and presented with obvious pathological damages, such as morphological abnormality of renal epithelial cells, epithelial cell necrosis and inflammatory infiltration. Meanwhile, in situ terminal deoxynucleotidyl transferase revealed a large quantity of apoptotic cells and higher PUMA protein and Caspase-3 protein levels were observed in the renal tissues of mice in the LPS group (both P < 0.05). Compared with the Chow+LPS group, the findings above in the HFD + LPS group were more pronounced (all P < 0.05). Conclusion HFD can aggravate LPS-induced acute kidney injury and apoptosis probably by up-regulating the expression level of PUMA.
【Key words】 p53 upregulated modulator of apoptosis(PUMA);High-fat diet;Diabetes mellitus;
Lipopolysaccharide;Acute kidney injury
近年来,由于超重和肥胖率的上升以及体育活动的减少,我国的2型糖尿病发病率迅速上升,已经成为公共卫生的主要挑战[1-2]。多项研究表明,肥胖以及2型糖尿病患者在临床及围术期中发生感染性并发症的风险更高,这可能导致脓毒症发生率增高以及ICU脓毒症相关患者的病死率增加[3-5]。脓毒症是宿主对感染的反应失调导致的危及生命的器官功能障碍[6]。肾脏是脓毒症发展过程中最容易受损的器官[4-5, 7]。脓毒症相关急性肾损伤(S-AKI)在ICU较为常见,同时AKI会导致脓毒症患者病死率增高。与ICU其他损伤相比,S-AKI病死率更高[8-9]。此外,有研究表明糖尿病是术后感染、S-AKI的独立危险因素[10-11]。因此,关注糖尿病患者的S-AKI成为急需解决的临床问题,然而目前研究并不多。
既往研究显示,多种因素参与了S-AKI的发病机制,比如炎症损伤、氧化应激、凋亡等,其中凋亡被证明起了重要作用[12-13]。p53上调凋亡调控因子(PUMA)是近年发现的一种具有促凋亡作用的p53靶基因,既往研究发现其与缺血再灌注、肿瘤及脓毒血症等病理生理过程有密切联系[14-15]。然而PUMA与2型糖尿病关系研究较少,其是否参与糖尿病患者S-AKI的发生发展目前仍未清楚。本实验旨在探讨PUMA诱导的凋亡与糖尿病脓毒症小鼠AKI的联系,从而进一步寻找糖尿病患者S-AKI的防治方法。
材料与方法
一、材 料
24只6~8周龄雄性SPF级C57BL/6小鼠购自南京大学模式动物研究中心,体质量19 ~ 23 g,饲养于中山大学附属第三医院实验动物中心,饲养期间保持动物房室温25℃、相对湿度60%及12 h人工日光灯管照射,小鼠自由饮水和进食。普通饲料及高脂饲料分别购自中山大学实验动物中心及美国Research Diets公司,Optium Xceed 血糖仪购自美国Abbott Diabetes Care公司,4%甲醛缓冲溶液购自美国Sigma-Aldrich公司,苏木素染色液及伊红染液购自武汉塞维尔公司,蛋白酶抑制剂、乙二胺四乙酸、RIPA 蛋白裂解液、BCA 蛋白浓度测定试剂盒购自美国 Thermo Scientific 公司,PUMA及Caspase-3抗体购自英国Abcam公司,原位末端转移酶标记技术(TUNEL)试剂盒购自美国Roche公司,DAB显色剂购自丹麦DAKO公司。本动物实验经中山大学动物伦理委员会批准(批准号:IACUC-F3-161002)。
二、方 法
1. 模型制备与造模
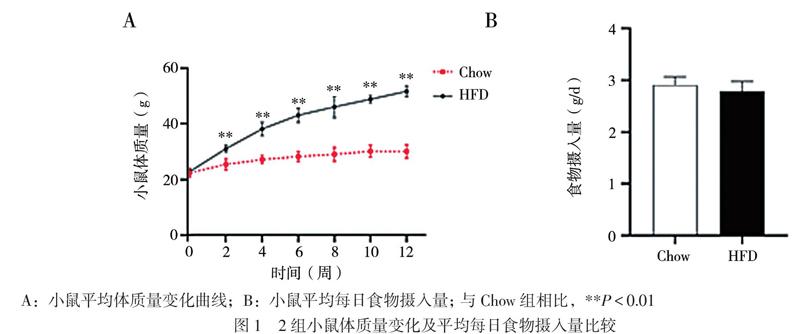
待小鼠适应环境1周后,采用随机数表法分成普食(Chow)组和高脂饮食(HFD)组,每组各12只小鼠,分别给予普通啮齿动物饲料(热量百分比为:70%碳水化合物、10%脂肪、20%蛋白质)和高脂肪饲料(热量百分比为:20%碳水化合物、60%脂肪、20%蛋白质)喂养。每2周评估体质量和每日食物摄入量,饮食干预12周后进行OGTT和胰岛素耐受性试验(IPITT),利用GraphPad Prism 8软件计算OGTT及IPITT曲线的曲线下面积(AUC)。饮食干预结束后,分别再分为对照组(Con组)和LPS干预组(LPS组)。LPS组给予LPS 10 mg/kg腹腔注射制备小鼠S-AKI模型,Con组给予等体积磷酸盐缓冲液(PBS)腹腔注射。注射后24 h给予安乐死,通过眼球取血和收集肾组织标本进行进一步检测。
2. HE染色
取小鼠新鲜肾脏组织去除包膜,长轴方向对切。经4%多聚甲醛固定过夜,石蜡包埋切片。常规行HE染色,放大200倍,光学显微镜下观察并拍摄图像。
3. 蛋白免疫印迹法
取肾脏组织30 mg于200 μl预冷含蛋白酶抑制剂的RIPA裂解液中提取总蛋白,BCA法測定蛋白浓度。取40 μg样品蛋白于10%分离胶和5%浓缩胶行十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE)、转膜、脱脂奶粉封闭1 h,加入1∶200兔抗PUMA或者Caspase-3抗体4℃过夜孵育。次日TBS、TBST交替洗膜后加入1∶10 000 红外荧光染料标记的二抗,室温孵育1 h。TBS、TBST 交替洗膜,Odyssey双色红外激光成像系统曝光,Image-Pro Plus软件灰度分析,用目的蛋白灰度值/内参灰度值表示目的蛋白相对表达水平。
4. TUNEL检测及凋亡指数计算
取石蜡包埋的小鼠肾组织切片,根据Roche公司的TACS TdT原位细胞凋亡检测试剂盒产品说明书进行操作,检测肾脏组织凋亡细胞,DAB显色后细胞核呈棕褐色为阳性反应。每张切片随机选取20个视野(放大400倍),于光学显微镜下观察并采集图像计数,利用Image J软件定量阳性标记的细胞;计算阳性细胞数和肾脏细胞总数,凋亡指数=阳性细胞数/肾脏细胞总数×100%。
三、统计学处理
使用SPSS 22.0分析所有数据。使用Kolmogorov- Smirnov检验数据的正态性,Levene检验用于检验方差齐性。符合正态分布的计量资料以表示,2组间比较用独立样本t检验,重复测量资料使用重复测量方差分析分析交互效应、主效应或单独效应;析因设计资料使用析因设计方差分析。α= 0.05。
结 果
一、12周HFD饮食对小鼠体质量、血糖和胰岛素的影响
1. 12周HFD饮食对小鼠体质量的影响
小鼠平均体质量变化曲线提示饮食干预与时间之间存在交互作用(F = 102.885,P < 0.001)。与Chow组小鼠相比,HFD组的小鼠在饮食干预2周开始出现体质量增加(t2周 = 6.275,P < 0.001;t4周= 10.200,P < 0.001;t6周 = 12.560,P < 0.001;t8周 = 9.846,P < 0.001;t10周 = 19.830,P < 0.001;t12周 = 18.370,P < 0.001),该现象这一直持续到12周,见图1A。各组小鼠平均每日食物摄入量在组间比较差异无统计学意义(t = 1.304,P = 0.217),见图1B。
2. 12周HFD对小鼠血糖和胰岛素的影响
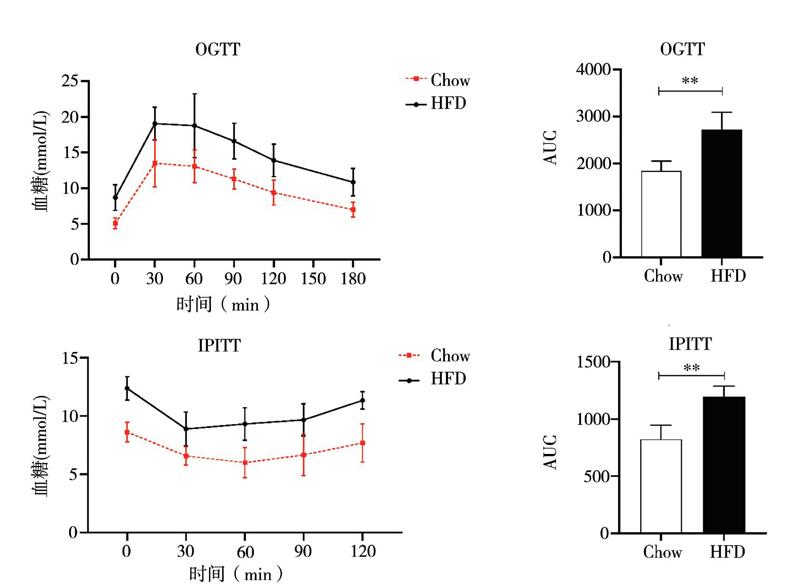
OGTT与时间效应之间不存在交互作用(F = 0.803,P = 0.552);时间主效应(F = 57.831,P < 0.001)和处理主效应(F = 28.829,P < 0.001)有统计学意义。HFD组小鼠在测试的各个时间点血糖水平均高于Chow组,同时AUC升高[(2714±378)mm2 vs.(1844±210)mm2,t = 5.319,P = 0.002)],表明HFD饮食干预后小鼠的葡萄糖耐受性变差,见图2A、B。此外,IPITT与时间之间不存在交互作用(F = 1.060,P = 0.386);时间主效应(F = 19.690,P < 0.001)和处理主效应(F = 47.536, P < 0.001)有统计学意义; HFD组小鼠在测试的各个时间点血糖水平均高于Chow组, HFD组小鼠AUC也较Chow组增加[(1193±94)mm2 vs.(823±122)mm2,t = 6.335,P < 0.001],表明HFD饮食干预后小鼠对胰岛素治疗的反应性变差,见图2C、D。上述数据表明HFD组小鼠符合2型糖尿病的特征。
二、HFD对LPS导致AKI的影响
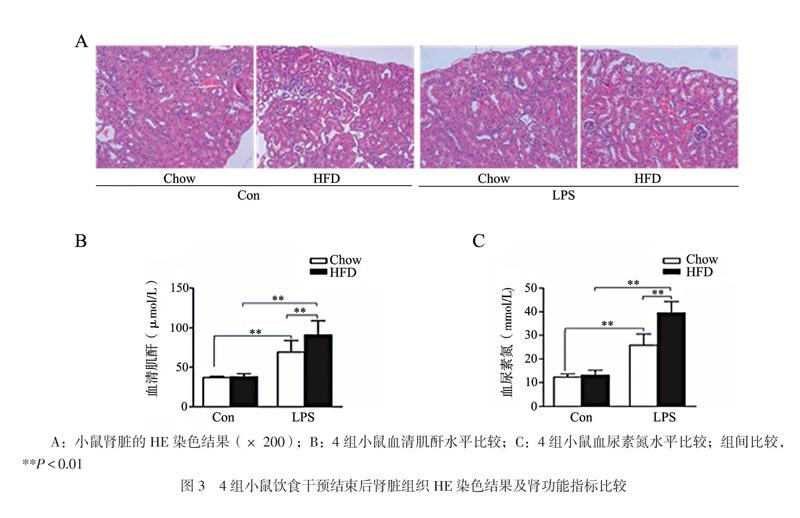
HE染色显示,Chow+Con组小鼠肾小球及肾小管结构正常;HFD+Con组可见肾小管区域空泡,肾小球囊腔扩大;经LPS腹腔注射的Chow+LPS组与HFD+LPS组小鼠可见肾上皮细胞变平失去正常形态,上皮细胞坏死和炎症浸润,部分肾上皮细胞核染色部分甚至完全缺失,同时肾小管腔出现中重度膨胀。其中,HFD饮食干预组小鼠肾病理损伤更为明显,见图3A。析因设计方差分析结果表明,饮食因素与LPS处理间的交互作用无统计学意义(血清肌酐F = 1.534,P = 0.244;血尿素氮F = 3.038,P = 0.112);与各自对照组相比,LPS干预后的小鼠血清肌酐和血尿素氮均升高(LPS因素的主效应检验P均< 0.001)。HFD+LPS组血清肌酐和血尿素氮均高于Chow+LPS组(血清肌酐t = 5.430,P = 0.006;血尿素氮t = 4.881,P = 0.003),见图3B、C。上述提示LPS对于小鼠肾组织结构及肾功能有不同程度的损伤,在HFD组损伤表现得更为明显。
三、HFD对LPS干预后肾组织PUMA蛋白水平的影响
使用蛋白免疫印迹法研究了不同组小鼠间PUMA表达水平存在差异。析因设计方差分析结果表明,饮食因素与LPS处理间的交互作用有统计学意义(F = 7.594,P = 0.025),与对照组相比,LPS干预后的小鼠肾脏PUMA蛋白表达均升高(饮食因素固定时,LPS单独效应P < 0.001);而与Chow+LPS组相比,HFD会明显加剧LPS导致的PUMA蛋白水平增加(LPS干预时,HFD的单独效应P < 0.001),见图4。
四、HFD加剧LPS导致的细胞凋亡
TUNEL染色显示,Chow组小鼠肾脏组织未见细胞凋亡;而LPS处理后小鼠肾组织尤其是肾小管部分可见大量凋亡细胞。析因设计方差分析结果表明,饮食因素与LPS处理间的交互作用有统计学意义(F = 19.779,P < 0.001)并且HFD+LPS组小鼠较Chow+LPS 组凋亡细胞数量增加(HFD的单独效应P < 0.001),见图5。
五、HFD加剧LPS导致的肾组织Caspase-3蛋白水平增加
析因设计方差分析结果表明,饮食因素与LPS处理间的交互作用有统计学意义(F = 13.644,P = 0.006)。与Chow+Con组相比,LPS干预后的Chow+LPS组小鼠肾组织Caspase-3表达水平升高(LPS的单独效应P < 0.001);与Chow+LPS组相比,HFD+LPS组小鼠肾组织Caspase-3表达水平亦升高(HFD的单独效应P < 0.001),见图6。
讨 论
肥胖与糖尿病的预防和管理将成为我国面临的一項重大挑战,二者关系密切并且会增加患者围术期感染性并发症的风险以及病死率。本研究通过HFD喂养C57BL/6J雄性小鼠构建2型糖尿病模型,随后给予LPS干预诱导S-AK,初步探讨HFD对LPS诱导的小鼠S-AKI的影响[16-18]。结果显示,经LPS干预的小鼠均表现出AKI症状,而HFD喂养的小鼠肾组织损伤比普通饲料喂养的小鼠更为严重,表现为肾脏结构破坏、血清肌酐和血尿素氮升高,同时肾小管及其他肾组织细胞凋亡数量增多、PUMA和Caspase-3表达升高。
目前肥胖与糖尿病已成为我国的重要卫生问题。一项全国调查表明,2010年中国20 ~ 59岁成年人的超重(23.0 kg/m2≤ BMI < 27.5 kg/m2)患病率高达40.7%,而2014年肥胖(BMI ≥27.5 kg/m2)患病率为12.9%[19]。另一项于2015至2017年由滕卫平教授团队进行的全国性横断面研究显示,中国成年居民的糖尿病患病率为12.8%,糖尿病前期患病率高达35.2%[1]。饮食引起的肥胖正是代谢并发症(如胰岛素抵抗、2型糖尿病和心血管疾病)的主要危险因素[20]。此外,研究表明肥胖和2型糖尿病不仅会增加患者感染的风险,还是S-AKI的独立危险因素,但目前的治疗手段仍非常有限[3-5]。高脂喂养会导致小鼠肥胖,由于胰岛的补偿不足,进一步导致高胰岛素血症和葡萄糖稳态改变[16]。因此,该模型被认为能准确地模拟人类生理状态[21]。本研究显示,12周HFD喂养的小鼠体质量较普通饲料喂养小鼠增长更快且胰岛素耐量、葡萄糖耐量降低,表明在C57BL/6小鼠上成功构建了HFD诱导的糖尿病模型并可将其作为合适的模型进行研究。
LPS作为革兰阴性细菌的外膜成分,是败血症的主要刺激因子,可通过刺激细胞释放大量的炎症细胞因子和自由基诱发炎症级联反应[22]。在S-AKI 的发病机制中起重要作用[23]。肾脏是由LPS引起脓毒症中最脆弱的靶器官之一,高达60%的脓毒症患者患有AKI[7]。同时Hsu等[11]证实糖尿病是S-AKI的独立危险因素。既往研究表明,肾功能迅速下降为AKI临床特征,包括肾小球滤过率下降、尿量减少以及血清肌酐水平升高等[24]。本研究结果与其一致,LPS干预后小鼠的血清肌酐和血尿素氮水平明显升高,肾病理损伤加重,而且HFD喂养小鼠肾损伤更为明显,证明2型糖尿病会加重S-AKI。
[9] Zhi DY, Lin J, Zhuang HZ, Dong L, Ji XJ, Guo DC, Yang XW, Liu S, Yue Z, Yu SJ, Duan ML. Acute kidney injury in critically ill patients with sepsis: clinical characteristics and outcomes. J Invest Surg, 2019, 32(8):689-696.
[10] Plaeke P, De Man JG, Coenen S, Jorens PG, De Winter BY, Hubens G. Clinical-and surgery-specific risk factors for post-operative sepsis: a systematic review and meta-analysis of over 30 million patients. Surg Today, 2020, 50(5):427-439.
[11] Hsu YC, Hsu CW. Septic acute kidney injury patients in emergency department: the risk factors and its correlation to serum lactate. Am J Emerg Med, 2019, 37(2):204-208.
[12] Agarwal A, Dong Z, Harris R, Murray P, Parikh SM, Rosner MH, Kellum JA, Ronco C; Acute Dialysis Quality Initiative XIII Working Group. Cellular and molecular mechanisms of AKI. J Am Soc Nephrol, 2016, 27(5):1288-1299.
[13] Du J, Jiang S, Hu Z, Tang S, Sun Y, He J, Li Z, Yi B, Wang J, Zhang H, Li YC. Vitamin D receptor activation protects against lipopolysaccharide-induced acute kidney injury through suppression of tubular cell apoptosis. Am J Physiol Renal Physiol, 2019, 316(5):F1068-F1077.
[14] Yang J, Zhao X, Tang M, Li L, Lei Y, Cheng P, Guo W, Zheng Y, Wang W, Luo N, Peng Y, Tong A, Wei Y, Nie C, Yuan Z. The role of ROS and subsequent DNA-damage response in PUMA-induced apoptosis of ovarian cancer cells. Oncotarget, 2017, 8(14):23492-23506.
[15] Nakano K, Vousden KH. PUMA, a novel proapoptotic gene, is induced by p53. Mol Cell, 2001, 7(3):683-694.
[16] Winzell MS, Ahrén B. The high-fat diet-fed mouse: a model for studying mechanisms and treatment of impaired glucose tolerance and type 2 diabetes. Diabetes, 2004, 53(Suppl 3):S215-S219.
[17] 梁日英,符暢,梁华,徐芬,王美君,蔡梦茵.利拉鲁肽抑制ERS改善高脂饮食诱导的DN肾损害.新医学,2019,50(11):826-831.
[18] Doi K, Leelahavanichkul A, Yuen PS, Star RA. Animal models of sepsis and sepsis-induced kidney injury. J Clin Invest, 2009, 119(10):2868-2878.
[19] Tian Y, Jiang C, Wang M, Cai R, Zhang Y, He Z, Wang H, Wu D, Wang F, Liu X, He Z, An P, Wang M, Tang Q, Yang Y, Zhao J, Lv S, Zhou W, Yu B, Lan J, Yang X, Zhang L, Tian H, Gu Z, Song Y, Huang T, McNaughton LR. BMI, leisure-time physical activity, and physical fitness in adults in China: results from a series of national surveys, 2000-14. Lancet Diabetes Endocrinol, 2016, 4(6):487-497.
[20] Després JP, Lemieux I. Abdominal obesity and metabolic syndrome. Nature, 2006, 444(7121):881-887.
[21] Heydemann A. An overview of murine high fat diet as a model for type 2 diabetes mellitus. J Diabetes Res, 2016, 2016:2902351.
[22] Aziz M, Jacob A, Yang WL, Matsuda A, Wang P. Current trends in inflammatory and immunomodulatory mediators in sepsis. J Leukoc Biol, 2013, 93(3):329-342.
[23] Stasi A, Intini A, Divella C, Franzin R, Montemurno E, Grandaliano G, Ronco C, Fiaccadori E, Pertosa GB, Gesualdo L, Castellano G. Emerging role of lipopolysaccharide binding protein in sepsis-induced acute kidney injury. Nephrol Dial Transplant, 2017, 32(1):24-31.
[24] Thomas ME, Blaine C, Dawnay A, Devonald MA, Ftouh S, Laing C, Latchem S, Lewington A, Milford DV, Ostermann M. The definition of acute kidney injury and its use in practice. Kidney Int, 2015, 87(1):62-73.
[25] Vogelstein B, Lane D, Levine AJ. Surfing the p53 network. Nature, 2000, 408(6810):307-310.
[26] Wali JA, Rondas D, McKenzie MD, Zhao Y, Elkerbout L, Fynch S, Gurzov EN, Akira S, Mathieu C, Kay TW, Overbergh L, Strasser A, Thomas HE. The proapoptotic BH3-only proteins Bim and Puma are downstream of endoplasmic reticulum and mitochondrial oxidative stress in pancreatic islets in response to glucotoxicity. Cell Death Dis, 2014, 5(3):e1124.
(收稿日期:2020-06-20)
(本文編辑:林燕薇)
