外源蔗糖对高NH胁迫下拟南芥碳氮代谢的影响①
2021-01-12杨顺瑛郝东利苏彦华
李 祎,杨顺瑛,郝东利,苏彦华
李 祎1,2,杨顺瑛1,郝东利1,苏彦华1*
(1土壤与农业可持续发展国家重点实验室(中国科学院南京土壤研究所),南京 210008;2 中国科学院大学,北京 100049)
以拟南芥col-0、和为试验材料,采取基质培养的方法,以常规营养液(4 mmol/L NH4+)处理为对照,设置高NH4+(20 mmol/L)营养液中分别添加0% 蔗糖(T1)、5% 蔗糖(T2)处理,通过测定植株地上部分的鲜重,叶绿素、游离NH4+、可溶性糖、可溶性蛋白、矿质元素含量及谷氨酰胺合成酶(GS)、谷氨酸脱氢酶(GDH)酶活性等指标,研究外源蔗糖对NH4+胁迫拟南芥碳氮代谢的影响。结果表明:与CK相比,T1处理下,3个拟南芥株系植株生长均受到严重的抑制。鲜重及GS、GDH活性降低,游离NH4+、叶绿素、可溶性糖和可溶性蛋白含量增加;植株的氮、磷、钾、钙含量增加,镁、铁含量减少。其中col-0植株在T1处理下受到的抑制比和植株更为显著。与T1处理相比,T2处理增加了拟南芥植株的鲜重,显著提高了可溶性糖和可溶性蛋白含量,提高了GS和GDH活性;降低了叶绿素和游离NH4+的含量,提高了植株的氮、磷、钾、钙、镁含量,降低了植株铁含量,其中,外源蔗糖对col-0植株高NH4+毒害的缓解较两个突变体植株更为显著。
蔗糖;高NH4+胁迫;拟南芥;碳代谢;氮代谢
碳和氮是植物体内两大重要元素,其化合物在植物的生命代谢过程中起着至关重要的作用,因此碳和氮代谢是植物体内最重要的两大代谢过程[1]。碳氮代谢相互影响,相互制约。氮主要通过铵态氮(NH4+-N)和硝态氮(NO– 3-N)两种离子形态吸收进入植物体内[2-3]。适量的NH4+能够促进植物生长[4-6],但是过量的NH4+则会对植株的生长产生毒害作用[7-8],主要表现有植物根系粗短,根冠比下降,叶子黄化,同时还会抑制种子发芽,甚至严重的会导致植株死亡。已有研究表明,植物对铵态氮的吸收主要是通过铵转运蛋白家族(ammonium transporter,AMT)来负责[9-10]。当根系周围因施用氮肥而出现局部NH4+浓度较高(≥1 mmol/L)时,由AMT所介导的NH4+吸收作用达到饱和,根系的NH4+吸收能力不再随NH4+浓度的增加而增强[11]。
糖作为植物体内重要的大分子物质,不仅参与光合作用中的碳代谢,为氮代谢提供能量和碳架[12],还可以作为信号分子被植物细胞感知[13],在己糖激酶、糖代谢中间物以及糖分子水平展开其调节能力[14]。除此之外,糖也能参与植物氮同化酶的调节,可以促进离体植物叶片中硝酸还原酶(NR)在转录水平上的表达[15];外源蔗糖还可以显著提高烟草叶片中谷氨酰胺合成酶(GS)的活性[16],缓解高NO– 3胁迫对叶用莴苣生长的抑制[17]。
本试验以拟南芥铵转运蛋白基因的T-DNA突变体和野生型为材料,通过比较外源添加蔗糖下,AMT的T-DNA缺陷体及野生型在高NH4+胁迫下碳、氮代谢关键酶活性等指标的变化,探索高NH4+胁迫下外源蔗糖维持拟南芥碳、氮代谢平衡机理,为减轻NH4+胁迫对作物的毒害作用提供参考依据。
1 材料与方法
1.1 材料
野生型拟南芥(, Columbia)为本实验室保存(下文简称col-0)。Salk-063887C (下文简称)和CS372164 (下文简称) 这两个 AMT的T-DNA插入突变体购自ABRC (www.arabidopsis.org)。
2Mix rTaq,RNAiso Plus和 PrimeScriptTMIIRT 试剂盒以及 TaKaRa Ex Taq购自宝生物工程(大连)有限公司。引物由生工生物工程(上海)有限公司合成。其他生化试剂均为国产分析纯试剂。
1.2 试验方法
1.2.1 拟南芥植株幼苗准备 拟南芥植株幼苗培养方法参考文献[18],光照培养箱的温度为 23℃ ± 1 ℃,光周期为16 h光照、8 h黑暗,光照强度为100 μmol/ (m2·s)。培养基成分根据Yuan等[19]修改得:2 mmol/L NH4NO3,1 mmol/L KH2PO4,1 mmol/L MgSO4,250 μmol/L K2SO4,250 μmol/L CaCl2,100 μmol/L Na-Fe- EDTA,50 μmol/L KCl,50 μmol/L H3BO3,5 μmol/L MnSO4,1 μmol/L ZnSO4,1 μmol/L CuSO4,1 μmol/L Na2MoO4,1 mmol/L MES-KOH(2-码啉已磺酸),1% (/)蔗糖,0.8%(/)琼脂,pH 5.7。纯合体拟南芥种子先用10% ()的次氯酸钠和0.1%(/)SDS(十二烷基硫酸钠)消毒 5 min,然后用灭菌水清洗干净(5 次),置4 ℃低温避光保存48 h后播种于培养基(10 cm×10 cm)上,密封。将培养皿直立地置于光照培养箱中,让根沿琼脂表面向下生长。
1.3 测定项目及方法
1.3.1和突变体纯合体鉴定和的基因名称及引物序列见表1。

表1 拟南芥T-DNA突变体株系及引物序列
取样生长21 d的拟南芥叶片,采用蔗糖法[20-21]提取基因组DNA,随后进行PCR反应,PCR所用引物序列如表1所示。反应体系如下:模板DNA 1 μl,正向引物(10 μmol/L)0.4 μl,反向引物(10 μmol/L)0.4 μl,2×Mix rTaq 10 μl,双蒸水8.2 μl,总体积20 μl,混匀后进行PCR 反应。PCR 反应条件为:94 ℃预变性 3 min;94 ℃变性 30 s,60 ℃退火 45 s,72 ℃延伸 90 s,30次循环;最后 72 ℃延伸 10 min。PCR 产物利用1.0% 琼脂糖凝胶电泳检测,所用的电泳缓冲溶液为1×TAE,电泳电压为 120 V。
利用 TaKaRa的RNAiso Plus 试剂提取拟南芥野生型与待检测T-DNA 插入株系叶片的 RNA。用 NanoDrop 2000超微量分光光度计测定RNA的浓度。利用 Prime-Script TMIIRT试剂盒合成 cDNA。然后,利用基因的特异引物-F(5′- CATCAACCTTAACCTCTCAGACTCCA-3′)和- R(5′-GGTTTGGCCCATCAGAATCG-3′)进行 RT- PCR 检测的表达;利用基因的特异引物-F(5′-CATCAACCTTAACCTCTCAGACTCCA-3′)和-R(5′-GGTTTGGCCCATCAGAATCG-3′)进行 RT-PCR 检测的表达。基因作为内参,引物序列为 ACTIN1-F:5′-ACACCAGACATAGTAGCAGAAATCAAG-3′,ACTIN1-R:5′-GAGCCTTACAACGCTACTCTGTCTGTC-3′。扩增条件:94 ℃ 3 min;94 ℃ 3 min,58 ℃ 30 s,72 ℃ 1 min,25个循环;最后 72 ℃延伸 5 min。扩增产物用 1.0% 琼脂糖凝胶电泳进行分析。
1.3.2 植株生理生化指标测定 将外源添加蔗糖处理4周的拟南芥植株收样,并且测定其地上部分的鲜重。参照文献[22-23],测定叶绿素含量;采用蒽酮比色法测定可溶性糖含量;采用考马斯亮蓝G-250染色法测定可溶性蛋白含量;采用靛酚蓝比色法测定游离NH4+含量。
称取0.2 g鲜样叶片,放入预冷的研钵中,加入 1.5 ml 预冷的提取缓冲液,添加少量石英砂在冰上研磨,匀浆收集至1个 2.0 ml离心管中,4 ℃,16 000离心20 min,然后将上清液转移到新的离心管中测定相关酶活性。提取缓冲液组成:50 mmol/L Tris-HCl (pH 7.5),10 mmol/L MgCl2,1 mmol/L EDTA,1 mmol/L EGTA,1 mmol/L苯甲脒,1 mmol/L ε-氨基乙酸和10 μmol/L亮抑酶肽。采用Magalhaes和Huber[24]方法测定GS和GDH酶活性。
1.3.3 植株矿质元素含量测定 用天平称量拟南芥地上部新鲜样品,参照文献[23],采用凯氏定氮法测定全氮含量;采用H2SO4-H2O2–钒钼黄比色法测定全磷含量;采用H2SO4-H2O2火焰原子吸收分光光度法测定全钾含量;采用干灰化–稀HCl溶解–火焰原子吸收分光光度法[23],测定钙、镁、铁含量。
1.4 数据分析
采用Microsoft Excel 2013软件和SPSS13.0软件进行试验数据的统计和相关性分析,采用Duncan’s检验法进行显著性差异分析。
2 结果与分析
2.1 amt1.1和amt1.3插入纯合体的鉴定
图1中A是拟南芥株系鉴定的示意图。对拟南芥和株系鉴定结果如图1中B、D所示,结果显示,该和突变体有非常清晰的插入特异性扩增条带,产物大约为700 bp。对两个株系DNA 样品利用 T-DNA 插入两端的LP 和 RP 引物进行了PCR 扩增,其结果如图 1 中C和E所示,野生型样品有预测的 1 057 bp和1 101 bp 大小的特异 PCR 产物,而和株系样品并没有扩增条带,说明和为纯合的T-DNA插入。对其进行定量PCR,结果如F所示,在株系中,几乎检测不到,表明株系在T-DNA 插入的作用下,基因完全被敲除。在株系中,几乎检测不到,表明株系在T-DNA 插入的作用下,基因完全被敲除。
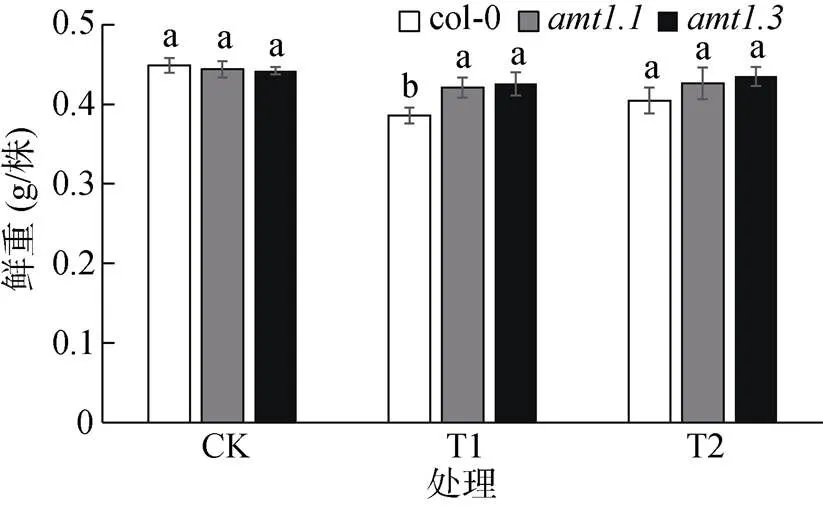
2.2 外源蔗糖对高NH4+ 胁迫下拟南芥植株鲜重的影响
从图2可以看出,CK处理下,col-0和、三种植株地上部分鲜重没有显著差异。与CK处理相比,T1处理下拟南芥植株的鲜重出现降低,3种植株的降幅分别降低了13.9%、5.2% 和3.6%,其中col-0植株的降低幅度最大,远远大于和植株。与T1处理相比,T2处理下3种植株的鲜重有所增加,增加的幅度依次为4.8%、1.2% 和2.1%,其中,col-0植株的增加幅度大于和植株,表明蔗糖可以缓解高NH4+胁迫对拟南芥生长的抑制,其中对col-0植株的效果更为明显。
4) 系统所需的控制器不能与现有部件干涉,并且处理速度要快,环境要求度不能太高。因此选用嵌入式开发板作为控制处理单元以满足上述要求。
2.3 外源蔗糖对高NH4+ 胁迫下拟南芥植株游离NH4+ 和叶绿素含量的影响
从图3 中可以看出,和CK处理相比,T1处理下,col-0、和植株体内的游离NH4+含量分别增加了34.9%、17.3% 和22.5%,其中,col-0的游离NH4+含量增加最为明显;和T1处理相比,T2处理下,游离NH4+含量分别降低了12.5%、5.9% 和8.1%。外源添加蔗糖可以在一定程度上减少植物体内游离NH4+含量,相较而言,外源添加蔗糖对高NH4+胁迫下col-0植株缓解能力更强。

(A:T-DNA突变体插入片段PCR鉴定模式图;B:col-0和amt1.1的LBb1和LP引物扩增结果;C:col-0和amt1.1的RP和LP引物扩增结果,其中M为Takara DL 2000 DNA Marker,1为col-0,2是amt1.1;D:col-0和amt1.3的LBb1和LP引物扩增结果;E:col-0和amt1.3的RP和LP引物扩增结果,M为Takara DL 2000 DNA Marker,1为col-0,3是amt1.3;F:col-0、amt1.1、amt1.3株系在At4g13510和At3g24300的表达结果,ACTIN1为内参)
(柱体上方不同小写字母表示相同处理下不同株系植株间差异在P<0.05水平显著,下同)
叶绿素含量也是反映植物体中氮含量的一个重要指标。从图3可以看出,和CK处理相比,T1处理下,植物体内的叶绿素含量分别增加了35.1%、26.4% 和26.9%,其中,col-0植株的叶绿素含量变化最为明显,和T1处理相比,T2处理下,植株体内的叶绿素含量分别降低了8.5%、5.5% 和7.9%。可以看出,外源添加蔗糖可以在一定程度上缓解高NH4+对拟南芥植株的胁迫,其中,对col-0植株的影响更为明显。
2.4 外源蔗糖对高NH4+ 胁迫下拟南芥植株可溶性糖和可溶性蛋白含量的影响
植物中碳水化合物是重要的渗透调节物质。由图4可见,CK处理下,col-0、和植株的可溶性糖含量并没有明显差异;T1处理下,与CK处理相比,col-0、和植株的可溶性糖含量分别增加21.5%、12.1% 和12.3%,其中col-0植株的增长明显高于和植株,col-0和、植株间达到显著性差异。与T1处理相比,T2处理下,col-0、和植株的可溶性糖含量分别增加17.7%、11.2% 和8.4%,col-0植株的增长更为明显,col-0和、植株间达到显著性差异。
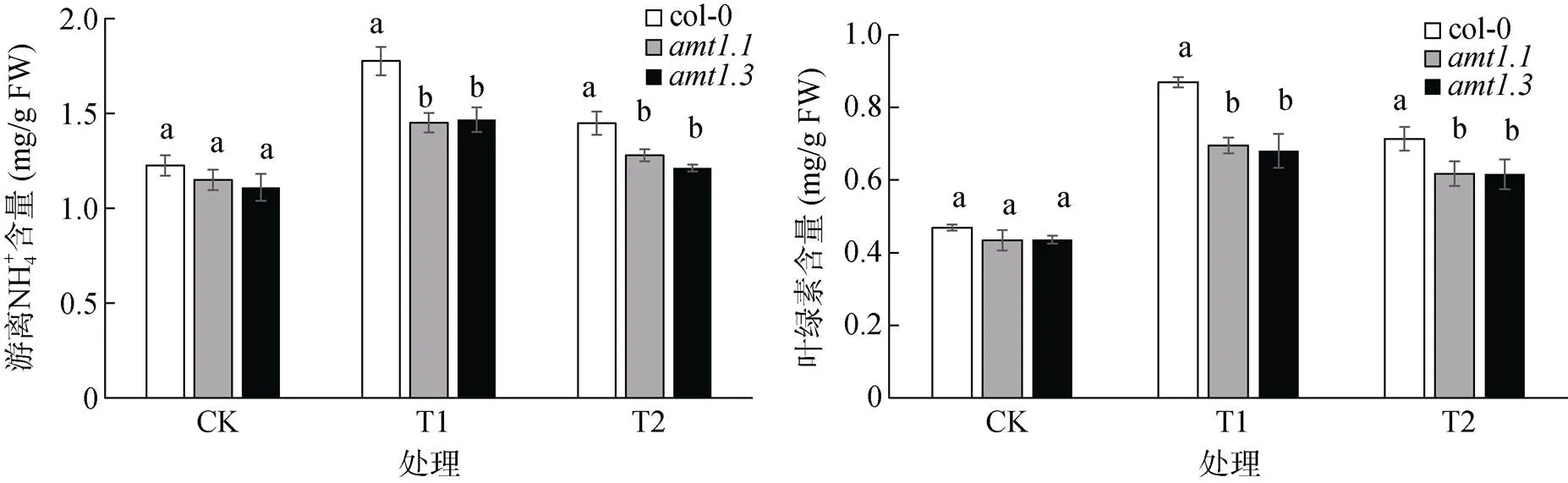
图3 外源蔗糖对高NH4+ 胁迫下拟南芥植株的游离NH4+ 和叶绿素含量的影响
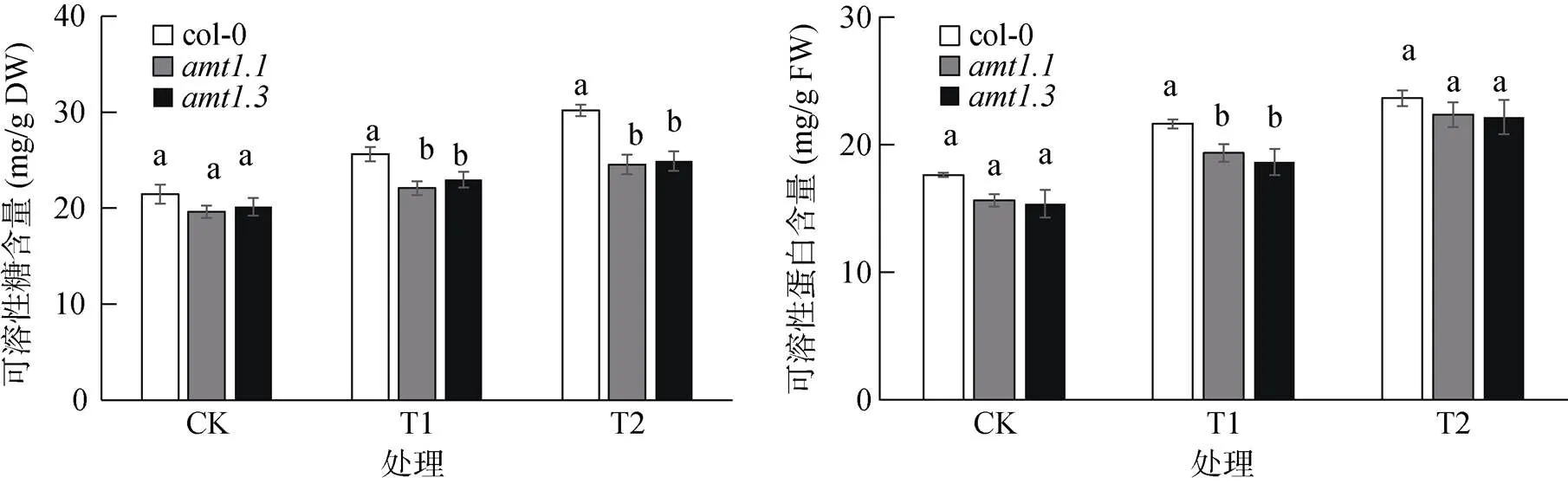
图4 外源蔗糖对高NH4+ 胁迫下拟南芥植株可溶性糖和可溶性蛋白含量的影响
和CK处理相比,T1处理下,col-0、和植株的可溶性蛋白含量都出现增加,分别增加了22.8%、21.8% 和23.2%;col-0和、植株间达到显著性差异。与T1处理相比,T2处理下,3种植株的可溶性蛋白含量出现增加,分别增加了9.2%、15.5% 和18.9%。CK和T2处理下,col-0和、植株间差异不显著。
高NH4+胁迫下,拟南芥植株的可溶性糖含量和可溶性蛋白含量会出现增加,添加外源蔗糖在一定程度上增加了植株体内可溶性糖和可溶性蛋白含量,从而增加植株的碳水化合物含量,维持细胞内渗透压的平衡,从而提高了植物的抗逆性,同时为氮代谢提供碳源,维持碳氮代谢。
2.5 外源蔗糖对高NH4+ 胁迫下拟南芥植株GS和GDH活性的影响
GS、GDH是氮代谢中的关键酶,GS是无机氮转化为有机氮的关键酶,GDH是连接碳、氮代谢的关键点。从图5可知,与CK处理相比,T1处理下,叶片中GS的活性呈现大幅度的降低,col-0、和植株分别下降了35.1%、35.6% 和29.2%,其中col-0植株的降低幅度最大,说明高NH4+胁迫降低了GS的活性,对col-0植株的胁迫最为明显,但是3个株系植株之间并没有显著性差异;与T1处理相比,T2处理下,3个株系植株的GS活性出现不同程度的增加,分别提高了38.1%、44.8% 和35.8%,说明外源蔗糖可以提高植株中GS的活性,促进植物中无机氮转化为有机氮的过程。
与CK处理相比,T1处理下,col-0、和植株的GDH活性分别降低了30.6%、17.3%和10.6%,其中col-0植株的降低幅度最为显著,3个株系植株之间达到显著性差异;与T1处理相比,T2处理下提高了植物的GDH活性,3个株系植株分别提高了38.5%、19.7% 和12.1%,其中col-0植株的提高幅度最大,表明外源蔗糖可以一定程度上提高植物中GDH活性,对col-0植株的GDH活性提高最为明显。

图5 外源蔗糖对高NH4+ 胁迫下拟南芥植株的GS和GDH活性的影响
2.6 外源添加蔗糖对高NH4+ 胁迫下植株矿质元素含量的影响
表2是外源添加蔗糖后,植物体内矿质元素的含量。从表2中可知,3个株系植株的氮、磷、钾、钙含量变化规律都为T2>T1>CK。与CK处理相比,T1处理下拟南芥植株的氮含量增加,3个株系分别增加了49.6%、23.9% 和25.9%;与T1处理相比,T2处理下,植株氮含量显著增加了20.0%、30.1% 和34.8%。对于植株磷含量,T1处理下比CK处理增加了41.7%、32.9% 和28.1%;T2处理下,和T1处理相比,分别增加了25.7%、11.1% 和1.7%。对于植株钾含量,与CK处理相比,T1处理下col-0、、植株分别增加了11.2%、16.1% 和13.8%;与T1处理相比,T2处理下分别增加了14.0%、9.8% 和8.8%。对于植株钙含量,变化幅度和其他元素相比较低,与CK处理相比,T1处理下col-0、、植株分别增加了1.0%、1.9% 和5.2%,T2处理和T1处理相比提高了1.6%、3.8% 和1.3%。高NH4+胁迫下,植株的氮、磷、钾、钙含量都表现出不同程度的增加,外源添加蔗糖后,氮、磷、钾、钙含量也都出现不同幅度的提高。

表2 外源蔗糖对高NH4+ 胁迫下拟南芥植株矿质元素含量的影响(mg/g, FW)
注:表中同行不同小写字母表示相同处理下不同株系植株间差异在<0.05水平显著。
植株镁含量的变化规律是CK>T2>T1,与CK处理相比,T1处理下降低了20.3%、8.1% 和5.6%,T2处理和T1处理相比,分别提高了1.0%、8.0% 和4.0%,高NH4+胁迫下植株镁含量减少,外源添加蔗糖在一定程度上提高了植株镁含量。植株铁含量的变化规律是T1>CK>T2,和CK处理相比,T1处理下,植株铁含量分别增加了37.5%、40.0% 和13.7%,T2处理和T1处理相比减少了30.3%、31.4% 和36.3%。高NH4+胁迫下植株铁含量增加,外源添加蔗糖在一定程度下减少植株的铁含量。
3 讨论
氮是植物生长发育所必需的营养元素[25-26]。而NH4+是植物重要的氮素来源之一,但是其在植株体内的过量累积会对植株造成伤害。植物的鲜重可直观地反映植株生长状况[27-28]。高浓度的NH4+甚至还抑制植物的生长,降低植株的含水量及产量[29-30]。Togoro等[31]试验结果表明,供应NH4+的植株体内非常容易积累大量的游离NH4+,猜测这可能是植株生长受到抑制的原因之一。缺失AMT会导致植物的NH4+吸收能力显著下降[11]。叶绿素含量也是反映植物体中氮含量的一个重要指标。李保海和施卫明[32]报道高NH4+能增加拟南芥植株的叶绿素含量。罗金葵等[33]也报道适当增加NH4+会提高小白菜的叶绿素含量,促进叶面积的生长,随NH4+浓度升高叶绿素含量逐渐变高。本文试验结果也与之符合,高NH4+胁迫下拟南芥植株的鲜重减少,体内游离NH4+积累量增多,叶绿素含量增加。col-0和、植株相比,受高NH4+毒害更为严重,可能是因为和植株缺失相关AMT基因,NH4+吸收能力降低,游离NH4+积累较少,从而降低了高NH4+毒害。
本试验中,高NH4+胁迫的同时外源添加蔗糖可以显著缓解高NH4+对植株生长的抑制作用。为了排除因为蔗糖本身营养对植株鲜重的提高,在试验前进行了正常NH4+外源添加5% 蔗糖处理,结果显示,该处理植物的鲜重、氮含量和CK处理相比,并没有显著性差异(数据未显示),因此排除因为蔗糖营养的缘故。现有大量研究表明[34-36],植株在逆境胁迫下会通过渗透调节来适应环境,而可溶性糖、可溶性蛋白和游离脯氨酸作为植物体内重要的渗透调节物质均可作为衡量植物抗逆性的指标。常丽丽等[17]报道外源蔗糖可以缓解高NO– 3 胁迫对叶用莴苣生长的抑制,提高叶用莴苣的可溶性糖含量,降低NH4+含量;李小刚[37]通过叶面喷施蔗糖提高了NO– 3胁迫下黄瓜幼苗中碳水化合物含量,提高了碳、氮代谢相关酶活性。而本试验中,在T1高NH4+胁迫处理下,拟南芥可溶性糖和可溶性蛋白含量增加,可能是植物为了更好地适应高NH4+胁迫,通过渗透调节缓解高NH4+胁迫的影响;T2处理下外源添加蔗糖后,拟南芥植株中可溶性糖和可溶性蛋白含量增加,说明外源蔗糖可以使植株中的碳水化合物含量增加,维持细胞内渗透压平衡,从而提高植株的抗逆性,同时为氮代谢提供碳源,维持碳、氮平衡。
GS在植物体内主要参与无机氮转化为有机氮这一过程,在ATP供能下,催化NH4+和谷氨酸合成可溶性物质[38]。因此,植物GS基因表达受到NH4+的影响,会因植物种类、NH4+浓度及器官的不同而表现出不同的情况,有些植物里面NH4+即可诱导GS基因的表达,增加GS的活性,而在另外一些植物中则会抑制其GS基因的表达,降低GS的活性[39-41]。本试验中,高NH4+胁迫下降低了GS活性,抑制了无机氮转化为有机氮的过程,从而抑制了整个植株的氮代谢过程,外源添加蔗糖可以提高GS活性,缓解高NH4+胁迫对氮代谢的抑制。GDH是连接碳、氮代谢的关键酶[42],一般在植物体内氨浓度较高时起作用。在本研究中,与T1处理相比,T2处理增加外源添加蔗糖后,GDH活性增加,可能是由于高NH4+胁迫下植株体内NH4+含量增加,而外源蔗糖可以通过提高GDH的活性来转化植株体内的NH4+,提高植株对氮的利用率,减轻NH4+毒性,同时为氨同化提供碳骨架。
盐逆境条件下,植株体内的离子含量发生改变,会对原来的离子平衡关系造成影响,对植株的生长发育产生不利的影响[43]。研究表明,硝酸盐胁迫下,黄瓜叶片中钙、钾含量增加,铁、镁含量降低[44]。本研究结果表明,高NH4+处理下,添加外源蔗糖后,拟南芥植株的氮、磷、钾、钙、镁含量都出现增加,其中氮、磷、钾含量增加比较显著。氮含量增加,表明植株利用氮的能力增强,加快植株对氮的吸收利用,一定程度上缓解了高NH4+毒害。但外源蔗糖不能提高植株铁含量。已有文献报道[45],高NH4+胁迫会降低植株的含钾量,而本试验中随着NH4+浓度的增加,植株含钾量也随之增加,推测可能是因为本试验测定的是以鲜重为基础的含钾量,高NH4+降低了植株的含水量,因此植株鲜重的含钾量增加。高NH4+胁迫显著抑制了拟南芥的生长,影响了矿质元素在植株中的含量,外源蔗糖可缓解高NH4+胁迫对拟南芥生长的抑制作用,并提高了各矿质元素的含量,说明外源蔗糖可通过影响矿质元素的吸收积累,维持离子之间的平衡,减轻高NH4+胁迫对拟南芥的毒害作用。
4 结论
NH4+胁迫显著抑制了拟南芥植株的生长,外源添加蔗糖可以缓解高NH4+胁迫的抑制,这可能是由于外源蔗糖可以提高植株体内碳水化合物的含量,维持细胞内渗透压平衡,从而提高植株的抗逆性;另外,外源蔗糖处理增加了GS和GDH活性,加速氨同化作用,减少植株体内游离NH4+含量;其还可以通过矿质元素的吸收积累,减轻高NH4+胁迫对拟南芥的毒害作用。
[1] 宋建民, 田纪春, 赵世杰. 植物光合碳和氮代谢之间的关系及其调节[J]. 植物生理学通讯, 1998, 34(3): 3–5.
[2] 李宝珍, 范晓荣, 徐国华. 植物吸收利用铵态氮和硝态氮的分子调控[J]. 植物生理学通讯, 2009, 45(1): 80–88.
[3] 陈琪, 刘之广, 张民, 等. 包膜磷酸二铵配施黄腐酸提高小麦产量及土壤养分供应强度[J]. 土壤学报, 2018, 55(6): 1472–1484.
[4] Nitrate-ammonium synergism in rice. A subcellular flux analysis[J]. Plant Physiology, 1999, 119(3): 1041– 1046.
[5] Masclaux-Daubresse C, Reisdorf-Cren M, Pageau K, et al. Glutamine synthetase-glutamate synthase pathway and glutamate dehydrogenase play distinct roles in the sink-source nitrogen cycle in tobacco[J]. Plant Physiology, 2006, 140(2): 444–456.
[6] Siddiqi M Y, Malhotra B, Min X J, et al. Effects of ammonium and inorganic carbon enrichment on growth and yield of a hydroponic tomato crop[J]. Journal of Plant Nutrition and Soil Science, 2002, 165(2): 191–197.
[7] Britto D T, Kronzucker H J. NH4+toxicity in higher plants: A critical review[J]. Journal of Plant Physiology, 2002, 159(6):567–584.
[8] Krupa S V. Effects of atmospheric ammonia (NH3) on terrestrial vegetation: A review[J]. Environmental Pollution, 2003, 124(2):179–221.
[9] Loqué D, von Wirén N. Regulatory levels for the transport of ammonium in plant roots[J]. Journal of Experimental Botany, 2004, 55(401): 1293–1305.
[10] 李素梅, 施卫明. 水稻铵转运蛋白基因OsAMT1;2的启动子分析[J]. 土壤, 2018, 50(3): 455–461.
[11] 燕金香. 水稻铵离子与钾离子吸收的交互作用研究[D]. 北京: 中国农业科学院, 2018.
[12] Huppe H C, Turpin D H. Integration of carbon and nitrogen metabolism in plant and algal cells[J]. Annual Review of Plant Physiology and Plant Molecular Biology, 1994, 45(1): 577–607.
[13] 谢祝捷, 姜东, 戴廷波, 等. 植物的糖信号及其对碳氮代谢基因的调控[J]. 植物生理学通讯, 2002, 38(4): 399– 405.
[14] Rolland F, Moore B, Sheen J. Sugar sensing and signaling in plants[J]. The Plant Cell, 2002, 14(suppl 1): S185–S205.
[15] Vincentz M, Moureaux T, Leydecker M T, et al. Regulation of nitrate and nitrite reductase expression inleaves by nitrogen and carbon metabolites[J]. The Plant Journal, 1993, 3(2): 315–324.
[16] Morcuende R, Krapp A, Hurry V, et al. Sucrose-feeding leads to increased rates of nitrate assimilation, increased rates of α-oxoglutarate synthesis, and increased synthesis of a wide spectrum of amino acids in tobacco leaves[J]. Planta, 1998, 206(3): 394–409.
[17] 常丽丽, 廖宗文, 陈日远, 等. 外源蔗糖对NO– 3胁迫下叶用莴苣碳氮代谢的影响[J]. 北方园艺: 2016, 1: 10–15.
[18] 刘峰, 施卫明. 拟南芥室内水培方法的改进[J]. 土壤, 2006, 38(1): 102–105.
[19] Yuan L X, Loqué D, Ye F H, et al. Nitrogen-dependent posttranscriptional regulation of the ammonium transporter AtAMT1;1[J]. Plant Physiology, 2007, 143(2): 732–744.
[20] Takakura K I, Nishio T. Safer DNA extraction from plant tissues using sucrose buffer and glass fiber filter[J]. Journal of Plant Research, 2012, 125(6): 805–807.
[21] Smith D S, Maxwell P W, de Boer S H. Comparison of several methods for the extraction of DNA from potatoes and potato-derived products[J]. Journal of Agricultural and Food Chemistry, 2005, 53(26): 9848–9859.
[22] 李合生. 植物生理生化实验原理与技术[M]. 北京: 高等教育出版社, 1999.
[23] 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000.
[24] Magalhaes J R, Huber D M. Response of ammonium assimilation enzymes to nitrogen form treatment in different plant species [J]. Journal of Plant Nutrition, 1991, 14: 175-185.
[25] 程谊, 张金波, 蔡祖聪. 气候-土壤-作物之间氮形态契合在氮肥管理中的关键作用[J]. 土壤学报, 2019, 56(3): 507–515.
[26] 孙海军, 闵炬, 施卫明, 等. 硝化抑制剂影响小麦产量、N2O与NH3排放的研究[J]. 土壤, 2017, 49(5): 876–881.
[27] Ni L Y. Growth ofunder low-light stress in eutrophic water[J]. Journal of Freshwater Ecology, 2001, 16(2): 249–256.
[28] Ni L Y. Effects of water column nutrient enrichment on the growth ofA. Been[J]. Journal of Aquatic Plant Management, 2001, 39(1): 83–87.
[29] Britto D T, Kronzucker H J. NH4+toxicity in higher plants: A critical review[J]. Journal of Plant Physiology, 2002, 159(6): 567–584.
[30] Gerendás J, Zhu Z J, Bendixen R, et al. Physiological and biochemical processes related to ammonium toxicity in higher plants[J]. Zeitschrift Für Pflanzenernährung Und Bodenkunde, 1997, 160(2): 239–251.
[31] Togoro H, Hiroshi T, Yoshio Y. Effect of nitrogen source on the chemical components in young plants[J]. Soil Science Plant Nutrition,1968,14: 47–55
[32] 李保海, 施卫明. 拟南芥幼苗对高NH4+响应的特征及不同生态型间的差异[J]. 土壤学报, 2007, 44(3): 508–515.
[33] 罗金葵, 陈巍, 张攀伟, 等. 增铵对小白菜生长和叶绿素含量的影响[J]. 土壤学报, 2005, 42(4): 614–618.
[34] 匡艺, 李廷轩, 余海英. 氮素对不同氮效率小黑麦基因型叶片保护酶活性和膜脂过氧化的影响[J]. 草业学报, 2011, 20(6): 93–100.
[35] 孙群, 梁宗锁, 王渭玲, 等. 氮对水分亏缺下玉米幼苗膜脂过氧化及光合速率的影响[J]. 西北农业学报, 2001, 10(1): 7–10.
[36] 王贺正, 张均, 吴金芝, 等. 不同氮素水平对小麦旗叶生理特性和产量的影响[J]. 草业学报, 2013, 22(4): 69–75.
[37] 李小刚. 外源蔗糖对NO– 3胁迫下黄瓜幼苗生长及生理生化特性的影响[D]. 泰安: 山东农业大学, 2011.
[38] Miflin B J, Habash D Z. The role of glutamine synthetase and glutamate dehydrogenase in nitrogen assimilation and possibilities for improvement in the nitrogen utilization of crops[J]. Journal of Experimental Botany, 2002, 53(370): 979–987.
[39] Hayakawa T, Kamachi K, Oikawa M, et al. Response of glutamine synthetase and glutamate synthase isoforms to nitrogen sources in rice cell cultures[J]. Plant and Cell Physiology, 1990, 31(8): 1071–1077.
[40] Zhang C F, Peng S B, Peng X X, et al. Response of glutamine synthetase isoforms to nitrogen sources in rice (L.) roots[J]. Plant Science, 1997, 125(2): 163–170.
[41] Chen W J. Expression of glutamine synthetase genes fromL. in transgenic plants[D]. London: Imperial College of Science and Technology, 1990
[42] 张国英. 不同氮素水平处理对水稻碳氮代谢关键酶GS和GDH活性及表达的影响[D]. 福州: 福建农林大学, 2012.
[43] 王素平, 贾永霞, 郭世荣, 等. 多胺对盐胁迫下黄瓜(L.)幼苗体内K+、Na+和Cl-含量及器官间分布的影响[J]. 生态学报, 2007, 27(3): 1122– 1129.
[44] 高青海. LaCl3缓解黄瓜硝酸盐胁迫生理机制的研究[D]. 泰安: 山东农业大学, 2008.
[45] Balkos K D, Britto D T, Kronzucker H J. Optimization of ammonium acquisition and metabolism by potassium in rice (L. cv. IR-72)[J]. Plant, Cell & Environment, 2010, 33(1): 23–34.
Effect of Exogenous Sucrose on Nitrogen and Carbon Metabolism ofUnder High NHStress
LI Yi1,2, YANG Shunying1, HAO Dongli1, SU Yanhua1*
(1 State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China; 2 University of Chinese Academy of Sciences, Beijing 100049, China)
col-0,andwere used as materials. By adding 0% (T1) or 5% (T2) sucrose to the culture solution, the influences of exogenous sucrose on nitrogen and carbon metabolism of threelines in nutrient solution under 20 mmol/L NH4+were investigated. Plants grown under 4 mmol/L NH4+were used as controls (CK). The fresh weight, the contents of chlorophyll, NH4+, soluble sugar and protein, the activity of glutamine synthetase (GS) and glutamate dehydrogenase (GDH), the mineral element contents of aboveground parts ofwere determined in this study. The results showed that, the growth of threelines was significantly restrained under 20 mmol/L NH4+condition (T1) compared with 4 mmol/L NH4+(CK). With the increasing of NH4+concentration, the fresh weight and the GS and GDH activities were reduced, but the contents of NH4+, chlorophyll, soluble sugar, soluble proteins, N, P, K and Ca ofwere increased, while the contents of Mg and Fe ofwere reduced. Compared withand, col-0 was more sensitive to high NH4+. Compared with T1 treatment, T2 treatment increased the fresh weight of, significantly increased the contents of soluble sugar and protein, enhanced the activities of GS and GDH, reduced the contents of NH4+and chlorophyll of, increased the contents of N, P, K, Ca and Mg but reduced the content of Fe in. Compared withand, exogenous addition of sucrose (T2) showed a better alleviation effect on high NH4+-stress in col-0.
Sucrose; High NH4+stress;;Carbon metabolism; Nitrogen metabolism
Q945.1
A
10.13758/j.cnki.tr.2020.06.004
李祎, 杨顺瑛, 郝东利, 等. 外源蔗糖对高NH4+胁迫下拟南芥碳氮代谢的影响. 土壤, 2020, 52(6): 1120–1128.
中国科学院南京土壤研究所“一三五”计划和领域前沿项目(ISSASIP1609)资助。
(yhsu@issas.ac.cn)
李祎(1988—),女,江苏扬州人,博士研究生,主要从事植物铵吸收同化的分子机制及调控研究。E-mail: liyi@issas.ac.cn
