口腔扁平苔藓患者血清和唾液中IL-1β、IL-5、IL-8、IL-12和 IFN-α的变化及临床意义
2021-01-05柳惠荣
柳惠荣

[摘要] 目的 研究口腔扁平苔藓(OLP)患者血清和唾液中IL-1β、IL-5、IL-8、IL-12和 IFN-α浓度变化及其临床意义。 方法 選取2017年6月至2020年8月就诊于菏泽市中医医院口腔科门诊的31例患者,分为糜烂型(EOLP)和非糜烂型(NEOLP)两组,健康志愿者30名(对照组)。采用流式微球分析方法(CBA)应用流式细胞仪测定血清和唾液标本IL-1β、IL-5、IL-8、IL-12和 IFN-α浓度。 结果 分别与健康对照组比较,治疗前EOLP组、NEOLP组血清和唾液中IL-8细胞因子浓度差异有统计学意义(P<0.05),而EOLP组和NEOLP组比较,差异无统计学意义(P>0.05);三组之间IL-1β、IL-5、IL-12和 IFN-α细胞因子浓度比较,差异无统计学意义(P>0.05)。三组血清和唾液各细胞因子浓度之间呈正相关,但相关程度较低(P>0.05)。 结论 血清和唾液中IL-8增高是促进OLP病理变化的部分原因。
[关键词] 扁平苔藓;口腔;白介素-1β;白介素-5;白介素-8;白介素-12;干扰素-α;流式微球分析方法
[中图分类号] R781.5 [文献标识码] A [文章编号] 1673-9701(2021)30-0034-05
[Abstract] Objective To study the concentrations changes of IL-1β,IL-5,IL-8,IL-12 and IFN-α in serum and saliva of patients with oral lichen planus (OLP) and their clinical significance. Methods A total of 31 patients who were admitted to the stomatology clinic in Heze Hospital of Traditional Chinese Medicine from June 2017 to August 2020 were selected and divided into two groups:the erosive oral lichen planus (EOLP) group and the non-erosive oral lichen planus (NEOLP) group. Another 30 healthy volunteers were selected as the control group. The concentrations of IL-1β,IL-5,IL-8,IL-12 and IFN-α in serum and saliva specimens were determined by cytometric bead array (CBA) using a flow cytometer. Results According to the separate comparison of the healthy control group with EOLP group or the NEOLP group before treatment,there were statistically significant differences in terms of IL-8 cytokine concentrations in serum and saliva (P<0.05),while the difference between the EOLP group and the NEOLP group was not statistically significant (P>0.05). There were no statistically significant differences in terms of concentrations of IL-1β,IL-5,IL-12 and IFN-α among the three groups (P>0.05). There was low positive correlation in terms of correlation with cytokine concentrations in serum and saliva among the three groups (P>0.05). Conclusion The increase in concentration of IL-8 in serum and saliva is part of the reason that promotes the pathological changes of OLP.
[Key words] Lichen planus; Oral cavity; Interleukin-1β; Interleukin-5; Interleukin-8; Interleukin-12; Interferon-α; Cytometric bead array
口腔扁平苔藓(Oral lichen planus,OLP)是一种常见的慢性口腔黏膜皮肤疾病,其发病与精神因素(如疲劳、焦虑、紧张)、免疫因素、内分泌因素、感染因素、微循环障碍等因素有关。一般根据病变黏膜的受损情况分为糜烂型(Erosive oral lichen planus,EOLP)和非糜烂型(Non-erosive oral lichen planus,NEOLP)。细胞因子主要包括一些小分子多肽,由多种免疫细胞分泌,在免疫应答过程中,细胞因子对于细胞之间相互作用、细胞的分化有重要调节作用。最近研究表明,OLP患者的黏膜损害因素中有细胞因子参与[1-2]。本研究应用流式细胞仪采用流式微球分析方法(Cytometric bead array,CBA)测定OLP患者血清和唾液中IL-1β、IL-5、IL-8、IL-12和 IFN-α细胞因子的水平,有利于更深入地了解OLP的发病机制,现报道如下。
1 资料与方法
1.1一般资料
选取2017年6月至2020年8月就诊于菏泽市中医医院口腔科门诊的OLP患者31例,其中NEOLP型16例,男7例,女9例,中位年龄39(17~64)岁; EOLP型15例,男6例,女9例,中位年龄38(17~62)岁。以我院健康志愿者30名作为正常对照,男14例,女16例,中位年龄39(17~64)岁。所有研究对象均签署知情同意书。三组一般资料比较,差异无统计学意义(P>0.05),具有可比性。
1.2 纳入标准
1.2.1 实验组纳入标准 经详细询问患者病史,常规口腔检查,根据临床表现、组织病理学检查,诊断为口腔扁平苔藓患者,并符合:①3个月内没有服药史;②无全身性疾病,如严重高血压、2型糖尿病、恶性肿瘤;③无OLP外的其他口腔黏膜疾病。
1.2.2 对照组纳入标准 同期至我院进行体检且体检结果显示身体健康,既往无扁平苔癣等疾病病史。
1.3方法
1.3.1 主要试剂和仪器 FACSCalibur流式细胞仪(BD公司,美国),细胞因子检测试剂盒(江西诺德医疗器械有限公司,中国)。
1.3.2 OLP组及健康组标本收集 ①静脉血采集:治疗前患者及对照组(体检者)早晨采血,空腹要求至少禁食8 h,离心(2500 g,15 min)后留取血清标本2 mL。②唾液标本采集:空腹于上午9:00收集非刺激性全唾液2 mL,立即进行离心(3500 g,15 min)后留取唾液标本。血清及唾液标本均贮存于-80℃待测。
1.3.3 IL-1β、IL-5、IL-8、IL-12和 IFN-α细胞因子浓度检测 在室温下进行实验,检测前取出标本置于室温(22℃~24℃),应用流式细胞仪分别检测血清和唾液中IL-1β、IL-5、IL-8、IL-12和 IFN-α细胞因子浓度。加25 μL捕获微球混合液于待测标本试管中,加入微球缓冲液25 μL,暗盒内放置30 min,之后加荧光检测试剂和待测样本各25 μL于试管中,旋涡振荡后暗盒内放置2.5 h。每个试管中加入1 mL磷酸盐缓冲溶液,离心(200 g,5 min),吸去上清,再加入0.3 mL磷酸盐缓冲溶液检测。
1.4 统计学方法
采用IBM SPSS Statistics 22.0版本统计学软件进行数据分析,符合正态分布的计量资料以均数±标准差(x±s)表示,各组指标间的差异应用One-way ANOVA方法分析,各组间数据两两比较应用Scheffe检验方法。P<0.05为差异有统计学意义。唾液和血清中的IL-1β、IL-5、IL-8、IL-12和 IFN-α细胞因子浓度间的相关性采用皮尔森相关系数进行相关性分析。
2 结果
2.1 OLP患者和健康对照组血清IL-1β、IL-5、IL-8、IL-12和 IFN-α浓度表达水平比较
NEOLP组和EOLP组血清IL-8浓度均高于对照组,差异有统计学意义(P<0.05),NEOLP组和EOLP组相比,差异无统计学意义(P>0.05);而三组IL-1β、IL-5、IL-12和 IFN-α浓度相比,差异均无统计学意义(P>0.05)。见表1。
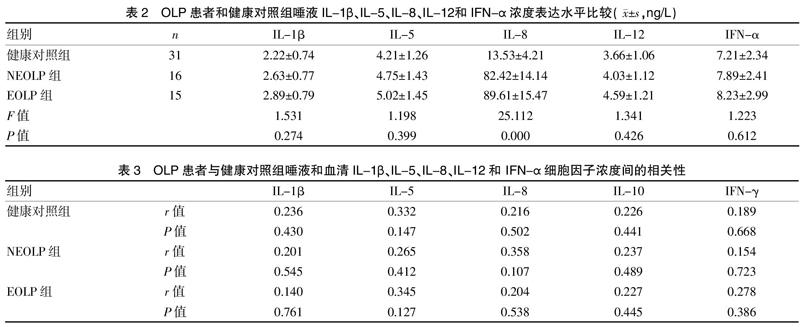
2.2 OLP患者和健康对照组唾液IL-1β、IL-5、IL-8、IL-12和 IFN-α浓度表达水平比较
与健康对照组比较, EOLP组、NEOLP组唾液中IL-8浓度差异有统计学意义(P<0.05),EOLP组和NEOLP组相比,差异无统计学意义(P>0.05);而三组之间IL-1β、IL-5、IL-12和IFN-α浓度相比,差异均无统计学意义(P>0.05)。见表2。
2.3 OLP患者与健康对照组唾液中和血清中的IL-1β、IL-5、IL-8、IL-12和IFN-α细胞因子浓度间的相关性
EOLP组、NEOLP组与健康对照组唾液和血清中的IL-1β、IL-5、IL-8、IL-12和 IFN-α细胞因子浓度呈正相关,但相关程度较低(P>0.05)。见表3。
3 讨论
OLP发病机制包括多种因素,目前倾向于免疫学说,即细胞介导的局部免疫应答紊乱在疾病的发生发展中发挥重要作用。OLP患者多无自觉症状,常偶然发现。有些患者遇热、酸、辛辣、咸味刺激时,局部敏感灼痛;或有木涩感、烧灼感,口干。临床上主要包括非糜烂型和糜烂型,这两种类型的发病机制是否不同,研究较少,本研究采用流式微球分析方法分别测定这两种类型的细胞因子浓度,以观察是否存在差异。CBA是集 ELISA 和细胞流式技术优点为一身的液相蛋白检测技术,其基本原理类似于ELISA的检测,即利用微小分散的颗粒捕获液体待测物,并利用流式细胞仪检测类似"三明治"的颗粒-待测物复合体所散发的荧光,从而测定待测物的数量。其优点为能够同时对多种蛋白进行定量检测,对样本需求量更少,检测更快速、更准确[2-3]。IL-1β是机体重要的炎症因子,主要由单核-巨噬细胞分泌,生物学作用包括两个方面,局部低浓度情况下发挥免疫调节,协同刺激抗原和T细胞活化,促进B细胞增殖和分泌抗体;高浓度产生发挥内分泌效应,诱导肝脏急性期蛋白合成,引起发热和恶病质。IL-1β與上皮间质转化(Epithelial-mesenchymal transition,EMT)过程关系密切。EMT通常发生在上皮细胞,表现为细胞连接与极性的丧失,获得间质细胞的表型特征。细胞表现为极性的丧失、黏附性降低、迁移能力增强,而这些正是肿瘤细胞的特征。通过EMT成像系统动态研究表明,在结直肠癌肿瘤细胞周围的炎症微环境中,巨噬细胞释放TNF-α和IL-1β,与肿瘤的EMT过程及疾病进展有关[4]。神经胶质瘤的肿瘤局部单核细胞释放的IL-1β和IL-18能够促进肿瘤的发展,小檗碱能够逆转EMT过程,抑制这些炎症细胞因子的产生,抑制胶质瘤细胞株U251和U87的迁移,导致细胞死亡[5]。本研究结果显示,OLP患者血清及唾液中IL-1β水平均无变化,推测IL-1β在OLP患者的病变过程中尤其是EMT过程未发挥重要作用。
IL-8由单核巨噬细胞分泌,其受体分为两类:趋化因子受体1和2(C-X-C chemokine receptor,CXCR1和CXCR2)。IL-8 是一种多功能因子,其生物学功能无种属特异性,主要介导细胞毒和局部炎症有关的免疫应答辅助抗体生成,参与细胞免疫及迟发型超敏型炎症的发生。IL-8可以吸引和激活中性粒细胞,中性粒细胞与IL-8接触后发生形态变化,定向游走到反应部位并释放一系列活性产物;这些作用可导致机体局部的炎症反应,达到杀菌和细胞损伤的目的。IL-8还可以招募嗜中性粒细胞,刺激血管生成和肿瘤细胞的增殖,较高的IL-8水平与肿瘤分级/分期更晚、肿瘤负荷更高有关。IL-8 还参与EMT变化,抑制肿瘤内的 IL-8 信号传导可延缓肿瘤进程并可增加多种实体瘤对临床化疗的敏感度[6]。部分OLP患者存在Akt/mTOR/pS6信号通路的活化,参与癌前病变的发生[7]。IL-8可通过自分泌和旁分泌方式,激活 AKT 信号通路,诱导EMT过程,IL-8不仅可以促进肿瘤细胞转移,更是预示癌症患者不良预后的细胞因子。体外实验表明,IL-8及其受体CXCR1 和 CXCR2与卵巢癌转移关系密切,IL-8通过激活Wnt/β-catenin信号通路,诱导EMT,促进卵巢癌细胞迁移。Reparixin是一种CXCR1/2抑制剂,可以逆转内源和外源性IL-8的这种作用[8]。体外实驗发现,牙龈卟啉单胞菌脂多糖(Porphyromonas gingivalis lipopolysaccharide,pg. LPS)刺激OLP患者的口腔成纤维母细胞(Myofibroblasts),其表达α-平滑肌肌动蛋白(α-SMA),可以分泌IL-6、IL-8和TNF-α等细胞因子[9]。
IL-5又称嗜酸性粒细胞分化因子,由活化T细胞产生,小鼠IL-5促进抗原刺激的B细胞分化为抗体合成细胞,促进抗体合成,IL-5对嗜酸性粒细胞的影响主要表现在分化、迁移、活化和存活等4个方面,在过敏性疾病及寄生虫感染后的病理损伤过程中,IL-5也发挥重要作用。IL-5还可以促使嗜酸粒细胞释放毒性蛋白,导致过敏性哮喘患者的气道反应性增高[10]。IL-5在OLP患者的变化及其发病中的作用研究较少。Wang等[11]报道OLP患者血清IL-5水平降低。本研究结果显示,OLP患者血清及唾液中IL-5水平均无变化,因此需要进一步研究。IL-12是一种具有多种生物学活性的免疫调节因子,促进Th0细胞向Th1细胞分化;能够刺激T细胞及NK细胞的增殖,促进细胞毒T细胞和NK细胞的活性,并促进其分泌IFN-γ、TNF-α等细胞因子,在抗肿瘤及抗感染中发挥重要作用。黄韵颖等[12]采用ELISA法测定OLP患者血清中IL-12与IL-27表达浓度均高于对照组,认为本病主要表现为细胞免疫功能受损为主,IL-12和IL-27浓度增高共同促进患者的炎症状态变化。本研究采用流式细胞术检测OLP患者血清及唾液中IL-12水平均无变化,是否与测定方法有关,尚需进一步研究。IFN-α由白细胞产生,在病毒感染的先天性免疫方面发挥作用,影响细胞增殖并调节免疫应答,如肿瘤浸润巨噬细胞中IFN-α的高表达可以导致树突状细胞活化增强、免疫效应细胞毒作用增强。IFN-α参与扁平苔藓的病理变化[13],但在OLP患者中是否参与及如何参与黏膜病理变化尚不清楚。本研究表明OLP患者血清及唾液中IFN-α水平均无变化。
本研究采用流式细胞术OLP患者血清及唾液中IL-1β、IL-5、IL-8、IL-12和 IFN-α 5种细胞因子浓度变化,只有血清和唾液中IL-8浓度增高,因此推测IL-8是参与OLP疾病发生发展的部分原因。既往研究采用流式细胞术测定OLP患者IL-2、IL-4、IL-6、IL-10、IL-17A、TNF-α和 IFN-γ共7种细胞因子的水平,发现血清和唾液中IL-4、IL-6、IL-17A和TNF-α增高,推测这些细胞因子增高参与患者口腔局部病理变化(资料待发表)。OLP患者IL-8浓度水平在唾液中比在血清中增高明显,与测定血清相比,唾液标本采集更加方便,测定唾液中IL-8水平有助于疾病活动量化的可能,便于治疗效果评价[14]。IL-8中和抗体,如ABX-IL8和HuMax-IL8治疗肿瘤的研究较多。为探讨抗IL-8在三阴乳腺癌的治疗作用机制,在体内和体外紧密连接蛋白低表达型(Claudin-low)乳腺癌模型中,IL-8中和抗体HuMax-IL8能够抑制肿瘤部位中性粒细胞和髓源性抑制细胞的活化和浸润,逆转间充质化(Mesenchymalization),阻止肿瘤生长和转移。在体外实验中,HuMax-IL8还能够增强NK和抗原特异性T细胞溶解肿瘤的敏感性[15]。HuMax-IL8治疗已经转移恶性肿瘤的Ⅰ期临床试验中,HuMax-IL8的安全性和耐受性良好,可以降低血清中增高的IL8,稳定治疗效果[16]。本研究结果显示,OLP患者血清和唾液中IL-8水平均增高,与国外报道一致[17]。国外研究发现,与健康人相比,OLP患者血清和唾液中IL-8水平增高,血清IL-8水平增高程度与疾病严重性相关,随访发现血清IL-8水平持续增高与癌变进展相关,降低IL-8水平的措施可能改善病情,阻断疾病进展,减少癌变可能,针对IL-8的中和抗体有可能为治疗OLP患者提供新的途径。地塞米松可以降低EOLP患者唾液中IL-8水平,部分揭示了地塞米松治疗OLP的作用机制,但是否能够降低血清中IL-8水平,以及对于NEOLP患者作用如何,尚不明确。慢性牙周炎血清IL-6、IL-8及TNF-α水平均增高,替硝唑联合盐酸米诺环素治疗后血清IL-6、IL-8及TNF-α水平均显著降低,表明这些药物可以有效调节血清炎症因子水平,降低炎症反应,改善牙周指标水平,缓解患者症状[18]。对于OLP患者,这些药物是否能够同样降低细胞因子水平,需进一步研究。中医药治疗本病可分为局部治疗和全身治疗,局部治疗对于糜烂溃疡型可使用养阴生肌散等药物;全身治疗以辨证论治为治则,根据不同辨证分型用药。如利湿健脾祛瘀汤可以有效改善OLP患者的临床症状,降低血清IL-8和TNF-α等炎症细胞因子水平,取得良好治疗效果[19]。因此,采用中西医结合的治疗措施是提高OLP疗效的有效途径,对于IL-8升高的难治性OLP患者,采用抗IL-8治疗是否能够取得满意治疗效果,尚需进一步研究。
参考文献
[1] Oberti L,Lucchese A,Petruzzi M,et al. Clinical management of oral lichen planus:A systematic review[J]. Mini Rev Med Chem,2019,19(13):1049-1059.
[2] Wei W,Sun Q,Deng YW,et al. Mixed and inhomogeneous expression profile of Th1/Th2 related cytokines detected by cytometric bead array in the saliva of patients with oral lichen planus[J]. Oral Surg Oral Med Oral Pathol Oral Radiol,2018,126(2):142-151.
[3] Bai R,Tao L,Li B,et al. Using cytometric bead arrays to detect cytokines in the serum of patients with different types of pulmonary tuberculosis[J]. Int J Immunopathol Pharmaco,2019,33:1-5.
[4] Ieda T,Tazawa H,Okabayashi H,et al. Visualization of epithelial-mesenchymal transition in an inflammatory microenvironment-colorectal cancer network[J]. Sci Rep,2019, 9(1):16 378-16 389.
[5] Tong L,Xie C,Wei Y,et al. Antitumor effects of berberine on gliomas via inactivation of caspase-1-mediated IL-1β and IL-18 release[J]. Front Oncol,2019,9(364):1-13.
[6] Zhao Z,Wang S,Lin Y,et al. Epithelial-mesenchymal transition in cancer:Role of the IL-8/IL-8R axis[J]. Oncol Lett,2017,13(6):4577-4584.
[7] Prodromidis G,Nikitakis NG,Sklavounou A. Immunohistochemical analysis of the activation status of the Akt/mTOR/pS6 signaling pathway in oral lichen planus[J]. Int J Dent,2013,2013:743 456-743 471.
[8] Wen J,Zhao Z,Huang L,et al. IL-8 promotes cell migration through regulating EMT by activating the Wnt/β-catenin pathway in ovarian cancer[J]. J Cell Mol Med,2020,24(2):1588-1598.
[9] Wang LP,Yang YS,Xiong XQ,et al. Oral lichen-planus-associated fibroblasts acquire myofibroblast characteristics and secrete pro-inflammatory cytokines in response to Porphyromonas gingivalis lipopolysaccharide stimulation[J]. BMC Oral Health,2018,18(1):197.
[10] Dougan M,Dranoff G,Dougan SK. GM-CSF,IL-3,and IL-5 family of cytokines:Regulators of inflammation[J]. Immunity,2019,50(4):796-811.
[11] Wang L,Wu W,Chen J,et al. MicroRNA microarray-based identification of involvement of miR-155 and miR-19a in development of oral lichen planus(OLP) by modulating Th1/Th2 balance via targeting eNOS and toll-like receptor 2(TLR2)[J]. Med Sci Monit,2018,24:3591-3603.
[12] 黃韵颖,周塑,蔡扬. 口腔扁平苔藓患者血清中白细胞介素-12和白细胞介素-27表达与免疫功能的相关性[J]. 华西口腔医学杂志,2016,34(2):140-144.
[13] Scheler M,Wenzel J,Tüting T,et al. Indoleamine 2,3-dioxygenase(IDO):The antagonist of type I interferon-driven skin inflammation?[J]. Am J Pathol,2007,171(6):1936-1943.
[14] Melguizo-Rodríguez,Costela-Ruiz VJ,Manzano-Moreno FJ,et al. Salivary biomarkers and their application in the diagnosis and monitoring of the most common oral pathologies[J]. Int J Mol Sci,2020,21(14):5173.
[15] Dominguez C,McCampbell KK,David JM,et al. Neutralization of IL-8 decreases tumor PMN-MDSCs and reduces mesenchymalization of claudin-low triple-negative breast cancer[J]. JCI Insight,2017,2(21):e94 296.
[16] Bilusic M,Heery CR,Collins JM,et al. Phase Ⅰ trial of HuMax-IL8(BMS-986253),an anti-IL-8 monoclonal antibody,in patients with metastatic or unresectable solid tumors[J]. J Immunother Cancer,2019,7(1):240.
[17] Mozaffari HR,Sharifi R,Mirbahari S,et al. A systematic review and meta-analysis study of salivary and serum interleukin-8 levels in oral lichen planus[J]. Postepy Dermatol Alergol,2018,35(6):599-604.
[18] 姚瑩. 替硝唑联合盐酸米诺环素对慢性牙周炎患者牙周指标及血清IL-8、TNF-α水平的影响[J]. 现代医学与健康研究电子杂志,2020,4(4):32-34.
[19] 郭宝辉,王景文,宋辉. 利湿健脾祛瘀汤结合西医常规疗法治疗口腔扁平苔藓临床研究[J]. 国际中医中药杂志,2019,41(11):1193-1196.
(收稿日期:2020-12-09)
