特洛细胞在动脉粥样硬化小鼠颈动脉血管损伤修复中的变化
2020-12-23景德龙姜秋燕肖园园许莹田虎济南市济钢医院济南500临沂金锣医院山东第一医科大学第一附属医院山东省千佛山医院
景德龙,姜秋燕,肖园园,许莹,田虎 济南市济钢医院,济南500;临沂金锣医院;山东第一医科大学第一附属医院(山东省千佛山医院)
自21世纪以来,随着全民生活水平的不断提高,高油脂、高盐饮食日益成为人民生活的常态,由此引发的心血管疾病发病率也不断升高[1]。动脉粥样硬化是一个由多种免疫细胞、炎症细胞共同参与的不可逆转的病理生理学过程,最终导致目标血管狭窄闭塞,引起相应组织、器官缺血坏死[2]。特洛细胞是20世纪初期发现的间质干细胞来源的新型细胞,具有形成三维网状支架结构的功能,在多种组织器官中发挥支撑作用;还具有为组织内实质细胞传递细胞间信号物质的作用,参与调节实质细胞的增殖、修复和凋亡过程[3,4]。已有研究在小鼠主动脉和颈动脉中发现特洛细胞的存在,并证实在多个特洛细胞之间可以形成三维网状结构,在维持血管壁正常结构方面发挥关键作用[5]。在临床外科实际工作中,我们发现动脉粥样硬化的患者术后血管壁恢复时间更长。而特洛细胞作为动脉血管壁内维持三维结构的重要细胞群,在动脉粥样硬化过程中是否出现形态结构的改变,是否参与粥样硬化的病理过程均尚未可知。为了深入了解特洛细胞在动脉粥样硬化血管锐性损伤修复过程中的变化,我们于2019年1月~2020年3月进行了如下研究。
1 材料与方法
1.1 材料 动物:雄性Apo E基因敲除(Apo E-/-)小鼠30只,6周龄,无特殊病原体级,体质量(39±6)g;正常SPF级小鼠30只,6周龄,体质量(40±9)g;实验动物均购于北京维通利华实验动物有限公司,每5只小鼠放于一个饲养箱内饲养,室温23 ℃、相对湿度55%,保证小鼠饮食饮水自由。主要试剂:二甲苯购于国药集团化学试剂有限公司;柠檬酸抗原修复液(pH 6.0,G1202)、BSA试剂(G5001)、CD117(1∶500稀释,GB11073)、血小板衍生生长因子受体(PDGFR,1∶200稀释,GB11261)、山羊抗兔二抗(1∶200稀释,G23303)均购于武汉赛维尔生物科技有限公司,CD34抗体(1∶3 000稀释,AB81289)购于美国Abcam公司。主要仪器:病理切片机(RM2016)购于上海徕卡仪器有限公司,动物便携式超声显像(CCS2022)购于北京Palmary电子仪器有限公司,荧光显微镜(XSP-C204)购于中国CIC公司。
1.2 动物分组及动脉粥样硬化建模 选择Apo E-/-小鼠30只作为观察组,采用高脂饮食的方法建立动脉粥样硬化小鼠模型[6]。高脂饮食10周后,应用动物便携式超声显像仪对小鼠颈动脉形成的粥样斑块进行测量,并确定动脉血管的狭窄程度,以小鼠颈动脉血管壁内粥样硬化斑块占据血管管径至少35%作为建模成功的标准。选择正常SPF级小鼠30只作为对照组,正常饮食喂养10周。
1.3 颈动脉损伤及修复处理 两组均保留3只小鼠作为术前对照,其余小鼠给予吸入性异氟烷进行全身麻醉前的诱导麻醉,待小鼠安静后,应用1%硫喷托纳注射液0.1 mL(0.9%生理盐水稀释,维持麻醉时间约20 min)进行腹腔内注射麻醉。麻醉成功后将小鼠置于无菌解剖台上,固定四肢及头部,常规消毒小鼠颈部,铺无菌巾。纵行切开小鼠颈部皮肤及皮下胸腺,裸露颈动脉血管,使用无损伤血管夹夹住动脉血管的两端,锐性切开部分颈动脉血管壁。在40倍电子显微镜下用10-0丝线将损伤血管缝合,确保缝合血管的血流通畅性,然后逐层缝合切口。术后切口处应用碘伏消毒,并涂抹托芬那酸膏和红霉素软膏。将小鼠放于温毯(约42 ℃)上进行麻醉复苏,术后均正常饮食,其他饲养条件不变。
1.4 颈动脉获取与处理 观察组和对照组术后存活数分别为24、26只,不明原因死亡分别为3、1只。术后8 h、48 h、21 d,观察组分别取7、8、9只,对照组分别取8、9、9只,参照1.3的方法进行麻醉。在小鼠气管旁钝性分离粘连组织,找到有缝合线结的颈动脉,在距离线结0.1 cm处上、下各放置血管夹,剪取血管夹之间的颈动脉血管,随即将标本放入通用标本固定液中保存。两组术前对照小鼠参照1.3的方法麻醉后取颈动脉标本。将小鼠颈部术口简单缝合,在麻醉状态下放入装有CO2的密闭瓶中处死。标本在固定液中保存6 h后取出,采用梯度乙醇脱水的方法对标本进行脱水处理,二甲苯和氯仿除去标本中的脱水剂。选取软石蜡对标本进行浸蜡和包埋,病理切片机将石腊块切成10 μm厚度的单张切片。
1.5 特洛细胞形态及数量观察 采用双标记免疫荧光染色法[7]。将两组颈动脉石蜡切片进行洗涤,置于盛满EDTA抗原修复缓冲液(pH 9.0)的修复盒中,于微波炉内进行抗原修复。使用组化笔在组织周围画圈(防止抗体流走),在圈内滴加自发荧光淬灭剂A液;常温孵育、滴加自发荧光淬灭剂B液,甩干后在圈内滴加10%正常兔血清均匀覆盖组织。室温封闭30 min,加入CD34、CD117、PDGFR一抗进行染色,最后经DAPI复染细胞核(表现为蓝色)。封片后荧光显色显微镜下观察细胞形态并进行拍照。CD34、CD117、PDGFR染色情况:对照组术后8 h标本CD34、CD117、PDGFR抗体荧光显色分别为红色、绿色、绿色,术后48 h、21 d均分别为绿色、红色、绿色;观察组术后8 h分别为绿色、红色、绿色,术后48 h分别为红色、红色、绿色,术后21 d分别为红色、绿色、绿色。同时选取面积大小为10 μm2的血管图像,对CD34阳性染色(CD34+)的特洛细胞进行计数,每个图像重复两次,取平均值。

2 结果
2.1 两组小鼠损伤后不同时间点颈动脉血管中特洛细胞形态变化比较 观察组和对照组术前绿色荧光的CD34+和PDGFR+特洛细胞均集中位于血管壁的外膜层中。术后8 h,观察组CD34+特洛细胞(绿色荧光)聚集在血管壁外膜损伤处,对照组血管壁外膜损伤处的CD34+特洛细胞(红色荧光)数量明显多于观察组,CD117+和PDGFR+特洛细胞也有相同表现,但细胞形态改变不明显。术后48 h,观察组CD117+特洛细胞(红色荧光)数量明显减少,细胞体扁平,由圆形或椭圆形变为细长的梭形,端足细长如丝;对照组CD34+(绿色荧光)和CD117+(红色荧光)特洛细胞形态较术后8 h无明显差别,端足形态无明显改变。术后21 d,观察组CD117+(绿色荧光)特洛细胞形态恢复至术前和术后8 h的形态,但特洛细胞数量较术后8 h明显减少;对照组CD34+(绿色荧光)、CD117+(红色荧光)和PDGFR+(绿色荧光)特洛细胞形态较术前无明显差别,数量无明显改变。
2.2 两组小鼠损伤后不同时间点颈动脉血管中特洛细胞数量比较 随着时间的推移,两组术后特洛细胞数量均呈现先升高后降低趋势。两组术前特洛细胞数量比较无明显差异(P>0.05)。观察组术后8 h特洛细胞数量高于术前,术后48 h和术后21 d特洛细胞数量均低于术前(P均<0.05);对照组术后8、48 h特洛细胞数量均高于术前(P均<0.05),术后21 d与术前比较无明显差异(P>0.05)。观察组术后8 h、48 h、21 d特洛细胞数量均低于对照组(P均<0.05)。见表1。
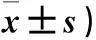
表1 两组小鼠损伤后不同时间点颈动脉血管中特洛细胞数量比较(个,
3 讨论
自特洛细胞被发现至今已有50余年的历史,目前研究重点多聚焦在这种特殊细胞的形态结构以及组织分布上[8, 9],关于特洛细胞在病理生理学方面的研究较少。虽然近几年来特洛细胞在皮肤免疫性硬化症、子宫肌瘤和肺纤维化的病理研究中有些进展,但是并没有从分子生物学的角度完全解释特洛细胞在疾病发生、发展过程中的各种改变[10, 11]。特洛细胞存在于动脉血管壁内,在动脉血管壁的外膜层和中膜层形成三维立体框架结构,支撑和维持血管的正常形态功能[12, 13]。目前,国内外关于特洛细胞免疫生物学指标的研究集中在CD34、CD117、PDGFR、VEGFR、CD28、CD31、Vimentin、Nanog和Sca-1等免疫标记抗体上,应用免疫荧光技术将标本中的组织染色后可以将组织中的特洛细胞和成纤维细胞、上皮细胞和巨噬细胞等常见细胞分离开来,再根据标记后细胞表现出的特殊形态结构将特洛细胞区分出来[14, 15]。虽然在不同的组织器官中,特洛细胞阳性表达的免疫生物学指标有所不同,但在小鼠动脉血管壁中特洛细胞阳性表达的免疫指标为CD34、CD117和PDGFR,这也是本研究应用CD34/CD117和CD34/PDGFR双标记免疫荧光染色法的理论基础。
动脉粥样硬化是发生于动脉血管壁的常见病理改变,粥样硬化斑块从动脉血管的损伤内膜开始,逐渐不可逆地向动脉外膜层进展。动脉粥样硬化过程中从内皮细胞开始发生细胞水样变性、脂肪样变性及泡沫样变性等病理学改变,变性的细胞逐渐增多并深达血管壁肌层,导致血管壁正常结构的退变及消失,弹性减弱甚至失去弹性[3,16,17]。在动脉粥样硬化疾病发生发展过程中,存在着大量正常细胞的变性坏死和炎性细胞浸润,而特洛细胞作为一种维持正常血管壁形态结构的功能性细胞,在动脉粥样硬化的病理发展过程中出现了细胞体脂肪样变性和水样变性,失去了细胞间广泛的连接。此时的血管如果受到损伤,在修复过程中受到脂质体侵蚀的细胞会因失去正常功能而影响血管壁修复[6]。
本研究结果显示,两组术前颈动脉血管中的特洛细胞数量无统计学差异,说明动脉粥样硬化并不会影响颈动脉血管中的特洛细胞数量。颈动脉血管损伤后修复过程中,对照组特洛细胞数量在术后8 h明显升高后又缓慢降低至损伤前水平,而观察组特洛细胞数量虽然也在术后8 h出现了升高趋势,但随着时间推移其数量明显降低,且观察组术后8 h、48 h和21 d特洛细胞数量均明显低于对照组。这说明在动脉粥样硬化小鼠颈动脉血管损伤修复的过程中,其特洛细胞数量明显少于正常小鼠。因此,特洛细胞参与了动脉粥样硬化小鼠的颈动脉血管损伤修复。本研究结果显示,观察组血管损伤修复过程中伴随着特洛细胞和端足形态改变,在损伤修复初期特洛细胞的细胞体由圆形或椭圆形变为细长的梭形,端足变得更加细长或消失,直到损伤修复后期(术后21 d)其细胞形态恢复至术前状态;但在正常动脉血管中,未发现上述特洛细胞形态的改变。分析原因,这可能与动脉粥样硬化过程中高血脂对血管壁的影响有关;在脂质体的影响下,特洛细胞的数量可能无法恢复到正常水平,从而延长了血管损伤后修复的时间。
综上所述,动脉粥样硬化并不会影响小鼠颈动脉血管中的特洛细胞数量,但动脉粥样硬化小鼠在颈动脉血管损伤修复过程中存在特洛细胞数量降低及形态异常。本研究仅从宏观角度阐述了特洛细胞在血管损伤修复过程中的数量变化规律,应用免疫生物学原理观察特洛细胞在血管修复不同阶段的形态改变,但只有应有透射电镜技术才能观察到特洛细胞内各种细胞器的种类改变及其在疾病不同阶段的超微结构改变[18, 19],这也是本研究的不足之处。在接下来的研究中,我们将从小鼠动脉粥样硬化血管的活体标本中分离特洛细胞,进行原代细胞培养,以达到从微观角度分析研究特洛细胞的目的。
