亚临界流体萃取富集金盏花中叶黄素工艺优化
2020-12-10刘小波张晓雪于长青贾鸿震张小燕
李 冰,刘小波,张晓雪,于长青,贾鸿震,张小燕,张 辉
(甘肃省轻工研究院有限责任公司,甘肃兰州 730030)
金盏花(CalendulaofficinalisL.)又名金盏菊,为菊科金盏菊属植物。其原产欧洲,18世纪后期传入我国,现已成为我国重要草本花卉之一[1]。金盏花不仅含有碳水化合物、脂肪、氨基酸等成分,而且含有类胡萝卜素、三萜皂甙和挥发油等活性成分[2-3]。其中叶黄素和叶黄素酯(维生素A原)为金盏花的主要成分,能够在人机体内通过转化产生可直接吸收的维生素A,可有效地预防和改善现代人长时间注视电脑、手机、电视所造成的眼疲劳[4-7]。叶黄素,又称植物黄体素,是一种广泛存在于蔬菜、花、水果和某些藻类生物中的天然色素,是目前广泛使用的食品色素之一,具有优良的抗氧化剂效果[8]。研究表明,它不仅是天然的着色剂,还具有保护视力、预防白内障、预防机体衰老引发的冠心病和癌症、防止动脉硬化及增强免疫力等重要作用[9-13]。叶黄素分子式为C40H56O2,由于叶黄素有多种同分异构体,人工合成工艺复杂,至今尚未成功,生产上只能从天然植物中提取得到[14-16]。
从天然植物中提取叶黄素主要采用传统的溶剂提取法[17]、超临界CO2流体萃取法[18-19]和微波辅助提取法[3]等,然而这些萃取方法大多有缺陷,难以实现规模化生产。近年来,亚临界溶剂萃取作为一种新型的提取方法,由于其溶剂残留低,且提取效率高,而被广泛应用于天然活性物质的提取。它与传统的溶剂法相比,克服了油脂提取后的精炼工艺,保留了有效成分的营养价值,提高了有效成分得率[20]。此外,与超临界CO2流体萃取法相比,亚临界流体萃取操作压力低,减少了设备投资和操作成本。同时1,1,1,2-四氟乙烷(R134a)的临界温度为101.1 ℃,临界压力为4.06 MPa,对极性物质具有强的溶解能力,同时扩散系数大、黏度系数小,在液态和临界点附近具有良好的溶剂性能,尤其适合天然原料的萃取[21]。目前,已有研究利用亚临界流体萃取技术从万寿菊中提取叶黄素的研究,但未见针对金盏花利用亚临界流体萃取叶黄素的研究。亚临界流体萃取工艺操作简单,提取高效、经济实用,特别适用于食品工业生物活性物质和热敏性物质的提取分离,适合金盏花中天然叶黄素的富集,工艺技术具有显著的优势[21-22]。因此,本研究借鉴其它天然色素萃取的现代化工艺技术,促使金盏花中叶黄素发挥更大的应用范围和使用价值。
综上,本研究以金盏花颗粒为原料,利用亚临界流体R134a萃取富集叶黄素,探讨金盏花颗粒尺寸、萃取时间、萃取压力、萃取温度和萃取次数对叶黄素萃取富集的影响,在此基础上利用Plackett-Burnman试验设计选出对其富集含量影响较大的3个因素,然后再运用响应面法优化确定亚临界R134a萃取富集叶黄素的最佳工艺参数,以期为金盏花中叶黄素的提取研究提供理论基础。
1 材料与方法
1.1 材料与仪器
金盏花圆柱形颗粒(直径5 mm,尺寸长度25 mm) 甘肃三一生物科技有限责任公司提供;叶黄素标准品(CAS号:127-40-2,纯度≥98.0%) 美国Solarbio公司;1,1,1,2-四氟乙烷(R134a)、环己烷(C6H12)、乙醚[(C2H5)2O]、正己烷(C6H10)、无水乙醇(C2H5OH)、甲基叔丁基醚(CH3OCC(CH3)3,MTBE)(均为色谱纯),二丁基羟基甲苯(C15H24O,BHT)、氢氧化钾(KOH)、碘(I2)(均为分析纯) 均购自国药集团化学试剂公司。
Agilent 1260高效液相色谱 北京京科瑞达科技有限公司;ES1035A型分析天平(感量0.01 mg和0.01 g) 厦门群隆仪器有限公司;24 L亚临界萃取中试成套定制设备 甘肃省轻工研究院有限责任公司;SHZ-D(III)型循环水真空泵 上海贝仑仪器设备有限公司;H1850型高速离心机 广州航信科学仪器有限公司。
1.2 实验方法
1.2.1 叶黄素的萃取富集工艺 将金盏花原料截成不同尺寸的颗粒。准确称量1.50 kg一定颗粒尺寸的金盏花原料加入萃取釜中,密封,进行抽真空,使压力表值为-0.6 MPa,即可完全排出萃取釜内空气。然后打开高压柱塞泵,将R134a经高压柱塞加压,再经过板式换热器加热到一定萃取温度后打入萃取釜,通过视镜观察液位淹没金盏花颗粒为止[21,23]。控制一定的萃取压力,始终使萃取溶剂R134a保持液态,然后萃取一定的时间,萃取1次,萃取完成后,通过切换阀门,将含有叶黄素的萃取物导入分离罐,然后通过加热使R134a不断的气化分离,同时打开压缩机将不断气化的R134a蒸汽通过系统隔膜压缩机压缩进入冷凝器冷凝液化后回收至溶剂储罐循环使用。而萃取富集成分通过分离放出,经过高速离心分离(4 ℃,3000 r/min,10 min)、过滤后得到含有叶黄素的金盏花萃取物。
1.2.2 单因素实验设计
1.2.2.1 颗粒尺寸 按照“1.2.1”的方法,控制萃取时间为40 min,萃取压力1.2 MPa,萃取温度40 ℃,萃取次数1次,考察金盏花颗粒尺寸(5、10、15、20、25 mm)对亚临界萃取富集叶黄素含量的影响。
1.2.2.2 萃取时间 在上述优化颗粒尺寸的基础上,确定颗粒尺寸为10 mm,萃取压力1.2 MPa,萃取温度40 ℃,萃取次数1次,考察萃取时间(30、35、40、45、50 min)对亚临界萃取富集叶黄素含量的影响。
1.2.2.3 萃取压力 在上述优化颗粒尺寸和萃取时间的基础上,确定颗粒尺寸为10 mm、萃取时间为45 min,萃取温度40 ℃,萃取次数1次,考察萃取压力(0.8、1.0、1.2、1.4、1.6 MPa)对亚临界萃取富集叶黄素含量的影响。
1.2.2.4 萃取温度 在上述优化颗粒尺寸、萃取时间和萃取压力的基础上,确定颗粒尺寸为10 mm、萃取时间45 min、萃取压力1.2 MPa,萃取次数1次,考察萃取温度(30、35、40、45、50 ℃)亚临界萃取富集叶黄素含量的影响。
1.2.2.5 萃取次数 在上述优化颗粒尺寸、萃取时间、萃取压力和萃取温度的基础上,确定颗粒尺寸为10 mm、萃取时间45 min、萃取压力1.2 MPa、萃取温度40 ℃,考察萃取次数(1、2、3、4次)对亚临界萃取富集叶黄素含量的影响。
1.2.3 Plackett-Burman试验设计 通过Plackett-Burman试验设计可以确定因素对响应值的影响作用,筛选出对响应值有影响的因素[24-25]。本试验以萃取物中叶黄素含量为响应值,在单因素的基础上,利用Plackett-Burman设计金盏花颗粒尺寸、萃取时间、萃取压力、萃取温度、萃取次数5个因素对叶黄素含量萃取富集的影响,为进一步的Box-Behnken试验奠定基础。试验因素及水平见表1。

表1 Plackett-Burman试验设计因素及水平表
1.2.4 响应面试验设计 通过单因素实验及Plackett-Burman试验设计的结果,筛选出对叶黄素富集含量影响显著的3个因素,然后运用Box-Behnken试验设计进行3因素3水平的响应面试验优化。以萃取物叶黄素含量为响应值(Y),分别以萃取时间(A)、萃取温度(B)、萃取次数(C)为自变量进行优化。Box-Behnken 试验优化水平设计见表2。
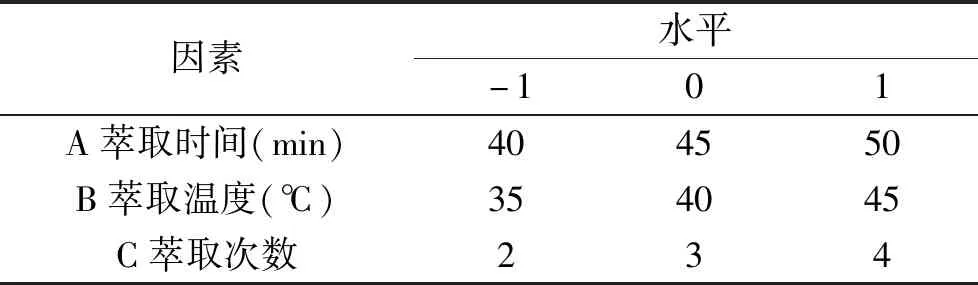
表2 Box-Behnken中心试验设计因素及水平表
1.2.5 叶黄素含量的测定 通过开展金盏花中叶黄素的提取的单因素实验发现,在相同萃取次数条件下,利用亚临界流体萃取法提取得到的叶黄素提取率(24.43%)且无显著差异(P=0.325),进而进一步研究提取物中叶黄素含量的差异性,发现不同影响因素对提取物中叶黄素的含量影响显著(P<0.05),所以在本研究中选取了提取物中的叶黄素含量作为评价指标。
1.2.5.1 色谱条件 叶黄素含量的检测参考《食品中叶黄素的测定》的方法[26-27]。色谱柱:Symmetry C18(250 mm×4.6 mm,5 μm),流动相A:甲醇/水(88+12,体积比;含0.1% BHT)-甲基叔丁基醚(含0.1% BHT);梯度洗脱,0~18 min,甲醇/水由100%变换至10%;18 min,甲醇/水由10%变换至100%,保留10 min。紫外检测器波长:445 nm,进样量:50 μL,流速:1.0 mL/min,柱温:30 ℃。
1.2.5.2 标准曲线的绘制 准确称取5 mg(精确至0.01 mg)叶黄素标准品,将其溶解在0.1% BHT乙醇溶液中,并定容至100 mL,配制成50 μg/mL的标准液。然后分别吸取0.050、0.100、0.200、0.400、1.00 mL置于5个25 mL棕色容量瓶中,然后用0.1% BHT乙醇溶液定容至刻线,摇匀,配制成梯度标准液(0.100、0.200、0.400、0.800、2.000 μg/mL),使用前过0.45 μm滤膜。按照金盏花前处理及试样测定的方法上高效液相色谱仪,同时做空白对照,经计算线性回归方程:y=103.3x-35.073(R2=0.999,n=5),其中y为峰面积,x为叶黄素浓度(μg/mL)[21]。
1.2.5.3 金盏花前处理及试样测定 准确称取2 g(精确至0.0001 g)萃取物于50 mL聚丙烯离心管中,加入约0.2 g BHT和10 mL乙醇,混匀,加入10 mL 10%氢氧化钾溶液,涡旋振荡1 min混匀,室温避光振荡皂化30 min,以10 mL萃取溶剂避光涡旋振荡提取3 min,4500 r/min离心3 min,重复提取2次,合并提取液,以10 mL水洗涤,4500 r/min离心3 min分层,重复洗涤1次,合并有机相于室温减压浓缩至近干,以0.1% BHT乙醇溶液涡旋振荡溶解残渣并定容至5 mL,过0.45 μm滤膜,供液相色谱测定[21]。
提取物中叶黄素含量计算:
式中:X:试样中叶黄素的含量,%;c:由标准曲线而得的样液中标准品的含量,μg/mL;V:样品最终定容体积,mL;m:称样量,g;F:校正系数。
1.3 数据处理
采用SPSS对单因素实验数据进行处理(所有数据均以MEAN±SD表示),并利用单因素ANOVA检验中的LSD法和Duncan法进行显著性分析,显著性水平P<0.05。运用Design-Expert 8.0中的Plackett-Burman试验设计和Box-Behnken试验设计进行结果分析并作图。
2 结果与分析
2.1 单因素实验结果
2.1.1 颗粒尺寸对叶黄素含量的影响 图1反映的是金盏花颗粒尺寸对叶黄素含量的影响。在其它萃取条件相同条件下,随着颗粒尺寸的增加,金盏花萃取物中叶黄素含量呈先升高后降低的趋势,且在金盏花颗粒尺寸为10 mm时,金盏花萃取物中叶黄素含量达到27.54%的最大值,这可能是因为物料颗粒尺寸过小,物料容易被泡散,细小物料粉末下沉,形成了物料堆积,增大了传质阻力,同时致使亚临界R134a只沿着阻力小的线路通过料层,形成许多针孔,使萃取不均匀[28]。随着金盏花颗粒尺寸超过10 mm时,萃取物中叶黄素的含量显著下降(P<0.05),这可能是由于金盏花颗粒尺寸增大,导致了R134a与物料接触不良,使得溶剂进入物料的阻力变大[29]。因此,在后续的提取过程中选取10 mm为萃取颗粒尺寸。

图1 颗粒尺寸对叶黄素含量的影响
2.1.2 萃取时间对叶黄素含量的影响 由图2可知,当萃取时间在30~45 min时,随着萃取时间的延长,金盏花萃取物中叶黄素的含量显著增大(P<0.05),在萃取时间为45 min时,萃取物中叶黄素含量最大,为27.54%,继续延长萃取时间,叶黄素富集含量呈下降趋势,但差异不显著(P>0.05)。随着萃取时间的增加,萃取物中叶黄素含量呈先升后降的趋势,这是由于亚临界流体萃取是一个溶剂与溶质之间的传质平衡的体现,这个平衡过程需要一定的时间来实现[20,30]。在亚临界萃取初期,R134a与金盏花颗粒之间的接触不够充分,部分叶黄素没有充分溶出,萃取物中叶黄素的含量较低,随着萃取时间的延长,溶剂与溶质之间达到了一个动态平衡的状态,此时叶黄素的溶出量最大。当时间超过45 min时,叶黄素含量出现下降趋势,这可能是由于时间的延长导致反式叶黄素发生了氧化降解[31]。故认为萃取时间为45 min较好。

图2 萃取时间对叶黄素含量的影响
2.1.3 萃取压力对叶黄素含量的影响 在前期试验基础上,确定金盏花颗粒尺寸为10 mm、萃取时间为45 min,研究萃取压力对叶黄素含量的影响。结果如图3所示,研究发现,萃取压力从0.8 MPa升高到1.0 MPa时叶黄素含量显著增大(P<0.05),之后继续升高萃取压力到1.6 MPa时,在此区间叶黄素含量增加不显著(P>0.05),这说明在一定的压力范围内,亚临界流体R134a的密度随着压力的增加而增大,随之溶解能力也增加,且随着萃取压力增大,溶质分子内的相互作用力也增加,叶黄素的溶解性也增加,萃取物中叶黄素含量增加[21]。当压力高于1.0 MPa时,萃取压力对叶黄素含量影响不显著(P>0.05),这说明当压力高于R134a流体的亚临界状态压力时,亚临界流体对叶黄素的溶解性影响较小,而且亚临界流体黏度随着压力升高而升高,阻止了溶质向溶剂中的扩散,所以叶黄素的含量升高不显著[32]。同时考虑到压力对R134a溶解能力的影响,故而选择萃取压力为1.2 MPa较合适。

图3 萃取压力对叶黄素含量的影响
2.1.4 萃取温度对叶黄素含量的影响 图4反映的是萃取温度对叶黄素含量的影响。从图4可以看出随着萃取温度的升高,萃取物中叶黄素含量呈先增加后降低的趋势。当萃取温度从30 ℃升高到40 ℃时叶黄素含量显著增大(P<0.05),这可能是由于温度的升高增大了溶剂和溶质分子之间的布朗运动作用,使得溶质能够尽可能地溶出[33]。但随着温度升高到40 ℃以上时,叶黄素的含量反而出现了下降的现象,且在温度为50 ℃时差异显著(P<0.05),这是由于温度的升高导致了R134a溶剂的挥发性也随之增大,使得部分溶剂气化,降低了其溶解性。同时萃取温度过高,叶黄素易受热分解,导致了萃取物中的叶黄素的含量减少[28]。因此,选择40 ℃作为后续萃取温度。

图4 萃取温度对叶黄素含量的影响
2.1.5 萃取次数对叶黄素含量的影响 在前期试验的基础上,固定金盏花颗粒尺寸为10 mm,萃取时间45 min、萃取压力1.2 MPa、萃取温度40 ℃,考察萃取次数对叶黄素含量的影响。结果见图5,实验结果表明,亚临界流体R134a萃取物中叶黄素的富集含量随着萃取次数的增加逐渐提高,且在前3次萃取时萃取物中叶黄素的含量显著增加(P<0.05)。但当萃取次数达到3次以上时,叶黄素含量上升开始变得缓慢,且萃取3次与萃取4次时萃取物中叶黄素的含量增加不显著(P>0.05),这说明金盏花颗粒经过3次亚临界流体萃取后,已基本达到了完全萃取叶黄素的效果[21]。因此在本实验中以3次萃取作为最优萃取次数,且在此条件下得到的叶黄素含量达到了31.78%。

图5 萃取次数对叶黄素含量的影响
2.2 Plackett-Burman试验结果
通过Plackett-Burman试验设计对影响金盏花中萃取叶黄素的因素进行显著性分析,Plackett-Burman试验设计及结果见表3,试验结果方差分析见表4,偏回归系数及显著性检验见表5。

表3 Plackett-Burman试验设计及结果

表4 Plackett-Burman设计的方差分析表
从表4可知,该试验模型极显著(P<0.01)。从表5 Plackett-Burman试验结果的偏回归系数及显著性检验分析可知,萃取时间(B)、萃取温度(D)、萃取次数(E)三个因素对金盏花中叶黄素的萃取富集影响极显著(P<0.01),所以选择萃取时间、萃取温度和萃取次数进行响应面的优化设计试验。颗粒尺寸(A)和萃取压力(C)两个因素对叶黄素含量影响不显著(P>0.05),所以在后续试验中分别将其固定为10 mm和1.2 MPa。

表5 偏回归系数及显著性检验
2.3 Box-Behnken试验结果
2.3.1 叶黄素提取优化试验设计及结果 利用Design-Expert 8.0对表6中的数据进行方差分析和回归分析,对试验结果进行拟合。以萃取时间(A)、萃取温度(B)和萃取次数(C)为自变量,拟合得到回归方程:
叶黄素含量(%)=31.61-0.17A-0.18B+1.02C-0.2AB-0.038AC-0.027BC-0.51A2-0.37B2-0.53C2。

表6 Box-Behnken试验设计及结果

表7 Box-Behnken试验结果方差分析表

2.3.2 响应面交互作用分析 响应面3D曲面图反映的是两两因素之间对响应值的影响作用,其中3D曲面图越陡峭,说明两因素之间交互作用越明显。从图6可以看出萃取时间和萃取温度、萃取时间和萃取次数、萃取温度萃取次数之间两两的交互作用不显著(P>0.05),该结果与方差分析结果一致。

图6 交互作用对叶黄素含量影响的响应面图
2.3.3 最优萃取工艺参数及验证 通过利用Design-Expert 8.0设计分析得到的亚临界流体萃取富集金盏花中叶黄素工艺为颗粒尺寸10 mm、萃取时间44.24 min、萃取压力1.2 MPa、萃取温度38.79 ℃、萃取次数3.98次,预测萃取物中叶黄素含量为32.14%。考虑到实际操作,验证试验取颗粒尺寸10 mm、萃取时间44 min、萃取压力1.2 MPa、萃取温度39 ℃、萃取次数4次的条件下进行实验。在此条件下进行3次平行试验,得到的金盏花萃取物中叶黄素含量为32.28%±0.33%(P=0.128),与预测值相差0.44%,说明模型有效。这一研究萃取得到的萃取物中叶黄素含量明显高于周彦芳等[34]的利用有机溶剂法提取得到的浸膏中的含量(16.5%)和超临界CO2法萃取得到的浸膏中的含量(2.6%),可见,本方法提取效果相对较高,同时,亚临界流体萃取法富集金盏花中叶黄素工艺操作简单,萃取浸膏中叶黄素的含量较高,相比有机溶剂萃取法和超临界CO2法萃取法具有一定的优越性,为金盏花中提取叶黄素的工业化提供了可行性基础。
3 结论
本研究通过利用单因素实验及Plackett-Burman试验设计筛选出对叶黄素含量具有显著影响的因素,并在此基础上进一步利用Design-Expert 8.0中的Box-Behnken试验设计对亚临界流体萃取富集金盏花中叶黄素工艺进行研究,得出亚临界流体萃取富集金盏花中叶黄素最佳工艺为:金盏花颗粒尺寸10 mm、萃取时间44 min、萃取压力1.2 MPa、萃取温度39 ℃、萃取次数4次,在此条件下,进行3次平行试验,亚临界萃取物中叶黄素含量可达到32.28%。同时,亚临界流体萃取富集金盏花中叶黄素工艺操作简单,能够实现工业化生产。该研究可以为富集金盏花中叶黄素的产业化研究提供一定的理论参考。
