转基因稻谷Bt蛋白降解及长期取食对印度谷螟体内3种抗氧化酶活性的影响
2020-12-08王康旭吴学友陶冶心陈二虎唐培安
王康旭,吴学友,陶冶心,陈二虎,唐培安
(南京财经大学 食品科学与工程学院,江苏高校粮油质量安全控制及深加工重点实验室,江苏 南京 210023)
印度谷螟Plodia interpunctella(Hübener)是世界性的鳞翅目储粮害虫,能够危害稻谷、小麦、玉米、干果、药材和多种作物种子的生产和储藏[1]。传统防治方法具有抗性发生普遍、残留风险高等缺点,严重威胁了粮食和食品安全的有力保障[2]。转基因抗虫水稻,是指将非水稻来源的抗虫基因导入水稻体内所培育出的新型水稻品种[3]。其中的抗虫基因大多来源于苏云金芽孢杆菌(Bacillus thuringiensis, Bt),这是因为 Bt在其形成芽孢的过程中会产生具有杀虫效果的晶体蛋白(cry)[4],在借助基因工程的方法后,可以在水稻中大量表达此类杀虫蛋白,赋予作物抗虫性[5]。研究表明,转Bt基因水稻对多种鳞翅目昆虫均具有良好的防治效果,例如稻纵卷叶螟Cnaphalocrocis medinalis、印度谷螟和二化螟Chilo suppressalis等[6-7]。
保护酶是昆虫体内最主要的生理生化相关酶系之一,主要包括过氧化物酶(peroxidase, POD)、过氧化氢酶(catalase, CAT)和超氧化物歧化酶(superoxide dismutase, SOD)等[8]。一般而言,生物体中的保护酶会长期处于一种动态平衡状态,使游离自由基保持在一个较低水平状态,以避免自由基对机体的破坏,起到保护作用。但是,一旦生物体内的保护酶平衡被打破,机体就可能受到自由基的伤害。同时研究表明,当昆虫取食Bt毒蛋白后,体内保护酶的平衡会遭到破坏,过量的自由基会损伤机体。此时昆虫为了保护和维持机体的正常功能就会升高保护酶活性,从而影响害虫的生理状态[9]。
前期研究表明,在短期取食转Bt稻谷后,印度谷螟体内的三种保护酶活力呈现上调趋势,但是长期取食转 Bt稻谷及其制品后害虫体内的保护酶活力状态尚不清楚,影响了害虫对转Bt作物的相关毒理机制研究[10-11]。本实验以印度谷螟幼虫为试虫,利用转Bt稻谷为原料制取得到的大米粉为饲料,对试虫进行长期喂食处理,通过酶活分析方法研究了印度谷螟幼虫在长期取食转 Bt水稻制品后体内的保护酶活性变化。本研究不仅有利于揭示转Bt稻谷对于印度谷螟作用的生理生化机理,还可以为相关毒理学机制提供深入研究依据,有利于转基因稻谷的安全储藏和合理利用。
1 材料与方法
1.1 供试水稻及虫源
稻谷华恢1号:通过基因枪法介导,将融合抗虫基因Cry1Ab/Cry1Ac导入非转基因水稻品系明恢63获得的转Bt基因抗虫水稻,由华中农业大学作物遗传改良国家重点实验室提供,标记为HH/Bt。
稻谷明恢63:为转Cry1Ab/Cry1Ac基因水稻华恢1号的非转基因亲本对照,标记为MH/CK。
实验所采用的印度谷螟品系采自江苏省吴江市,用完全不含 Bt毒素(明恢 63)的大米粉在实验室内连续喂养2年,作为敏感种群。饲养条件为:温度(30±0.5) ℃、湿度70%~80%、黑暗条件培养。
1.2 储藏条件
将新收获的转Cry1Ab/Cry1Ac基因稻谷(HH/Bt)样品从低温贮藏室中取出,恢复至室温后,经除杂后,分装在5 L广口瓶中,盖紧橡胶塞,并用石蜡密封瓶口,置于(25±1) ℃人工气候箱中储藏,每隔30 d取样一次,检测水分和Bt蛋白含量。供试稻谷明恢63(MH/CK)做同样处理。
1.3 水分测定
稻谷样品的水分测定按照 GB 5009.3—2016直接干燥法进行。
1.4 Bt蛋白含量测定
采用酶联免疫吸附测定法(ELISA)。测定时,将稻谷提取物加入到已经由Cry1Ab/Cry1Ac蛋白抗体包被的微孔板中,抗体同样品提取物中的目标蛋白进行作用,之后加入辣根过氧化物酶标记(HRP-labeled)的Cry1Ab/Cry1Ac二抗,进行检测。产物在 450 nm处有吸收峰,且产物颜色与OD值在一定范围内呈正比,因此,可根据标准曲线求得样品Cry1Ab/Cry1Ac蛋白含量。
1.5 试虫处理
将不同质量的转Bt基因大米粉掺入普通米粉中,充分搅拌混匀,配制成含量为50、100、200、400 mg/g的转Bt基因大米粉的饲料。取实验室长期培养的印度谷螟5龄幼虫若干只,饥饿处理24 h后作为供试虫体。所有试虫分为3组。置于2 cm直径的培养盒中,每个培养盒接种一头,分别用含有0、50、100、200、400 mg/g的转Bt基因大米粉饲养12 d后取样。另外,我们从敏感种群中随机挑选了部分试虫,在含有50、100 mg/g转基因大米粉的饲料中连续筛选培养5个月后取样。所有样品冷冻保存于–80 ℃冰箱中,用于酶源制备。
1.6 酶源制备
待匀浆的印度谷螟幼虫经过流动的纯净水冲洗后,用滤纸将表面水分吸干。对幼虫进行称重,置于试虫9倍重的0.9%的低温生理盐水的玻璃匀浆器中进行研磨,之后将匀浆液在 2 000~3 000 r/min下低温离心15 min,取离心后上清液作为待测酶源,置于–80 ℃冰箱中保存备用。实验重复3次。
1.7 酶源蛋白质含量测定
采用考马斯亮蓝G–250法测定待测酶源中的总蛋白含量,以牛血清蛋白(BSA)为标准蛋白进行计算。
1.8 酶活性测定
本实验采用南京建成生物工程研究所生产的SOD、POD和CAT活力检测试剂,按试剂盒说明进行操作。被测样品的抗氧化酶活性计算公式如下:

1.9 数据统计与分析
采用GraphPad软件LSD方法进行方差分析,重复数据计算其平均值和标准误(SE)。
2 结果与分析
2.1 稻谷水分含量变化
储藏前,HH/Bt和MH/CK稻谷的初始水分分别为13.31%和13.18%,无显著差异(P>0.05)。在随后的270 d储藏期内,对HH/Bt稻谷的水分含量进行的检测分为糙米和稻壳两部分进行,结果见图1。从HH/Bt稻谷的糙米和稻壳水分变化趋势可以看出,随着储藏时间增加,其水分含量在逐渐降低,在270 d的储藏期内,HH/Bt糙米水分由储藏前的13.31%下降至12.46%,HH/Bt稻谷稻壳的水分由储藏前的10.11%下降至8.54%。

图1 储藏期内HH/Bt稻谷(糙米和稻壳)水分变化
2.2 Bt蛋白标准曲线
以 1.8×10–2、1.5×10–2、1.0×10–2、5.0×10–3和1.0×10–3μg/mL 浓度梯度的Cry1Ab标准液,经EnvirotogixCry1Ab/Cry1Ac平板试剂盒酶联免疫反应后,在450 nm波长下,用多功能酶标仪读取波长其OD值,绘制的标准曲线如图2所示。

图2 Bt蛋白标准曲线
2.3 储藏期内稻谷Bt蛋白含量变化
在25 ℃条件下,历时270 d(9个月)的储藏期内,转Cry1Ab/Cry1Ac基因稻谷的糙米和稻壳中Bt蛋白含量的变化分别如图3、图4所示,测定结果显示,随着储藏时间的增加,HH/Bt稻谷的糙米和稻壳中Bt蛋白含量均降低,HH/Bt稻谷的糙米中Bt蛋白含量由储藏前的5.534 μg/g,在储藏90、180、270 d后分别降至4.818、4.551、4.003 μg/g。HH/Bt稻谷的稻壳中 Bt蛋白含量由储藏前的1.003 μg/g,在储藏90、180、270 d后分别降至0.839、0.672、0.328 μg/g。在 270 d的储藏期内,HH/Bt稻谷的稻壳中Bt蛋白的自然降解率较糙米中的大,HH/Bt稻谷的糙米和稻壳中Bt蛋白降解率分别为27.7%和67.3%。
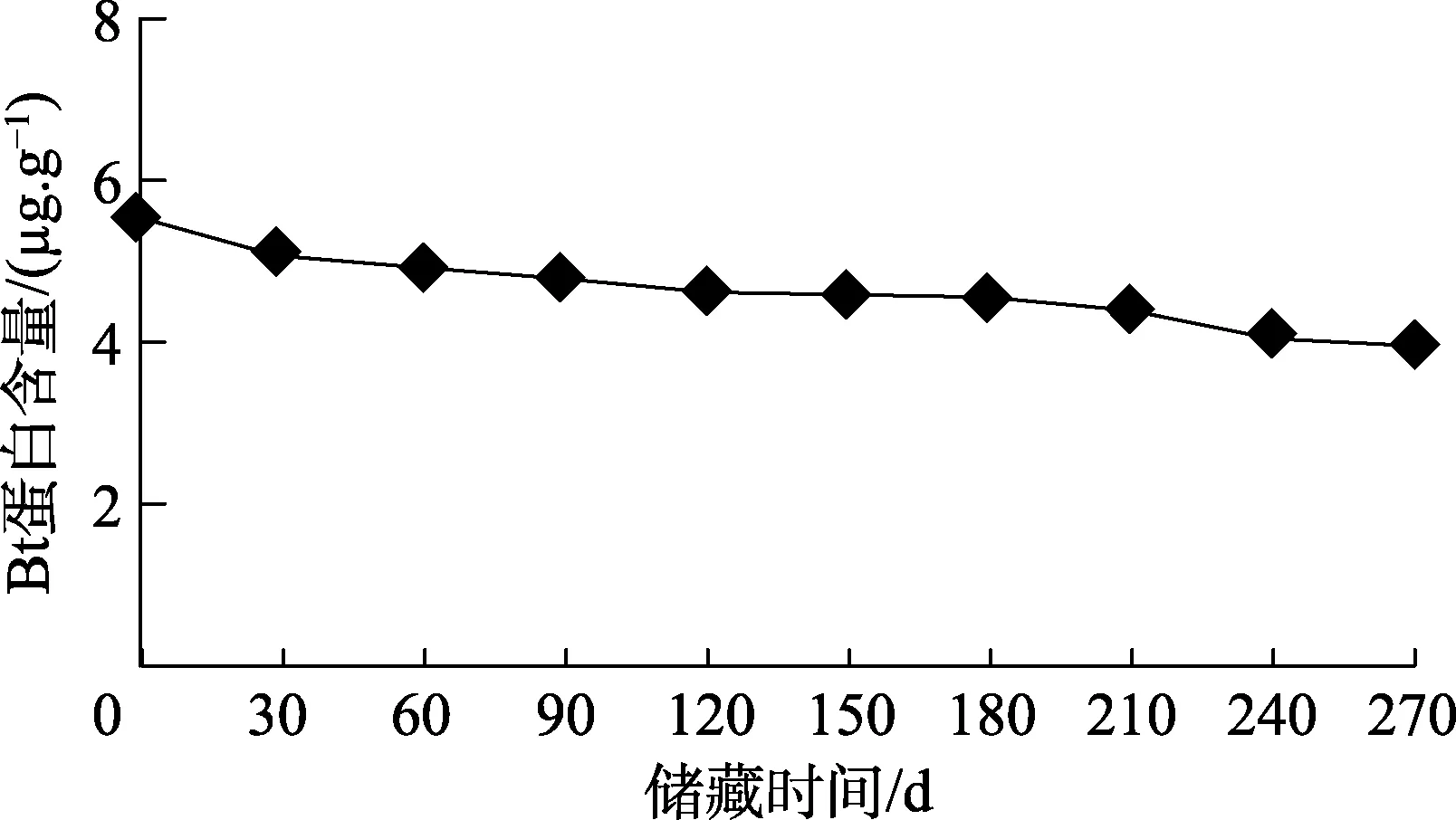
图3 储藏期内HH/Bt稻谷的糙米中Bt蛋白含量变化
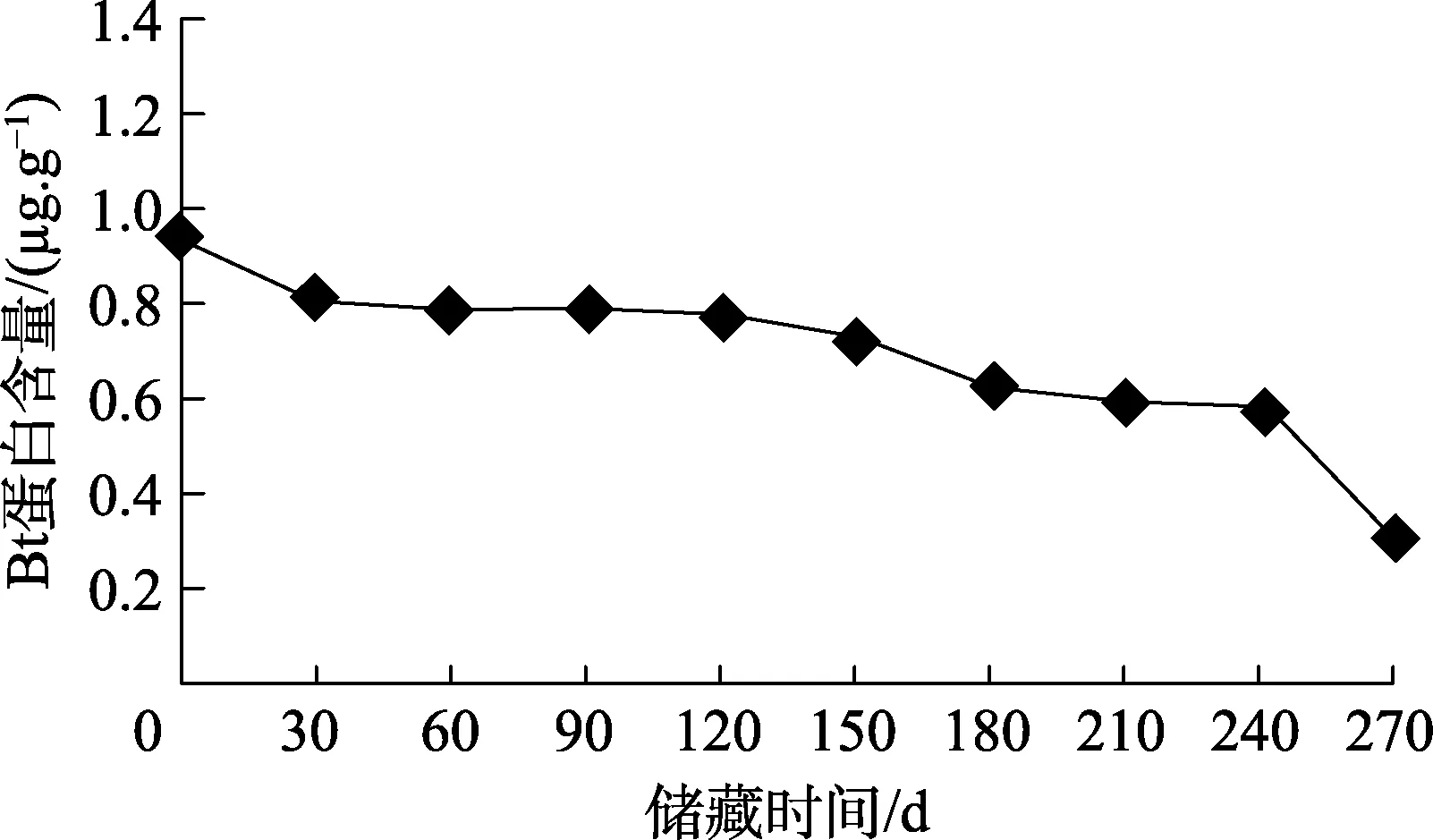
图4 储藏期内HH/Bt稻谷的稻壳中Bt蛋白含量变化
储藏期内HH/Bt稻谷的糙米和稻壳中Bt蛋白含量的差异分析结果表明,随着储藏时间的延长,转Cry1Ab/Cry1Ac基因稻谷的糙米和稻壳中Bt蛋白的含量显著下降(P<0.05),储藏60、240 d后,糙米和稻壳中Bt蛋白含量分别为4.930、4.067、0.842、0.623 μg/g。同一储藏期,对糙米和稻壳中的 Bt毒蛋白含量的差异分析结果表明,储藏前(0 d)转Cry1Ab/Cry1Ac基因稻谷的糙米和稻壳中Bt蛋白的含量差异极显著(P<0.05),储藏270 d后,该转基因稻谷的糙米和稻壳中Bt蛋白含量差异仍极显著(P<0.05)。
2.4 转Bt基因大米粉对印度谷螟幼虫体内SOD活性的影响
转 Bt基因大米粉对印度谷螟幼虫体内 SOD的影响如图5所示。在用不同浓度的转Bt基因大米粉饲喂印度谷螟幼虫12 d后,其体内SOD活性随着取食饲料中转 Bt基因水稻浓度的上升而下降,在取食400 mg/g转Bt基因水稻后,SOD活性与对照相比差异达到最大,下降了 28.4%。另外,图6显示了用50、100 mg/g的转Bt基因大米粉持续饲养印度谷螟5个月后,对试虫种群体内的SOD活性进行测定的结果,发现取食含有50、100 mg/g的转基因大米粉饲料的印度谷螟种群的SOD活性与对照相比分别下降了10.33%、38.75%,该结果与12 d的饲养处理结果趋势基本一致。深入分析认为,在长期取食转Bt基因大米粉后,幼虫体内的SOD活性明显受到抑制,并且取食的饲料中转基因大米粉含量越高,SOD活性抑制效果越显著。这说明,长期取食转Bt基因水稻后,Bt毒蛋白可能会抑制SOD对体内O2–的清除。
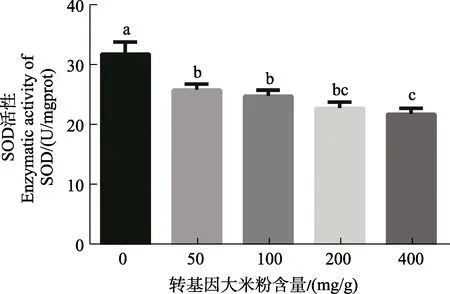
图5 不同含量转基因大米粉饲养印度谷螟幼虫12天对其SOD酶活力的影响
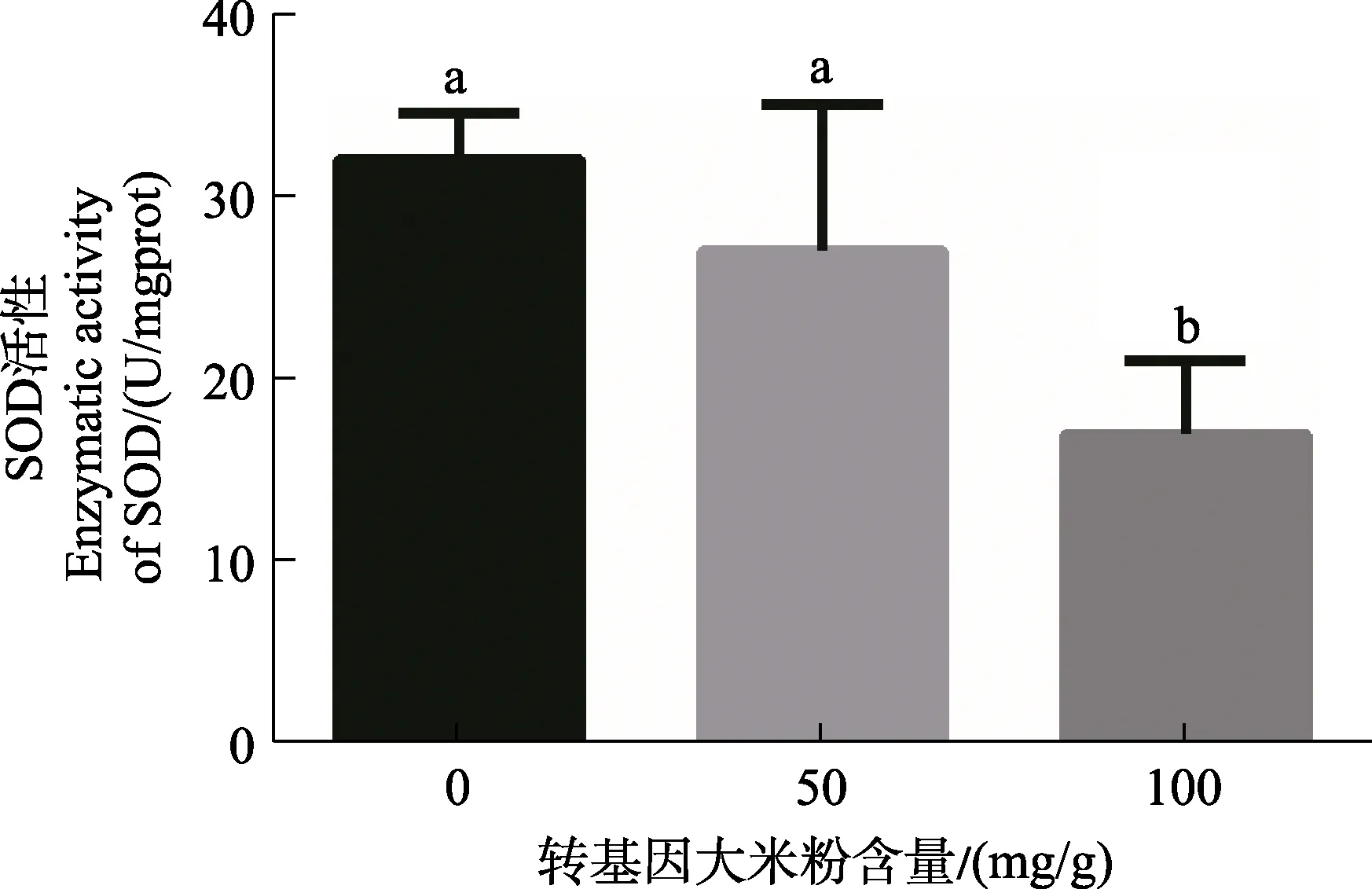
图6 由不同含量转基因大米粉饲养5个月后的印度谷螟种群体内的SOD活性
2.5 转Bt基因水稻对印度谷螟幼虫体内POD活性的影响
在用不同含量的转Bt基因水稻饲喂印度谷螟幼虫12 d后,其体内POD活性变化的情况如图7所示,取食转 Bt基因水稻后,幼虫体内的 POD活性显著升高,且随着饲料中转Bt基因水稻浓度的上升而下降,但始终高于对照组。图8表明利用不同含量的转Bt基因大米粉饲料饲养5个月的印度谷螟种群,其幼虫体内的POD活性进行测定的结果,该结果与12 d的饲养结果一致,通过转基因大米粉的POD活性高于对照组。由此可见,在利用转基因大米粉长期饲养印度谷螟后,其体内的POD活性明显升高,说明其抵抗Bt毒素的能力显著增强,通过提高试虫体内的POD活性以维持细胞内 H2O2的动态平衡。然而摄入高浓度Bt毒素的幼虫体内POD活性比摄入低浓度的低,这可能是由于印度谷螟幼虫对低浓度Bt毒素具有更快更强的适应性,形成了较为完善的防御系统。
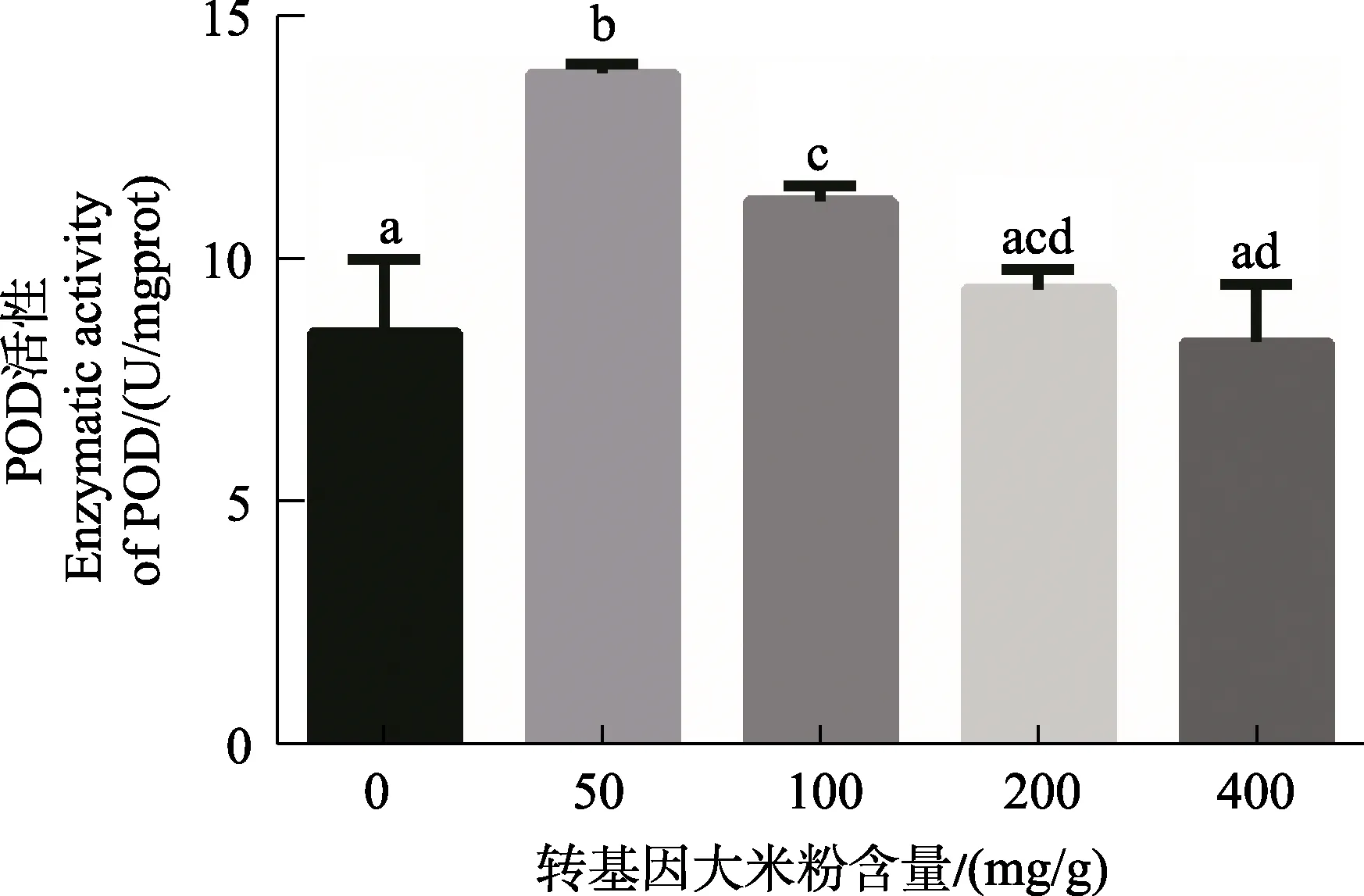
图7 不同含量转基因大米粉饲养印度谷螟幼虫12天对其POD活性的影响
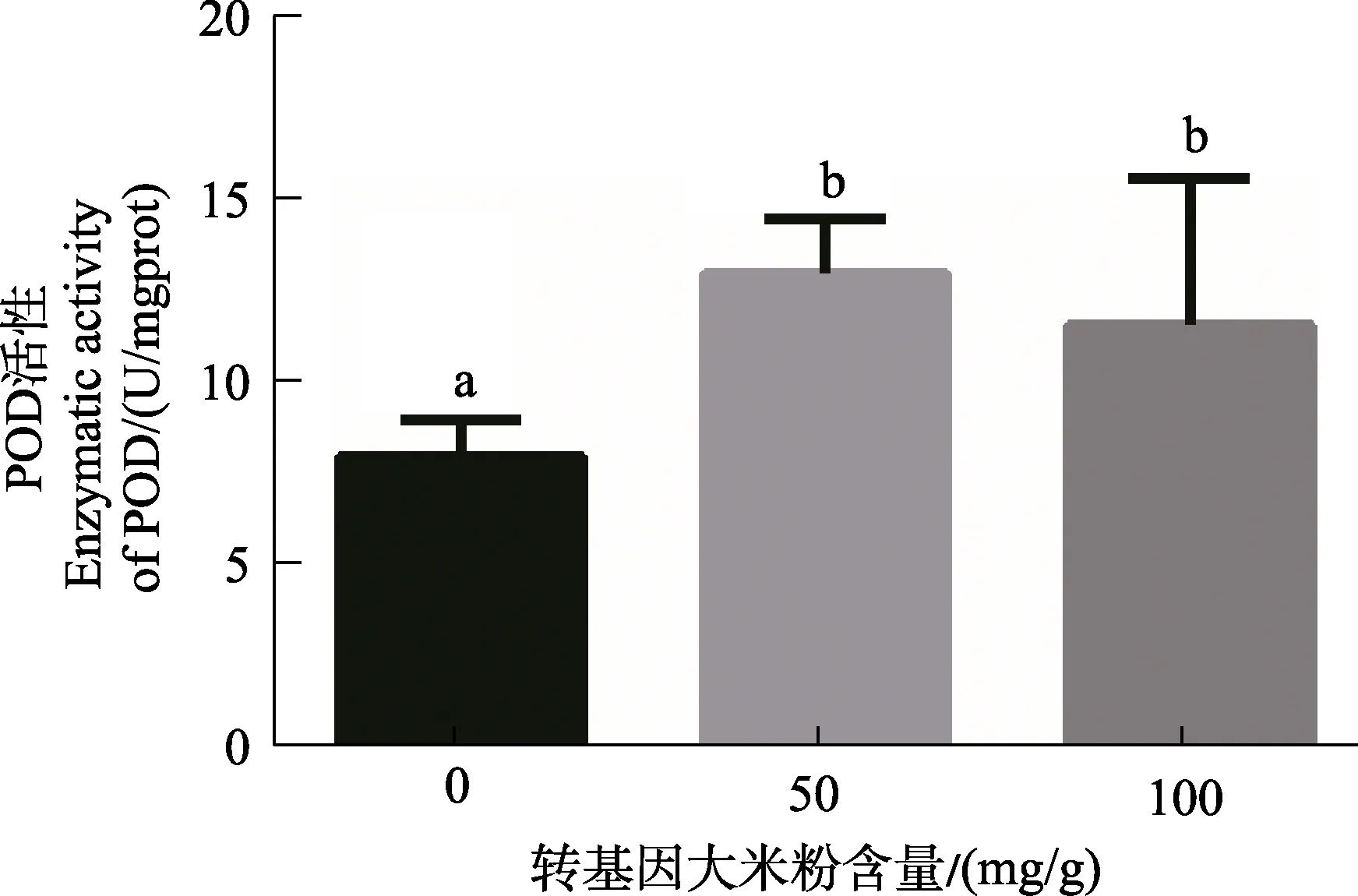
图8 由不同含量转基因大米粉饲养5个月后的印度谷螟种群体内的POD活性
2.6 转Bt基因水稻对印度谷螟幼虫体内CAT活性的影响
由图 9可以看出,在印度谷螟幼虫取食转基因大米粉含量>50 mg/g的大米粉饲料后,其体内的CAT活性均显著高于对照组,且随着Bt大米粉含量的增加,CAT活性呈增加趋势。图10表明利用不同含量的转Bt基因大米粉饲料饲养5个月的印度谷螟种群,其体内CAT活性的变化。在长期摄入Bt毒素后,幼虫体内的CAT活性均显著高于对照组。
由此可见,在印度谷螟幼虫长期取食含有 Bt大米粉的饲料后,其体内CAT活性会发生上调,可能可以借此来清除体内过量的H2O2,从而维持细胞内游离自由基的相对稳定,以抵抗Bt毒素的胁迫。
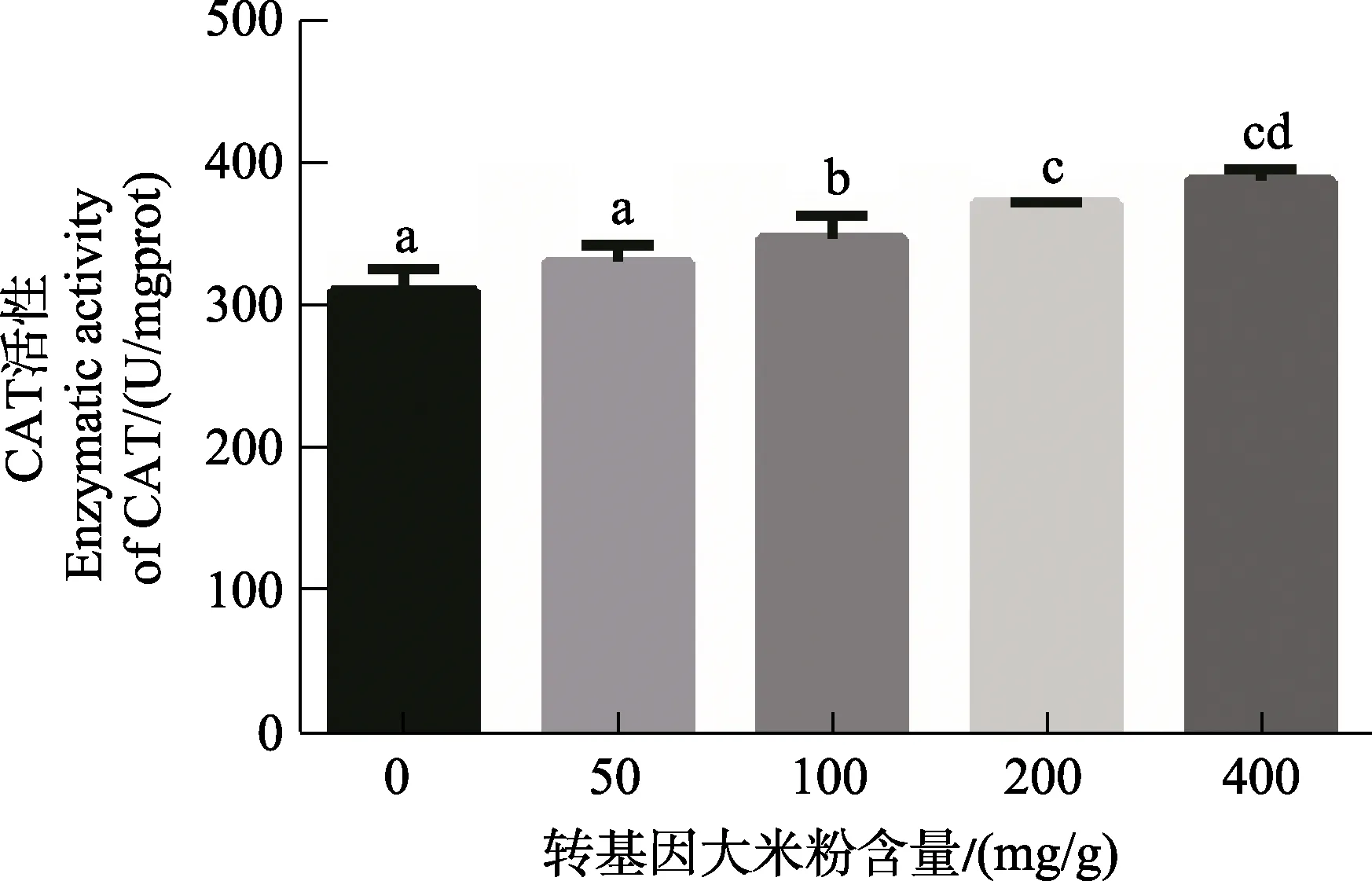
图9 不同含量转基因大米粉饲养印度谷螟幼虫12天对其CAT活性的影响

图10 由不同含量转基因大米粉饲养5个月后的印度谷螟种群体内的CAT活性
3 讨论
本试验针对 25 ℃仓储条件下,水分含量为13%的转Cry1Ab/Cry1Ac基因稻谷(HH/Bt)进行为期270 d的储藏研究,研究表明,随着储藏时间的增加,HH/Bt稻谷的糙米和稻壳的水分在逐渐降低,HH/Bt稻谷的糙米和稻壳中Bt蛋白含量显著下降;同一储藏期,HH/Bt稻谷的糙米中Bt蛋白含量显著高于稻壳。林镇清等[12]以早籼稻为材料,进行高大平房仓储藏,跟踪测定了2006年3月至2008年7月期间,仓中稻谷水分含量的变化,指出质量好的稻谷,在控温、控湿较为理想的仓房内,稻谷水分会随着储藏时间的延长而逐渐降低。本文对转基因稻谷的水分变化研究结果与其所得结论相一致。
谢小波和舒庆尧等[13]对美国一龙公司(Envirotogix)开发的Cry1Ab/Cry1Ac平板试剂盒用于转Cry1Ab基因水稻中 Bt蛋白含量测定进行了评估,指出该试剂盒具有良好的检测灵敏度和快速的特点,其最低 Bt蛋白检测浓度为0.5 ng/g。本试验所采用的试剂盒是 Envirotogix在原Cry1Ab/Cry1Ac检测试剂盒基础上加以改进以适合转基因稻谷检测之用。Tu等[14]开发的转Cry1Ab/Cry1Ac基因水稻估测其Bt蛋白表达量占总可溶蛋白的 0.01%~0.20%,为高表达水平,继而开发的该转Cry1Ab/Cry1Ac基因水稻明恢 63(T51–1)Bt蛋白含量高达 20 μg/g[15]。姜永厚等[16]对转Cry1Ab基因克螟稻 1号(亲本为秀水11)孕穗期和成熟期的茎秆中Bt蛋白含量测定结果分别为43.20、22.27 μg/g,而吴立成[17]对成熟期该转基因水稻地上部分 Bt蛋白含量测定结果为 7.98 μg/g。Bashir等[18]对转Cry1Ac和Cry2A的印度香米收获10 d后的子粒中Bt含量测定结果分别为 0.3、0.26 μg/g。陈浩[19]测定的转Cry1Ac、Cry2A*、Cry9C*基因的水稻明恢 63(TAC–2、T2A–1、T9C–3)成熟种子中Bt蛋白的含量分别为 8.15、12.98、20.10 μg/g。对于上述所测定的Bt蛋白的差异,亲本水稻性状、构建的基因、启动子、生长环境等都会影响到转 Bt基因水稻中Bt蛋白的表达水平。
自然环境储藏条件下,赵文娟[20]的对转Cry1Ac/SCK基因Ⅱ优MS67的Bt蛋白含量进行连续9个月监测结果显示,Bt蛋白含量在1.262~1.593 μg/g,且在前期储藏中蛋白降解较快,后期降解速度趋于平缓。转Bt基因谷物中的Bt蛋白降解途径有:自身代谢分解、光照、微生物分解等。宋伟等[21]的研究指出在25 ℃,13.5%水分含量的储藏稻谷中,霉菌等微生物的数量相对较少。本文模拟25 ℃、无光照的仓储条件,研究HH/Bt稻谷对 Bt蛋白的自身代谢分解,对转Cry1Ab/Cry1Ac基因稻谷270 d的储藏中,糙米和稻壳中的Bt蛋白的自然降解规律与前述报道呈一致性。
随着转基因作物的推广和应用,研究人员对Bt伴胞晶体蛋白的相关杀虫机理已进行了详尽的研究,在相关害虫取食转Bt作物后,害虫机体会产生相应的应激反应,导致了系列代谢变化,若Bt毒素刺激能够控制在范围内,虫体可以通过调整对应的代谢功能以适应相应的代谢影响,若刺激强度超过虫体的代谢能力时,会影响害虫的生理状态。所以,我们可以通过研究昆虫体内酶系的变化情况来分析Bt毒素的相关毒理学机制。昆虫体内广泛存在以SOD、CAT和POD为代表的保护酶系统,能够保护昆虫机体免受自由基损伤,在昆虫多种生理生化过程中发挥着关键性的作用[11]。本试验研究了印度谷螟取食转Bt大米粉后,其体内的主要保护酶的对应变化,深入探究了害虫长期摄入Bt毒蛋白与其机体代谢情况的对应关系。
在转Bt水稻短时诱导培养中,印度谷螟幼虫体内SOD活力上升,而CAT和POD的活力低于对照,受到了抑制,说明印度谷螟作为转Bt基因水稻的靶标害虫,Bt毒蛋白被幼虫摄入后,短期内可扰乱幼虫SOD,CAT和POD保护酶系统的动态平衡,对害虫机体产生毒害作用。本试验在此基础上研究了印度谷螟长期取食不同含量转Bt基因大米粉12 d及连续筛选饲养5个月后,其体内保护酶的变化情况,该结果与转Bt基因稻谷短期饲喂幼虫结果显著不同。在长期喂食试验中,我们发现SOD活性显著低于对照组,而POD和CAT的活性高于对照组。这说明印度谷螟幼虫在较为长期取食Bt毒蛋白的过程中,自身形成了较为完善的防御系统,可能通过提高 POD和 CAT的活性来实现H2O2、氧化酚类和胺类化合物的催化反应,从而有效清除了体内H2O2和酚类、胺类物质毒性[11]。而长期喂食后,SOD活性仍然受到了抑制,这说明三种保护酶的表达调控机制可能存在一定的差异,虫体通过POD和CAT活性的提高以弥补SOD活力的下降,以保护和维持机体进行正常的代谢,使试虫对Bt毒素产生了一定的耐受性,但是保护酶的相关调控网络还有待进一步探索。另外,我们还对取食转基因大米粉后的印度谷螟生长发育情况进行了系统性探索[23],同时,还利用转录组测序技术对取食转基因大米粉后的印度谷螟中的差异表达基因进行了分析[24],相关结果将同本文研究一道为揭示 Bt毒素的抗性机理以及毒理学效应奠定了理论基础。
