腺病毒构建过表达睫状神经营养因子对骨髓间充质干细胞的影响
2020-12-04徐国兴
林 雯,徐国兴
0引言
骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)是一类存在于骨髓间质组织中的成体干细胞,来源广泛、易培养,可高效扩增,进行自体移植无伦理争议及免疫排斥,是移植治疗病变视网膜的种子细胞。近年来,干细胞治疗视网膜病变的研究和试验已获得一定的进展,其中间充质干细胞(mesenchymal stem cells, MSCs)最引人注目。MSCs是来源于中胚层的成体干细胞,其视网膜保护机制主要有:(1)细胞替代治疗:MSCs在特定微环境中可被诱导分化为视网膜细胞,在一定程度上起到替代作用[1],从而达到治疗目的;(2)旁分泌作用:MSCs可以分泌睫状神经营养因子(ciliary neurotrophic factor, CNTF)、脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)等多种神经营养因子,调节周围受损组织的微环境,激活靶器官的修复机制,抑制视网膜细胞凋亡[2];(3)调控血管生成的微环境,抑制新生血管的大量产生[3];(4)促进视网膜形成新的突触连接和信号转导,提高视功能[4];(5)MSCs还具有免疫调节能力,抑制炎症因子的释放[5-6],自体或异体移植后无免疫排斥反应,并且在体内移植后归巢至受损靶组织[7]。Tracy 等[8]利用基因修饰的MSCs过表达可溶性溶酶体酶来治疗因PPT-1基因突变引起的溶酶体酶缺陷性视网膜变性,并未观察到MSCs在玻璃体发生增殖或侵袭,说明基因修饰的MSCs在眼内长期分泌所需蛋白治疗视网膜变性是一种安全可靠的方法。还有其他研究表明MSCs是良好的基因载体[9-11]。由此可见,基因修饰的MSCs在视网膜病变研究中展现出广阔的应用前景。本研究拟通过腺病毒载体修饰BMSCs,使其过表达CNTF,为视网膜病变的体外研究提供新途径。
1材料和方法
1.1材料大鼠骨髓间充质干细胞(广州赛业),大鼠骨髓间充质干细胞完全培养液(广州赛业),0.25%胰酶(美国Gibco),293A细胞(上海汉恒生物),载体pHBAd-MCMV-GFP(上海汉恒生物),大肠杆菌菌株DH5α(北京Tiangen),限制性内切酶(美国Fermentas),T4连接酶(美国Fermentas),质粒DNA小、大量抽提试剂盒(北京康为世纪),凝胶回收试剂盒(美国Axygen),琼脂糖、琼脂粉(法国Biowest),DNA ladder(美国Fermentas),一次性培养瓶/培养皿(美国Corning),ELISA试剂盒(英国Abcam)。PCR仪(美国Applied Biosystems),紫外分光光度计(美国Beckman),DNA电泳仪(美国Applied Biosystems),凝胶分析仪(美国Bio Rad),荧光显微镜(日本奥林巴斯),酶标仪(美国Molecular Devices)。
1.2方法
1.2.1大鼠骨髓间充质干细胞的培养及传代BMSCs以5×105个/皿密度接种于10cm培养皿,每盘加入完全培养液10mL,置于37℃、5%CO2和95%相对湿度的培养箱中培养,每2d进行换液,当细胞密度超过80%时进行传代。吸除培养皿内旧培养液,用PBS洗涤2遍,加入0.25%胰酶1mL,放入培养箱内孵育1min后,把培养皿放置在倒置显微镜下进行观察,发现胞质回缩变圆时,应立即用等量完全培养液终止消化,反复吹打,形成细胞悬液,以1∶2传代接种在新培养皿内,传代后间隔2d换液,直至细胞生长至80%汇合后,继续传代,如此反复,取第3代细胞用于后续实验。
1.2.2腺病毒包装和扩增及纯化(1)目的基因片段的获取:根据Genebank上大鼠CNTF基因(NM_013166.1)编码区(CDS),委托基因公司化学合成目的基因,pHBAd-MCMV-GFP载体用BamH I和EcoR I双酶切(酶切体系含载体、BamH I、EcoR I、10×buffer和水),载体酶切完成后胶回收。(2)合成的序列载体用BamH I和EcoR I双酶切获得CNTF片段,目的片段与载体连接,酶切完成后胶回收。(3)转化感受态细胞:事先准备好用于包装病毒的293A细胞和病毒质粒,转染每个直径为6cm的培养皿,complex成分:穿梭质粒2μg,p-BHG(delta)E1,3 cre 4μg。Opti MEM在37℃水浴中预热,Lipofiter TM转染试剂恢复至室温后使用,使用前摇匀,抗性:Amp,37℃培养过夜。转染后6h换新鲜培养液。(4)病毒的收集:病毒收集前观察病毒空斑是否形成,为限制病毒的扩散及空斑更好的形成,在培养液中加入琼脂糖,空斑形成后连着琼脂糖一起将空斑挑起,放入新鲜培养基中过夜。转化后的CNTF平板挑菌,37℃,250r/min摇菌14h,菌液进行PCR鉴定,并将阳性克隆菌液送基因公司测序。(5)病毒的扩增:将培养基中病毒加入新鲜293A细胞培养液中进行病毒少量扩增。至细胞再次出现空斑,收集细胞及上清,反复冻融三次收集病毒,以此病毒为P1代病毒,以P1代腺病毒感染293A细胞,连续进行三代感染,至P4代进行腺病毒的大量扩增,待空斑形成后收集病毒并对病毒进行体外纯化和浓缩。(6)病毒的纯化:采用CsCl密度梯度离心-透析联用法纯化病毒,CsCl梯度的制备方法如下:加入2.0mL密度为1.40g/mL的CsCl溶液,然后缓慢加入3.0mL密度为1.30g/mL的CsCl溶液,再加入5mL的病毒悬浮液,透析袋使用前用10mmol/L的EDTA-Na2煮沸10min,20000r/min室温离心2h,收集密度在1.3~1.4g/mL的病毒条带至透析袋中,配制透析缓冲液:50g蔗糖,10mL 1mmol/L Tris-HCl,pH8.0,2mL 1mmol/L MgCl2定容至1L,在透析缓冲液4℃搅拌透析过夜,中间换一次透析液。收集病毒,测定病毒滴度。(7)病毒重悬和保存:500μL的PBS重悬病毒沉淀,置于-80℃保存备用。
1.2.3腺病毒感染BMSCs取第3代生长良好的BMSCs,以2×104个/mL的密度接种于24孔板中,每孔加入0.5mL,培养18h后细胞融合率约50%~60%,每孔更换为新鲜完全培养液1mL,调整腺病毒感染复数(multiplicity of infection, MOI)为10,加入稀释好的腺病毒液,轻晃混匀,继续感染7h后,PBS洗3遍,更换为新鲜完全培养液。
1.2.4 ELISA检测细胞上清液中CNTF分泌水平调整BMSCs密度,按2×104个/孔的密度接种于6孔板,24h后细胞约为5×104个/孔,更换不含青霉素-链霉素和胎牛血清的新鲜培养基,1mL/孔;设置三组:空白对照组(未转染腺病毒组)、GFP-BMSCs组(空载腺病毒感染,病毒滴度2×1010TU/mL,MOI=200)、CNTF-BMSCs组(CNTF腺病毒感染,病毒滴度1010TU/mL,MOI=200),感染7h后PBS洗3次,1mL/孔全量更换培养液,更换为含FBS和青霉素-链霉素的大鼠BMSCs完全培养液,1、2、3d后收集各组细胞上清液,2000r/min离心20min,取上清液,按照ELISA试剂盒操作说明书测定各组上清液中CNTF的蛋白浓度。比较三组上清液中CNTF的蛋白浓度。
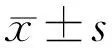
2结果
2.1合成的目的基因序列合成的目的基因为含有CNTF序列的pHBAd-MCMV-GFP载体,ggatcc及gaattc分别为BamH I和EcoR I酶切位点,目的基因序列如下:
ggatccATGGCTTTCGCAGAGCAAACACCTCTGACCCTT
CACCGCCGGGACCTCTGTAGCCGTTCTATCTGGCTAGCAA
GGAAGATTCGTTCAGACCTGACTGCTCTTATGGAATCTTA
TGTAAAACATCAGGGCCTGAATAAAAATATCAACCTTGAC
TCAGTGGATGGTGTACCAGTGGCAAGCACTGATCGTTGGA
GTGAGATGACTGAGGCAGAGCGACTCCAAGAGAACCTCC
AGGCTTACCGTACCTTCCAAGGGATGTTAACCAAGCTCTT
AGAAGACCAGAGAGTACATTTCACCCCAACTGAAGGTGA
CTTCCATCAGGCAATACATACTCTTATGCTCCAAGTTTCT
GCCTTTGCCTACCAGCTAGAGGAGTTAATGGTGCTTCTGG
AACAGAAGATCCCTGAAAATGAGGCTGATGGGATGCCTG
CCACAGTTGGAGATGGTGGTCTCTTTGAGAAGAAGCTAT
GGGGCTTGAAGGTCCTTCAAGAGCTCTCACAGTGGACTG
TGAGGTCTATCCATGACCTTCGTGTCATTTCTTCTCATCA
GATGGGAATCTCAGCACTTGAGAGCCATTATGGGGCCAA
AGATAAGCAGATGTAGgaattc。
2.2含有CNTF的pHBAd-MCMV-GFP载体酶切回收结果含有CNTF的pHBAd-MCMV-GFP载体酶切后得到约5500bp大小的产物,如图1 Lane2~5所示,与pHBAd-MCMV-GFP载体大小一致。
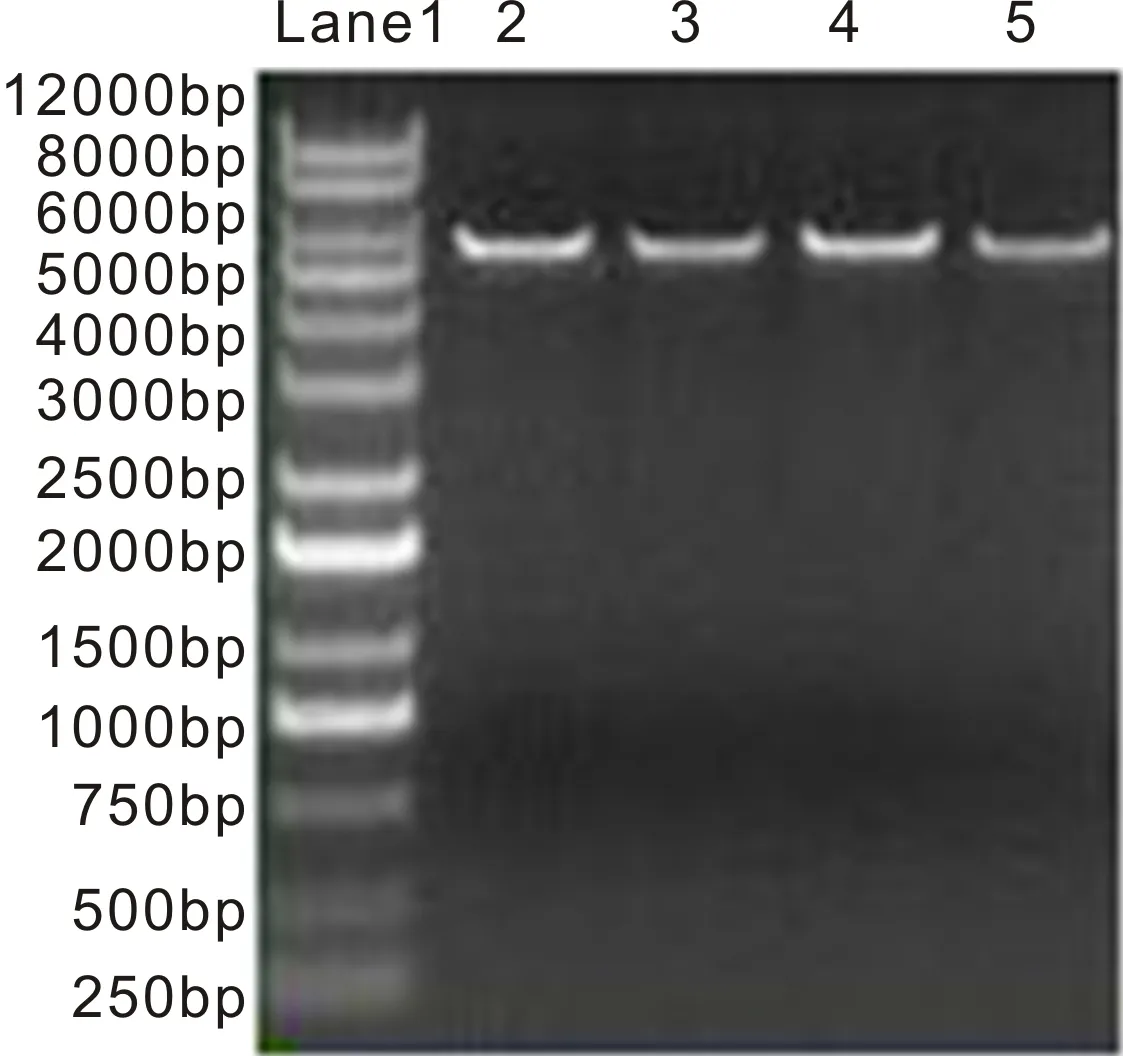
图1 pHBAd-MCMV-GFP载体胶回收结果 Lane1:DNA Marker,Lane2~5:pHBAd-MCMV-GFP载体。
2.3合成的序列载体用BamH I和EcoR I双酶切获得CNTF片段并且酶切完成后胶回收合成的序列用BamH I和EcoR I进行双酶切,获得约5500bp及600bp大小的产物(图2,Lane1),分别与载体和CNTF大小一致,说明目的基因构建成功。

图2 合成载体双酶切胶回收结果 Lane1:CNTF合成载体双酶切产物,上方为GV287载体,下方为CNTF基因;Lane2:DNA Marker。
2.4 CNTF单克隆PCR鉴定结果用通用引物对CNTF单克隆进行PCR检测,得到的目的基因比CNTF大200bp左右(图3,Lane2~7),与引物大小一致,说明CNTF单克隆构建成功。
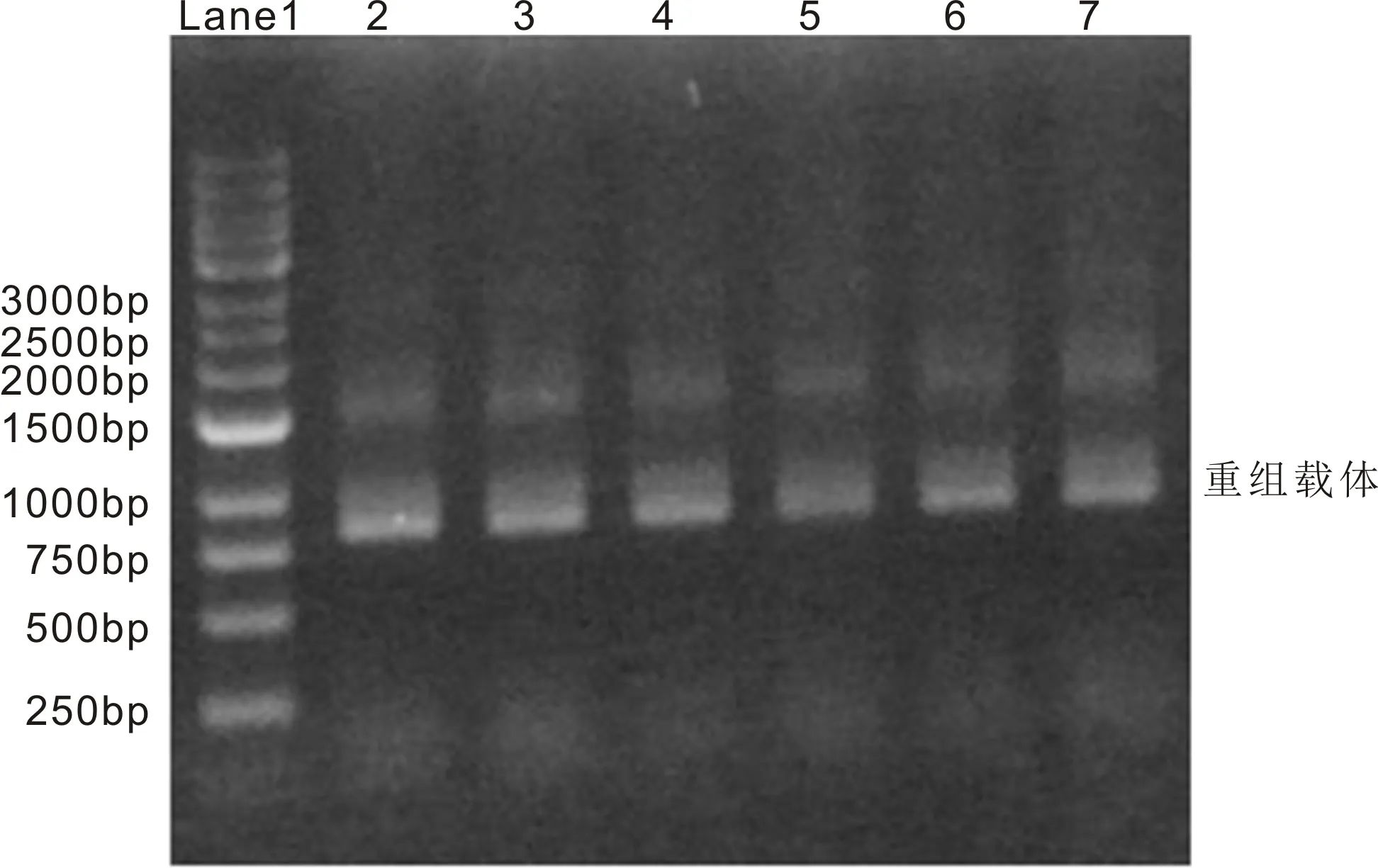
图3 CNTF单克隆PCR鉴定结果 Lane1:DNA Marker;Lane2~7:重组载体。
2.5 pHBAd-MCMV-GFP- CNTF重组载体测序结果CNTF过表达载体测序结果:
GCGGAAGGCTCGGTCGTCGCAGTCTTCGGTCTGACCA
CCGTAGAACGCAGATCGAATTAAGCTTGGGCTGCAGGTCG
ACTCTAGAGGATCCATGGCTTTCGCAGAGCAAACACCTCT
GACCCTTCACCGCCGGGACCTCTGTAGCCGTTCTATCTGGC
TAGCAAGGAAGATTCGTTCAGACCTGACTGCTCTTATGGAA
TCTTATGTAAAACATCAGGGCCTGAATAAAAATATCAACCT
TGACTCAGTGGATGGTGTACCAGTGGCAAGCACTGATCGTT
GGAGTGAGATGACTGAGGCAGAGCGACTCCAAGAGAACCT
CCAGGCTTACCGTACCTTCCAAGGGATGTTAACCAAGCTCT
TAGAAGACCAGAGAGTACATTTCACCCCAACTGAAGGTGA
CTTCCATCAGGCAATACATACTCTTATGCTCCAAGTTTCTG
CCTTTGCCTACCAGCTAGAGGAGTTAATGGTGCTTCTGGAA
CAGAAGATCCCTGAAAATGAGGCTGATGGGATGCCTGCCA
CAGTTGGAGATGGTGGTCTCTTTGAGAAGAAGCTATGGGG
CTTGAAGGTCCTTCAAGAGCTCTCACAGTGGACTGTGAGG
TCTATCCATGACCTTCGTGTCATTTCTTCTCATCAGATGGG
AATCTCAGCACTTGAGAGCCATTATGGGGCCAAAGATAAG
CAGATGTAGGAATTCAGATCTGGTACCGTCGACGCGGCCG
CTCGAGCCGATATCATAACCGTATTACCGCCATGCATTAGT
TATTAATAGTAATCAATTACGGGGTCATTAGTTCATAGCCC
ATATATGGAGTTCCGCGTTACATAACTTACGGTAAATGGCC
CGCCTGGCTGACCGCCCAACGACCCCCGCCCATTGACGTC
AATAATGACGTATGTTCCCATAGTAACGCCAATAGGGACTT
TCCATTGACGTCAATGGGTGGAGTATTTACGGTAAACTGCC
CACTTGGCAGTACATCAAGTGTATCATATG。测序结果比对显示:阳性克隆中的序列与CNTF上(NM_013166.1)的CDS区完全一致(图4,绿色标记部分),表明克隆成功。
图4 阳性克隆的测序结果分析。
2.6各组在不同时间点上清液的CNTF蛋白浓度腺病毒转染后1、2、3d,检测三个组的CNTF蛋白浓度(表3)。结果表明,各组在不同时间点CNTF蛋白浓度差异有统计学意义(F时间=2266.250,P时间<0.001;F组间=14969.493,P组间<0.001;F组间×时间=3336.505,P组间×时间<0.001)。1、2、3d各时间点,与空白对照组相比,实验组的CNTF蛋白浓度上调,差异均有统计学意义(P<0.05);与阴性对照组相比,实验组的CNTF蛋白浓度上调,差异均有统计学意义(P<0.05)。在实验组内,CNTF蛋白浓度随时间延长而提高,差异均具有统计学意义(P<0.05),见表3。

表3 各组在不同时间点上清液中的CNTF蛋白浓度
3讨论
CNTF对视网膜的保护机制主要有:(1)直接作用于感光细胞[12-13],阻止光感受器的变性和凋亡;(2)激活Müller细胞[14],使之分泌保护光感受器的神经营养因子;
(3)促进谷氨酸盐转运蛋白的合成或分布,提高谷氨酸盐的处理效率,减少对视网膜神经元的兴奋毒性损伤[15];(4)增强视网膜细胞对新陈代谢损害的抵抗力,提高视网膜的应激能力[15]。CNTF可以促进动物视细胞的存活[16],在变性视网膜中,CNTF可以加快视锥细胞外段的更新[17],还能抑制视网膜神经节细胞凋亡,其视网膜神经保护功能已被广泛研究。在啮齿类动物中,经玻璃体腔注射CNTF蛋白可引起Müller细胞和视网膜神经节细胞的信号转导及转录活化因子3(signal transducer and activator of transcription 3, STAT3)磷酸化显著增加,而感光细胞的STAT3无明显改变[15, 18]。因此,CNTF也有可能是间接通过其他细胞,如Müller细胞分泌细胞因子从而保护光感受器。RPE细胞顶端存在CNTF受体复合物,提示RPE细胞可对CNTF产生应答[19]。CNTF可促进RPE细胞存活,加速光感受器的更新,促进Müller细胞分泌神经营养因子等,从而保护视网膜。综上,CNTF对视网膜的保护研究具有重要意义。
使BMSCs过表达CNTF,可通过非病毒载体和病毒载体。非病毒载体表达时间短,对细胞转染率低并且不易保存。腺病毒载体构建周期短,转染时间短且转染率高,使用方便,但不能整合到靶细胞基因组中[20],因此适合用作短期的体外实验。慢病毒可携带较大的基因片段,并整合到靶细胞基因组中,可以在宿主内长期、高效稳定地表达[21-22],然而合成周期较长,扩增步骤繁琐,适用于较长时间的体内实验,国内已有武晶晶等[23]利用慢病毒对BMSCs进行基因修饰,使其过表达CNTF。单纯注射或单剂量使用CNTF蛋白,药物半衰期短[24]、浓度波动较大,为使CNTF在体外高效稳定地表达,进一步研究过表达CNTF蛋白的BMSCs在体外研究中对视网膜的保护作用,我们成功构建了过表达CNTF的腺病毒,并利用病毒系统感染BMSCs,使其持续高效表达CNTF成为可能,以期为视网膜疾病的体外研究提供新思路。
