适合流式细胞仪分析的大豆细胞核解离液的筛选与应用
2020-12-04陈林潘贞志戴毅宋丽
陈林 潘贞志 戴毅 宋丽
(1.扬州大学农业科技发展研究院 教育部农业与农产品安全国际合作联合实验室,扬州 225009;2.扬州大学生物科学与技术学院,扬州 225009)
流式细胞术是应用流式细胞仪对处于液流中的单个细胞或生物颗粒进行多参数、快速分析定量及分选的方法。随着荧光分子标记技术的发展,流式细胞检测广泛的应用在生命科学领域:如通过流式细胞术来分析细胞的各种代谢特征,判断细胞凋亡和细胞坏死[1-2],评估细胞的分化和增殖特性[3],以及DNA含量分析、细胞群比例的测定和分选[4]。流式细胞检测在植物学研究中的应用主要有以下几个方面:(1)植物细胞核分析,如:测定DNA的含量[5]、进行植物遗传倍性分析[6]、细胞周期分析、测定基因组大小[7-8];(2)染色体分析及分选和构建染色体文库[9-10];(3)原生质体和细胞融合产物分析及分选[11];(4)应用在系统生物学和生态学上[12]。
然而,与动物细胞或医学研究领域不同,植物细胞具有坚韧的细胞壁,细胞成分如多酚等大量富集,难以分离得到用于流式检测的单细胞悬液。因此,为了对植物材料中核DNA进行定性及定量分析,目前主要采取两种策略[13]:一种策略是酶解去除植物细胞的细胞壁从而收获原生质体,原生质体在低渗溶液中吸水破裂进一步分离细胞核;另一策略是在合适的缓冲液中,通过物理机械切割植物材料使植物细胞破裂,从而使细胞核释放到缓冲液中。Galbraith等[14]最早提出建立机械切割的方法并通过Galbraith’s核解离液成功测定了数种植物的DNA含量和细胞周期。Lee 等[15]改良MgSO4缓冲液成分并使核提取液通过一个棉柱,去除多酚类和细胞碎片,可从兰花中可分离出完整的细胞核用于流式检测;Loureiro等[16]采用GPB和WPB缓冲液制备了37种不同叶组织结构和化学成分的草本和木本植物标本,采用流式细胞仪分析其细胞核DNA含量;李思璐[17]通过流式细胞检测MgSO4缓冲液制备的核悬浮液,研究不同逆境胁迫下玉米不同组织器官在各个发育时期内核复制的发生规律;张琳琳等[18]分别在Otto和LB01缓冲液中解离出细胞核并利用流式细胞术首次测定药用植物黄芩的基因组大小;刘凤霞等[19]从5种缓冲液中筛选出适合通过机械切割制备完整的梨叶片的细胞核悬浮液的核解离液。
大豆是我国重要的粮油作物,然而近年来干旱或洪涝灾害发生频繁,严重影响了其生产发展。大豆根系发育愈好,受水分胁迫危害的程度就愈小,抗逆性越强。因此,深入挖掘逆境下大豆根系发育的调控机理,对减轻干旱或涝渍威胁、保障大豆安全生产具有重要的现实意义[20]。植物根系的生长发育离不开细胞的分裂和分化,无论是根原基的起始与分裂,还是分生组织的形成和活化,都涉及到细胞周期中的细胞分裂和细胞生长两个交替循环的过程[21-22]。此外,植物中一些细胞由于发育和/或环境因素的影响会在S期后跳过G2和M期直接回到G1期,再次起始DNA复制,如此循环导致形成多倍体的细胞[23-24]。因此研究细胞周期调控的机理不仅可以阐明植物生长发育的分子机制,也有利于阐明胁迫对作物生长影响的机制。
本研究在参考流式细胞术在其它植物物种检测DNA含量的研究基础上,寻找适合不同大豆品种的叶片及根组织的细胞核解离液及完善植物流式细胞分析方法及细胞核的制备方法,并利用该技术对PEG模拟的干旱胁迫下大豆根尖中细胞周期的调控进行了分析,为今后使用流式细胞仪对测定大豆DNA的含量、细胞比例和遗传倍性、细胞周期的调控研究提供了技术支持。
1 材料与方法
1.1 材料
供试材料为大豆品种包括William 82、Holladay、PI 567611、PI 567651、Fiskeby III,由扬州大学大豆遗传育种实验室保存。
1.2 方法
1.2.1 植物细胞核解离液配制 本实验所用6种核解离液配方见表1。
1.2.2 PEG 6000模拟干旱处理 大豆种子经吸水膨胀后种植在土壤中,萌发生长6 d,选择生长状态一致的豆苗,避免损伤大豆根系的前提下洗净尘土,根系分别浸没在浓度分别为0%和20% PEG 6000溶液中胁迫7 d后,将根系残余的PEG 6000洗涤干净,取2 cm左右的幼嫩根尖用于细胞核悬浮液制备。
1.2.3 细胞核悬浮液制备 取新鲜幼嫩的大豆叶片或根组织,蒸馏水洗净表面尘土并用滤纸吸干残余水分。培养皿置冰上预冷,加入5 mL预冷细胞核解离液,将植物材料浸没在解离液中,用锋利的刀片一次性快速切割植物材料。轻微的吹吸核解离液,但避免产生气泡,以减少释放的细胞核粘连在植物组织上,细胞核解离液经400目细胞滤器过滤,滤液放置于4℃或者冰上孵育5 min。滤液于4℃、1 000 r/min离心1 min,小心移去上清,沉淀经适量体积的新鲜的细胞核解离液重悬,经终浓度为4 μg/mL的DAPI染色10 min至60 min。

表1 核解离缓冲液配方
1.2.4 流式细胞仪分析 取制备好的细胞核悬浮液500 μL,用FACS LSRFortessa流式细胞分析仪(BD公司,美国)在低流速条件下检测,至少吸取10 000 个经DAPI染色的颗粒。用Modfit 5.0软件分析结果,分别画出吸收的颗粒数(count)和荧光强度(Fluorescence intensity,FL)关系图,所有样品运行参数设置一致,测定参数主要有相对荧光强度、变异系数(Coefficient variation,CV)、碎片背景(Debris background factor,DF)。
2 结果
2.1 不同核解离液对细胞核解离的影响
本研究共采用6种不同核解离液分离大豆叶片细胞的细胞核。经流式检测分析发现,根据散射光检测信号,Galbraith’s核解离液(图1-A)、LB01核解离液(图1-B)、和mG核解离液(图1-C)可获得清晰的2团细胞器颗粒信号聚集区域,而Tris·MgCl2核解离液(图1-D)、GPB核解离液(图1-E)和WPB(图1-F)核解离液中仅有一团细胞颗粒信号富集区域。通过对比大豆根中细胞核散射光信号,确认黑色框选中区域的信号对应为细胞核的散射光信号,推测在黑色框以外区域的信号富集可能为叶绿体细胞器。
2.2 不同解离液对DNA相对含量的影响
为了进一步确定适合大豆幼嫩叶片细胞核提取的核解离液,实验结果用Modfit5.0软件,以荧光面积信号为横轴,以细胞核颗粒数为纵轴,根据所选定的信号区域显示统计结果。通过DNA相对含量直方图(图2)可以得出:在Galbraith’s核解离液(图2-A)、mG核解离液(图2-B)和LB01核解离液(图2-C)提取的细胞核悬浮液在G0/G1期均形成了呈正态分布的DNA峰,并且其变异系数CV均小于5%,分别是2.78%、4.24%和2.96%。但是Galbraith’s核解离液和mG核解离液中多倍体检测到的量较少,在G2/M期未形成较明显的峰,这有可能对DNA倍性和细胞周期以及有丝分裂各时期细胞数量的分析造成一定的误差。LB01核解离液可检测到显著的G2/M期峰,虽然LB01解离液所形成的碎片较Galbraith's核解离液和mG核解离液多,但是在检测细胞周期及遗传倍性中相对更好。相反,GPB核解离液(图2-E)和WPB核解离液(图2-F)中DNA峰较差,碎片很多,其变异系数较大。Tris·MgCl2核解离液(图2-D)可以形成呈正态分布的DNA峰,但DNA峰与另外由5种核解离液所得的DNA峰在荧光强度上,明显相对减小且偏移较大,表明Tris·MgCl2核解离液可能对核内染色质的分布造成了影响。
进一步利用Galbraith’s核解离液(图3-A)和LB01 核解离液(图3-B)对大豆根中的细胞核进行了解离,研究结果表明两种核解离液均在G0/G1期和G2/M 期均形成了呈正态分布的DNA峰。综上所述,Galbraith’s和 LB01 核解离液适用于大豆叶和根中细胞核的解离。
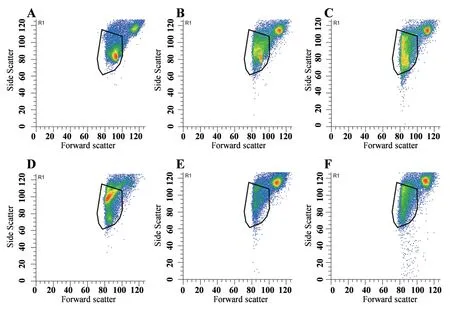
图1 不同核解离液处理获得的大豆嫩叶组织细胞核散射光特征
2.3 不同核解离液对细胞核提取效率的比较
用Galbraith’s和LB01两种不同核解离液提取的悬浮液细胞核形态观察结果见图3。结果表明这两种核解离液不但可获得较多的单个细胞核,而且细胞核呈饱满的圆形或者椭圆形悬浮在核解离液中,较好辨认。因此这两种核解离液能较好保证完整的细胞核从细胞中释放出来,同时可以减少细胞中的次生代谢物的游离,尽管也有少量的几个单颗粒细胞核黏在一起或者与其他杂质黏在一起的情况发生。
对比6种核解离液产生的细胞碎片发现,WPB和GPB核解离液中碎片较多,其中GPB核解离液不能分离出完整的细胞核,且细胞核的形态不完整,导致荧光信号不能聚集。因此这两种核解离液不适合分离大豆细胞核。其中Tris·MgCl2核解离液中叶绿体的污染较少,但是细胞碎片较多。WPB、GPB以及Tris·MgCl2核解离液流速较慢,单位时间内颗粒数较少,也表明这3种核解离液不能高效的分离细胞核。
2.4 LB01核解离液在不同大豆品种上的适用性及应用性
为验证LB01解离液是否具有广适性,首先分别取大豆不同品种Holladay、PI 567611、PI 567651、FiskebyIII新鲜幼嫩的根尖,在LB01核解离液中机械切割释放出细胞核,通过流式细胞仪检测其DNA含量并分析遗传倍性,结果如图4所示。细胞核悬浮液在G0/G1期和G2/M期均形成了呈正态分布的DNA峰,并且其变异系数CV均小于5%。因此,LB01核解离液在其他大豆品种上亦具有良好的适用性。尽管不同大豆品种的细胞核的散射光特征上存在微小差异,可能是由于细胞核在颗粒大小及复杂程度上存在细微差异。
为进一步分析LB01解离液和流式细胞仪在大豆细胞周期检测上的应用,我们同时检测了PEG6000模拟干旱处理对不同大豆品种根尖的细胞周期的调控。结果(图4)表明20% PEG6000处理使G2/M细胞比例相对增多,显著促进核内复制。同时我们发现不同品种大豆对相同浓度PEG胁迫响应程度不同,例如PI 567651根尖的G2/M期细胞比例未处理为16.17%,处理后为63.22%,说明细胞周期被显著阻滞(图4-E-F);但是PI 567611中根尖的G2/M期细胞比例未处理为24.36%,处理后的29.24%,虽然细胞周期被抑制,但是其响应PEG胁迫程度较其它品种低(图4-C-D)。该研究结果不仅表明利用LB01核解离液和流式细胞术可成功检测大豆根尖的细胞周期,而且表明干旱胁迫参与调控大豆根尖的细胞周期进程,及不同大豆品种响应程度有差异。

图2 不同核解离液获得的大豆嫩叶组织细胞核DNA相对含量

图3 不同核解离液获得的大豆根细胞核DNA相对含量及形态学观察
3 讨论
田新民等[25]建议选取适合实验材料的解离液时可参照成功测定同属或同科的物种的解离液,因此本研究为将来研究豆科植物利用流式细胞仪技术上提供参考。此外,由于流式细胞检测需要在短时间内分析大量的细胞核悬液,因此对提取的细胞核悬液的纯度和浓度要求较高,浓度为1×105-1×107个/mL的高纯度完整的单颗粒细胞核较为适宜[26]。本实验中由于叶绿体DNA可与染料DAPI结合,在分选时出现荧光值而干扰细胞核信号,而根组织中没有叶绿体,由其制备的细胞核悬液的纯度和浓度更高。因此,叶片组织和根组织相比,根组织是更适合流式细胞仪分选的材料。
核解离液中添加非离子型表面活性剂(如Tween-20或Triton X-100)可以促进细胞核的释放及防止黏性物质粘住细胞核。本研究中所有的核解离液均添加了一定浓度的Triton X-100,但是提取细胞核的效果有差异。在所有的细胞核解离液,Galbraith’s解离液的解离效果最好,其Triton X-100浓度是0.1%,而WPB和GPB中,Triton X-100 浓度较高(0.5%-1%),核解离液中Triton X-100 的浓度可能是关键因素之一。此外,离心强度过大或时间过短,细胞核仍悬浮在核解离液中达不到富集的效果,在下一步弃多余核解离液而丢失;离心强度过大或时间过长,制备的细胞核悬浮液杂质会明显增加甚至干扰检测。
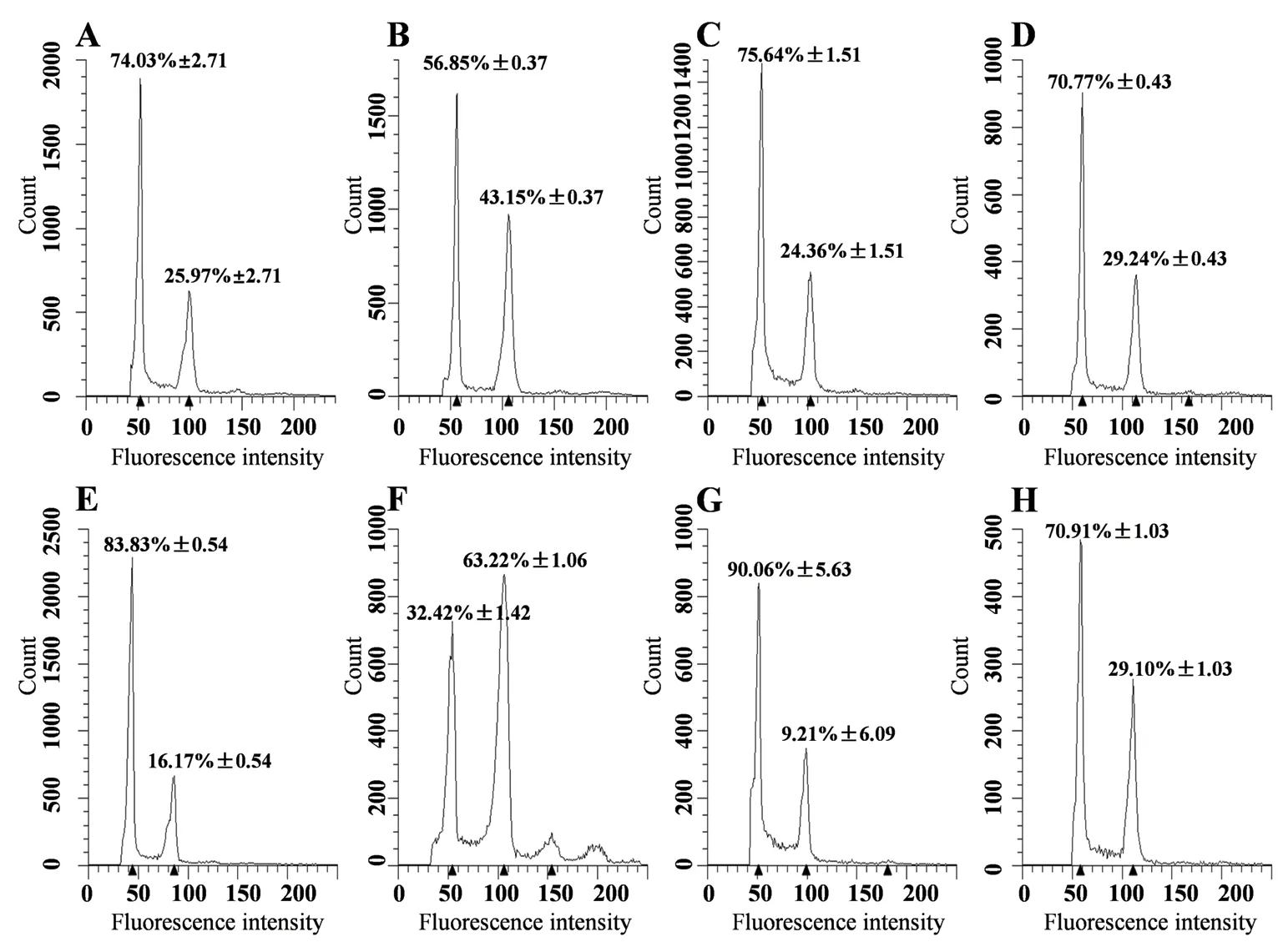
图4 不同大豆品种在PEG模拟干旱胁迫前后细胞周期的分析
核内复制有助于维持植物在压力条件下的生长以适应不利的环境因素。在许多物种中,水分胁迫可以通过降低细胞周期蛋白依赖性激酶的活性来抑制有丝分裂周期,增加核内复制周期。细胞核内复制水平的提高可促进细胞扩张,从而减轻水分亏缺对细胞大小的影响,帮助植物减缓所受到的胁迫伤害[27-28]。本研究在筛选适合大豆组织的核解离液的基础上,进一步对大豆干旱胁迫下细胞周期的调控进行了初步分析,本实验采用LB01核解离液提取的细胞核悬浮液的变异系数均小于5%,且碎片较少,主峰非常明显,说明该核解离液不仅分离大豆根的细胞核效果较好,而且由此对应的细胞周期分析实验结果可靠,为进一步研究逆境对大豆核内复制水平的影响提供技术支持。本研究为使用流式细胞仪简便、快速、准确地研究大豆细胞核DNA的含量、细胞周期和遗传倍性奠定了基础
4 结论
本研究利用流式细胞仪分析对比了6种细胞核解离液的分离效果,找到了适合大豆叶片及根组织的细胞核解离液。其中Galbraith’s核解离液的核分离效果最好,LB01核解离液次之,但LB01核解离液可检测到显著的G2/M 期峰,在细胞周期及遗传倍性中相对更好。进一步通过比对不同大豆品种中PEG处理前后根尖细胞核细胞周期,表明LB01核解离液亦具有良好的适用性及应用性。
