一株沙门氏菌Ⅲb 60:r:e,n,x,z15的分离、鉴定及其检测方法比较
2020-11-24章志超鄢雷娜匡佩琳
章志超,鄢雷娜,匡佩琳,*
(1.江西省食品检验检测研究院,江西南昌330001;2.江西省药品检验检测研究院,江西南昌330029)
沙门氏菌是最常见的食源性致病菌之一。根据生化反应和DNA同源性等特征,沙门氏菌属可分为肠道沙门氏菌和邦戈尔沙门氏菌两大类,其中肠道沙门氏菌又分为Ⅰ、Ⅱ、Ⅲa、Ⅲb、Ⅳ和Ⅵ,6个亚种[1]。日常食品中畜禽肉类、蛋类、乳类食品最易受沙门氏菌污染,尤其是生鲜类[2-3]。巧克力的高脂、高糖成分为沙门氏菌的生存提供了保护环境,使细菌更容易到达肠道,引起人体感染[4-5]。沙门氏菌能够引起人和动物感染败血症与胃肠炎等疾病,其中使人类致病的常见沙门氏菌主要来自肠道沙门氏菌肠道亚种(I),如肠炎沙门氏菌、鼠伤寒沙门氏菌、猪霍乱沙门氏菌、鸡沙门氏菌等[3,6-7]。
目前,传统培养和生化鉴定仍是食品中沙门氏菌检测最常用的方法之一,我国食品安全监督检验也采用了基于此原理建立的方法GB 4789.4-2016《食品安全国家标准食品微生物学检验沙门氏菌检验》对沙门氏菌进行检测[8]。该方法需要至少4 d~6 d才能得出检测结果[9],耗时较长,不利于对该类致病菌污染的快速判断与相关突发事件的及时处置。因此,实际研究中荧光聚合酶链式反应(polymerase chain reaction,PCR)、商业化的BAX System Q7鉴定系统、VITEK2生化鉴定系统、Riboprinter基因指纹鉴定技术和MiniVIDAS系统等分子生物学或免疫学技术常常被应用于沙门氏菌的快速筛查或鉴定当中[2,10-11]。
沙门氏菌Ⅲb最早被分离自蛇等冷血动物及环境中,也被报道检出于一些畜禽当中[1,12-13]。该菌在沙门氏菌常见的食品宿主中被检出频率不高,当采用GB 4789.4-2016《食品安全国家标准食品微生物学检验沙门氏菌检验》的方法进行检测时,沙门氏菌Ⅲb的部分生化和表型特征不够典型,往往导致漏检情况的发生[14]。同时沙门氏菌及其干扰菌的增菌和分离研究多针对常见的鼠伤寒沙门氏菌和肠炎沙门氏菌等[15-17],对沙门氏菌Ⅲb在该方面研究的文献报道不多。本研究在标准方法的基础上,探讨了实验室常用的商业化的BAX System Q7、VITEK2系统和Riboprinter基因指纹鉴定技术在检测以巧克力为基质的沙门氏菌样品的适用情况及特点,对检出的沙门氏菌Ⅲb生化和血清型特征检测过程进行了细致描述,同时比较了沙门氏菌Ⅲb 60:r:e,n,x,z15在不同培养基中的增菌分离特征,形成了一套分离、鉴定沙门氏菌Ⅲb 60:r:e,n,x,z15较优的检测方案,为准确、快速检测出食品中该类不常见的沙门氏菌提供参考。
1 材料与方法
1.1 材料与试剂
巧克力:样品编号分别为 0716、0752、0362,来自中国食品药品检定研究院的NIFDC-PT-135沙门菌能力验证计划。肠炎沙门氏菌CICC 24119:中国工业微生物菌种保藏管理中心。
缓冲蛋白胨水(buffered peptone water,BPW)、亚硒酸盐胱氨酸(selenite cystine,SC)增菌液、四硫磺酸钠煌绿增菌液(tetrathionate Broth,TTB)、沙门菌增菌液体培养基(rappaport-vassiliadis,RV)、木糖赖氨酸脱氧胆盐(xylose lysine desoxycholate,XLD)琼脂、亚硫酸铋(bismuth sulfite,BS)琼脂、沙门氏菌显色培养基、沙门氏菌生化鉴定套装:北京陆桥生物技术有限公司;沙门氏菌属诊断血清:宁波天润生物药业有限公司;VITEK2革兰氏阴性菌鉴定卡:法国梅里埃生物公司;BAX Q7沙门氏菌检测试剂盒、Riboprinter全自动基因指纹图谱鉴定套装:美国杜邦公司。
1.2 仪器与设备
ZXSD-A1430生化培养箱:上海智城分析仪器制造有限公司;BAX System Q7全自动病原微生物检测系统、RiboPrinter?全自动微生物基因指纹鉴定系统:美国杜邦公司;VITEK2 Compact 60全自动微生物生化鉴定系统:法国梅里埃生物公司。
1.3 方法
1.3.1 预增菌
将巧克力样品加入90 mL灭菌的BPW中,参照GB/T 4789.24-2003《食品卫生微生物学检验 糖果、糕点、蜜饯检验》[18]融化样品,充分均质混匀后,于36℃静置培养18 h。
1.3.2 增菌、选择性分离、生化鉴定和血清型鉴定
样品预增菌后,参照GB 4789.4-2016《食品安全国家标准食品微生物学检验沙门氏菌检验》[9]方法依次进行增菌、选择性分离、传统生化鉴定和血清型鉴定。同时挑取可疑菌,纯化后进行VITEK2上机鉴定。
1.3.3 目标菌分子初筛
将样品培养后BPW、TTB增菌液和SC增菌液作为检测对象,参照BAX Q7沙门氏菌检测试剂盒进行检测,依次完成加入裂解试剂、孵育、裂解过程,加入到PCR反应试剂后扩增,结果自动分析等步骤,对目标菌进行初筛。
1.3.4 目标菌基因指纹鉴定确证
生化鉴定为阳性的菌株经活化后,加入200 μL样品专用缓冲液,振荡混匀,取30 μL菌悬液进行热处理后,每管分别加入裂解液A和B各5 μL,根据仪器提示放入相应反应试剂进行检测和分析。
1.3.5 菌株在不同培养基上的生长指数测定
将分离得到的沙门氏菌Ⅲb和其干扰菌,弗氏柠檬酸杆菌、摩根氏菌摩根亚种和奇异变形杆菌分别经TTB、SC、RV 培养基增菌后,参照 GB 4789.28-2013《食品安全国家标准食品微生物学检验培养基和试剂的质量要求》[19]中“目标菌半定量划线法”的方法分别划线XLD、TTB和BS固体培养基,并按标准规定进行培养,重复试验2次,并统计生长指数,以肠炎沙门氏菌CICC 24119作为阳性参照菌。结果以“平均值±标准差”表示。

图1 PCR熔解曲线图Fig.1 PCR melting curve
2 结果与分析
2.1 分子初筛结果分析
按照GB 4789.4-2016《食品安全国家标准食品微生物学检验沙门氏菌检验》中沙门氏菌检测方法流程进行增菌后,采用BAX System Q7系统分别对BPW、SC和TTB增菌液进行沙门氏菌检测,如图1所示。
采用BPW预增菌后,检测未得到正常的熔解曲线,显示信号错误。SC和TTB增菌液对应的PCR链熔解曲线图均有内部质控峰,试验有效。样品0362和样品0752的两种增菌液对应的PCR链熔解曲线均无目标峰,表示未检出沙门氏菌;样品0716经SC增菌后,PCR链熔解曲线图中出现目标峰,且远高于质控峰,显示为强阳性结果,表明SC增菌液中沙门氏菌浓度较高;而样品0716经TTB增菌后,经检测质控峰远大于目标峰,显示为弱阳性结果。
由分子初筛结果可知,选择不同增菌液经BAX System Q7系统检测,结果差异较大。由于巧克力样品直接溶解于BPW中增菌,导致加入反应体系的增菌液中含有较多脂肪,且颜色较深等因素可能对试验结果造成干扰。Jasson等[5]指出巧克力样品的低水分活度等特性,其中沙门氏菌污染量往往极低,且微生物多呈受损伤状态。因此采用TTB等一些选择性强的增菌液作为上机模板很可能得到假阴性结果。研究采用的巧克力样品SC增菌液适合该仪器检测,样品经增菌后,仅需约3.5 h出结果,结果与指定结果相符,具有准确、快速的特点。与普通PCR和荧光PCR方法相比,该方法简化了DNA提取与反应体系配制流程,且反应体系采用了干粉制剂,仅需加入DNA模板便可上机检测,操作简单,降低了对检测人员的分子生物实验操作的技术要求。因此,邓晓丽等[20]检测金黄色葡萄球菌时也指出该方法适合基层检测人员对致病菌的快筛应用。
2.2 培养微生物选择性分离
样品经增菌培养后,采用3种不同的选择性固体培养基分别对TTB增菌液和SC增菌液进行划线分离。样品0362和0752对应的增菌液澄清,选择性平板上均无菌落生长,未检出沙门氏菌,与分子初筛结果一致。样品0716的增菌液浑浊,选择性平板上均有菌落生长,如图2所示。

图2 样品增菌液在不同选择性分离培养基上的划线分离结果Fig.2 The streaking results of different enrichment medium
同等划线条件下,SC增菌液划线菌落显著多于TTB增菌液;沙门显色培养基的选择性则更强,平板上细菌种类少,且只在划线1-2区有菌落生长。
在XLD平板上分离得到:菌落边缘接近透明,带较大黑色中心(菌落Z-1);菌落较小,边缘接近透明,有中心黑点(菌落Z-2);菌落呈黄色,饱满、光滑湿润(菌落Z-3);菌落呈黄色,扁平略有凹陷、干燥(菌落Z-4)。在BS平板上分离得到:菌落黑色,略带金属光泽(菌落Z-5);菌落边缘接近棕色,带黑色中心且无金属光泽(菌落Z-6)。在沙门显色平板上分离得到:菌落呈浅棕灰色或浅红色(菌落Z-7、Z-8),同时按照沙门显色培养基使用说明,将生长的一些绿色菌落视为非可疑菌。
2.3 可疑菌生化鉴定
参照GB 4789.4-2016《食品安全国家标准食品微生物学检验沙门氏菌检验》对分离得到的可疑菌进行生化鉴定,鉴定结果见表1。

表1 可疑菌的生化鉴定Table 1 Biochemical identification of suspected bacteria
菌株 Z-1、Z-2、Z-6、Z-7 和 Z-8 的赖氨酸脱羧酶反应阴性、pH7.2尿素反应阳性,鉴定为非沙门氏菌,同时VITEK2鉴定为奇异变形杆菌(相似度均为99%);菌株Z-4在三糖铁琼脂上反应和赖氨酸脱羧酶反应表明该菌不是沙门氏菌,VITEK2鉴定为弗氏柠檬酸杆菌(相似度99%);菌株Z-5的pH7.2尿素和靛基质反应均为阳性,初步判断该菌不是沙门氏菌,VITEK2鉴定也确证该菌为摩根氏菌摩根亚种(相似度99%);在初步生化鉴定的基础上,菌株Z-3进一步进行了沙门氏菌属的生化群相关生化反应试验,结果表明:该菌与沙门氏菌属生化群Ⅲ吻合,同时VITEK2鉴定为沙门氏菌Ⅲb(相似度96%),因此可以确定该菌为沙门氏菌,样品0716为阳性样品。由此可见,在沙门氏菌Ⅲb的检测中,VITEK2较传统鉴定方法更有优势:操作简单、快速,能够直接鉴定到种水平。
试验中没有从BS平板和沙门显色平板上挑取到阳性菌株,为了进一步确定该菌在这两种培养基上的菌落形态,将菌株Z-3活化后接种于上述两种培养基中。菌落形态如图3所示。

图3 沙门氏菌Ⅲ b分别接种于沙门氏菌显色培养基和BS琼脂上的菌落形态Fig.3 Morphological characteristics of colonies of Salmonella Ⅲ b in salmonella chromogenic agar and BS agar
阳性菌株Z-3在沙门氏菌显色培养基上菌落边缘接近透明,略带浅红色,绿色菌落中心;在BS平板上则菌落较小,边缘透明,中心黑色。该阳性菌在沙门显色培养基上不是培养基说明书上提示的典型(浅)紫红色菌落,在BS平板上则由于干扰菌的存在,且目标菌菌落太小,因此导致试验中阳性菌在这两类平板上未被筛选得到。同时需要指出的是:XLD平板上弗氏柠檬酸杆菌与沙门氏菌Ⅲb 60:r:e,n,x,z15菌落特征非常接近,不易区分。不少学者在检测沙门氏菌Ⅲb时均提出了与本研究类似的问题,认为该类沙门菌的检测难度较大,对检验人员的技术水平要求较高[15,21]。同时,一些对沙门氏菌的选择性培养或干扰菌研究报道多基于典型菌落特征的常见沙门氏菌进行分析,未将沙门氏菌Ⅲb考虑在内,导致结果略显片面[15]
2.4 目标菌血清学分型
按照国标进一步对菌株Z-3的血清型分析,结果表明:菌株Z-3不被常用的O多价A-F血清凝集,容易导致漏检误判。当进一步采用其它O血清试验时,菌株Z-3能够被O60凝集。同时对菌株Z-3进行H血清的第一相和第二相检查,发现该菌株能够为r血清凝集。为了确定其它H血清凝集情况,参照GB 4789.4-2016《食品安全国家标准 食品微生物学检验 沙门氏菌检验》中的简易平板法进行抑制诱导[9],结果发现经诱导后,H 血清中 e,n,x,z15能够凝集菌株 Z-3。参照相关文献[22],最终生化鉴定确定为沙门氏菌属的菌株Z-3 的血清型为:60:r:e,n,x,z15。
2.5 阳性菌基因指纹鉴定
为进一步确证筛选到的阳性菌株,选用RiboPrinter全自动微生物基因指纹鉴定系统对菌株Z-3进行鉴定,试验中选用PvuII限制性内切酶对菌的基因组进行处理,如表2所示。

表2 菌株Z-3的RiboPrinter系统鉴定结果Table 2 Identification results of Z-3 analyzed by RiboPrinter system
菌株Z-3的两次鉴定结果均为沙门氏菌Ⅲb 60:r:e,n,x,z15,相似度分别为 93%和 92%,大于 85%,结果可信。这与上述生化和血清型鉴定结果一致。由2.4可知,与常见的沙门菌相比,沙门氏菌Ⅲb的血清型鉴定试验更为繁琐,且要求实验室储备的鉴定血清种类较全,才能够得到准确结果。本研究采用的Riboprinter鉴定系统能够为沙门氏菌Ⅲb的血清型判断提供良好的参考,但在该类菌的应用研究报道不多,多应用于鼠伤寒沙门氏菌等一些常见的沙门菌的鉴定和分型[10,23]。
2.6 不同分离条件下目标菌和干扰菌的生长情况比较
由于上述4种鉴定方法在沙门菌Ⅲb的筛选和鉴定中都离不开样品增菌或划线分离等筛选程序,因此为了获得更好的检测方案,有必要比较不同增菌液和分离培养基组合对沙门氏菌的分离效果。肠炎沙门氏菌是导致沙门氏菌病最常见的病原之一[3],代表一类在菌落形态典型(XLD平板上呈边缘透明,中心黑色;BS平板上为带有金属光泽的棕褐色菌落;沙门显色培养基上为紫红色菌落)的常见沙门氏菌,因此研究中以肠炎沙门氏菌CICC 24119为参照比较菌。结合样品中分离得到的阳性菌和干扰菌的选择性生长和菌落特征表征两方面,对国内外主要的沙门菌检测标准使用的几种分离培养基进行了培养效果比较[9,24]。沙门氏菌及其干扰菌在不同分离培养基上的生长指数检测结果如表3所示。
SC培养基增菌选择性较差,接种划线BS分离培养基时,仅弗氏柠檬酸杆菌生长指数较小,其它接种情况下,各干扰菌和参照菌生长良好,与沙门氏菌Ⅲb的生长差异不大,生长指数无显著性差异。3种干扰菌经TTB培养后,生长指数接近0,几乎被完全抑制;两种沙门氏菌经TTB培养,划线相同培养基后,生长指数无显著性差异,生长指数处在4~9之间。可见,TTB虽然对沙门氏菌增殖效果不如SC,但总体具有良好的生长选择性。BAX System Q7系统的检测结果也印证了SC和TTB对沙门氏菌的增殖特点。RV培养基对3种干扰菌同样具有良好的抑制效果,同时RV对沙门氏菌Ⅲb也有一定的抑制作用,因此更适合肠炎沙门氏菌等常见沙门氏菌的增殖。因此分析试验结果可知,在沙门氏菌的分离过程中,增菌液较选择性固体培养基对目标菌的选择生长方面发挥更为关键的作用,后者更大的作用则体现在目标菌菌落特征的表征方面。SC培养基适合沙门菌含量极低、菌群结构简单的样品增菌;TTB和RV培养基则适合沙门菌含量较高,菌群结构复杂的样品分离目标菌,其中TTB较RV更适合沙门氏菌Ⅲb的增菌。
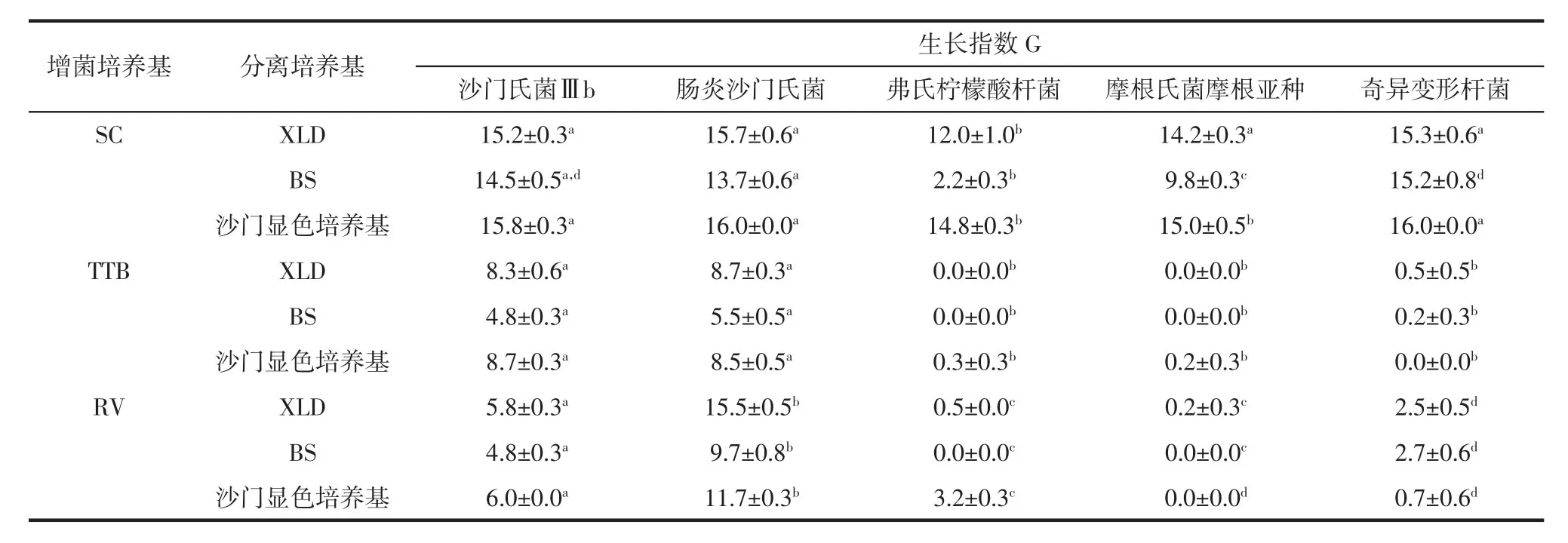
表3 沙门氏菌及其干扰菌的在不同分离培养基上的生长指数Table 3 Growth index of Salmonella and interfering strains in different selective medium
3 结论
样品0752和0362均检出沙门氏菌,样品0716检出沙门氏菌Ⅲb 60:r:e,n,x,z15。检测结果与指定值相符,结果满意。该菌的传统生化鉴定需要结合生化群鉴别试验,常用的O多价A-F血清也不凝集,必要时还需结合文献进行辅助判断,因此整个检验流程均容易漏筛误判。国家标准方法对该类不常见致病菌鉴定时,耗时长达7 d以上,借助BAX System Q7、VITEK2和Riboprinter3系统均能够有效缩短检测时间,起到相互验证的目的。VITEK2系统和RiboPrinter系统均能够对沙门氏菌Ⅲb 60:r:e,n,x,z15鉴定到种水平,且后者能给出血清型。当沙门氏菌含量较低,且存在多种干扰菌的阳性巧克力样品中,预增菌后采用TTB增菌,XLD或沙门显色培养基分离后,经RiboPrinter系统鉴定能够更高效地筛选得到沙门氏菌Ⅲb 60:r:e,n,x,z15。
