鸿雁骨胶原多肽制备及其抗氧化活性研究
2020-11-24熊明泽孙尧崔本海高冷
熊明泽,孙尧,*,崔本海,高冷,*
(1.长春工业大学化学与生命科学学院,吉林长春130012;2.通榆县向海崔成大雁养殖有限公司,吉林白城137000)
鸿雁(Anser cygnoides)是我国传统狩猎鸟类,其肉品野味浓郁、营养丰富、脂肪和胆固醇含量低,且具有祛风、舒筋、壮骨之保健功能,深受人们喜爱,现已在多个省份进行人工驯化养殖,并形成一定规模[1]。目前,我国对于鸿雁的开发仅局限于肉类食用,关于雁骨的利用并没有好的方法,造成了大量骨资源浪费。
畜禽骨骼中含有如蛋白质、氨基酸、矿物质、软骨素、骨胶等具有保健作用的功能物质[2],其所含的蛋白质中,胶原蛋白占到90%以上,能够促进人体皮下组织的代谢功能,还可以延缓衰老[3]。胶原蛋白主要为三螺旋结构,不易被生物体利用,酶解会使其转变为肽和游离氨基酸[4]。近年来,骨胶原多肽因其丰富的营养价值和生理功能成为当前研究的热点,国内外对于骨骼酶解的报道较多,主要集中在猪骨[5]、牛骨[6]、鱼骨[7]等,酶解雁骨制备胶原多肽的研究却鲜见报道。大量研究表明:酶解动物骨蛋白得到的胶原多肽具有降血压[8]、抗氧化[9]、抗骨质疏松[10]等生理活性。庄本庆等[11]以牛骨粉为原料,以水解度为指标,选用两种酶酶解制备胶原多肽,采用正交试验设计优化了酶解工艺条件。郭冰洁等[12]采用热水抽提法提取鹿骨中的胶原蛋白,再经胃、胰蛋白酶酶解,制得鹿骨多肽,然后以鹿骨多肽的水解度为指标,通过单因素和正交试验优化鹿骨多肽的胰蛋白酶酶解工艺。
本文采用复合酶酶解制备雁骨胶原多肽,利用响应面分析对酶解工艺进行优化,确定雁骨胶原多肽制备的最佳工艺,通过不同的体外抗氧化指标对鸿雁骨胶原多肽的抗氧化活性进行测定,同时分析其氨基酸组成和相对分子质量,为进一步开发利用雁骨胶原多肽提供数据参考。
1 材料与方法
1.1 材料与试剂
鸿雁雁骨:通榆县向海崔成大雁养殖有限公司提供。
木瓜蛋白酶(400 U/mg):北京鼎国昌盛生物技术有限责任公司;中性蛋白酶(200 U/mg)、碱性蛋白酶(60 U/mg):北京奥博星生物技术有限责任公司;胰蛋白酶(250 U/mg)、胃蛋白酶(3 000 U/mg):北京索莱宝科技有限公司;30%Acr-Bis:博士德生物工程有限公司;考马斯亮蓝R-250:美国Sigma-Aldrich公司;彩色预染标准蛋白 Marker(10 kDa~250 kDa):美国赛默飞世尔科技公司;邻苯三酚、30%过氧化氢溶液:南京化学试剂有限公司;其他化学试剂为国产分析纯。
1.2 仪器与设备
冷冻干燥机(LGJ-30):北京松源华兴科技发展有限公司;电热恒温水浴锅(DK-S26):上海精宏实验设备有限公司;中草药粉碎机(FW135):天津市泰斯特仪器有限公司;高速台式离心机(TGL-IGC):上海安亭科学仪器厂;电子天平(HX2002T):慈溪市天东衡器厂;紫外-可见分光光度计(TU-1800PC):北京普析通用仪器有限责任公司;冷冻高速离心机(GL-10MC):长沙湘锐离心机有限公司;微型漩涡混合仪(XW-80A):上海沪西分析仪器厂;培养箱/干燥箱(PH-050A):上海一恒科学仪器有限公司;电泳仪(DYY-10C):北京六一生物科技有限公司;TSK gel Super SW2000凝胶过滤色谱柱(300 mm×4.6 mm,4 μm):上海东曹生物科技有限公司;氨基酸分析仪(L-8900):日本日立公司。
1.3 方法
1.3.1 雁骨粉的制备
将去肉雁骨切成1 cm~2 cm的骨段,将骨段与石油醚以1∶2(g/mL)的骨/溶液比混合,用超声辅助提取油脂6 h,每2 h更换溶剂并去除油脂,然后用纯水以1∶20(g/mL)的比例洗涤去除油脂后的骨段3次。然后将骨段用0.05mol/L乙二胺四乙酸-二钠(ethylene diamine tetraacetic acid-2Na,EDTA-2Na)溶液以 1 ∶10(g/mL)的比例脱矿质24 h,并且每12 h更换溶液,然后将脱矿质骨段用纯水以1∶20(g/mL)的比例洗涤10 min,并进行3次洗涤。将脱矿物质后的骨段置于2%NaCl溶液中[质量体积比为 1 ∶5(g/mL)],25 ℃条件下静置10 h,取出杂蛋白,并用纯水清洗骨段3次。将处理后的骨段在超低温冰箱中冻存,然后置于真空冷冻干燥机中进行干燥,最后通过万能粉碎机对冻干后的雁骨进行粉碎,过40目筛,制备得到雁骨粉。
1.3.2 雁骨胶原蛋白及胶原多肽的制备工艺
骨粉水浴溶解→离心分离→真空抽滤→蒸发浓缩→胶原蛋白浓缩液→真空冷冻干燥→胶原蛋白粉。
骨粉溶解→调节pH值→加酶水浴酶解→95℃灭酶→冷却后离心分离→真空抽滤→蒸发浓缩→胶原多肽浓缩液→真空冷冻干燥→胶原多肽粉。
1.3.3 酶解工艺
1.3.3.1 蛋白酶筛选
由于蛋白酶具有底物特异性、作用位点专一性的特点,因此不同蛋白酶对鸿雁雁骨的水解程度不同,且酶解产物的功能性质也有所不同[13]。本试验选用木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、胰蛋白酶和胃蛋白酶5种蛋白酶进行酶解试验,配置5%的雁骨粉溶液,按照表1条件调节起始pH值(磷酸盐缓冲液调节pH值),酶解5 h,95℃灭酶10 min,5 000 r/min离心10 min,取上清液测定酶解液水解度。同时设置空白组,不添加酶酶解,提取雁骨胶原蛋白。
采用两种方式调节酶解pH值:一种是调节起始pH值;另一种是加入磷酸盐缓冲液,维持酶解过程pH值不变。以水解度为指标,将这两种方式进行试验对比,选出3种最佳酶组成复合酶和最佳pH值调节方式。具体酶解条件见表1。
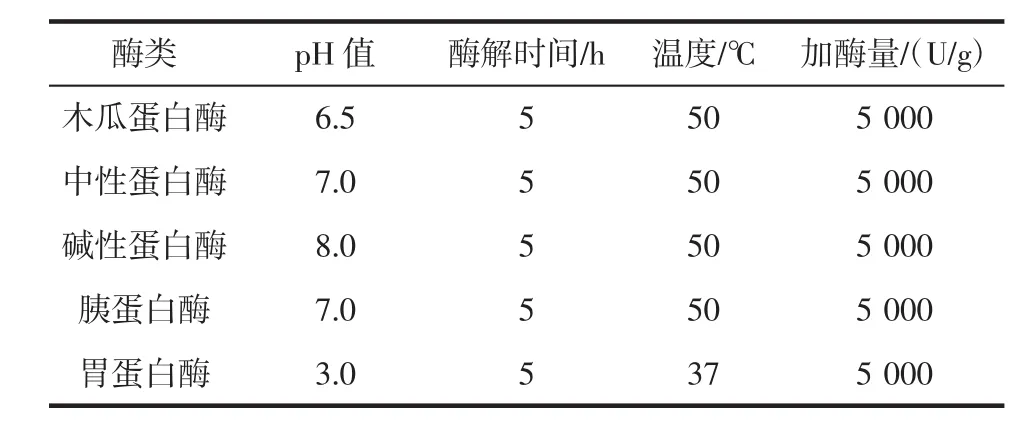
表1 各蛋白酶反应条件Table 1 Reaction conditions of different enzymes
1.3.3.2 复合酶配比选择
配制5%的雁骨粉溶液,加入磷酸盐溶液调节pH值为7,加酶量5 000 U/g(木瓜蛋白酶、中性蛋白酶、碱性蛋白酶质量比分别为 2∶1∶1、1∶2∶1、1 ∶1 ∶2),在50℃的水浴锅中酶解5 h,测定其水解度。并以3种单一酶作为对照,选择最佳复合酶配比。
1.3.3.3 单因素试验
将雁骨粉配制成5%的溶液,分别在酶解温度35、40、45、50、55、60 ℃,pH 值 4、5、6、7、8、9,加酶量 3 000、4 000、5 000、6 000、7 000、8 000 U/g,酶解时间 1、2、3、4、5、6 h的条件下进行单因素试验,以水解度为指标筛选出最佳的酶解条件。
1.3.3.4 响应面试验优化酶解工艺
以酶解温度、加酶量、pH值为影响因素,以水解度为响应值,采用Box-Behnken组合方法进行三因素三水平响应面试验设计,Design-Expert 8.1软件设计试验并对数据进行分析,设计如表2。

表2 Box-Behnken试验因素水平Table 2 Box-Behnken test factor levels
1.3.4 水解度测定
采用甲醛滴定法测定氨基态氮含量,凯氏定氮法测定总氮含量[14]。水解度(DH)按式(1)计算:

式中:DH为水解度,%;N1为上清液中氨基态氮含量,mol/L;N0为样品中总氮含量,mol/L。
1.3.5 雁骨胶原多肽抗氧化能力测定
在本研究中选取VC为对照样品,对未酶解的胶原蛋白和经木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、复合酶酶解制备的雁骨胶原多肽分别进行抗氧化能力测定,比较经复合酶酶解制备的雁骨胶原多肽抗氧化能力的强弱,并计算其IC50值。体外试验设置的底物质量浓度梯度为 1、2、3、4、5、6 mg/mL。
1.3.5.1 清除O2-·的能力测定
采用邻苯三酚自氧化法[15],邻苯三酚在碱性条件下会发生自氧化,生成有色中间产物和超氧阴离子自由基,O2-·对自氧化有催化作用。具体操作:取不同组分样品1 mL,加入0.05 mol/L的Tris-HCl缓冲液(pH 8.2)4.5 mL,蒸馏水2 mL,2.5 mmol/L邻苯三酚溶液0.5 mL,混匀后在25℃水浴中反应20 min,测定产物在299 nm处吸光度。以蒸馏水代替样品做空白组,按式(2)计算超氧阴离子自由基清除率。
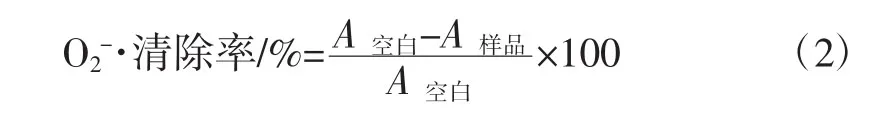
式中:A样品为样品吸光度;A空白为空白的吸光度。
1.3.5.2 清除·OH的能力测定
先取不同组分样品1 mL放入试管中,然后取0.025 mol/L、pH 7.4 的磷酸缓冲液 1 mL、40 μg/mL 番红花红1 mL、3%过氧化氢1mL(新鲜配制)、0.945 mmol/L乙二胺四乙酸铁(Ⅱ)钠盐[ethylene diamine tetraacetic acid-Fe(Ⅱ),EDTA-Fe(Ⅱ)]溶液(新鲜配制)1 mL,均匀混合后在37℃水浴中反应45 min,然后在520 nm波长处测定吸光度。空白组以1 mL蒸馏水代替样品,对照组以2 mL蒸馏水代替EDTA-Fe(Ⅱ)和样品,并按式(3)计算·OH 清除率[16]。

式中:A样品、A空白、A对照分别为样品、空白和对照组的吸光度。
1.3.6 雁骨胶原多肽分子量测定
1.3.6.1 十二烷基硫酸钠-聚丙烯酰胺凝胶电泳测定方法
对复合酶酶解制备的雁骨胶原多肽进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析。将样品于0.5 mol/L的乙酸溶液中溶解后调至中性,将中性样品与上样缓冲液以体积比为4∶1的比例混合,沸水浴5 min,冷却后12 000 r/min离心5 min,取10 μL上清液上样。采用12%的分离胶和5%的浓缩胶,用考马斯亮蓝染色液染色。
1.3.6.2 分子排阻色谱法
精密称取经复合酶最优条件下酶解制备的雁骨胶原多肽粉100 mg,置于10 mL容量瓶中,加水溶解并定容至刻度,摇匀得浓度为10 mg/mL的胶原多肽水溶液,作为供试品溶液。TSk gel Super SW2000色谱柱(300 mm×4.6 mm,4 μm),流动相:0.1 mol/L 磷酸盐缓冲溶液(phosphate buffer saline,PBS)(pH=7.0)+0.1 mol/L硫酸钠溶液;检测波长:214 nm;流速:1 mL/min;进样量:5 μL。采用分子量标准品:肌球蛋白(16 950 Da)、抑肽酶(6 512 Da)、胰岛素 B(3 496 Da)、生长激素释放抑制因子(1 521 Da)、苯丙氨酸(165 Da)。依据标准品的分子量,采用外标法计算获得经复合酶在最优条件下酶解制备的雁骨胶原多肽的分子量大小[17]。
1.3.7 氨基酸组成测定
样品处理:准确称取0.02 g雁骨胶原多肽冻干样品于水解管中,加入10 mL 6 mol/L HCl,加入3滴~4滴苯酚溶液,将水解管放入冷冻剂中,冷冻3 min~5 min,抽真空充入氮气后封口,在110℃的恒温鼓风干燥箱内水解22 h,取出冷却,将水解液过滤,用去离子水多次冲洗水解管,将水解液转移到50 mL容量瓶内并定容。取1mL水解液于5 mL容量瓶中,用真空干燥器在40℃~50℃干燥,残留物用1 mL~2 mL纯水溶解,再干燥,反复进行两次,最后蒸干,用1mL pH2.2的缓冲液溶解,供仪器测定用[18]。
测定:准确吸取0.200 mL混合氨基酸标准,用pH2.2的缓冲液稀释到5 mL,此标准稀释液浓度为5.00 nmol/μL,作为上机测定用的氨基酸标准,用氨基酸自动分析仪以外标法测定样品的氨基酸种类和含量。
1.4 数据统计分析
试验数据用Origin 9.0软件进行数据处理以及作图,响应面优化采用Design Expert 8.1,数据为3次试验的平均值。显著性分析采用SPSS16.0,p<0.05表示差异显著。
2 结果与分析
2.1 蛋白酶的筛选
不同蛋白酶的水解效果比较见图1。
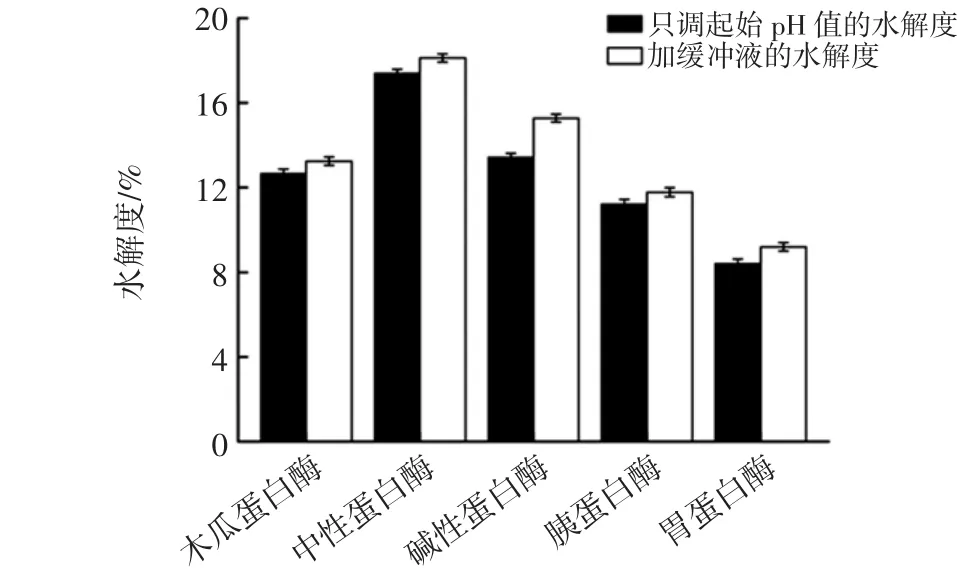
图1 不同蛋白酶的水解效果比较Fig.1 Comparison of hydrolysis effects of different proteases
由图1看出,加缓冲液调节pH值的水解度略高于只调节起始pH值的水解度,其中木瓜蛋白酶、中性蛋白酶、碱性蛋白酶在缓冲液调节pH值的条件下测得的水解度明显要高于胰蛋白酶和胃蛋白酶的水解度(p<0.05),所以本试验选择木瓜蛋白酶、中性蛋白酶和碱性蛋白酶组成复合酶进行第一步酶解。
2.2 复合酶配比的选择
复合酶配比对水解度的影响见图2。
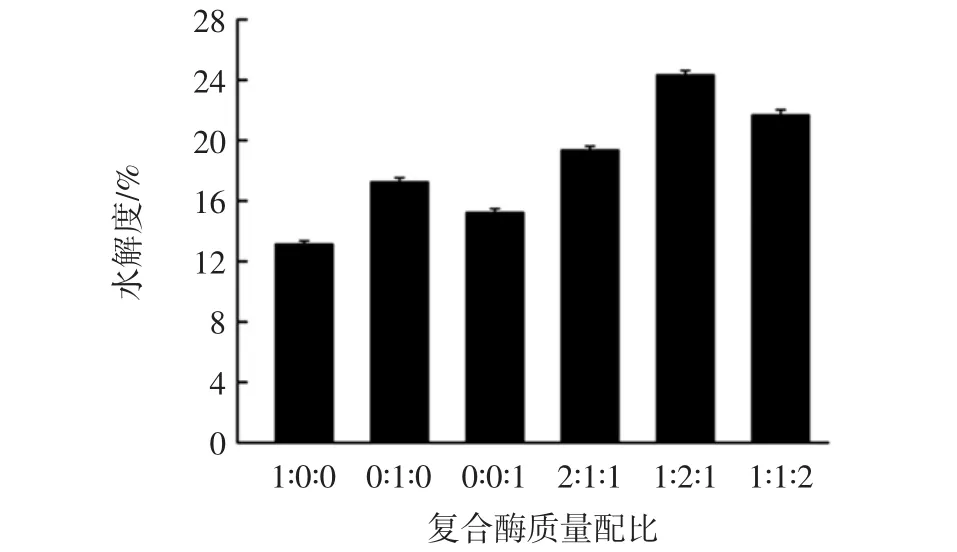
图2 复合酶配比对水解度的影响Fig.2 Effect of enzyme ratio on hydrolysis degree
由图2可知,采用复合酶酶解雁骨的水解度要优于单一酶(p<0.05),而且不同配比的复合酶酶解雁骨的水解度大小顺序为 1∶2∶1>1∶1∶2>2∶1∶1,当 3种酶的质量比为1∶2∶1时,水解度最大为24.34%,故木瓜蛋白酶、中性蛋白酶和碱性蛋白酶复合的比例选用1 ∶2 ∶1。
2.3 单因素试验
不同酶解条件对水解度的影响见图3。
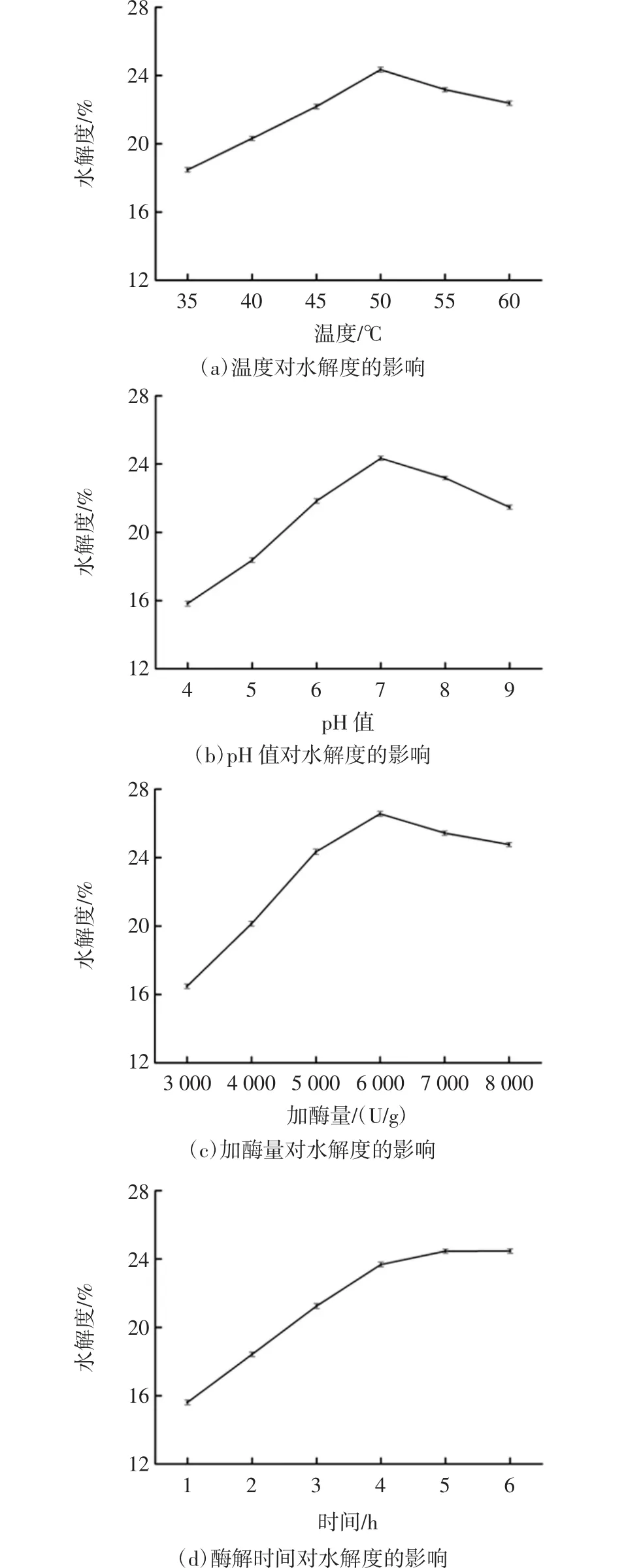
图3 不同酶解条件对水解度的影响Fig.3 Effect of different enzymatic hydrolysis conditions on hydrolysis degree
由图3(a)可知,当温度小于50℃时,随着温度的升高,水解度逐渐上升;在50℃时,水解度达到最大值。当温度大于50℃时,水解度下降,可能是温度过高导致蛋白酶变性,从而使酶解反应速率降低[19]。所以,酶解温度选定为50℃。
由图3(b)可知,当pH<7时,水解度随着pH值升高而升高;当pH>7时,水解度随着pH值的升高而下降;当pH值为7时,水解度达到最大值。当pH>7时,酶的活性受到影响,水解度降低,因此雁骨的酶解pH值为7。
由图3(c)可知,水解度随着加酶量的增加,呈先增加后减少的趋势。原因是随着加酶量的增加,酶与底物结合的几率增大,反应速率升高,水解度相应增大;但随着加酶量的增多,底物蛋白相对不足,导致反应进程减弱,水解度逐渐减小。因此,加酶量选定为6 000 U/g。
由图3(d)可知,水解度随着雁骨粉酶解时间的延长而逐渐增高,然后趋于平衡,当酶解时间到5 h时,水解度到达最大值,因此酶解时间选择5 h。
2.4 响应面试验结果
2.4.1 响应面试验设计及结果
以水解度为响应值,综合单因素试验结果选取酶解温度、pH值和加酶量3个因素进行Box-Behnken响应面试验设计,试验设计及结果如表3所示。方差分析见表4。
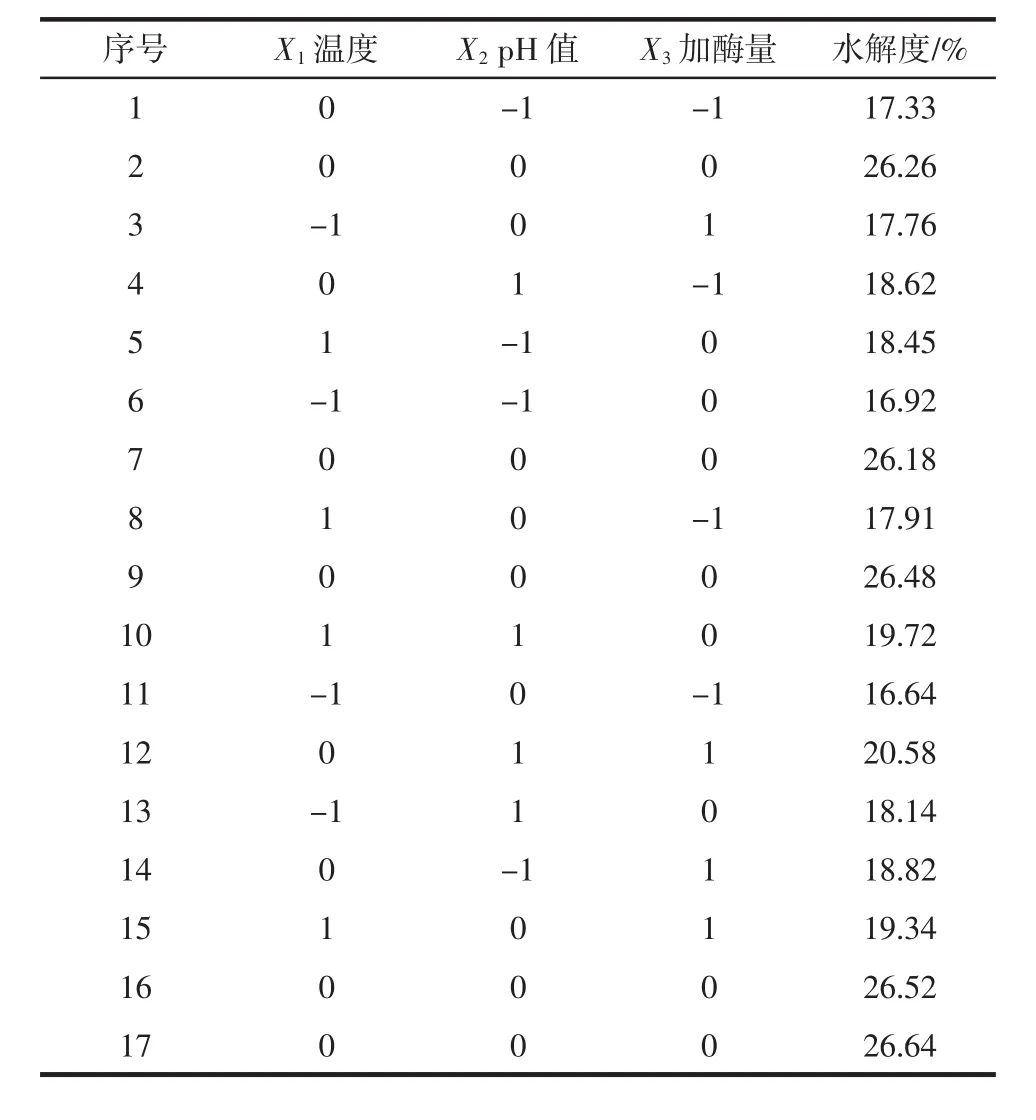
表3 响应面试验设计及结果Table 3 Experimental design and results for response surface analysis
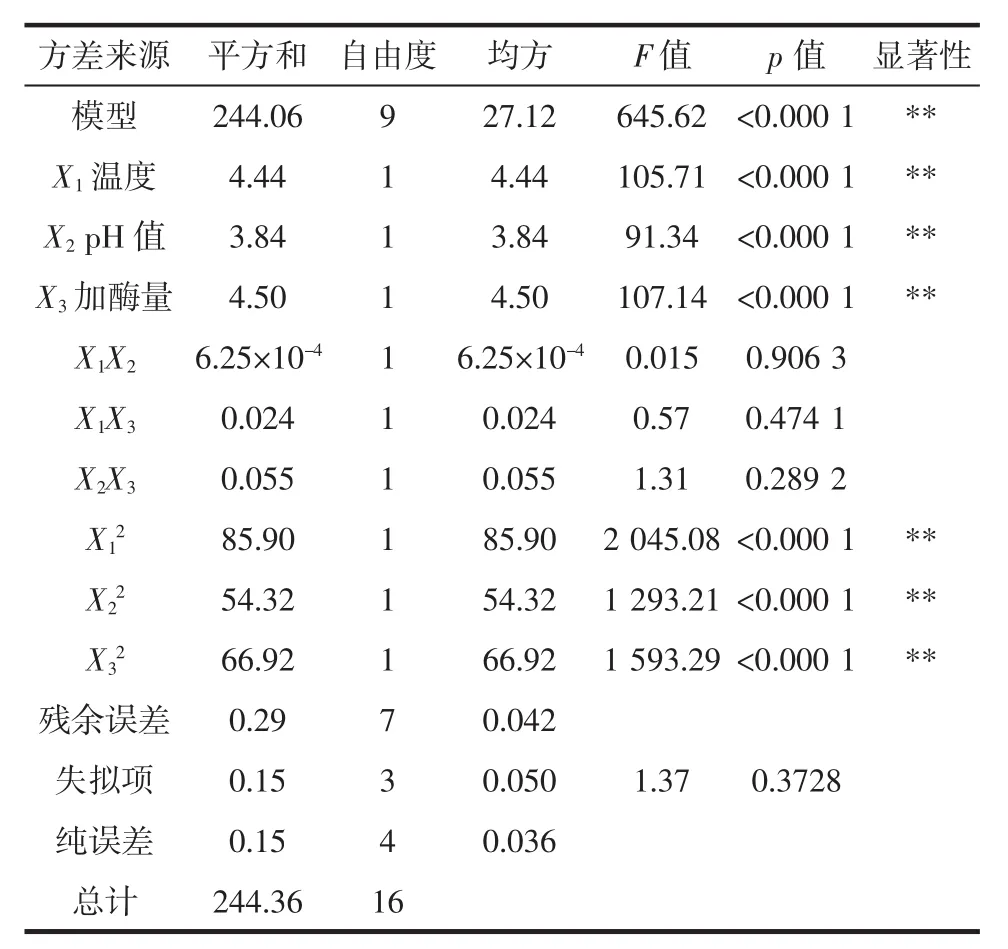
表4 响应面试验方差分析Table 4 Analysis of variance(ANOVA)of response surface regression model
用Design-Expert 8.1软件对结果中的试验数据进行拟合回归,以酶解温度(X1)、pH 值(X2)、加酶量(X3)为自变量,水解度为因变量(响应值Y),建立二次多元回归方程模型:
Y=26.42+0.74X1+0.69X2+0.75X3+0.013X1X2+0.077X1X3+0.12X2X3-4.52X12-3.59X22-3.99X32
从表4可知水解度结果的方差分析:使用二次模型拟合各因素与水解度的关系,模型的p<0.000 1,说明这个试验模型极显著。失拟项p=0.372 8>0.05,表明结果不显著,但是该方程对试验的拟合程度好,该试验方案可行。因素X1、X2与X3三者的线性效应以及平方效应对水解度的影响呈极显著水平(p<0.000 1),水解度受因素X1X2、X1X3、X2X3的交互作用后的结果不明显。根据一次回归方程系数的绝对值比较可得,各因素对水解度影响大小的主次为:加酶量>酶解温度>pH值。各因素交互作用对水解度的影响见图4。
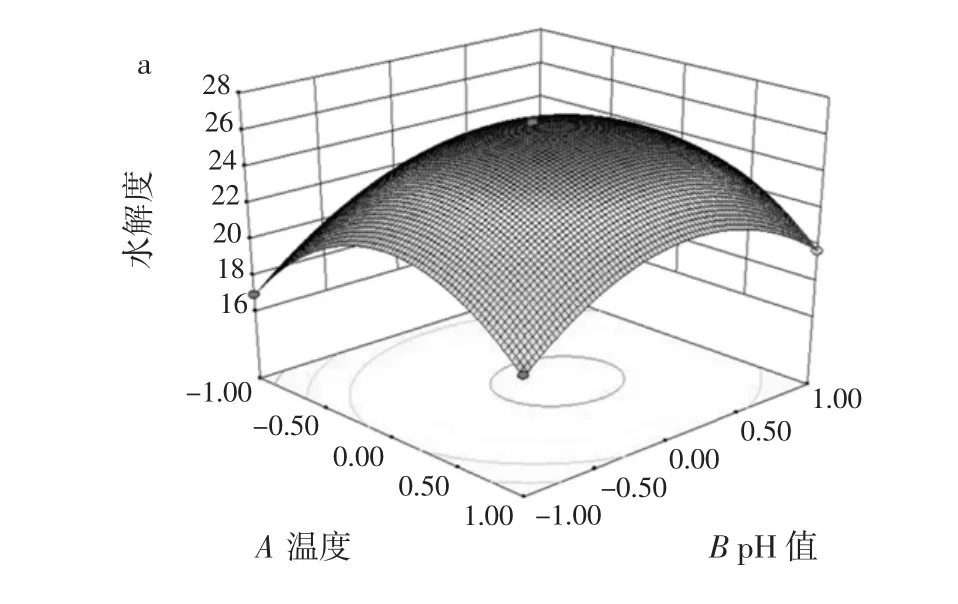

图4 各因素交互作用对水解度的影响Fig.4 Influence of each factor interaction on the hydrolysis degree
由图4a可知,随着酶解温度和pH值的逐渐增加,雁骨水解度先急速升高再缓慢下降,等高线的形状趋近于椭圆形,水解度受酶解温度和pH值的交互效应后变化显著。由图4b可知,随着酶解温度和加酶量的逐渐升高,水解度先急速上升再匀速下降,等高线的形状为椭圆形,说明水解度受加酶量和酶解温度交互效应后的变化极显著。由图4c可知,随着pH值和加酶量的逐渐延长,水解度匀速上升然后匀速下降,说明水解度受pH值和加酶量的交互效应后的变化极显著。
2.4.2 工艺优化验证试验结果
通过单因素试验确定酶解时间为5 h,通过Design-Expert 8.1软件进行试验设计分析,预测最优酶解工艺:酶解温度为50.4℃,最佳pH值为7.1,最佳加酶量为6 100 U/g,水解度为26.52%。根据预测试验方案的可操作性,将工艺参数改为:酶解温度50℃,pH值7.1,加酶量6 100 U/g,对该工艺参数进行验证,3次试验测定计算平均值,水解度为26.34%,与预测值接近,说明该响应面模型具有有效性。
2.5 抗氧化能力测定
2.5.1 超氧阴离子自由基清除能力
超氧阴离子自由基清除能力见图5。
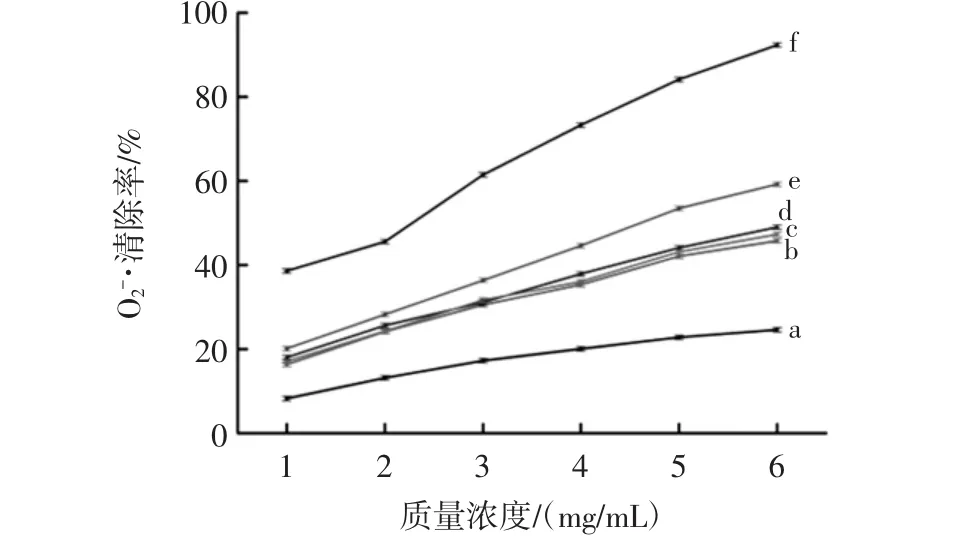
图5 雁骨胶原多肽对O2-·的清除能力Fig.5 The ability of Anser cygnoides bone collagen peptide to clear O2-·
超氧阴离子自由基是生物有机体代谢过程中能产生强氧化能力的自由基,对其清除效果可用来表征样品的抗氧化能力[20]。由图5可知,经酶解制备的雁骨胶原多肽对O2-·清除率要比未酶解的胶原蛋白高,且复合酶酶解制备的胶原多肽对O2-·清除率比单一酶要高,随抗氧化剂质量浓度的增加,雁骨胶原多肽与VC对O2-·清除率也随之增大,但是都比VC对O2-·清除率低,其中雁骨胶原多肽质量浓度为6mg/mL时,胶原多肽对O2-·清除率最大为59.21%,其IC50值为2.16mg/mL。
2.5.2 羟基自由基清除能力
羟基自由基清除能力见图6。

图6 雁骨胶原多肽对·OH的清除能力Fig.6 The ability of Anser cygnoides bone collagen peptide to clear·OH
由图6可以看出,雁骨胶原多肽对羟基自由基有明显的清除作用,经复合酶酶解制备的雁骨胶原多肽对羟基自由基的清除能力比单一酶更好,但其清除效果都低于VC。当雁骨胶原多肽的质量浓度为6 mg/mL时,胶原多肽对·OH清除率最大为51.82%,其IC50值为1.79 mg/mL。
2.6 分子量测定结果
2.6.1 SDS-PAGE结果
雁骨胶原多肽的SDS-PAGE图谱见图7。
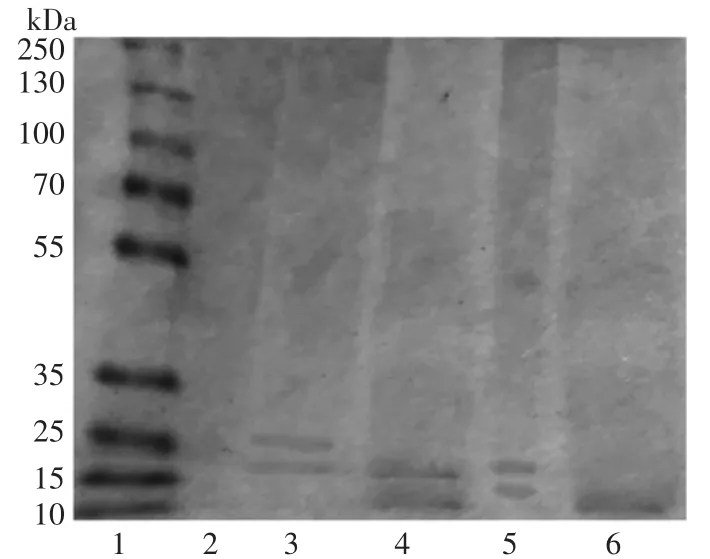
图7 雁骨胶原多肽的SDS-PAGE图谱Fig.7 SDS-PAGE map of collagen peptide from Anser cygnoides bone
如图7所示,未经酶解的雁骨胶原蛋白分子量比较大且分布较广,主要分布在75 kDa~210 kDa之间;木瓜蛋白酶酶解制备的雁骨胶原多肽在18、25 kDa处有清晰条带;中性蛋白酶酶解制备的雁骨胶原多肽在10、17 kDa处有清晰条带;碱性蛋白酶酶解制备的雁骨胶原多肽在12、18 kDa处有清晰条带;复合酶酶解制备的雁骨胶原多肽在10 kDa处有清晰条带。相比较之下,经复合酶酶解制备的雁骨胶原多肽分子量更小,酶解效果更好。
2.6.2 分子排阻色谱结果
根据5种分子量大小不同的标准品物质的色谱结果,以其保留时间为横坐标(T),相对分子量的对数为纵坐标(lgMW)。计算得到线性方程lgMW=-0.232 2T+6.488,R2=0.997 3。
经复合酶在最优酶解条件下酶解制备的雁骨胶原多肽的分子排阻色谱图见图8,由检测结果可知,雁骨胶原多肽的保留时间在10.521 min~15.315 min,通过线性方程计算得到其相应的分子量大小为851 Da~11 092 Da。
2.7 雁骨胶原多肽的氨基酸组成分析
对不同蛋白酶酶解制备的雁骨胶原多肽进行氨基酸组成成分分析,测定结果如表5所示。
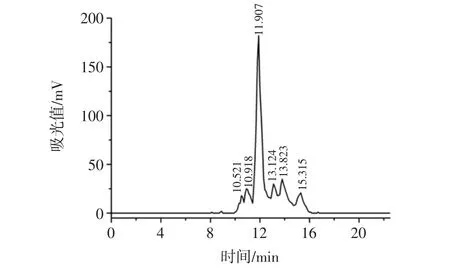
图8 雁骨胶原多肽分子排阻色谱图Fig.8 Size exclusion chromatography of collagen peptide from Anser cygnoides bone

表5 不同蛋白酶酶解制备的雁骨胶原多肽氨基酸含量Table 5 Amino acid content of Anser cygnoides bone collagen polypeptide prepared by different protease digestion
半胱氨酸、酪氨酸、异亮氨酸、组氨酸、蛋氨酸的含量很少,但谷氨酸、甘氨酸、丙氨酸、脯氨酸、羟脯氨酸的含量较高,雁骨胶原多肽的氨基酸组成与马面鱼骨[21]胶原多肽的氨基酸组成相似。张英等[22]研究了19种氨基酸对超氧阴离子和羟基自由基的抑制作用,结果发现 Tyr、Asp、Lys、Glu、Met、Gly 和 Asn 等氨基酸对自由基的清除能力较强,而本试验中发现这类氨基酸的含量达42.64%以上,从而使雁骨胶原多肽具有较强抗氧化活性。
3 结论
通过单因素试验和响应面建模优化复合酶酶解制备雁骨胶原多肽工艺,得到最优制备条件为:酶解时间5 h、酶解温度50℃、pH值7.1、加酶量6 100 U/g,此条件下水解度为26.34%。通过对O2-·和·OH的清除能力的测定,当雁骨胶原多肽的质量浓度为6 mg/mL时,O2-·的清除率和·OH的清除率最大分别为59.21%、51.82%,其 IC50值分别为 2.16、1.79 mg/mL,显示出雁骨胶原多肽具有很好的抗氧化活性。通过SDS-PAGE试验及分子排阻色谱法测定,得到经复合酶酶解制备的雁骨胶原多肽分子量大小在851 Da~11 092 Da。氨基酸分析表明,雁骨胶原多肽富含甘氨酸(Gly)、丙氨酸(Ala)、脯氨酸(Pro)和羟脯氨酸(Hyp),与胶原蛋白氨基酸组成特点相一致,且这些特定的氨基酸与胶原多肽的抗氧化活性相关。该研究为鸿雁骨胶原多肽的酶解制备工艺提供理论依据,也为鸿雁骨骼资源的利用提供新思路。
