植物乳杆菌CGMCC8198冻干菌粉的制备工艺优化
2020-11-24刘敏敏席茂盛李中媛宋亚囝张同存罗学刚
刘敏敏,席茂盛,李中媛,宋亚囝,张同存,罗学刚,*
(1.天津科技大学生物工程学院工业发酵微生物教育部重点实验室暨天津市工业微生物重点实验室,天津300457;2.天津市微生物代谢与发酵过程控制技术工程中心,天津300457)
近年来,植物乳杆菌作为一种益生菌频繁出现在大众视野,已被用于多种发酵食品的手工和工业生产中,其产品也逐渐受到广大消费者的青睐。同时,植物乳杆菌已被允许开发不同的益生菌配方,其抗菌特性对食品安全也有显著效果[1-2]。植物乳杆菌既可以天然存在形式参与传统发酵过程,也可以纯种发酵剂形式添加到现代发酵工艺中[3],其制品在生产、运输及使用过程中不可避免地会受到各种环境所带来的影响,例如传统食品发酵就要在相对寒冷的条件下进行[4]。而在这些发酵食品生产过程中处在低温环境中的乳酸菌起着至关重要的作用,不仅如此,定植肠道活菌数要求高于106CFU/mL才能发挥其益生效果[5]。因此研究植物乳杆菌的冻干保护及抗冷冻对其实际应用有着重要意义。
真空冷冻干燥是在真空条件下进行的,使冻结物料中的固态水升华从而被除去的一种高效干燥方法,常用于乳品发酵剂的工业化制备,通过真空冷冻干燥既能保持产品的优良特性,又能达到快速干燥的效果[6]。然而,低温会影响乳酸菌有关营养运输的膜流动性发生变化,使细胞代谢的酶活性降低及翻译过程的RNA结构稳定性发生变化,所有这些都将进一步影响细菌的存活率[7]。因此选用合理的冻干保护剂就成为解决问题的关键手段[8-9]。通常来讲,冻干保护剂可分为两种:一种是分子量较小的化合物如氨基酸、低分子的糖类和糖醇类等;另一种是分子量较大的物质如蛋白质、多糖、以及其他的合成聚合物等[10-12]。通过将不同分子量的化合物进行组合复配往往可以实现更好的保护效果[13]。
植物乳杆菌CGMCC8198是本课题组前期筛选获得的一株对人体健康有促进作用的乳酸菌,已被证明具有很好的降血糖、降血脂、美白等功效[14-15]。本试验以植物乳杆菌CGMCC8198作为研究对象,通过单因素试验探究保护剂对菌体存活率的影响,然后选择不同的水平组合采用正交试验方法对复合冻干保护剂进行分析得出最优配方,通过细胞流式术对发酵剂的活性进行评价[16-19],并进一步对冻干菌粉的活性进行探究,旨在为植物乳杆菌的冷冻干燥提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌株
植物乳杆菌(Lactobacillus plantarum)CGMCC8198:天津科技大学微生态与分子药理研究室-80℃保藏。
1.1.2 试剂
浓缩乳清蛋白粉(食品级)、木糖醇、壳寡糖、氯化钠、磷酸二氢钠、戊二醛、无水乙醇(均为分析纯):天津市江天化工有限公司;MRS肉汤培养基:海博生物技术有限公司;碘化丙啶(propidium Iiodide,PI)、5(6)-羧基荧光素琥珀酰亚胺酯[(6)-carboxyfluorescein diacetate N-succinimidyl ester,CFSE]、胰蛋白酶 (250 U/mg)、胃蛋白酶(3 000 U/mg)均为生物试剂:天津索罗门生物科技有限公司。
1.2 仪器与设备
YQX-III厌氧培养箱:上海龙跃仪器设备有限公司;Alpha 2-4 LD plus快速冷冻干燥机:德国chirst公司;FEI-Apreo场发射高分辨扫描电子显微镜:美国捷克公司;CR21G高速冷冻离心机:日本HITACHI公司;C6多功能细胞分析仪:美国Accuri公司;ZWYRD2401恒温培养振荡器:上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 菌悬液及其他溶液的制备
将植物乳杆菌CGMCC8198以2%的接种量接种于加有液体培养基的三角瓶中,置于37℃厌氧培养箱中过夜;取菌液收集到离心管中,4℃条件下6 000 r/min离心10 min,弃掉上清液;用0.9%生理盐水补充至离心前体积,重复离心3次收获菌泥,将菌泥悬浮于生理盐水中,最终体积为原发酵液体积的1/10,制成菌悬液。
模拟人工胃液[20]:用50%的盐酸将无菌水调至不同pH 值,分别为 2.0、2.5、3.0,经 115 ℃高压灭菌 20 min,冷却后加入10 g/L胃蛋白酶,经0.22 μm滤膜过滤除菌,制得 pH 2.0、pH 2.5、pH 3.0 的人工胃液。
模拟人工肠液[20]:称取磷酸二氢钾6.8 g溶于无菌水,调节pH值为7.4,115℃高压灭菌20 min,冷却后加入10 g/L胰蛋白酶,经0.22 μm微孔滤膜除菌备用。
1.3.2 真空冷冻干燥
将菌悬液与配制的保护剂按体积比1∶3的比例混合均匀后分装于冻干瓶中,装样高度为0.3 cm~0.4 cm,在-80℃冰箱预冻24 h以上。待快速冷冻干燥机开机预冷1 h后迅速将预冻好的样品放置物料盘内,期间应确保样品不回融。在冷冻干燥机盖好后,开始抽真空,进入真空冷冻干燥。约24 h之后,冷冻干燥过程结束;将冻干样品取出后放于干燥处保藏备用。
1.3.3 活菌数及冻干存活率的测定
将冻干菌粉用0.1 mol/L磷酸盐缓冲液(phosphate buffer saline,PBS)复水至冻干前体积,以10的倍数依次递增稀释,取 3 个合适的稀释度(10-8、10-9、10-10),吸取50 μL的菌液于MRS固体培养基涂布均匀,每个稀释度作3个平行,37℃厌氧培养36 h,计数。
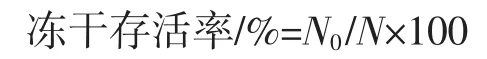
式中:N0为冻干菌粉复水至原菌液体积后的活菌数,CFU/mL;N为冻干前原菌液单位体积活菌数,CFU/mL。
1.3.4 单因素试验
在浓缩乳清蛋白粉和壳寡糖质量分数分别为10%和4%的条件下,选定木糖醇添加量依次为0.5%、1%、1.5%、2%、2.5%5个水平,以冻干后的存活率为检测指标,得到木糖醇在复合保护剂中最佳的添加量;在木糖醇和壳寡糖质量分数分别为1%和4%的条件下,选定浓缩乳清蛋白粉添加量依次为5%、10%、15%、20%、25%5个水平,以冻干后的存活率为检测指标,得到浓缩乳清蛋白粉在复合保护剂中最佳的添加量;在木糖醇和浓缩乳清蛋白粉质量分数分别为1%和10%的条件下,选定壳寡糖添加量依次为2%、4%、6%、8%、10%5个水平,以冻干后的存活率为检测指标,得到壳寡糖在复合保护剂中最佳的添加量。
1.3.5 正交试验
在单因素试验结果的基础上,通过正交试验进行三因素试验,各因素分别设计3个水平,研究木糖醇(A)、浓缩乳清蛋白粉(B)和壳寡糖(C)质量分数对冻干存活率的影响。各因素试验水平如表1所示。

表1 冻干保护剂正交试验因素水平表Table 1 Factor level of orthogonal test for freeze-dried protective agent
1.3.6 场发射高分辨扫描电镜分析
将添加不同保护剂的冻干菌粉分别用导电胶固定于样品台,喷金后置入场发射扫描电镜内,进行电镜观察并拍照。
1.3.7 流式细胞术分析菌粉活力
将冻干菌粉用0.1 mol/L的PBS复水,4℃条件下12 000 r/min离心2 min,收集菌体;洗涤2次后重悬于PBS中,将菌悬液浓度控制在1×106CFU/mL:分别取1 mL菌悬浮液置于100℃水浴30 min,热处理杀死所有菌体,与1 mL新鲜菌体悬浮液混合;取100 μL加到896 μL 的 PBS 中,然后分别加入 2 μL PI和 2 μL CFSE于37℃避光孵育15 min;用于评价两种染液区分死活细菌的效果。优化后的冻干菌粉用同样的方法处理。
1.3.8 冻干菌粉的耐受性测试
取0.01 g冻干菌粉加入装有10 mL人工胃液的试管中,于37℃摇床振荡处理2 h;取样计数。另取0.1 mL菌液作对照。
取0.01 g冻干菌粉加入装有10 mL人工肠液的试管中,于37℃摇床振荡处理,每隔20 min取样计数,持续2 h。
1.3.9 数据统计分析
采用originpro9.1作图,试验数据使用SPSS19.0软件进行分析。每组试验重复3次,结果表示为平均数。
2 结果与分析
2.1 工艺优化结果
2.1.1 单因素试验
探究在冻干保护剂中添加不同质量分数的木糖醇、浓缩乳清蛋白粉及壳寡糖对植物乳杆菌CGMCC8198冻干存活率的影响,结果如图1所示。
由图1a可知,冻干保护剂中木糖醇质量分数为1%时,冻干存活率达到最大值。之后随质量分数升高冻干存活率降低,可能是由黏度升高造成菌体分布不均匀导致。而在质量分数为0.5%时发生一定程度下降,其原因应该是由于质量分数太低无法对菌体起到充分保护效果所引起的。根据试验结果,选取木糖醇质量分数为1%进行后续试验。由图1b可知,冻干保护剂中浓缩乳清蛋白粉质量分数在5%~15%范围内冻干存活率持续升高,在此之后略有下降,但程度并不明显基本保持在一定范围内。根据试验结果并考虑经济因素,选取浓缩乳清蛋白粉质量分数为15%进行后续试验。由图1c可知,冻干保护剂中壳寡糖质量分数在2%~8%范围内,冻干存活率随着质量分数增加而升高,且在8%时达到最大值。在10%时,冻干存活率发生一定程度的下降。最后根据试验结果选取壳寡糖质量分数为8%进行后续试验。


图1 单因素试验结果Fig.1 The results of single factor test
2.1.2 正交试验
在单因素试验结果的基础上,以菌体冻干存活率为响应值,对复合冻干保护剂的配方进行优化。正交试验结果及极差分析见表2。

表2 冻干存活率正交试验结果及极差分析Table 2 Orthogonal test results and range analysis of freeze-dried survival rate
从极差分析结果得出,三因素影响顺序为B>C>A,即冻干保护剂中浓缩乳清蛋白粉的质量分数对冻干存活率的影响最大,其次分别为壳寡糖和木糖醇。最佳的物料配比组合为A3B2C1,即木糖醇1.5%、浓缩乳清蛋白粉15%、壳寡糖6%
冻干存活率方差分析见表3。

表3 冻干存活率方差分析Table 3 Variance analysis of freeze-dried survival rate
从方差分析结果得出,试验所选修正模型P值0.043<0.05,说明模型对实际情况具有代表性。3个变量木糖醇质量分数、浓缩乳清蛋白粉质量分数和壳寡糖质量分数均对冻干存活率产生显著性影响,且浓缩乳清蛋白粉质量分数产生影响最大。三因素对冻干存活率的影响顺序为浓缩乳清蛋白粉(B)>壳寡糖(C)>木糖醇(A),这与正交试验极差分析结果一致。
2.1.3 验证试验
在最佳工艺条件下,即冻干保护剂中木糖醇、浓缩乳清蛋白粉及壳寡糖质量分数分别为1.5%、15%及6%,菌体的冻干存活率达到84.90%,高于正交试验中各试验组。由此可得菌体在最优冻干保护剂的保护下经过真空冷冻干燥后仍能保持较高的存活率。
2.2 电镜扫描结果
将按最优比添加单一保护剂和复合保护剂的冻干菌粉在场发射高分辨扫描电镜下放大5 000倍,观察菌粉的结构见图2。
由图2d可以看出添加复合保护剂组冻干菌粉表面相对光滑,个体完整且无致密小孔,相对未添加保护剂组结构较为稳定且均匀,对菌体能形成完整的保护,使细胞免受低温的破坏;而添加单一保护剂的冻干菌粉大多呈疏松结构,表面粗糙且多褶皱、多孔洞、多塌陷、无规则,部分结构较松散,没有形成完整的屏障。结果表明添加复合保护剂的冻干菌粉结构更平整,对菌体包裹效果更完全,在冻干过程中可能会起到更好的保护作用。
2.3 细胞流式术评价菌粉活性

图2 添加不同保护剂的冻干菌粉扫描电镜图Fig.2 Scanning electron microscope of freeze-dried bacterial powder with different protective agents
为了证明PI-CFSE双染色能够区分不同生理状态下的植物乳杆菌CGMCC8198菌体,首先对50%的活菌和50%死菌混合样品进行流式细胞分析,得到的荧光信号图见图3。

图3 PI-CFSE双染色荧光信号图Fig.3 The graph of PI-CFSE double staining fluorescence signal
根据染色特征菌体被分在4个不同的区域,位于荧光信号图左上区域反映的是被PI标记的死菌数约占45.33%,而右下区域反映的是CFSE标记的活菌数约占40.26%;未被染色的菌体只占到总数的0.51%。结果表明,PI-CFSE双染色可以很好的区分不同生理状态下的植物乳杆菌CGMCC8198菌体。
对添加复合保护剂的冻干菌粉进行分析见图4。
图4a和图4b分别为植物乳杆菌CGMCC8198冻干前后菌体PI-CFSE双染色荧光信号图。比较可以得出,冻干后的菌体活性发生一定程度下降,表现在冻干后右下象限细胞的相对比例减少,而在左上和右上象限细胞明显增加,冻干前后菌体活性表见表4。

图4 冻干前后菌体活性图Fig.4 Bacterial activity diagram before and after freeze-drying

表4 冻干前后菌体活性表Table 4 Cell activity before and after lyophilization
由表4可知,相较不加保护剂的全无活性还是表现出较大差异,约80.47%的活性得到保持,表明该复合保护剂会起到一定程度的保护效果。
2.4 冻干菌粉在模拟人工胃液和模拟人工肠液中的耐受性
冻干菌粉在不同pH值模拟胃液中的存活率如表5所示。

表5 冻干菌粉耐酸存活率对比Table 5 Comparison of acid-resistant survival rate of freezedried fungus powder
由表5可以看出,在不同pH值情况下,保护剂组的存活率都明显高于对照组,说明该复合保护剂在酸性条件下也会对菌体起到保护作用,但仍有较大的提升空间。
冻干菌粉在模拟肠液的活菌数变化如图5所示。

图5 冻干菌粉在模拟肠液中的活菌数变化Fig.5 Changes of viable bacterial count of freeze-dried bacterial powder in simulated intestinal juice
图5可以看出,冻干菌粉在模拟肠液处理80 min后活菌数基本保持稳定,可达到3.40×108CFU/mL,表明该菌粉具有较好的肠溶性。
3 结论
本研究通过单因素、正交试验确定了植物乳杆菌CGMCC8198冻干制剂中复合保护剂的优化配方为浓缩乳清蛋白15%、壳寡糖6%及木糖醇1.5%。在此条件下,场发射高分辨电镜及扫描流式细胞术分析显示该复合保护剂具有很好的保护效果。耐受性试验进一步证实优化后的冻干菌粉具有较好的耐酸性及肠溶性。综上所述,本研究结果为该菌株在功能性食品方面的应用提供了理论基础。
