水域生境好氧不产氧光合细菌(AAPB)研究进展*
2020-10-29张海涵刘凯文黄廷林杨尚业苗雨甜张梦瑶
张海涵,王 燕,刘凯文,黄廷林,李 楠,杨尚业,司 凡,苗雨甜,黄 鑫,张梦瑶
(西安建筑科技大学,陕西省环境工程重点实验室,西北水资源与环境生态教育部重点实验室,西安 710055)
光合细菌(photosynthesis bacteria,PB),地球上出现最早、自然界中普遍存在、具有原始光能合成体系的原核微生物[1],根据PB所含光合色素、电子供体的不同及光合作用过程中是否产氧而分为产氧光合细菌(蓝细菌、原绿菌)和不产氧光合细菌(紫色细菌和绿色细菌)[2-3]. 多年来,不产氧光合细菌在物种与模式、特性与功能及系统发育分析等方面成为研究热点[4-5],它通过光合作用来减少二氧化碳,与水环境中溶解铁、硫等元素的氧化过程相关[6],并应用于水体中含氮污染物的去除、水质的净化及水体的改善等方面[7]. 目前,不产氧光合细菌还参与光合型微生物燃料电池的开发,且与其他生物电化学系统相比,该生物燃料电池具有较高的输出功率[2].
好氧不产氧光合细菌(aerobic anoxygenic photosynthesis bacteria,AAPB)为一类具有不产氧功能的光合细菌[8-9],它能够在好氧条件下,以还原性有机化合物作为电子供体,通过其体内含有的细菌叶绿素a(BChl.a)来获得光能进行光合作用,同时以环境中的有机质为营养物质来获取细胞生长及代谢所需的能量,且这一过程不释放氧气[10-17]. AAPB借助光合作用产生的ATP可补充其生长所需的能量,不仅减少了其对有机碳的消耗,同时增加了进入细胞的溶解有机碳(dissolved organic carbon,DOC)的量,这使得AAPB在生物地球化学循环中作用重大[18-20],被认为是全球海洋物质循环的重要贡献者[21],其发现为探究功能菌群在海洋碳循环中的作用及贡献提供了新方向.
针对水域生境,为了探明不同水环境中AAPB多样性分布及其环境调控因素,本文对AAPB的栖息环境与生长特性、菌群丰度与分布、功能与意义以及影响因素等方面进行了综述. 主要介绍AAPB的发现及其分子生物学鉴定方法,分析不同水体中AAPB丰度、多样性及影响其群落结构组成的主要环境因子,评价AAPB在水域生境中的重要地位与意义.
1 AAPB细胞色素及研究方法
1.1 AAPB的发现及细胞色素
1979年,含有细菌叶绿素的专性好氧菌Erythrobacterlongus首次被发现于日本Tokyo海湾[22],1998年,AAPB菌株JF-1(Citromicrobiumbathyomarinum)成功分离于太平洋黑暗热液区[23]. 随后不同栖息环境中的AAPB陆续被报道,且种群结构及组成随栖息环境的不同而发生显著改变. BChl.a组成了AAPB光反应中心复合体的一部分,为AAPB的光捕获色素[16],AAPB通过体内的BChl.a来获得光能为自身的生长代谢提供部分能量,BChl.a浓度影响着AAPB的能量传递,从而影响其在海洋生态系统碳循环中的作用大小,因此对BChl.a的研究可能对AAPB生理学的研究提供一定的科学线索.
Jiao等[24]对太平洋、印度洋及中国海中BChl.a和Chl.a进行研究发现,垂向分布上,陆架100 m以上、大洋150 m以上水层均检测到BChl.a的存在,且陆架水体中BChl.a浓度高于大洋水体中BChl.a浓度,BChl.a浓度及占比随水深变化不显著,表明BChl.a耐光变能力较强. 水平分布上,BChl.a浓度近岸高于外海,BChl.a/Chl.a近岸低于外海,Lami等[25]对南太平洋海水中BChl.a和Chl.a浓度进行研究发现,BChl.a存在于海洋的透光层,且BChl.a/Chl.a随水深增加而减小. Fauteux等[26]的研究发现尽管AAPB丰度在冬季有明显降低,但仍可以在湖泊冰面下检测到,这与Cottrell等[27]的研究结果一致. 综上,海洋中BChl.a在水体中的垂向分布差异显著,且在海洋碳循环中基于BChl.a进行的不产氧光合作用对基于进行Chl.a进行的光合作用具有重要的补充作用.
Mašín等[10]对贫营养、中营养及富营养化湖泊中BChl.a浓度的垂向分布规律进行研究发现,贫营养化湖泊中BChl.a浓度最高值出现于表层水体,并随水深增加而逐渐减小;富营养化湖泊中BChl.a浓度最高值出现于底部,而表层没有检测到BChl.a的存在,结果表明AAPB丰度与BChl.a浓度呈正相关,营养化程度较高的湖泊中AAPB丰度较大,这可能是由于营养化程度较高的湖泊中颗粒附着物较多,导致AAPB丰度增加. Cottrell等[28]对颗粒富集型河口AAPB细胞内BChl.a进行研究发现,与河口上游相比,河口下游由于颗粒物较富集,AAPB丰度较高,并且其细胞内BChl.a含量相应较大,这为Mašín等[10]的研究结果提供一定的科学解释. 研究结果表明营养化程度不同的水体中BChl.a浓度分布差异显著,从而影响着AAPB的丰度与分布.
除细菌叶绿素外,AAPB体内还含有丰富的类胡萝卜素,其外观多以橙色为主,但这些类胡萝卜素并不影响AAPB的能量传递,它们仅分布于细胞膜、细胞质上等[16].
1.2 AAPB分子生物学鉴定方法
目前,关于水环境中AAPB的检测方法主要包括实时荧光定量PCR法(qPCR)[29]、红外快速脉冲速率(IRFRR)诱导荧光瞬态动力学法[20]、红外荧光显微镜法(IREM)[30]、高效液相色谱法(HPLC)[31]和基于时间序列观察的蓝藻校准红外荧光显微镜法(TIREM)[32]. 其中,qPCR方法是基于对功能基因pufM(编码光化学反应中心的小亚基)进行系统发育分析来研究AAPB物种组成,但该方法的局限性在于AAPB菌群中某些种类未完全被认知,其在引物设计方面存在不足之处,不能够直接估算出AAPB丰度,pufM功能基因扩增相关引物见表1. IRFRR、IREM、HPLC和TIREM这4种方法均是基于BChl.a的红外荧光作为诊断信号来对AAPB进行检测. 但由于AAPB细胞内BChl.a浓度低,且易受叶绿素的红外干扰,因此IRFRR和IREM方法都不能准确定量AAPB;而HPLC方法虽然能够对色素进行定性定量研究,但无法研究AAPB占细菌总数的比例;TIREM方法则不仅能够精确定量AAPB,并且能够解决AAPB所占细菌总数比例的问题.

表1 pufM基因的引物类型
基于对AAPB功能光合基因pufM的扩增,Du等[42]采用qPCR方法对海洋环境中的AAPB数量进行了研究分析;黄春萍等[43]结合qPCR及克隆文库方法研究了川西高寒森林溪流环境中AAPB丰度、多样性变化及其环境影响因素;陈晓洁等[44]通过qPCR及克隆文库方法对湖光岩玛珥湖中AAPB进行了检测. 尽管qPCR方法操作简便、速度快,应用较广,但该方法对引物的要求较高,并且未知种类的引物设计较困难,即存在较大的局限性.
Fauteux等[27]结合IREM和HPLC方法调查了淡水湖中AAPB丰度、细胞生理状态及BChl.a浓度的变化规律;Cepkov等[45]结合IREM和HPLC两种方法,通过测定BChl.a在特定波长处荧光信号的昼夜变化来分析AAPB的生长率和死亡率. 但基于BChl.a红外荧光信号所测定的AAPB丰度往往存在较大的误差,这是由于荧光信号受环境因素及细菌细胞生理状态影响,例如含Chl.a的蓝细菌(聚球藻、原绿球藻)在特定条件下可发出红外荧光而导致AAPB丰度计算存在显著性误差[46-47],Zhang等[48]在检测东海AAPB动力学变化的过程中发现,聚球藻对AAPB丰度的计算带来了较大误差.
基于以上问题,Jiao等[24]建立了TIREM方法,该方法可对误差进行校正,从而获得准确的AAPB丰度及所占比例. Jiang等[49]采用TIREM方法发现内陆湖中优势AAPB菌群为α-和γ-变形菌,且种群结构组成受pH和盐度影响较大;Liu等[50]利用TIREM方法检测到海洋环境中AAPB丰度存在显著的昼夜变化,且生长速率快速. 目前来讲,TIREM方法为计算AAPB丰度最为准确且操作简便的检测方法.
近年来,AAPB成员陆续被发现报道,表2为已发现的部分AAPB成员,可以看出海洋环境中发现的AAPB大多以α-变形菌为主,但组成随海洋环境地理位置、气候条件及营养盐状态的不同而有所差异;湖泊环境中AAPB中则多以β-变形菌为主,即AAPB组成因栖息环境的不同及其他物理化学因素影响而呈现出显著差异性.
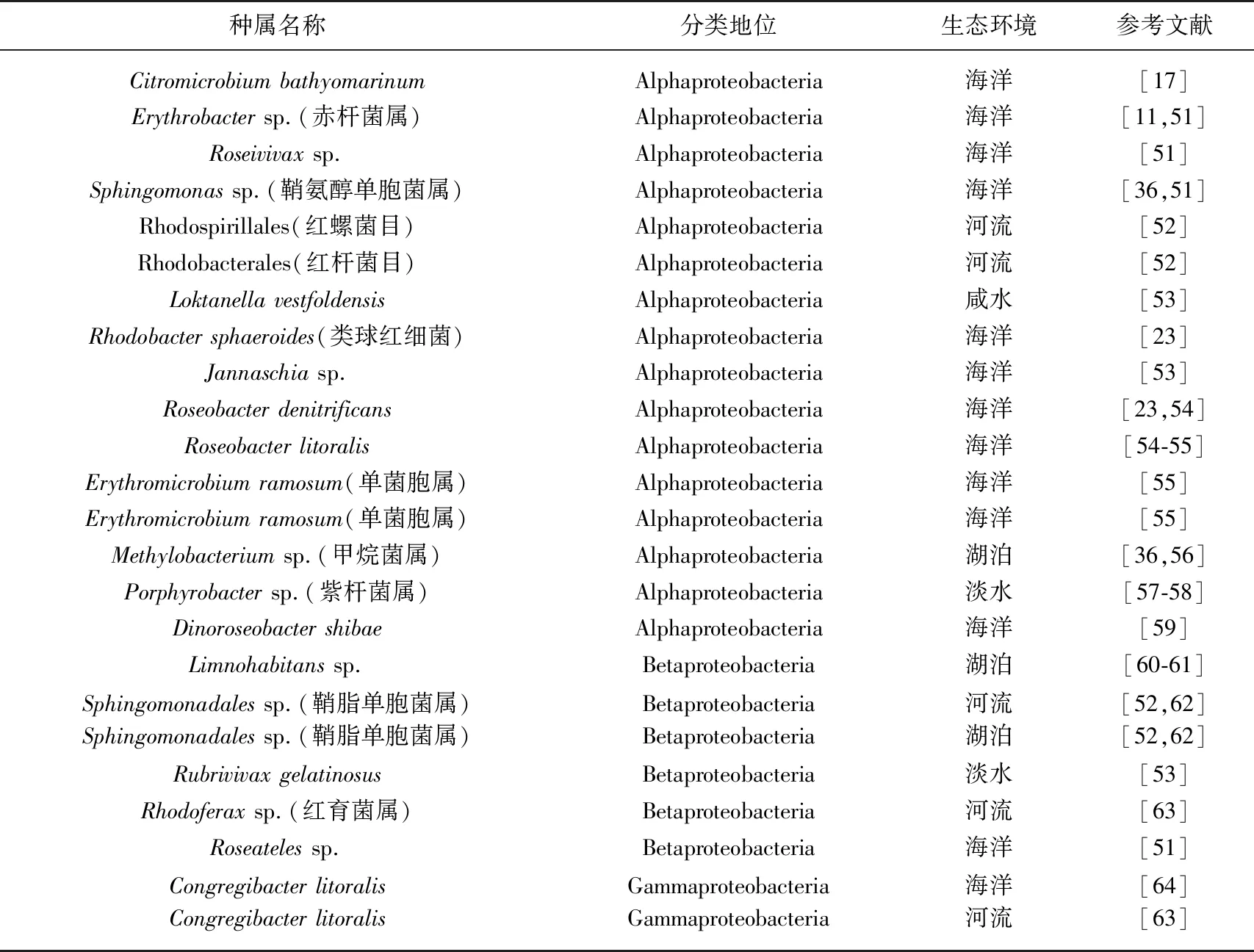
表2 水域生境中已报道的好氧不产氧光合细菌
2 AAPB栖息环境及多样性
2.1 AAPB分布特征
AAPB广泛分布于各种水域生境,如海洋[9,11,13-14,21,65-69]、热液口[23]、河流及河口[12,63,70-71]、内陆盐湖[50]、淡水湖泊[10,46,72-75]等,其丰度及群落组成随栖息环境不同而差异显著,AAPB相关研究见表3.
2.2 AAPB丰度、多样性及其影响因素
基于对光合基因pufM功能基因系统发育分析,大部分AAPB属于α-、β-和γ-变形菌类群[21,42,63,81],且其丰度及组成随栖息环境的不同而呈现出差异性[29].
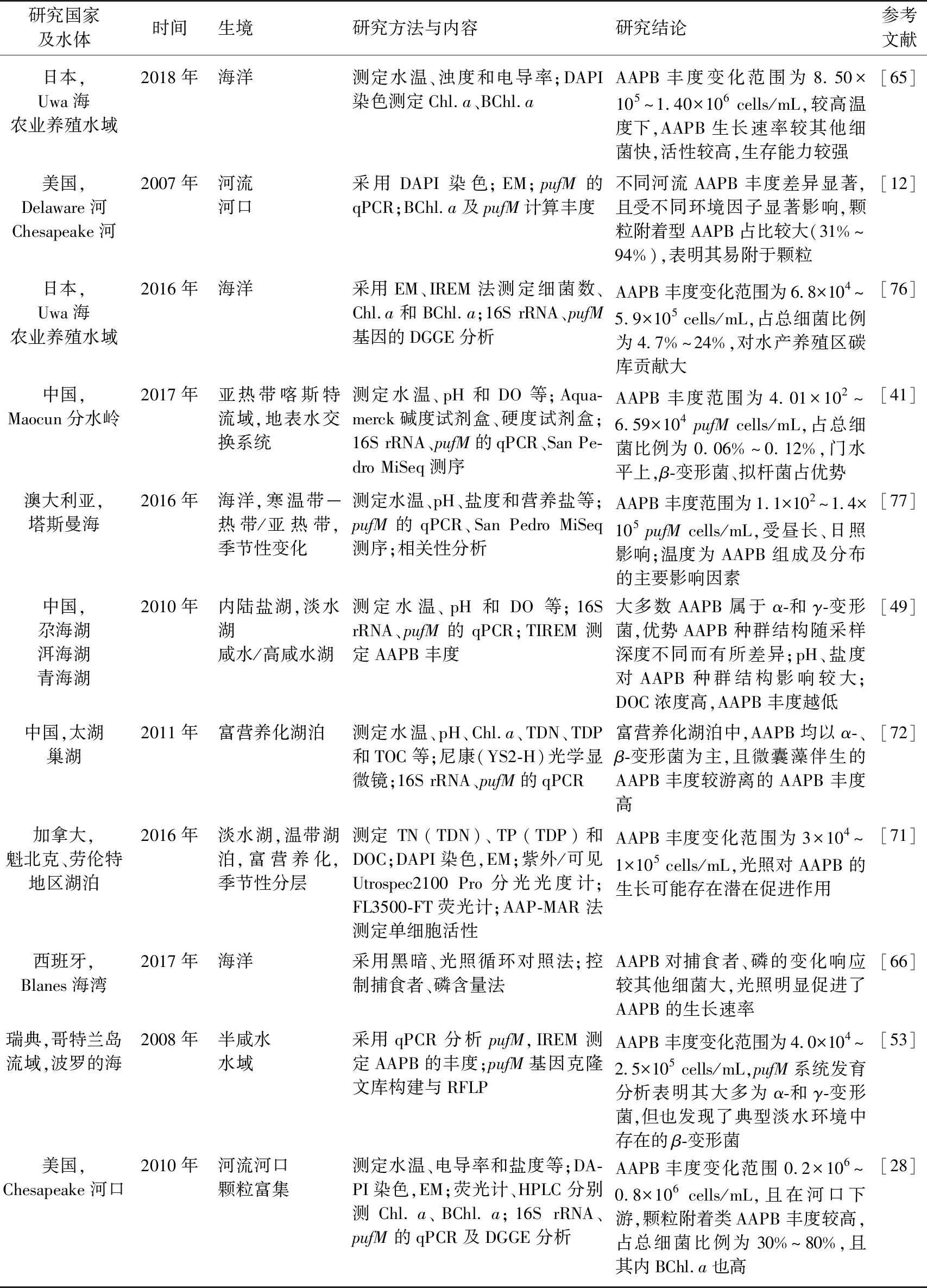
表3 AAPB相关研究
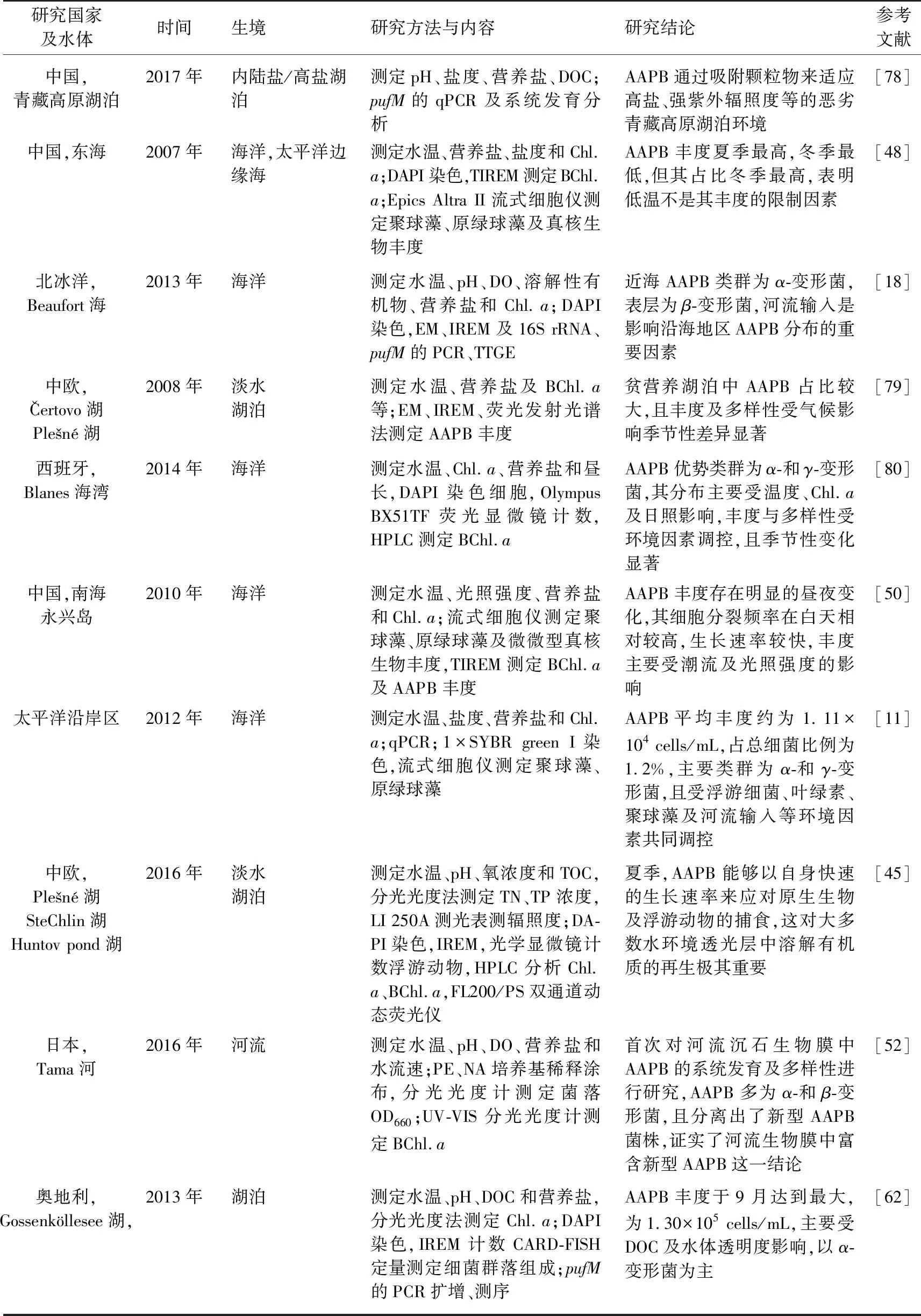
续表3
海洋环境中AAPB丰度高,如Sato-Takabe等[56]的研究发现日本Uwa海域环境中AAPB丰度变化范围为8.50×105~1.40×106cells/mL;Bibiloni-Isaksson等[77]的研究发现澳大利亚塔斯曼海洋环境中AAPB丰度范围为1.1×102~1.4×105pufMcells/mL;Ritchie等[11]的研究发现太平洋沿岸区AAPB平均丰度约为1.11×104cells/mL. 此外,海洋环境中AAPB主要以α-和γ-变形菌为主,温度、光照及Chl.a浓度为影响其分布及多样性的重要因素[67,77]. AAPB丰度与Chl.a浓度呈正相关,表明其依赖于浮游植物所产生的DOC,或是其和浮游植物的分布受相同因子制约[82]. 此外,溶解氧(DO)、总磷(TP)及pH对AAPB丰度影响也较大[83],有研究表明,磷对细菌及浮游植物的生长起着限制性作用[84-85]. 河流输入也是影响沿海地区AAPB分布的重要因素[18],当有河流输入时,当地盐度无显著影响,但浊度会显著增加[86],从而促使颗粒物大量富集,导致AAPB丰度增大[12]. Auladell等[1]的研究发现部分AAPB菌群丰度与种群结构存在显著的季节性变化,且与浮游植物之间存在较强的互作关系(如甲藻),并且已在各种海洋环境中观察到了大量附着型AAPB. 可见,温度、光照及Chl.a为影响海洋环境中AAPB丰度及多样性的主要因素.
各类河流及河口环境中的AAPB丰度与多样性均较高,如Cottrell等[28]的研究发现河流生境中AAPB丰度达到105cells/mL,并且在河口下游,颗粒附着类AAPB占总细菌比例高至30%~80%;Waidner等[63]的研究发现Delaware河流水体中优势AAPB菌群以γ-变形菌为主,其丰度与盐度呈正相关,其分布受盐度、营养盐等环境因子调控,且在盐度小于5%的水域内AAPB以Rhodoferax-like为主. 可见,河流河口中环境中颗粒附着型AAPB占据较大优势,且丰度及多样性受盐度影响较大.
2.3 AAPB代谢多样性及其影响因素
研究表明,AAPB具有代谢多样性的特点[87-89],可利用多种碳(C)源来维持生长与代谢[90-91],且不同C源对AAPB种群结构也会产生一定的影响,如赵吉睿等[92]的研究发现乌梁素海水体中AAPB菌群可利用葡萄糖、丙酮酸钠和酵母提取物等不同C源来进行生长,且菌群结构在经C源诱导后出现了Porphyrobactertepidarius和Rhodobactermegalophilus等种类,使得α-变形菌所占比例显著增加(约65%). 此外,与Thiocapsaroseopersicina相近的序列在经丙酮酸钠诱导后成为了优势类群,使得γ-变形菌比例增大至30%. AAPB在光照条件下对C源的利用率较黑暗条件下有明显的提高,其细胞变大,细胞数有明显的增加,表明光照对AAPB的生长具有一定的促进作用[66,93-95],但较高的光照强度会使菌绿素的表达受到影响,从而使其C源利用率受到抑制[96].
此外,AAPB还具有较高的生长速率,甚至超过总细菌群落的生长速率[97],对这一现象的解释是在某种情况下,AAPB与总细菌群落相比具有较高的细胞分裂频率[50]. 温度较高时,AAPB生长速率明显高于其他细菌,活性较高,生存能力较强,且对温度变化的敏感程度较大,相对优势可能较高一些[65]. 尽管AAPB丰度相对较低,并且所占原核生物群落比例较小,但其生长速率远高于某些浮游细菌,在海洋物质循环中起着重大作用[98],尤其是在C循环中. 因此,AAPB在调控水体中有机物含量、种类和迁变过程发挥重要作用,具体机制尚不明确.
3 AAPB在元素循环中的作用
3.1 AAPB脱氮特性及其影响因素
氮(N)循环是整个水圈物质循环的重要组成部分,在水体营养物质循环中占据重要地位[99]. 而微生物凭借其快速的生长速率,在N循环中发挥着巨大的作用,成为全球生物地球化学循环的主要驱动者[100-102]. 近年来,由于水环境中氮污染愈加严重,水体富营养化成为我国最重要的环境问题之一,为了解决这一问题,微生物脱氮技术以高效、经济、无二次污染等优点而被广泛应用与研究. 目前,关于光合细菌是否具有脱氮作用的话题倍受争议[103],直到1976年,具有反硝化脱氮功能的光合细菌——Rhodopseudomonassphaeroides(红假单胞菌亚种)被发现,光合细菌的脱氮作用才得以肯定[104].

陈晨[36]采用传统涂布划线方法从内蒙古高山湖泊中分离筛选出了脱氮活性较强的AAPB菌株W2、W38,在以NH3-N为N源的情况下,两者的总氮去除率分别为36.48%、30.57%,NH3-N去除率分别为95.66%、93.72%,结果表明,部分AAPB具有良好的脱氮功能,这对水环境生态系统N的转化具有重要意义.
3.2 AAPB在C及其他元素循环中的作用
AAPB对水环境中C循环的潜在贡献主要取决于其借助光合作用产生的ATP来补充细胞呼吸和依靠还原剂生成碳合成代谢以减少对现有有机碳的消耗[28]. 它可以通过光合作用产生部分能量用于细胞生长与代谢,这一潜能可能会促进河流及淡水环境中的物质循环[50],并且能够以自身较快的生长速率来应对原生生物及浮游动物的捕食,这对大多数水环境透光层中溶解有机质的再生意义重大[114]. 在污染严重的富营养化湖泊中,AAPB等功能菌群的存在使得原本不稳定的生态系统得以维持和发展[115].
AAPB对海洋、贫营养大洋及淡水等水环境中的生物量贡献重大,推动着C及其他元素的生物地球化学循环[1,28,32,70],同时在污染物降解、环境修复、生物除污等方面潜力巨大[116]. 例如从淡水湖中所分离出的MIM37菌株具有还原、矿化重金属,降解微囊藻毒素和多环芳烃类等多种致癌物等功能[94]. 综上分析,AAPB以高多样性、快生长率、强竞争力广泛存在于不同水环境中,并在C及其他元素循环中扮演着重要角色[21].
4 展望
本文对典型水环境中AAPB栖息环境、生物学功能进行了较全面的综述,但关于AAPB在饮用水水源水库中对有机物赋存形态和迁变特性研究尚且未见报道. 水库作为半自然性水体是地球陆地水圈的重要组成部分,参与生态系统水文和生源要素物质循环. 水库是碳、氮、硫等元素转化的重要场所,在流域尺度上的各类物质汇集在水库中,耦合多介质物理、化学和生物学过程,对水库水环境健康和城乡供水安全产生重要影响. 微生物是驱动水库地球元素循环和生态系统运行的关键生物因子、物质循环与能量流动的基石,开拓水库微生物研究领域不仅有助于深入解析水库生态系统结构与功能,完善水圈微生物数据库,促进地球科学与生命科学间的深度交叉与融合,而且为我国水库微生物资源保育与可持续开发利用,发展基于微生物群落代谢调控的水库水体/沉积物功能微生物修复技术提供重要科技支撑.
关于贫营养水源水库生境中AAPB的研究还需从多方面进行深度探究:(1)AAPB是否存在于深水型贫营养水源水库生态系统中,其分布规律是否存在时空变化,AAPB多样性及种群结构受哪些水质因子综合调控以及与水体有机物的关系等;(2)夏、秋季AAPB与藻类之间是否存在光与生态位的竞争关系及AAPB在藻华消涨过程中的代谢促进/抑制作用;(3)水源水库中AAPB的培养筛选、分离及其种群结构分析(基于pufM功能基因),解析功能菌株脱氮效率;(4)有关AAPB结构及生理代谢机制间的相互作用及调节,氮代谢机制及其如何作用于环境生理生态方面还需探索综上分析,对典型水环境中AAPB的深入探究将推动AAPB在水圈生物地球化学循环中的作用机制研究,有助于深入解析不同水圈(如寡营养水源水库生态系统)生境碳氮循环和能量流动中的地位和作用.
针对水库生境而言,后续研究重点将侧重于以下几个方面:(1)探究水源水库水体AAPB功能基因数量表达及种群结构组成时空演替特征及其与碳素循环的偶联关系;(2)高通量DNA测序及qPCR技术揭示AAPB种群在垂向水层中的变迁规律;(3)解析AAPB群落结构与水质(重点关注有机物)参数间的偶联机制;(4)采用共生网络分析方法探究游离型、颗粒附着型AAPB与藻类的互作关系,以期为水源水库中AAPB及其驱动水库生态系统C、N循环相关研究提供科学依据.
