生鲜畜禽肉中沙门氏菌全基因组分析与分子溯源
2020-10-19郭焜鹏张海韵王芳斌
宋 晟 高 晗 严 礼 郭焜鹏 张海韵 王芳斌
(1. 食品安全监测与预警湖南省重点实验室,湖南 长沙 410117;2. 湖南省食品质量监督检验研究院,湖南 长沙 410117)
沙门氏菌广泛分布于自然界,是一种属于肠杆菌科的革兰氏阴性杆菌,就邦戈尔沙门氏菌和肠道沙门氏菌这两个物种而言,迄今就已发现2 500余种血清型。作为一种人畜共患的主要病原菌,沙门氏菌通常会引起发热、呕吐等不良反应,是腹泻病全球四大病因之一[1-2]。某种情况下,沙门氏菌甚至可以进入血液,引发脑膜炎。为治疗沙门氏菌病,通常采用抗微生物药物,但大量抗生素的滥用,导致部分菌株产生耐药性,使药物失效[3-4]。人类患沙门氏菌病有可能是食用了被沙门氏菌污染的动物源性食品,如蛋、肉、禽和奶等。对于沙门氏菌以及其他食源性致病菌的溯源研究,主要有传统的沙门氏菌分离鉴定技术、多位点序列分型(Multi locus sequence typing,MLST)技术以及脉冲场凝胶电泳(Pulsed field gel electrophoresis,PFGE),近年来,随着新一代基因组测序技术的发展,基于全基因组测序分子分型技术广泛应用于食源性致病菌溯源中,具有快速精准等技术优势[5-7]。
实验室对长沙市销售的生鲜鸡肉、生鲜猪肉进行了随机取样调查,依据GB 4789.4—2016分离、鉴定样品中的沙门氏菌,以充分了解长沙市销售的生鲜鸡肉、生鲜猪肉的污染状况,为防治沙门氏菌所引起的食源性疾病提供参考依据,并对分离鉴定出的40株沙门氏菌,进行全基因测序与分子溯源分析,研究其溯源关系、致病机理、耐药机理,为沙门氏菌基因层面的深入研究提供一定的试验依据。
1 材料与方法
1.1 材料
鼠伤寒沙门氏菌标准菌株ATCC14028:实验室保存;
生鲜猪肉(24份,每份2 kg)、生鲜鸡肉(27份,每份2 kg):湖南省长沙市各大农贸市场;
缓冲蛋白胨水(BPW)、四硫酸钠煌绿增菌液(TTB)、亚硒酸盐胱氨酸增菌液(SC)、HE琼脂:青岛海博生物技术有限公司;
亚硫酸铋琼脂(BS)、木糖赖氨酸脱氧胆盐琼脂(XLD)、革兰氏染色液试剂盒(Gram Stain)、三糖铁琼脂(TSI)、营养琼脂(NA):北京陆桥技术股份有限公司;
革兰氏阴性菌鉴定试剂卡(GN):法国Chromagar公司。
1.2 仪器
拍击式均质器:Masticator Silver型,西班牙IUL公司;
低温培养箱:MIR-254L-PC型,日本松下电器产业株式会社;
全自动微生物鉴定系统:VITEK 2 compact30型,法国生物梅里埃股份有限公司。
1.3 样品的采集与处理
将采集的新鲜猪肉24份与整鸡27份放入无菌均质袋中,用BPW冲淋后,拍击式均质器拍击猪肉2 min,用手搓揉整鸡2 min,BPW淋洗液培养18 h。
1.4 增菌与分离培养
吸取1 mL培养18 h的BPW淋洗液,转种至10 mL TTB中,(42±1) ℃培养24 h,同时吸取1 mL培养18 h的BPW淋洗液,转种至10 mL SC中,(36±1) ℃培养24 h。从TTB与SC中各挑1环划线至XLD、BS、HE平板。BS平板与XLD平板(36±1) ℃培养48 h,HE平板(36±1) ℃培养24 h。
1.5 生化试验
自选择性琼脂平板上挑取沙门氏菌典型菌落,接种三糖铁,(36±1) ℃培养24 h。
1.6 革兰氏染色
自选择性琼脂平板上挑取沙门氏菌典型菌落,经生理盐水稀释,涂片固定后,革兰氏染色,显微镜观察细菌形态。
1.7 鉴定与菌株保存
自选择性琼脂平板上挑取典型菌落,接种营养琼脂(36±1) ℃培养24 h,得到纯化单菌落,采用全自动微生物生化鉴定系统进行菌种鉴定。单菌落经营养琼脂纯化后用菌种保存管于-70 ℃保存。
1.8 全基因组测序
对40株沙门氏菌进行基因组DNA的提取、测序、功能基因预测注释等工作由广州研科生物科技有限公司完成。
2 结果与分析
2.1 菌株形态、生化鉴定结果
分离获得的40株典型菌株,在BS琼脂培养基上,形态为棕褐色或黑色且有金属光泽,菌落周围呈黑色;在HE琼脂培养基上,形态为蓝绿色,带黑色中心;在XLD琼脂培养基上,形态为粉红色,带黑色中心。接种三糖铁琼脂,斜面红色产碱,底层黄色产酸,产H2S琼脂呈黑色,产气,琼脂中有气泡;经革兰氏染色,油镜可观察,两端钝圆的红色杆菌,革兰氏阴性,经全自动微生物生化鉴定系统鉴定为沙门菌属。
24份生鲜猪肉中有20份样品检出沙门氏菌,检出率为83.3%;27份生鲜整鸡中有20份样品检出沙门氏菌,检出率为74.1%,说明零售生鲜猪肉与生鲜整鸡沙门氏菌的污染率非常高。
2.2 40株沙门氏菌基因组基本信息
采用二代测序技术对40株沙门氏菌进行全基因组测序,并进行序列组装。由表1可知,猪源性沙门氏菌的scaffold数目在24~71,基因组总长度分布为3 842 688~5 019 323 bp,GC含量平均为54.08%。由表2可知,基因数在4 012~4 382,基因平均长度在932~958 bp。鸡源性沙门氏菌的scaffold数目在23~73,基因组总长度分布为4 638 420~5 201 462 bp,GC含量平均为51.93%。基因数在4 016~4 476,基因平均长度在930~959 bp。20株猪源性沙门氏菌基因组总长度的平均值比20株鸡源性沙门氏菌基因组总长度的平均值小425 799 bp,而GC平均含量却比20株鸡源性沙门氏菌多2.15%,说明猪源性沙门氏菌与鸡源性沙门氏菌在基因组层面存在差异,也暗示两者来源不同,在运输与销售环节的交叉污染可能性小,而饲养、屠宰运输环节猪与猪之间、鸡与鸡之间污染可能性大。
2.3 猪源性、鸡源性沙门氏菌单拷贝直系同源基因分析
直系同源是指不同物种之间的某一部分序列具有同源性,例如蛋白质的同源性,DNA序列的同源性,而单拷贝直系同源基因是指在不同物种中具有相同序列,相同功能,但基因组中拷贝数为1的基因。单拷贝直系同源基因,大部分为管家基因,在分子系统学中起重要的分子标记作用,通常用于构建生命树的主干及主干和末梢之间的分枝[8]。分别对20株鸡源性沙门氏菌与20株猪源性沙门氏菌的基因组信息进行分析,统计基因家族、单拷贝直系同源基因、多拷贝直系同源基因、独立旁系同源基因、其他直系同源基因。由表3、4可知,20株猪源性沙门氏菌共有3 988个基因家族,单拷贝直系同源基因数在2 170~2 191,鸡源性沙门氏菌共有3 919个基因家族,单拷贝直系同源基因数在2 159~2 183。单拷贝直系同源基因主要包括内肽酶活性基因、水解酶基因、蛋白质分泌调节基因、核糖体结构基因、谷氨酰-tRNA还原酶基因等。

表1 20株猪源性沙门氏菌基因组信息
2.4 基于单拷贝直系同源基因分别构建猪源性、鸡源性沙门氏菌系统进化树
基于单拷贝直系同源基因分别构建猪源性沙门氏菌系统进化树(见图1),结果显示20株猪源性沙门氏菌明显聚集为5簇,FC10728、FC11983、FC10743、FC11961、FC11980 5株聚集为1簇,FC10733、FC12045、FC10701、FC10726 4株聚集为1簇,FC10738、FC10718、FC10717 3株聚集为1簇,FC10758、FC11967 2株聚集为1簇,FC10739、FC10745 2株聚集为1簇,另有4株FC10755、FC11958、FC10730、FC10702无明显聚集。
FC10728、FC11983、FC10743、FC11961、FC11980 5株猪源性沙门氏菌聚集为1簇,但采样点各不相同,说明该菌种在不同销售点均存在污染,而污染源可能是来源于同一个屠宰基地或同一个养殖生产基地。FC10733与FC10701聚集为1簇,且来源于同一销售点,说明销售点存在交叉污染,或来源于同一供货渠道。另有FC10707与FC10743,FC11983与FC119582分别来源于2个销售点,且并不聚集,说明该销售点所销售的猪肉存在多株猪源性沙门氏菌污染的情况,可能是不同的供货渠道所致。从同源性的程度来看,FC10701、FC10726与FC10733同源性极高,分别来源于2个销售点,FC10717与FC10738同源性极高,分别来源于2个销售点,FC10728与FC10743同源性极高,分别来源于2个销售点,FC11961、FC11980与FC11983同源性极高,分别来源于3个销售点,说明其销售的猪肉分别来源于同一供货渠道。
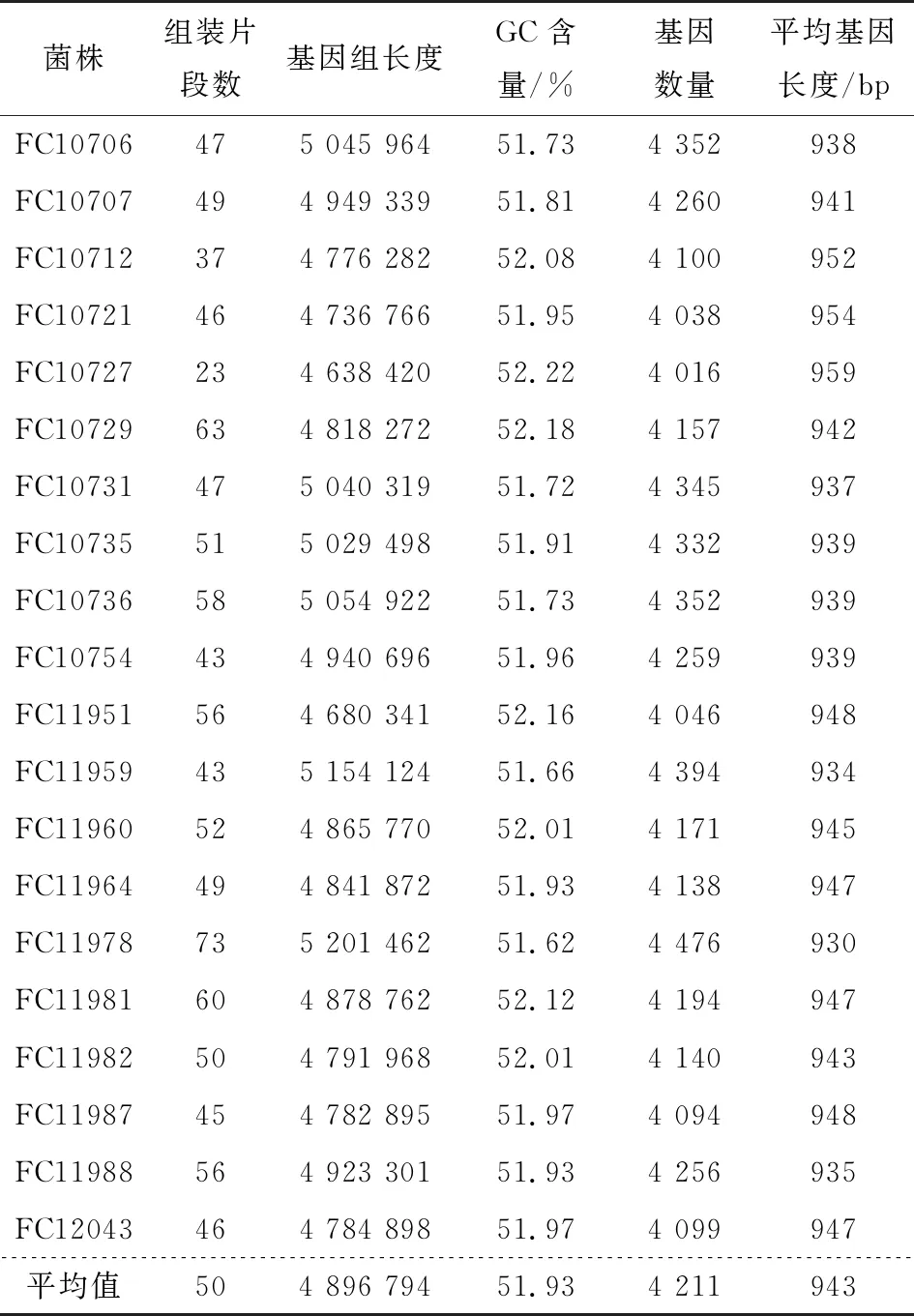
表2 20株鸡源性沙门氏菌基因组信息

表3 20株猪源性沙门氏菌直系基因与旁系基因分析
基于单拷贝直系同源基因分别构建鸡源性沙门氏菌系统进化树(见图2),结果显示20株鸡源性沙门氏菌明显聚集为5簇,FC10706、FC10707、FC10731、FC10736、FC11978、FC11982 6株聚集为1簇,FC10721、FC11960、FC11964、FC11987、FC12043 5株聚集为1簇,FC10754、FC11959、FC11988 3株聚集为1簇,FC10729、FC11981 2株聚集为1簇,另有4株FC10712、FC10727、FC10735、FC11951无明显聚集。
FC10706、FC10707、FC10731、FC10736、FC11978、FC11982 6株鸡源性沙门氏菌聚集为1簇,其中FC10706、FC10707与FC10731来源于同一品牌超市的2个分店且同源性极高,说明同一品牌超市的供货渠道可能存在污染,导致分店销售的鸡肉污染同一沙门氏菌。FC11982与FC11959、FC11988与FC11960分别聚集成不同簇,但来源于同一销售点,说明该销售点所销售的鸡肉存在多株鸡源性沙门氏菌污染的情况,可能是不同的供货渠道所致,且存在交叉污染的可能。从同源性的程度来看,FC11960、FC12043、FC11987与FC11964同源性极高,分别来源于4个销售点,FC10754与FC11959同源性极高,分别来源于2个销售点,FC10728与FC10743同源性极高,分别来源于2个销售点,FC10706、FC10707、FC10731、FC10736与FC11978同源性极高,分别来源于4个销售点,说明其销售的鸡肉分别来源于同一供货渠道。

表4 20株鸡源性沙门氏菌直系基因与旁系基因分析
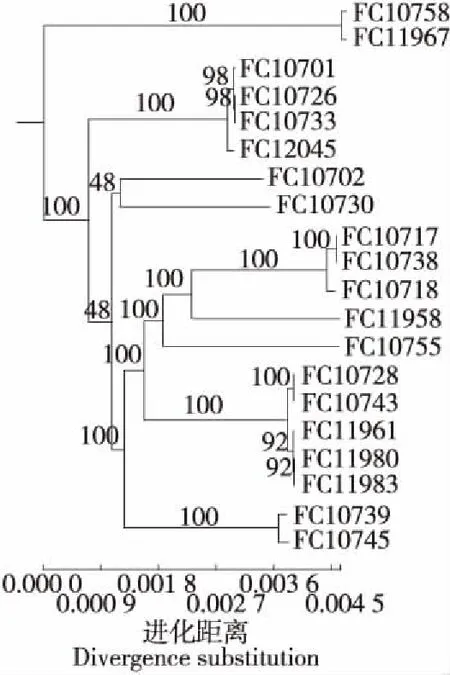
图1 基于单拷贝直系同源基因构建20株猪源性沙门氏菌系统进化树

图2 基于单拷贝直系同源基因构建20株鸡源性沙门氏菌系统进化树
2.5 猪源性、鸡源性沙门氏菌致病基因分析
通过数据比对与分析,发现20株猪源性沙门氏菌,20株鸡源性沙门氏菌,共涉及15种致病基因,如表5和表6所示。整体比较而言,鸡源性沙门氏菌致病基因较猪源性沙门氏菌多,20株鸡源性沙门氏菌共有277个致病基因,而20株猪源性沙门氏菌共有271个致病基因。fimA、fimD、ipaH9.8、ipgD&sopB、K08303、ptrB、sipA&ipaA、sipB&ipaB&bipB、sipC&ipaC&bipC、sipD&ipaD&bipD、yeeJ11个基因为20株猪源性沙门氏菌所共有;fimA、fimD、ipaH9.8、ipgD&sopB、K08303、ptrB、sipA&ipaA、sipB&ipaB&bipB、sipC&ipaC&bipC、sipD&ipaD&bipD、sptP、yeeJ12个基因为20株鸡源性沙门氏菌所共有。关于sopE基因,猪源性沙门氏菌中只有FC10730拥有,但鸡源性沙门氏菌中有FC10706、FC10707、FC10712、FC10731、FC10736、FC11978 6株拥有该基因。
15种致病基因涉及多种致病机理。fimA,基因注释为菌毛蛋白,特异性介导细菌对于骨髓源树突状细胞的粘附和侵袭作用[9]。fimD,基因注释为外膜引入蛋白,位于菌毛顶端的蛋白,是所有血清型的共有蛋白,介导沙门氏菌直接粘附宿主细胞。yeeJ,基因注释为黏附素,介导沙门氏菌对宿主细胞的粘附,对沙门氏菌的定植起重要作用,化学性质方面,黏附素可能为沙门氏菌表面某种特定的蛋白质结构或糖脂成分[10]。sipA&ipaA、sipB&ipaB&bipB、sipC&ipaC&bipC、sipD&ipaD&bipD,基因注释分别为侵袭素A、侵袭素B、侵袭素C、侵袭素D,4个基因均位于致病岛SPI-1,细菌进入宿主上皮细胞的关键因子,是沙门氏菌的关键毒力因子。ipaH9.8,基因注释为侵袭质粒抗原,可抑制血小板的正常凝集,促使水肿[11-12]。sopB,基因注释为磷脂酰肌醇-4,5-双磷酸4-磷酸酶,是一种肌醇磷酸酶,在发病机理中起重要作用,当沙门氏菌侵入人肠道上皮细胞并分泌sopB蛋白后,将激发3-磷酸肌醇激酶依赖性的信号传导,从而使肠上皮细胞Cl-水平提高,打乱宿主的多种信号传导途径。K08303,基因注释为蛋白酶,在上皮细胞起信号传导作用。ptrB,基因注释为寡肽酶B[13-14]。另有4个致病基因为个别沙门氏菌所有,其中sopE,只有7株沙门氏菌具有,该基因注释为效应蛋白,可介导肌动蛋白集合,起细菌内化作用;能刺激肠道上皮细胞导致炎症和腹泻,促进炎症细胞的趋化和增殖;破坏宿主细胞的肌动蛋白,进而使得细菌侵入;引起迟发性细胞毒作用,引起黏膜炎症反应。sopD,基因注释为效应蛋白,在入侵真核细胞中起协同作用。sptP,基因注释为效应蛋白,能引起至少两种蛋白的去磷酸化,抑制肥大细胞的脱颗粒,导致抑制嗜中性粒细胞的聚集,阻止血管内容物流如感染部位,从而引起细菌的全身性感染[15]。TROVE2&SSA2,基因注释为SS-A / Ro核糖核蛋白,是一种RNA-蛋白质复合体,功能上属于一种红斑狼疮抗原,SS-A / Ro抗体可作为新生儿红斑狼疮(NLE)的血清学标志[16]。
2.6 猪源性、鸡源性沙门氏菌耐药基因分析
通过数据比对与分析,发现20株猪源性沙门氏菌,20鸡源性沙门氏菌,共涉及15种耐药基因,如表7和表8所示。整体比较而言,鸡源性沙门氏菌与猪源性沙门氏菌的耐药基因分布情况基本类似,20株猪源性沙门氏菌共有294个耐药基因,20株鸡源性沙门氏菌共有293个耐药基因。acrA、ampG、ampC&penP、norR、norV、norW、nsrR、ompC、ompF、tolC、YHB1&hmp、lepA、pagP、SIG2&rpoS14个耐药基因为20株猪源性沙门氏菌所共有;acrA、ampG、ampC&penP、norR、norV、norW、nsrR、ompC、ompF、tolC、YHB1&hmp、lepA、pagP、SIG2&rpoS14个耐药基因为20株鸡源性沙门氏菌所共有,关于vanX基因,分别有14株猪源性沙门氏菌与13株鸡源性沙门氏菌有该基因。
15种耐药基因涉及多种耐药机制。acrA,基因注释为膜融合蛋白;TolC,基因注释为外膜通道蛋白,两者相互配合,形成主动外排系统,由膜融合蛋白acrA捕获抗菌药物后,通过外膜通道蛋白TolC,将抗菌药物运转至外界。ompC、ompF,基因注释为外膜孔蛋白,细菌接触抗菌药物后,发生外膜孔蛋白ompC、ompF的表达基因失活,造成孔蛋白丢失或严重减少,最终导致β-内酰胺类药物进入菌体内减少,切断β-内酰胺类药物输入细菌体内的途径,以产生耐药性。ampC&penP,基因注释为β-内酰胺酶,可使使易感抗生素水解而灭活[17]。ampG,基因注释为β-内酰胺酶感应信号传感器,编码一种依赖质子动力势能的单要素渗透酶,起到向胞浆内传递诱导信号的作用。AmpG蛋白是细胞黏肽循环中的关键蛋白。若ampG基因缺失,细菌会完全丧失AmpCβ-内酰胺酶的诱导性或只表达低水平诱导[18]。YHB1&hmp、norR、norV、norW、nsrR,基因注释分别为一氧化氮双加氧酶、厌氧型一氧化氮还原酶转录调节因子、厌氧型一氧化氮还原酶、一氧化氮还原酶FoRd-AND(+)、Rrf2家族转录调节因子 & 一氧化氮敏感的转录阻遏物,沙门氏菌通过还原一氧化氮,实现对一氧化氮的脱毒,导致吞噬细胞无法杀死沙门氏菌,从而提高沙门氏菌对宿主的抗性[19]。PagP,基因注释为酰基转移酶,沙门氏菌细胞外膜的酰基转移酶PagP,能将磷脂的C16碳脂肪酸链转移到内毒素分子的脂肪酸链上,形成次级脂肪酸链,PagP产生的内毒素可以干扰TLR4的识别,使沙门氏菌对阳离子抗菌肽产生抗性[20]。SIG2 & rpoS是RNA聚合酶的主要识别因子,当沙门氏菌处于逆境条件下sigma因子启动调控网,改变其对不同环境压力的应答,以克服胁迫环境。lepA,基因注释为GTP结合蛋白,能识别错误转位的核糖体,使其有机会正确转位。另有vanX为27株沙门氏菌具有,该基因注释为D-丙氨酰-D-丙氨酸二肽酶,可将细胞胞壁中合成的D-丙氨酰-D-丙氨酸水解,导致细胞壁前质末端的二肽发生结构化变化,从而降低万古霉素药物分子跟细菌细胞壁前质的结合力,以获得对万古霉素的耐药性[21]。

表5 20株猪源性沙门氏菌致病基因分析†
3 结论
(1) 长沙市零售的生鲜猪肉与生鲜整鸡,沙门氏菌的污染率非常高,如缺乏必要的微生物学知识及防护措施知识,很容易引发交叉污染,发生沙门氏菌食物中毒事件,因此在日常的食品安全监管以及卫生督导工作中,应加强沙门氏菌来源、防护、预防治疗的教育工作,消费者也应增强卫生防范意识。
(2) 通过对40株沙门氏菌进行全基因组测序,统计基因家族、单拷贝直系同源基因、多拷贝直系同源基因、独立旁系同源基因、其他直系同源基因相关信息,并以猪源性沙门氏菌2 170~2 191个单拷贝直系同源基因,鸡源性沙门氏菌2 159~2 183个单拷贝直系同源基因,构建系统进化树,实现了猪源性、鸡源性沙门氏菌的全基因溯源。
(3) 通过对猪源性、鸡源性沙门氏菌致病基因的预测可知,生鲜畜禽肉中筛选出的沙门氏菌含有多种毒力因子,包括侵袭基因、分泌效应蛋白、黏附素、肌醇磷酸酶、菌毛蛋白、外膜引入蛋白、效应分子,通过协同作用,产生综合毒力。在基因层面上阐明了沙门氏菌可能存在的致病基因与致病机制,提示了沙门氏菌潜在的致病风险,为药物研发与疾病治疗提供了分子基础。多个耐药基因,多种耐药机制的发现,说明养殖环节可能存在抗生素滥用的情况,加快高耐药性毒株的产生,因此,农业生产监管部门应加大抗生素使用危害的宣传力度,加强对养殖户抗生素使用的监管力度,从源头减少抗生素的使用,降低对抗生素的依赖。
