不同水解度对核桃分离蛋白酶解物功能特性的影响
2020-10-18刘猛史婷
刘猛,史婷
(1.吕梁学院生命科学系,山西吕梁033000;2.山西省特色植物功能成分工程研究中心,山西吕梁033000)
核桃富含矿物质元素、维生素、膳食纤维以及各种营养成分和功能性成分[1]。其油脂中含有大量不饱和脂肪酸[2],尤其含有很多对身体有益的油酸和亚油酸,也可能含有抗食道癌及中和铅中毒的物质[3-4]。核桃蛋白浓缩物和分离物可作为潜在的功能性食品成分[5]。近年来,我国核桃产量增加,2011年我国核桃年产量约为342万吨,2017年我国核桃年产量约365万吨[6-7]。以前核桃饼粕利用率很低,现在核桃副产物逐渐被开发成产品。比如核桃壳制备的活性炭、核桃粕制备的蛋白粉[8]。核桃粕生化性质和物理性质也被广泛研究。经研究,核桃饼粕的干物质、粗脂肪、粗纤维和非植酸磷常规营养成分含量较高,粗蛋白含量与大豆饼粕等同类饲料相当。维生素B1、维生素B6、锰及精氨酸等微量营养成分含量比大豆饼粕高[9]。
有研究证实了核桃蛋白经过酶水解以后,其溶解性、乳化性、起泡性等功能特性有了很大的变化,经酶修饰的蛋白可应用于生产[10]。Paz-Yépez等研究了颗粒大小和肠道条件对核桃和花生体外脂质和蛋白质消化的影响。结果表明,坚果颗粒大小对蛋白质水解和分析基质降解指数的影响最大。有研究也探究了不同水解度对大豆和花生分离蛋白的影响[11-12],表明随着水解度的增大,大豆蛋白持水性和最终黏度值降低,溶解性显著性增大;花生蛋白热稳定性、溶解度和成胶能力提高,蛋白品质得到提升[13-14]。不同油脂提取方法对核桃粉蛋白特性有影响,核桃分离蛋白功能特性因受到压力而发生改变[15]。核桃仁蛋白酶解物可应用于酿造,提高发酵性能。大豆天然蛋白的持水性很低,需要改性以提高持水性,使之应用于食品加工中,来改善肉制品产品质量[16]。这些研究说明了探究水解度对于核桃分离蛋白酶解物持水性、乳化性、乳化稳定性、起泡性、泡沫稳定性的影响有一定的实际意义。
1 材料与方法
1.1 材料与试剂
BCA蛋白浓度测定试剂盒(P0010S型):上海碧云天生物技术有限公司;色拉油:市售;碱性蛋白酶(酶活1×105U/g):河南安锐生物科技有限公司;盐酸、氢氧化钠(分析纯):天津市科密欧化学试剂有限公司。
1.2 仪器与设备
集热式恒温加热磁力搅拌器(DF-101S型):北京海天友诚仪器厂;离心机(SC-04型):盐城市凯特实验仪器有限公司;酶标仪(EPOCH2型):美国伯腾仪器有限公司;电子天平(FA2104S):上海舜宇恒平科学仪器有限公司。
1.3 方法
1.3.1 核桃分离蛋白的制备
用电子天平称取200 g核桃饼粕,按照料液比1∶10(g/mL)的比例,加蒸馏水2 000 mL,混匀后利用酸沉碱提[17-18]的原理用1 mol/L氢氧化钠滴定pH值至9.0,在超声回流装置中,50℃下提取1 h,之后放置30 min,置于离心机中3 000 r/min下离心20 min,结束后取出上清液,用1 mol/L盐酸缓慢调其pH值至4.5,再次放入离心机3 000 r/min离心20 min,取出沉淀层,加蒸馏水调节pH值至中性,放入离心机3 000 r/min离心20 min,离心管里的下层即为分离蛋白溶液。最后用BCA蛋白浓度测定试剂盒于酶标仪中测定后,处理数据得到核桃分离蛋白的浓度。
1.3.2 不同水解度核桃分离蛋白的制备
选择碱性蛋白酶对分离蛋白进行酶解,碱性蛋白酶酶解核桃饼粕分离蛋白的最优酶解条件:底物浓度为 5.0%[分离蛋白 ∶水=1 ∶20(g/mL)],酶解 pH 9,酶加入量 5 000 U/g,温度 55 ℃[19]。分别酶解 20、40、60、80、100、120、140、160 min。同时做一组空白对照试验,在酶解过程中,滴入0.5 mol/L NaOH溶液,反应液的pH值为恒定值9.0时停止滴入NaOH溶液。之后,将酶解液放入100°C水中灭酶15 min,冷却后,调节pH值至7.0,4 000 r/min离心5 min,上清液为酶解后产物。
1.3.3 水解度的测定
水解度采用pH-stat法[20-21]进行测定,根据水解过程中的0.5 mol/L NaOH(标定)的消耗量来计算水解程度。每20 min记录一次NaOH的消耗体积,直到完成所需水解过程,然后对此水解溶液进行高温灭酶处理,记录滴定过程使用的NaOH溶液的总量。
水解度(degree of hydrolysis,DH)的计算如公式(1)所示:
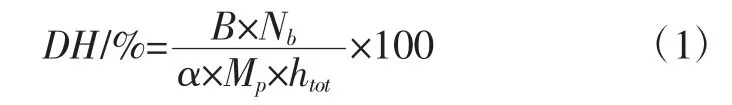
式中:B为水解过程完成时NaOH溶液消耗量,mL;Nb为标定的 NaOH 溶液实际浓度,mol/L;Mp为需要水解的核桃蛋白质量,g;htot为核桃蛋白中肽键的总数,取8.0 mmol/g;α为蛋白氨基的平均解离度,通常取数值7。
1.3.4 持水性的测定
取28.7 mL酶解产物,放入10 mL水中,匀速搅拌直至混合,放在恒温磁力搅动器中,调至温度50°C保温30 min。把上述溶液缓慢移入到确定质量的离心管中,4 500 r/min离心20 min,把上面一层液体移除之后,称出离心管与沉淀质量。
持水性(water holding capacity,WHC)的计算如公式(2)所示:

式中:M为样品质量,g;M1为离心管和沉淀物的总质量,g;M2为离心管和样品的总质量,g。
1.3.5 乳化性及乳化稳定性的测定
取28.7 mL酶解液,缓慢倒入40 mL水,再取40mL色拉油放入其中,在4 500 r/min下均质2 min,完成后,再将液体倒入离心管1 500 r/min离心15 min。测出离心管中乳化层高度和液体的高度,两者之比即为乳化性。
把以上液体放入90℃恒定温度水中静置30 min,然后降温冷却,15 000 r/min离心15 min,再次量出乳化层的高度。水浴后离心管中乳化层高度与初始乳化层高度之比即为乳化稳定性。
1.3.6 起泡性及泡沫稳定性的测定
取28.7mL酶解液,加入100mL蒸馏水,4000r/min均质2 min,测量泡沫总体积,此时的泡沫体积与100之比即为起泡性。然后静置样品30 min,再一次测量泡沫的总体积[22]。静置后的泡沫体积与均质停止时的泡沫体积之比即为泡沫稳定性。
1.4 统计学分析及绘图
数据采用Origin9.1软件进行计算绘图。采用SPSS 19.0软件进行显著性分析。数据以±s表示,P<0.05为显著性差异。
2 结果与分析
2.1 蛋白浓度的测定
蛋白质浓度标准曲线如图1所示。
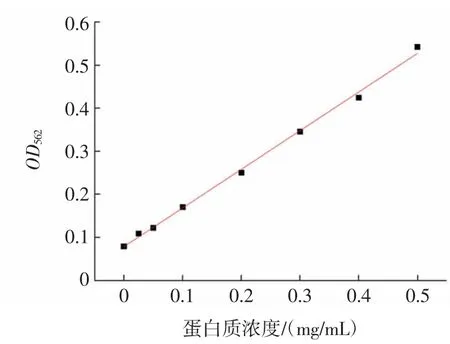
图1 BCA法测定蛋白质浓度标准曲线Fig.1 Standard curve of protein concentration determined by BCA method
以蛋白质浓度为横坐标,OD562为纵坐标,建立标准曲线的回归方程为y=0.897 37x+0.078 46(R2=0.996 78),由标准曲线得到分离蛋白样品中蛋白质浓度为34.8 mg/mL。
2.2 水解度的测定
核桃分离蛋白水解时间与水解度的关系如图2所示。
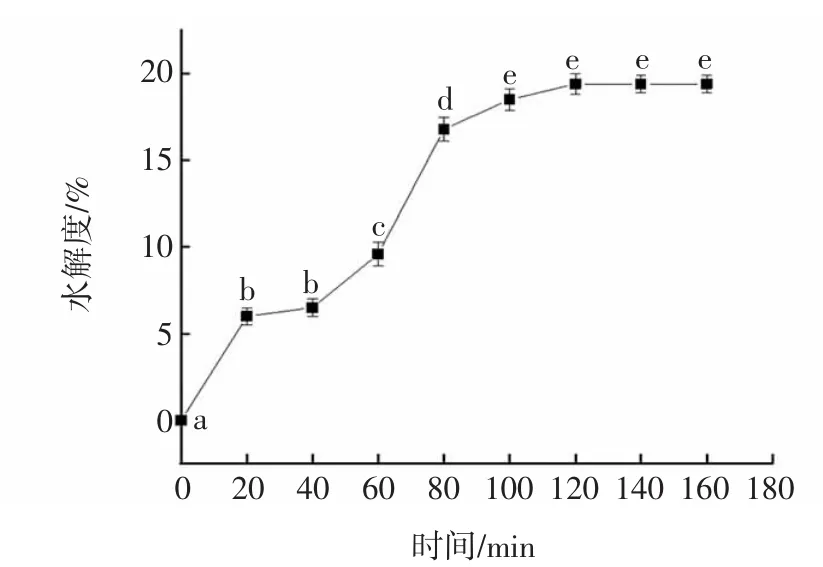
图2 核桃分离蛋白水解时间与水解度的关系Fig.2 The relationship between hydrolysis time and hydrolysis degree of walnut protein isolate
由图2可知,运用pH-stat法测定核桃粕蛋白的水解度,用碱性蛋白酶酶解核桃饼粕蛋白质,在前80 min时,水解速度较快,随着时间的延长,水解度增长速度变缓;当酶水解时间达到120 min时,达到最高值,此时为19.4%,此后时间延长,其水解度不再变化。即120 min为最大酶解程度所需的最短时间。由于在120 min以后水解度未发生改变,20 min和40 min对应的水解度无显著性差异,100 min和120 min对应的水解度无显著性差异,因此综合考虑之后,选取了 0、40、80、120 min 4个梯度进行功能性质的测定。
2.3 持水性的测定
不同水解度的核桃分离蛋白持水性如图3所示。
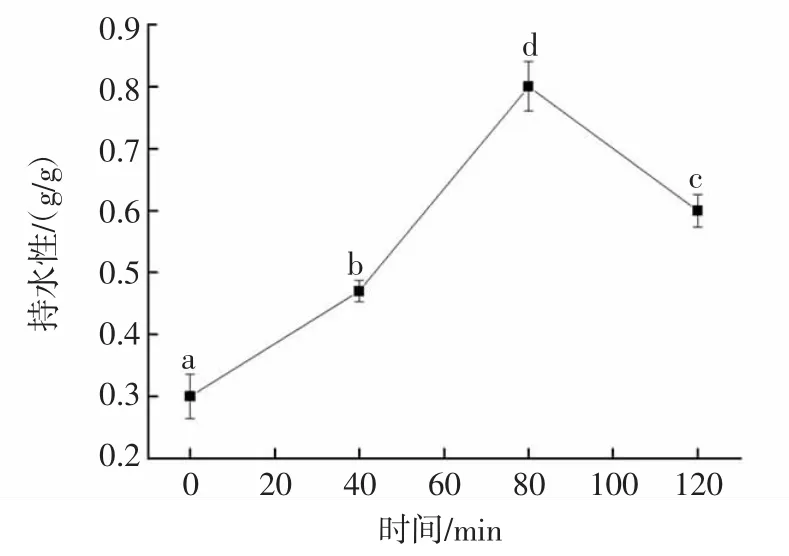
图3 核桃分离蛋白水解时间与持水性的关系Fig.3 The relationship between hydrolysis time of walnut protein isolate and water retention
由图3可知,酶解时间0~120 min,核桃分离蛋白的持水性呈现先增大后减小的趋势。酶解0~80 min,随着水解时间的延长,水解度逐渐增大,酶解80min时,分离蛋白持水性最佳。酶解时间超过80 min,持水性反而会下降。这是因为核桃蛋白经过蛋白酶水解,逐渐水解为低分子量的多肽,导致多肽链伸展、空间结构发生变化,持水性提高。当水解度过大时,多肽段变得很小,极易溶解于水中,不利于形成蛋白质的网状结构,持水性下降[12,23]。因此,持水性与水解度有一定的关系,持水性受多肽溶解的影响而变小。
2.4 乳化性及乳化稳定性的测定
不同水解度的核桃分离蛋白乳化性及乳化稳定性如图4所示。
由图4分析得出,酶解0~80 min,随着水解时间的增加,乳化性一直上升。酶解时间80 min~120 min,随着酶解程度的增大,乳化性却表现出下降的趋势。在一定的水解度下,核桃分离蛋白经酶解后,变为小分子,其中一些露在外的亲油基团使其对油脂分子的吸收能力变大,溶液中的氨基酸迅速转移到油和水的界面上,促进乳浊体系的形成,才会导致乳化性增强。后期随着水解度持续增大,蛋白水解超过极限,由于此时过度水解导致蛋白质的内部遭到破坏,与脂质分子的组合能力降低,乳化性下降。
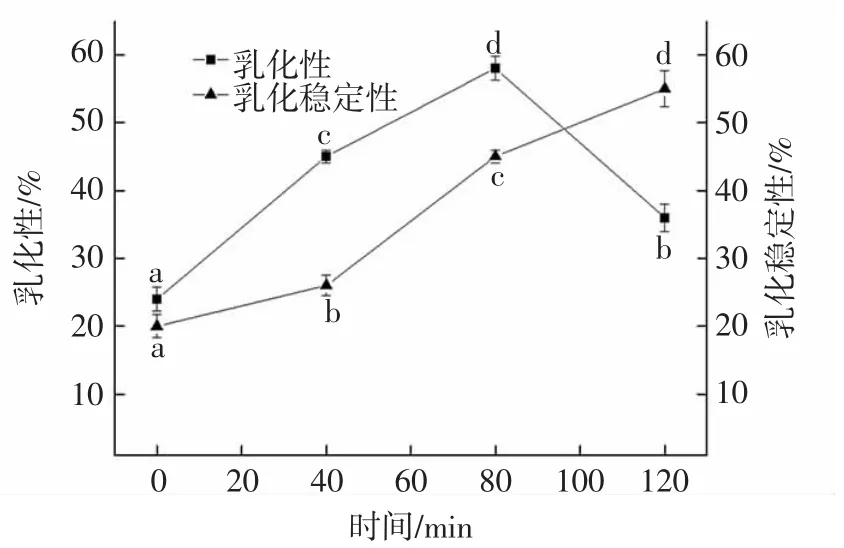
图4 核桃分离蛋白的水解时间与乳化性、乳化稳定性的关系Fig.4 The relationship between hydrolysis time of walnut protein isolate and emulsification property and stability
酶解0~120 min乳化稳定性随水解度的增大而一直升高,且开始上升趋势较缓,后来上升趋势较快。这是因为亲油基团对油脂分子形成了一定的屏障作用,乳化稳定性随着水解度的变大而增强,即趋势一致成正比。另外,由于受分子溶解性的作用,形成了界面膜以增强小分子的乳化稳定性。此外,又由于蛋白质是带电的,油分子被静电作用力吸到一侧阻碍了运动,从而提高了乳化稳定性。
2.5 起泡性及泡沫稳定性的测定
不同水解度的核桃分离蛋白起泡性及泡沫稳定性如图5所示。
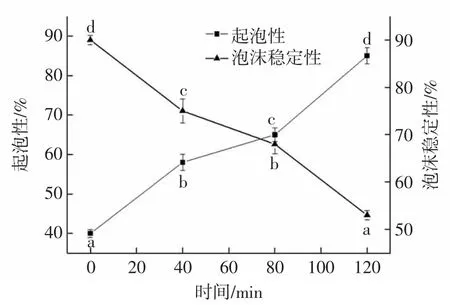
图5 核桃分离蛋白水解时间与起泡性及泡沫稳定性的关系Fig.5 The relationship between hydrolysis time of walnut protein isolate and foaming property and foam stability
由图5可知,核桃分离蛋白的起泡性在酶解0~120 min内,随水解时间的延长,一直呈增大的趋势。未进行酶解时,蛋白质起泡性最小,为40.0%,在120 min时起泡性达到最大值为85.0%。说明随着核桃分离蛋白水解度的增大,酶解产物的起泡性逐渐增大。当水解时间大于80 min,起泡性增长速度变快,这是因为酶解后,蛋白质分子的各条肽链舒展开来,通过分子之间的作用力使膜形成,此时酶解使分子之间的空间结构展开,亲脂性基团露出,将空气包埋在水中,液泡表面张力减小,气泡稳定性随之变大,促进表面膜形成后,蛋白的起泡性得以增大。
随着酶解时间的延长,核桃分离蛋白水解产物的泡沫稳定性逐渐减小,这是因为高度酶解后使产物中形成较多的小分子多肽,疏水基团暴露在外导致小的那一部分肽链无法使液体膜达到稳定,稳定性开始下降,也有一部分原因是随着酶解的逐步进行,电荷有所增加,蛋白质分子在气液表面的吸附作用被阻碍,从而降低了泡沫稳定性。
3 结论
将核桃饼粕用碱性蛋白酶水解,通过改变酶解的时间制成不同水解度的分离蛋白,研究水解度对其功能特性的影响。经研究得出,水解度可提高也可削弱某些功能特性。在酶解0~120 min内,起泡性及乳化稳定性随酶解程度增大而变大,持水性及乳化性随酶解程度的增大呈现先增大后减小的趋向,在中间的某个水解度达到最大值。泡沫稳定性随酶解程度增大而变小。
