纳米粒子在食源性致病菌检测中的应用进展
2020-09-29邱佩佩毋福海贺锦灿
邱佩佩,毋福海,白 研,贺锦灿
(广东药科大学 广东省公共卫生检测与评价工程中心,广东 广州 510310)
食源性疾病是指食用了被细菌和或其毒素、寄生虫、病毒、化学品或其他媒介污染的食物而引起的疾病[1]。虽然美国的食品供应是世界上最安全的,但联邦政府估计,每年约有4800万例食源性疾病患者(相当于六分之一的美国人)因食用受污染的食品而患病,并导致约12.8万人住院和3000人死亡[2]。根据世界卫生组织的一份关于食源性疾病的报告,由食源性致病菌引起的疾病和死亡持续威胁着全球的公共卫生安全[3]。因此,开发快速、准确且灵敏的食源性致病菌检测方法是预防食源性疾病暴发和确保食品安全的关键。目前食源性致病菌的常规检测方法包括培养和菌落计数法、酶联免疫吸附试验法(Enzyme-linked immunosorbent assay,ELISA)、聚合酶链反应法(Polymerase chain reaction,PCR)等[4-7]。然而,培养和菌落计数法费时费力,涉及细菌培养、重复富集、菌落分离以及各种生化和血清学鉴定试验,不适用于食源性致病菌的现场快速检测。尽管ELISA和PCR克服了耗时长的缺点,但需要昂贵的专用设备和复杂的样品前处理,甚至缺乏抗干扰能力。因此,研究人员致力于开发新的检测方法以降低检测时间和成本,同时提高检测技术的可靠性、灵敏度和特异性。
在过去的十几年间,纳米技术快速发展,特别是在生物医学检测领域[8-11]。由于纳米材料存在粒径小、比表面积大和表面反应活性高等特性,成为食源性致病菌检测领域的研究热点。此外,将抗体[12-14]、适配体[15-17]、抗菌肽[18-19]等识别元件修饰于纳米粒子表面,并结合新颖的分析技术,可提高食源性致病菌检测的特异性和灵敏度。本文主要总结了磁性纳米粒子(Magnetic nanoparticles,MNPs)、金纳米粒子(Gold nanoparticles,AuNPs)、银纳米粒子(Silver nanoparticles,AgNPs)、量子点(Quantum dots,QDs)、上转换纳米粒子(Upconversion nanoparticles,UCNPs)、二氧化硅纳米粒子(Silica nanoparticles,SiNPs)与磁性分离样品前处理技术或核磁共振(Nuclear magnetic resonance,NMR)、比色、表面增强拉曼散射(Surfaces enhance Raman scattering,SERS)、荧光等分析技术结合在食源性致病菌检测中的应用,以期为日后的研究提供思路。
1 纳米材料概述
纳米材料是指三维空间中至少有一维尺寸范围在1~100 nm之间的材料[20]。按结构可分为零维纳米材料、一维纳米材料、二维纳米材料、三维纳米材料,其中纳米粒子属于零维纳米材料;按物理性质可分为磁性纳米材料、光学纳米材料、半导体纳米材料等;按材质可分为金属纳米材料、无机纳米材料、有机纳米材料等。由于纳米材料的尺寸处于介观领域,其具有的表面效应、小尺寸效应、量子尺寸效应、宏观量子隧道效应等特性,使之具有磁学、光学、化学等性能[21]。
这些优异的性能使得纳米材料在化工、生物、医学等领域得到了广泛的应用,尤其在食源性致病菌检测应用中具有巨大优势。例如MNPs同时具有纳米材料和磁性材料的特性,能在外部磁场下快速分离并在移除磁场时重新分散,从而可实现目标细菌的快速分离;AuNPs具有良好的光学性能,可以通过诱导粒子聚集或分散导致颜色变化实现比色分析,适用于现场快速检测;QDs凭借其宽的激发光谱、窄的发射光谱和大的斯托克斯位移等特性而应用于食源性致病菌检测中。
2 磁性纳米粒子
2.1 磁性分离
MNPs具有纳米材料的小尺寸效应、比表面积效应和磁性材料的磁效应。当MNPs的粒径小于其超顺磁性临界尺寸时,粒子进入超顺磁性状态,这种特殊的磁性使粒子可通过外部磁体实现快速分离,并在没有磁场的情况下迅速重新分散[22]。因此,磁性分离技术能够有效地从复杂介质中分离和浓缩目标分析物,避免了繁琐的分离处理[23-24]。例如,Cheng等[25]提出了一种适配体和抗生素双重识别与磁性富集和荧光检测相结合的策略,方法对金黄色葡萄球菌的检出限(Limit of detection,LOD)为10 CFU/mL,复杂样品中的LOD为70 CFU/mL。Wang等[26]采用适配体修饰的镀银MNPs捕获细菌,捕获率达75%;基于该复合材料建立的SERS分析方法对金黄色葡萄球菌的LOD为10 CFU/mL。Yu等[27]将Fe3O4纳米粒子磁性分离与杂交链反应结合,降低了背景信号,对沙门氏菌的LOD为74 CFU/mL。此外,MNPs表面修饰非选择性识别元件后能同时捕获多种细菌,与SERS等分析方法结合可实现多种细菌的同时检测。如Yuan等[18]以抗菌肽修饰的Fe3O4纳米粒子作为捕获探针,4-巯基苯基硼酸修饰的镀金的银装饰氧化石墨烯纳米复合材料作为SERS标签,开发了一种三明治结构的生物传感器(图1)。该方法成功分离并检测了血样中浓度仅为10 CFU/mL的大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌。Li等[28]将磁性分离与SERS分析方法结合,使用镀银的MNPs快速鉴别了水样中的贝氏芽孢杆菌和大肠杆菌(<15 min)。尽管MNPs能够有效地从复杂介质中分离和浓缩细菌,但是在目标细菌浓度极低或多种待检物存在的情况下进行特异性捕获仍然较为困难[29]。
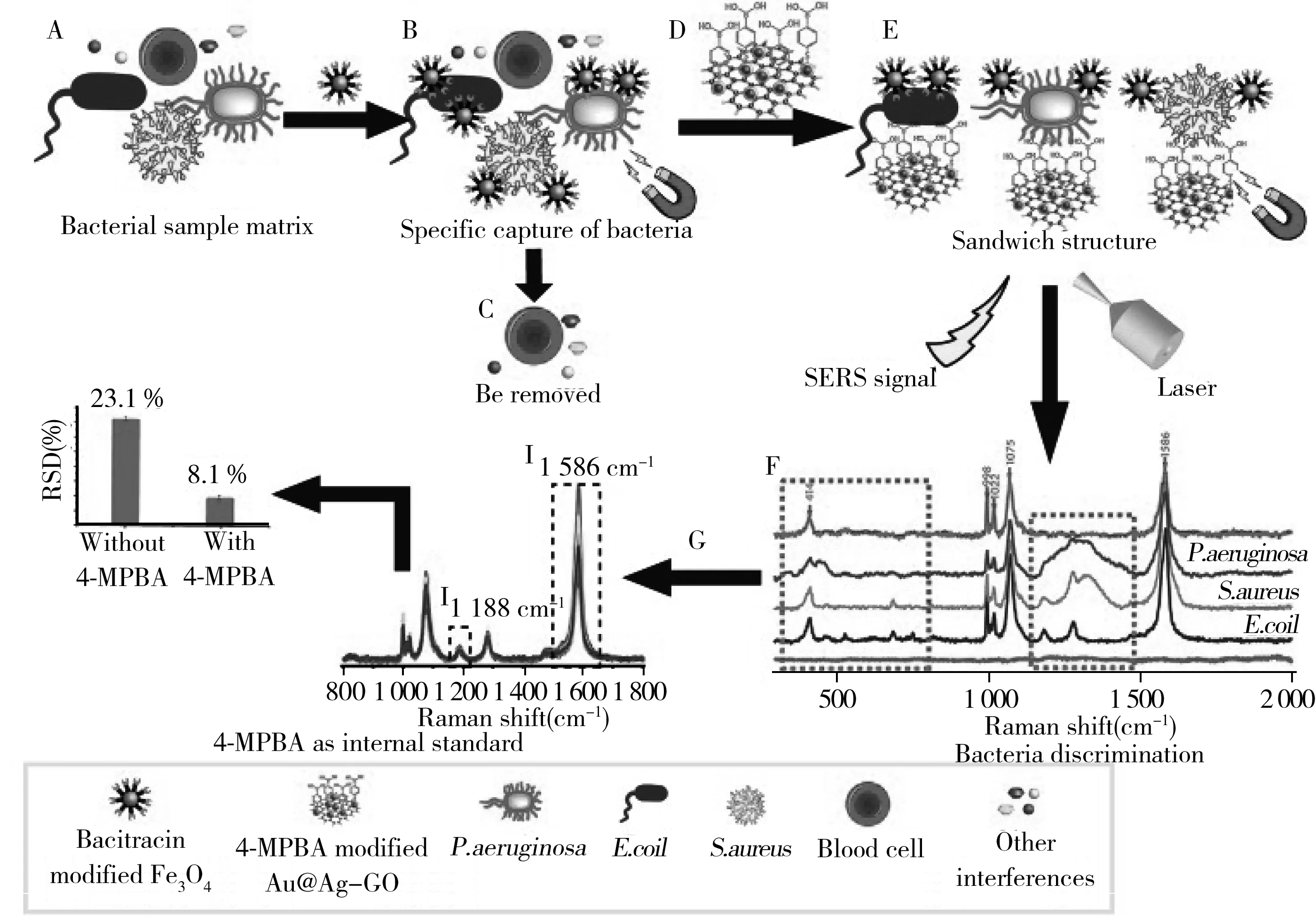
图1 基于MNPs的SERS分析示意图[18]Fig.1 Schematic diagram of SERS assay based on MNPs[18]
2.2 核磁共振检测
单个MNPs可以影响周围数十亿的水分子,其聚集会使水中质子的横向弛豫时间(T2)发生变化,从而可通过NMR技术来检测MNPs标记的目标细菌,提高检测灵敏度[30]。Zhao等[31]将单核细胞增生李斯特菌与MNPs上抗体的特异性结合,诱导MNPs的聚集,引起MNPs周围水分子的T2变化,并通过NMR检测ΔT2信号间接检测细菌,LOD为3 MPN(最大可能数)。Luo等[32]采用抗体修饰的MNPs对细菌进行磁分离,通过测量其T2信号反映目标细菌的含量,该方法可在30 min左右完成细菌的检测。除抗体外,适配体也常被用做识别元件。例如,Jia等[33]基于适配体修饰的MNPs,建立了磁弛豫开关传感器用于铜绿假单胞菌的检测,LOD为50 CFU/mL。但NMR测量无法区分哪个特定目标导致T2值变化,因此不能用于多种细菌的同时检测。此外,NMR仪器的成本较高、体积较大也限制了其在食源性致病菌检测中的应用。
3 贵金属纳米粒子
3.1 金纳米粒子
AuNPs具有易于合成和表面修饰、理化性质稳定、生物相容性好等优点,是食源性致病菌检测中较为常用的纳米粒子[34]。将识别元件修饰在AuNPs表面,构建功能化金纳米探针,能用于食源性致病菌的特异性检测。粒径较小的AuNPs存在强烈的局部表面等离子体共振(Local surface plasmon resonance,LSPR),在水溶液中通常呈红色,当AuNPs聚集时溶液颜色由红色变为蓝色,为比色分析提供了可能[35]。比色分析不需借助复杂仪器,可以用肉眼直接观察,因此适用于现场快速检测。例如,Verdoodt等[36]提出了一种基于抗体修饰的AuNPs检测乳酸杆菌属和金黄色葡萄球菌的比色方法,AuNPs通过抗体-抗原相互作用特异性识别目标细菌,在聚集时发生颜色变化。整个检测过程仅需1 min,乳酸杆菌和金黄色葡萄球菌的LOD分别为105 CFU/mL和120 CFU/mL。Ma等[37]也报道了一种类似的方法,将适配体修饰到AuNPs表面,通过适配体与细菌特异性结合使AuNPs发生聚集,颜色先由红色转变为紫色,再转变为蓝色。该方法对鼠伤寒沙门氏菌的LOD低至56 CFU/mL。最近,Zheng等[38]将AuNPs比色与智能手机成像结合,建立了一种快速检测大肠杆菌的方法,LOD为50 CFU/mL。为了提高比色方法的灵敏度,Thiramanas等[39]基于带正电的AuNPs与带负电的细菌细胞壁及酶之间的竞争性静电相互作用,提出了一种简单快速的细菌比色分析方法(图2)。该法对大肠杆菌的LOD低至10 CFU/mL。尽管AuNPs比色法简单、快速,但如何控制纳米粒子的聚集程度仍是难题[40],因此,基于聚集的比色方法可能很难发展为日常生活中食源性致病菌的定量检测方法。
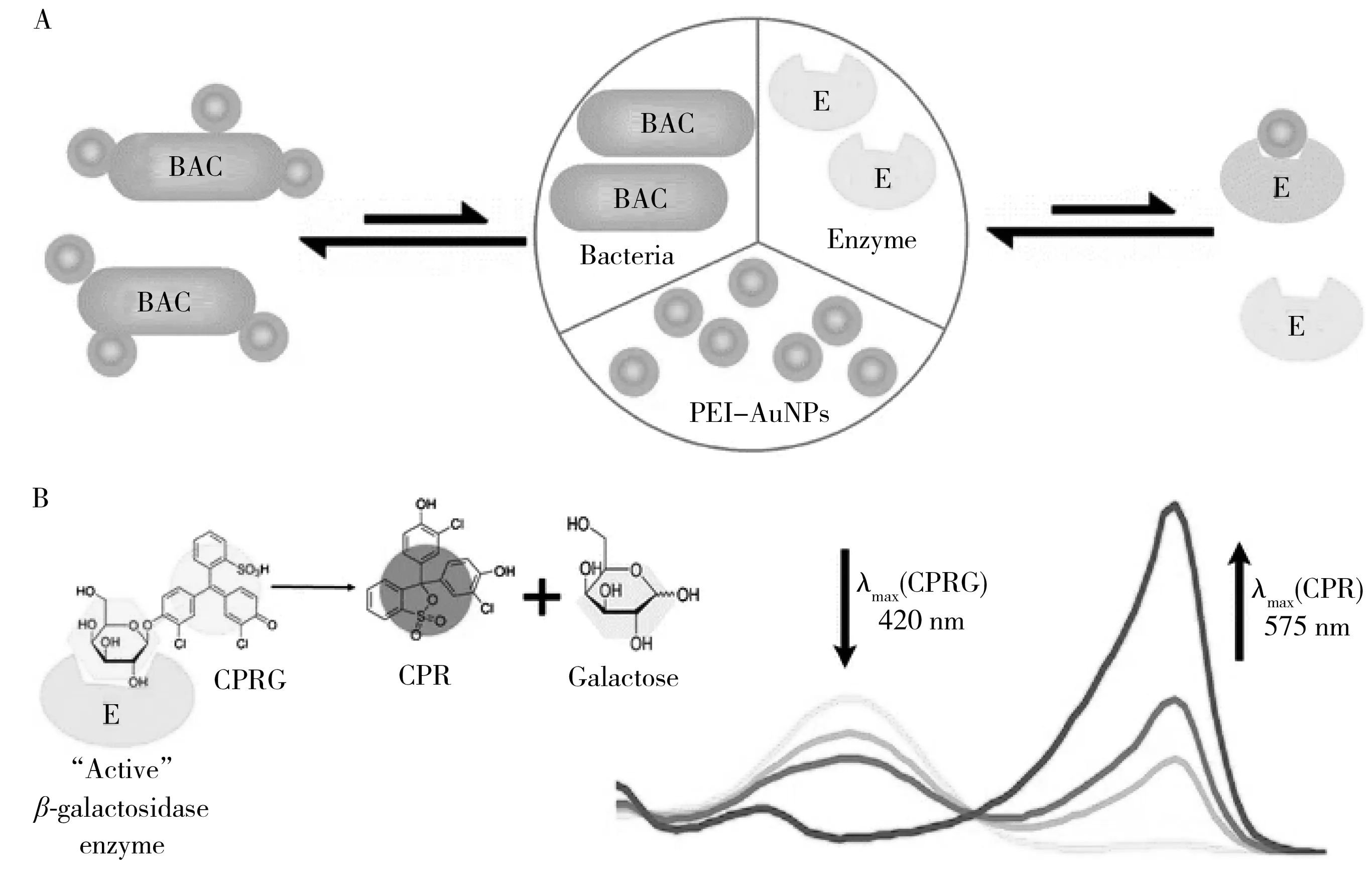
图2 基于AuNPs的酶放大比色分析示意图[39]Fig.2 Schematic diagram of enzyme amplified colorimetric assay based on AuNPs[39]
除比色分析外,AuNPs还常与免疫层析技术结合,不需借助任何大型复杂仪器,无需专业操作人员,快速、高效、低成本地检测食源性致病菌,适用于现场检测。Song等[41]采用基于双单克隆抗体的AuNPs免疫层析试纸条快速同时检测了志贺氏菌和大肠杆菌O157:H7,LOD均为106CFU/mL。虽然免疫层析技术优点众多,但是由于AuNPs本身不发光,需要大量粒子聚集方能变色,导致检测灵敏度较低。Bu等[42]利用金增强方法提高了传统AuNPs层析试纸条的灵敏度,用于对肠炎沙门氏菌的检测,增强后灵敏度提高2个数量级,LOD为104CFU/mL。Fu等[43]结合金增强和酶催化的两步级联信号放大策略提高灵敏度,用于大肠杆菌O157:H7的检测,LOD为1.25×101CFU/mL,比传统AuNPs免疫层析法(5.0×103CFU/mL)低约400倍。
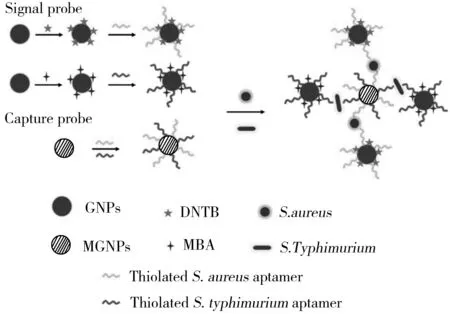
图3 基于AuNPs的SERS分析示意图[46]Fig.3 Schematic diagram of SERS assay based on AuNPs[46]
此外,AuNPs表面电子的集体振荡还被用于金属纳米表面拉曼散射的高度放大[44]。由于拉曼光谱上的振动或旋转跃迁对应于细菌细胞表面的特定分子结构,从而提供了一组化学“指纹”,这些“指纹”图谱有助于区分不同种类的细菌细胞,从而实现多种细菌的同时检测[45]。为了提高方法的特异性,研究者将拉曼标记分子与目标细菌结合,开发了一种SERS标记策略。例如,Zhang等[46]分别将两种不同的拉曼标记分子和适配体修饰在AuNPs上(适配体能特异性识别鼠伤寒沙门氏菌和金黄色葡萄球菌),结合磁性分离,同时检测了鼠伤寒沙门氏菌和金黄色葡萄球菌,不同的拉曼标记分子信号反映不同细菌的含量(图3)。该方法可在3 h内完成检测,对鼠伤寒沙门氏菌和金黄色葡萄球菌的LOD分别为15 CFU/mL和35 CFU/mL。SERS标记策略的不足在于不能直接获得目标细菌的固有“指纹”,且标签的非特异性结合可能导致假阳性信号[47]。尽管基于AuNPs的SERS分析方法较为灵敏,但是在实际的食源性致病菌SERS检测中还需要克服两个障碍:来自纳米材料的光谱干扰及繁琐的样品预处理。
3.2 银纳米粒子
AgNPs由于具有易于修饰、摩尔消光系数大等优点而受到研究者的关注。例如,Zhou等[48]在细菌细胞壁上原位合成AgNPs,用于SERS无标记检测饮用水中的细菌。这些表面存在AgNPs的细菌的拉曼信号比细菌混悬液的拉曼信号高约30倍,检测时间仅需10 min。通过SERS映射技术可以在疏水性载玻片上检测到低至2.5×102CFU/mL的细菌。为了提高AgNPs的稳定性,Wang等[49]在AgNPs的表面修饰一层金,与磁性分离结合,10 min内即可检测到大肠杆菌和金黄色葡萄球菌。由于AgNPs对某些生物具有毒性作用[50],因此在食源性致病菌检测领域的应用较少。
4 荧光纳米粒子
4.1 量子点
QDs具有激发光谱宽、发射光谱窄、斯托克斯位移大、光稳定性好、荧光效率高及摩尔消光系数大等优点,被广泛应用于食源性致病菌的检测。此外,单个光源可以同时激发多种不同颜色的荧光QDs,从而使QDs成为同时检测多种致病菌的理想探针。例如,Duan等[51]用不同适配体修饰的多色荧光QDs做荧光探针,建立了双重荧光共振能量转移(Fluorescence resonance energy transfer,FRET)检测平台。该法对副溶血性弧菌的LOD为25 CFU/mL,对鼠伤寒沙门氏菌的LOD为35 CFU/mL。Wang等[52]开发了一种使用不同抗体修饰的多色QDs作为荧光探针的荧光免疫测定方法,可同时检测肠炎沙门氏菌、金黄色葡萄球菌和大肠杆菌。研究人员将MNPs磁性分离和QDs荧光检测结合,降低了基体干扰,可快速分离细菌。例如,Dogan等[53]结合抗体修饰的MNPs和壳聚糖包被的CdTe QDs,开发了一种快速测定大肠杆菌的荧光方法,该方法的LOD为30 CFU/mL。Yin等[54]基于免疫磁珠分离和QDs反向测定策略开发了一种多通道免疫传感器,在1 h内一步即可同时检测大肠杆菌O157:H7和沙门氏菌,两者的LOD分别为30 CFU/mL和60 CFU/mL。Xue等[55]将免疫MNPs和QDs结合,定量检测大肠杆菌O157:H7,方法能在2 h内检测到低至14 CFU/mL的大肠杆菌O157:H7。QDs的荧光强度强且光稳定性好,能同时检测多种致病菌,未来的主要挑战是降低生产成本以及大规模生产尺寸均一、性能稳定的QDs。
4.2 上转换纳米粒子
UCNPs在近红外激发下能发出可见光,具有优良的光稳定性、窄的发射光谱、多色可调性、低背景荧光及毒性较小等优点,在基于荧光标记的食源性致病菌检测方面具有广阔的前景。Wu等[56]使用适配体修饰的多色UCNPs作为荧光标记,开发了一种同时检测3种病原菌的多重检测方法。该法对金黄色葡萄球菌、副溶血球菌、鼠伤寒沙门氏菌的LOD分别为25、10、15 CFU/mL。此外,Kurt等[57]使用适配体功能化的UCNPs和QDs开发了一种双波长激发荧光法,能同时检测金黄色葡萄球菌和鼠伤寒沙门氏菌(图4)。该方法对金黄色葡萄球菌和鼠伤寒沙门氏菌的LOD分别为16 CFU/mL和28 CFU/mL。Jin等[58]基于UCNPs荧光发射和AuNPs吸收之间的光谱重叠,开发了一种FRET检测平台。该方法可以快速、灵敏、选择性地检测3 CFU/mL的大肠杆菌。尽管基于UCNPs的荧光方法具有灵敏度高、检测速度快等优点,但UCNPs的制备方法不够成熟、生产成本较高、大规模生产困难,从而限制了其在食源性致病菌检测领域中的应用。
5 二氧化硅纳米粒子
SiNPs能将数千个具有荧光响应或拉曼响应的染料分子包裹在保护性硅胶基质中,具有良好的光稳定性,为基于荧光/拉曼的生物分析提供了高度放大和可再现的信号。Chen等[59]建立了一种基于SiNPs的间接免疫荧光测定方法,结合荧光显微镜或流式细胞术快速检测了大肠杆菌O157:H7。Shangguan等[60]将正介电电泳驱动在线富集技术与适配体和荧光分子修饰的SiNPs结合,能在微流体通道中检测金黄色葡萄球菌,该方法的LOD为93 CFU/mL。Hu等[61]将荧光素标记的空心二氧化硅纳米球与磁性分离结合,在75 min内实现了大肠杆菌O157:H7的检测,LOD为3 CFU/mL。Zhu等[62]分别在AuNPs表面修饰拉曼标记分子(4,4’-联吡啶)和二氧化硅壳层,制成一种SERS探针,该探针对大肠杆菌O157:H7的LOD低至10 CFU/mL。然而,SiNPs在食源性致病菌检测应用中仍存在染料易泄漏、包裹步骤复杂等问题。
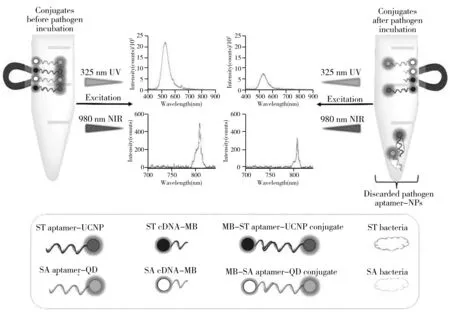
图4 基于UCNPs的荧光分析示意图[57]Fig.4 Schematic diagram of fluorescence assay based on UCNPs[57]
在食源性致病菌检测中,磁性纳米粒子基于其磁效应主要用于NMR分析,但在细菌浓度极低或多种待检物存在的情况下难以进行特异性捕获。贵金属纳米粒子凭借其独特的光学性质主要用于比色分析和SERS分析,但AuNPs聚集过程复杂且难以控制;而AgNPs则有生物毒性作用。荧光纳米粒子主要用于荧光分析,但QDs生产成本较高、批次间质量不一;UCNPs制备方法不够成熟、大规模生产困难。SiNPs在食源性致病菌检测应用中存在染料易泄漏、包裹步骤复杂等问题。各纳米粒子在食源性致病菌检测中的应用详见表1。
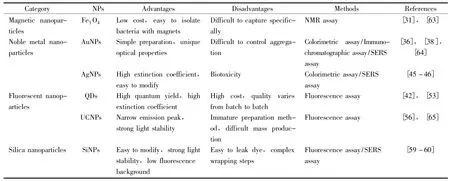
表1 不同纳米粒子用于食源性致病菌检测的总结Table 1 Summary of different nanoparticles used for foodborne pathogenic bacteria detection
6 总结与展望
纳米技术的迅速发展为食源性致病菌检测提供了新的方向,满足了快速、灵敏、特异性检测的要求,弥补了常规检测方法的不足。用纳米粒子构建的生物传感器,能有效地提高对目标细菌的识别能力,加速信号转导,实现信号放大,从而缩短检测时间,提高检测的特异性和灵敏度。但是,基于纳米粒子的检测方法尚有一些问题待解决。因此,未来的研究应集中在研究低成本、工业化、高质量的纳米粒子制备方法;研究控制纳米粒子大小、形状和聚集的策略;研究简单易行的纳米粒子表面修饰方法;提高生物识别元件选择性识别目标细菌的能力;以及提高磁性分离技术特异性分离和富集目标细菌的能力等方面。相信未来将研究出更多的快速、简便、灵敏的食源性致病菌检测方法来预防和控制食源性疾病并确保人们的食品安全。
